caricato da
common.user1826
Stereochimica: Isomeria e Chiralità

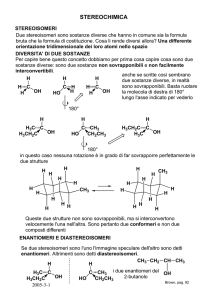
La sezione della chimica che tratta di struttura tridimensionale prende il nome di stereochimica. Stereoisomeri: composti con identica connettività ma con diverso orientamento degli atomi nello spazio ISOMERIA COSTITUZIONALE (STRUTTURALE) DIVERSA CONNETTIVITÀ (MATRICE DI CONNETTIVITÀ) H4 H2 H5 H3 H2 C2 C1 O H H4 C1 O C2 H5 H1 H6 H3 C1 C2 O H1 H2 H3 H4 H5 H6 H6 C1 C2 O H1 H2 H3 H4 H5 H6 C1 - 1 1 0 1 1 0 0 0 C1 - 0 1 1 1 1 0 0 0 C2 1 - 0 0 0 0 1 1 1 C2 0 - 1 0 0 0 1 1 1 O 1 0 - 1 0 0 0 0 0 O 1 1 - 0 0 0 0 0 0 H1 0 0 1 - 0 0 0 0 0 H1 1 0 0 - 0 0 0 0 0 H2 1 0 0 0 - 0 0 0 0 H2 1 0 0 0 - 0 0 0 0 H3 1 0 0 0 0 - 0 0 0 H3 1 0 0 0 0 - 0 0 0 H4 0 1 0 0 0 0 - 0 0 H4 0 1 0 0 0 0 - 0 0 H5 0 1 0 0 0 0 0 - 0 H5 0 1 0 0 0 0 0 - 0 H6 0 1 0 0 0 0 0 0 - H6 0 1 0 0 0 0 0 0 - Jean-Baptiste Biot (1774-1862) The history of stereochemistry begins in 1815 when Biot performed experiments using “polarized light." Ordinary light consists of light vibrating in numerous planes. However, when ordinary light is filtered, a single plane of polarized light can be obtained. Biot passed polarized light through various solutions and noted that certain solutions such as sugar can rotate polarized light. He also found the degree of rotation is a direct measure of the concentration of the solution. Substances capable of rotating a plane of polarized light were designated "optically active." It took more than 30 years to understand the cause of rotation of polarized light. 1. Light source 2. Unpolarized light 3. Polarizer 4. Polarized light 5. Sample tube containing organic molecules 6. 30° optical rotation 7. Movable analyzer 8. Observer Specific rotation [a]Tl = a / l * c where a = observed value, l = cell lenght (dm), and c = g/100 ml) Louis Pasteur (1822-1895) In 1848 Pasteur resolved (separated) an optically inactive substance (tartaric acid) into two optically active components. Each of the optically active components had properties identical to tartaric acid (density, melting point, solubility, etc.) except that one of the components rotated the polarized light clockwise (+) while the other component rotated the polarized light by the same amount counterclockwise (-). Pasteur made a proposal that still stands as the foundation of stereochemistry: The twin molecules of tartaric acid were mirror images of each other! Additional research by Pasteur revealed that one component of tartaric acid could be utilized for nutrition by micro-organisms but the other could not. On the basis of these experiments, Pasteur concluded that biological properties of chemical substances depend not only on the nature of the atoms comprising the molecules but also on the manner in which these atoms are arranged in space. (-) SiO4 (+) SiO4 CO2- CO2- HO H H OH CO2- H HO OH H CO2- Jacobus van't Hoff (1852-1911) In 1874 as a student at University of Utrecht, van't Hoff proposed the tetrahedral carbon. His proposal was based upon evidence of isomer number: Conversion of CH4 into CH3Y (Y=Cl,Br,F,I,OH,etc.) generates only one structure. When CH3Y converted into CH2YZ (CH2Cl2,CH2ClBr,CH2BrF,etc.), only one structure has ever been observed. van't Hoff realized that the four hydrogens in CH4 had to be equivalent (same environment) and a geometrical square was ruled out because it would form the two structures shown below: For tetrahedral CH4, the four equivalent hydrogens are in corners with H-C-H angles of 109.5° The tetrahedral carbon not only collaborated the absence of isomers CH3Y and CH2YZ, but also predicted the existence of mirror image isomers. When carbon makes four single bonds with four different groups such as CHFClBr, non-superimposable mirror-image molecules (enantiomers) exist: These enantiomers display virtually identical physical properties except for the direction of rotation of polarized light. An equal mixture of the mirror image twins, a racemate or racemic mixture, is optically inactive since rotations cancel one another. Emil Fisher (1852-1919) In 1894 Fisher performed one of the most remarkable feats in the history of chemistry: He identified the 16 stereoisomers for the aldohexoses (C6H12O6), the most prominent member being D-glucose. Fisher used cross representations (now called Fisher projections) to distinguish three-dimensional shapes. Fisher projections are shown for D and L glucose (D/L descriptors represent another Fisher innovation). Kelvin's definition "I call any geometrical figure, or group of points, chiral, and say it has chirality, if its image in a plane mirror, ideally realized, cannot be brought to coincide with itself." This is the celebrated definition stated by Lord Kelvin in 1904, in his Baltimore Lectures on Molecular Dynamics and the Wave Theory of Light. This statement is universally accepted as the definition of chirality. William Thomson (Lord Kelvin) (1824-1907) eir Vladmir Prelog (1906-1998) Prelog was awarded Nobel Prize in chemistry (1975) for research into the stereochemistry of alkaloids, antibiotics, enzymes, and other natural compounds. He designed the stereochemical distinctions used today for mirror image configurations: R/S designations for enantiomers and Z/E for geometric isomers. CONFIGURATION – the arrangement in space of the four different groups about a chirality center, or better stereogenic center. How do we show configurations? “wedge” formulas Fischer projections “cross structures” use only for chiral centers! Br F H Cl Br Cl H F In the Fischer projection, the horizontal bonds to the chiral center are always above the plane and the vertical bonds to the chiral center are below the plane. CH3 Br Cl H CH3 Br Cl H Cahn–Ingold–Prelog priority rules R/S assignments for selected compounds The hypothetical molecule bromochlorofluoroiodomethane shown in its Rconfiguration would be a very simple chiral compound. The priorities are assigned based on atomic number (Z): iodine (Z = 53) > bromine (Z = 35) > chlorine (Z = 17) > fluorine (Z = 9). Allowing fluorine (lowest priority) to point away from the viewer the rotation is clockwise hence the R-assignment. In the assignment of L-serine highest priority is given to the nitrogen atom (Z = 7) in the amino group (NH2). Both the methylalcohol group (CH2OH ) and the carboxylic acid group (COOH) have carbon atoms (Z = 6) but priority is given to the latter because the carbon atom in the COOH group is connected to a second oxygen (Z=8) whereas in the CH2OH group carbon is connected to a hydrogen atom (Z=1). Lowest priority is given to the hydrogen atom and as this atom points away from the viewer the counterclockwise decrease in priority over the three remaining substituents completes the assignment as S. The stereocenter in S-carvone is connected to one hydrogen atom (not shown, priority 4) and three carbon atoms. The isopropene group has priority 1 (carbon atoms only) and for the two remaining carbon atoms priority is decided with the carbon atoms two bonds removed from the stereocenter, one part of the cerbonyl group (O,O,C priority 2) and one part of an alkene (H,C,C priority 3). The resulting counterclockwise rotation results in a S . Una molecola è chirale se non obbedisce all’operazione di identità: Identità = Sovrapponibilità Due molecole, o più in generale due oggetti, che siano immagini speculari o sono sovrapponibili (identici) o non sono sovrapponibili (chirali). L’operazione che riconosce una molecola come chirale consiste proprio nel verificare la non-sovrapponibilità della stessa alla sua immagine speculare. Poiché in una molecola chirale non sono presenti piani, centri o assi alternanti di simmetria, la chiralità di una molecola può essere prevista sulla base della presenza o meno di tali elementi di simmetria. DUE MOLECOLE CON IDENTICA FORMULA ELEMENTARE Hanno la stessa connettività? SÌ STEREOISOMERI NO ISOMERI STRUTTURALI STEREOISOMERI Si interconvertono per rotazione attorno a legami s alla T di lavoro? NO ISOMERI CONFIGURAZIONALI SÌ ISOMERI CONFORMAZIONALI ISOMERI CONFIGURAZIONALI Sono immagini speculari? NO DIASTEREOISOMERI SÌ ENANTIOMERI Due molecole enantiomere l'una dell'altra possiedono le medesime proprietà fisiche, tranne una: la capacità di ruotare il piano della luce polarizzata. Tale capacità, definita potere rotatorio, è uguale in valore assoluto ma opposta di segno per ognuno dei due enantiomeri. Due molecole enantiomere l'una dell'altra manifestano anche la stessa reattività chimica in ambiente achirale o chirale racemico; ben diversa può invece essere la loro reattività nei confronti di un enantiomero di un'altra coppia. (+)-A* + X (non chirale) → (R)-A*X (50%) + (S)-A*X (50%) (+)-A* + (R)-B* (chirale) → (R,R)-A*B* (>50%) + (S,R)-A*B* (<50%) (+) indica una miscela racemica Enantiomer Uniqueness Derived from the Greek word "enantio" meaning opposite, enantiomers are nonsuperimposable mirror image structures. Because they possess identical physical properties--except for the direction of rotation of polarized light--they are often viewed as a single entity. But enantiomers can exhibit distinct chemical behavior when subjected to a chiral environment, that is, any environment consisting of a single enantiomer. Here are a few examples to demonstrate the point: •In the 1960s, many pregnant women who had taken racemic thalidomide gave birth to deformed babies. Ensuing investigations showed only the right-handed version of the drug to cause the same birth defects in rat embryos. •Sold over the counter in a number of pain remedies such as Advil and Nuprin, ibuprofen contains therapeutic activity only in the (+) isomer. •Our bodies can only metabolize (+) glucose and not (-) glucose. •(+) leucine tastes sweet while (-) leucine bitter. •Our bodies can utilize only (-) amino acids. La reazione di racemizzazione trasforma un enantiomero puro in una miscela racemica; calore, reagenti acido-basici, trasposizioni molecolari possono essere alla base del processo, che può essere catalizzato anche da enzimi, e quindi aver luogo all’interno di una cellula. Una racemizzazione enzimatica è stata osservata sia con la molecola del Thalidomide che dell’Ibuprofen. Questo ha conseguenze diverse nel caso dei due farmaci. • Il Thalidomide anche se disponibile in forma enantiomericamente pura non potrebbe essere comunque usato dato che l’eutomero sarebbe comunque trasformato nel distomero teratogeno. • L’Ibuprofen racemico può comunque essere somministrato poiché il distomero, in questo caso innocuo, viene trasformato nell’eutomero. O H (S) N O N O O CO2H (S) H (-) Thalidomide (eutomero) Ibuprofen According to the modern receptor-site theory, drugs attach themselves to specific sites by means of three dimensional bonding capabilities. The fit of a drug onto a receptor site was compared by Fisher to the fit of a key into a lock: The right drug is the "key" which can fit the receptor "lock" and turn on the desired biological response. Sometimes two slightly different keys will fit inside the same lock, but only one will open the door. When subjected to a chiral environment such as the human body, how are mirror image twins differentiated? Discrimination between enantiomers, called chiral recognition, depends on the degree of interaction exhibited between each enantiomer and the chiral bonding site. In a way, chiral recognition resembles the matching of a right hand with a right-handed glove. The illustration below represents interactions between chiral bonding site -CXYZ and enantiomers CRXYZ. For one enantiomer, a threepoint interaction is possible at X-X, Y-Y, and Z-Z; the other enantiomer can only accommodate at most a two-point interaction at X-X and Z-Z with the same chiral binding site. In this instance, chiral recognition relies on the absence of a Y-Y fit in conjunction with the other two interactions. Z X Z Y X Y X Y Z ENANTIOMERI: I CASO CENTRO CHIRALE ATOMO STEREOGENICO SIMMETRIA IN NATURA: EMOGLOBINA - PSEUDO CENTROSIMMETRIA ENANTIOMERI: II CASO ASSE CHIRALE A ALLENI A A A B B B B COMPOSTI SPIRANICI B B A A B B A B VINILIDENE CICLOALCANI A B A B A B A A ENANTIOMERI: II CASO ASSE CHIRALE A A A A B B DIFENILI B B Storicamente molecole dotate di chiralità per rotazione ristretta attorno legami s sono dette atropoisomeri In tutte le molecole viste dotate di asse di chiralità, la loro osservazione lungo l’asse stesso è di questo tipo: A A A B B B A B SIMMETRIA IN NATURA: LA DOPPIA ELICA DEL DNA, COSTITUITO DA DUE ELICHE DESTRORSE DI DUE FILAMENTI POLINUCLEOTIDICI ENANTIOMERI: III CASO PIANO CHIRALE TRANS-CICLOALCHENI QUANDO I SEGMENTI SATURI DI UN TRANS-CICLOALCHENE SONO INFERIORI AD UNA CERTA DIMENSIONE, SONO FORZATI AD USCIRE DAL PIANO DELL’ALCHENE, CHE NORMALMENTE È UNA PIANO DI SIMMETRIA DELL’ALCHENE, GENERANDO CHIRALITÀ. LA DIMENSIONE DETERMINA L’ENTITà DELLA BARRIERA DI INTERCONVERSIONE, E QUINDI DELLA POSSIBILITÀ DI SEPARARE ENANTIOMERI. (E)-CICLOOTTENE (E)-CICLONONENE (E)-CICLODECENE Ea = 36 Kcal/mol Ea = 20 Kcal/mol Ea = 11 Kcal/mol H H Ea=36Kcal/mol H Ea=10Kcal/mol H H H (+)-corona sedia (-)-corona ENANTIOMERI: III CASO O PIANO CHIRALE O O CO2H CO2H CO2H 10 O O O 1,10-dioxa[10]paraciclofano all'origine chiamati ansa composti [10]-paraciclofano racemizza a 200°C, [11]-paraciclofano racemizza a 85°C CO2H CO2H CO2H [2,2]paraciclofano n m CO2H [n,m]paraciclofano Il [3,4]paraciclofano racemizza a 150°C DIASTEREOISOMERI • Con n centri stereogenici, sono possibili 2n stereoisomeri, a loro volta raggruppabili in 2n-1 coppie di enantiomeri. Ciascuna coppia di enantiomeri è diastereomerica nei confronti di ogni altra coppia. CHO (R) H OH HO (R) H OH HO (R) H OH HO CHO (S) H (S) H (S) H CH2OH CH2OH D(+)-Ribosio L(-)-Ribosio CHO CHO (R) (S) H OH HO H (S) (R) HO H H OH (R) (S) H OH HO H CHO CHO (S) (R) HO H H OH (R) (S) H OH HO H (S) (R) H OH HO H CH2OH CH2OH D(-)-Arabinosio L-(+)-Arabinosio CHO CHO (R) (S) HO H H OH (S) (R) HO H H OH (S) (R) H OH HO H CH2OH CH2OH CH2OH CH2OH D(+)-Xilosio L(-)-Xilosio D(+)-Lixosio L(-)-Lixosio DIASTEREOISOMERI – DEGENERAZIONE FORME MESO nei casi degeneri, occorre distinguere fra due casi: • numero pari di stereocentri n: il numero di stereoisomeri chirali è 2n-1, mentre il numero di forme meso è 2 (n-2)/2. • numero dispari di stereocentri n: il numero di stereoisomeri chirali è 2(n-1) -2(n-1)/2, mentre il numero di forme meso è 2(n-1)/2. Queste formule valgono solo quando gli stereocentri sono inseriti in una catena lineare. • caso degenere con centri prochirali H HO H CO2H (R) OH (s) H (S) OH CO2H meso H H H CO2H (R) OH (r) OH (S) OH CO2H (R) OH H H OH (R) H HO CO2H meso diastereoisomeri HO CO2H (S) H HO H (S) H OH CO2H CO2H chirale chirale diastereoisomeri enantiomeri FORME MESO L’acido glutarico e le sue forme meso H HO H CO2H (R) OH (s) H (S) OH CO2H meso H H H CO2H (R) OH (r) OH (S) OH CO2H meso I due carboni contrassegnati da frecce sono stereogenici (due sostituenti uguali ma con diversa configurazione assoluta). Poiché essi giacciono su un elemento di simmetria (piano), si definiscono achirotopici. N.B. Nel definire il descrittore (r) o (s), si conviene che le priorità dei leganti siano (R) > (S). H H HO CO2H (R) OH * OH (R) H HO HO H CO2H (S) H * (S) H OH CO2H CO2H chirale chirale I due carboni asteriscati sono non stereogenici (due sostituenti uguali con uguale configurazione). Poiché essi non giacciono su un elemento di simmetria del tipo piano, centro, asse alternante (essi giacciono su un asse di rotazione semplice C2), si definiscono chirotopici (Mislow). • Elementi dinamici di simmetria dovuti a rotazione libera Nel valutare la chiralità di una molecola, come già visto occorre eseguirne l’analisi conformazionale e stimare i valori dei massimi di energia associati alle rotazioni. Se vi è rotazione libera alla temperatura di lavoro, una molecola che “transiti per una conformazione dotata di simmetria non è chirale. Se le barriere di rotazione sono alte ad es. > 20 Kcal/mol, a 25°C possono bloccarsi conformazioni chirali; lo stesso può avvenire allo stato solido nel reticolo cristallino. Meso-tartrati (achirali) e cis-1,2-diclorocicloesano H OH HO HO HO CO2R H HO CO2R Cl H RO2C H CO2R RO2C HO CO2R s plane (symmetric) Cl s plane Cl H CO2R CO2R OH H H HO H H H HO CO2R CO2R OH H CO2R HO H OH CO2R i centre of symmetry Cl Cl Cl Cl Cl Centri pro-stereogenici Facce e gruppi eterotopici Sono classificati come Omotopici Enantiotopici Diastereotopici LEGANTI OMOTOPICI DUE GRUPPI SOSTITUENTI O ATOMI OMOTOPICI HANNO LE SEGUENTI PROPRIETÀ: • SONO INTERSCAMBIABILI ATTRAVERSO ROTAZIONE SU ASSE DI SIMMETRIA SEMPLICE Cn • LA SOSTITUZIONE SEPARATA DI UNO E DELL’ALTRO CON UN LEGANTE DIVERSO (TAGGING) PORTA A PRODOTTI IDENTICI. Cl Cl Ha B -> a H Hb H b> Cl r Br Hb Cl Br Cl Ha Br Cl CO2H Ha OH HO Hb CO2H CO2H D OH Hb D HO > CO2H Ha Hb -> D CO2H Ha OH HO D CO2H Gli atomo di idrogeno Ha e Hb sono in entrambi i casi omotopici, scambiabili per rotazione di 180°, attorno all'asse C2 . Implicazione in 1H NMR: Ha e Hb sono equivalenti come chemical shift anche in ambiente chirale (solventi, agenti complessanti chirali). LEGANTI ENANTIOTOPICI DUE GRUPPI SOSTITUENTI O ATOMI ENANTIOTOPICI HANNO LE SEGUENTI PROPRIETÀ: • SONO INTERSCAMBIABILI ATTRAVERSO RIFLESSIONE SU UN PIANO DI SIMMETRIA s • LA SOSTITUZIONE SEPARATA DI UNO DI ESSI CON UN LEGANTE DIVERSO (TAGGING) PORTA A PRODOTTI ENANTIOMERICI. Cl Ha Br (R) F CO2H Ha OH Br OH (2R,3S) CO2H COOH (R) Ha Br 1H Hb -> Br Cl Ha Hb Ha -> Br F Hb -> Br Hb -> Br CO2H Ha OH Hb OH CO2H COOH Ha Hb Ha -> Br Ha -> Br Cl Br Hb F (S) CO2H Br OH Hb OH CO2H (2S,3R) COOH Br Hb (S) NMR: Ha e Hb hanno lo stesso chemical shift solo in ambiente achirale; In ambiente chirale non sono più magneticamente equivalenti e si distinguono. LEGANTI ENANTIOTOPICI Leganti enantiotopici vengono identificati con i descrittori pro-R e pro-S. Si sostituisce il legante enantiotopico L1 (detto anche prochirale) con un legante identico L1* ma al quale assegniamo arbitrariamente una priorità maggiore (nel caso dell’idrogeno L* potrebbe essere Deuterio). Se questa sostituzione porta ad uno stereocentro con configurazione R, L1 è definito pro-R. pro-S Cl Ha pro-R Hb Ha -> D COOH pro-R Ha Hb D F F pro-S Cl (S) Ha -> D Hb (S) COOH D Hb LEGANTI DIASTEREOTOPICI DUE GRUPPI SOSTITUENTI O ATOMI DIASTEREOTOPICI NON SONO CORRELATI DA ELEMENTI DI SIMMETRIA, PERTANTO LA SOSTITUZIONE SEPARATA DI UNO DI ESSI CON UN LEGANTE DIVERSO (TAGGING) PORTA A PRODOTTI DIASTEREOMERICI. HO H (R) (R) HO H COOH Hb -> Br (R) Ph O Br (S) Hb' Ha Ha' 1H Ha -> Br Ha Hb Ha Br O (R) COOH HO H (R) (S) COOH Br Hb Ph Hb -> Br Hb Ha O O Hb' Ha' Ph Ha -> Br Hb Br O (R) O (R) Hb' Ha' NMR: Ha e Hb hanno diverso chemical shift anche in ambiente achirale a meno di una coincidenza fortuita. TOPICITÀ FACCIALE Atomi A ibridati sp2 definiscono due diverse facce, rispettivamente sopra e sotto il piano che contiene il gruppo AB1B2B3. Le due facce sono definite omotopiche se l’ addizione di un legante da entrambe le facce porta alla stessa molecola, le due facce sono definite enantiotopiche se l’ addizione di un legante da una e dall’altra faccia porta a enantiomeri, le due facce sono definite diastereotopiche se l’ addizione di un legante da una e dall’altra faccia porta a diastereoisomeri. L re face L B1 A B3 B2 re face B1 B3 A B2 si face B3 B2 A B1 L L si face Assumendo il seguente ordine di priorità, B1 > B2 > B3, le due facce vengono definite re e si applicando ai tre sostituenti le classiche tecniche di definizione delle configurazioni assolute. Le due facce sono enantiotopiche. Se due sostituenti, es B1 e B2 sono uguali, le due facce sono omotopiche. Se la molecola trigonale contiene un centro stereogenico all'interno di uno dei sostituenti, es B1, e tutti i sostituenti sono diversi, le due facce sono diastereotopiche. FACCE ENANTIOTOPICHE D D D H D H D (R) Re H (S) H H (S) D D (R) D Si PhMgCl Ph (S) O H Re OH OH H (R) H Ph PhMgCl Si C2H5I H O H C2H5 OLi (S) Si (R) H C2H5I Re O C2H5 H FACCE OMOTOPICHE PhMgCl Ph OH OH O Ph PhMgCl sovrapponibili FACCE DIASTEREOTOPICHE C2H5I O (Z) H OLi H C2H5 (R) H (S) H O C2H5I H Ph (S) (S) H Ph (S) C2H5 Entrambe i reagenti sono planari con facce enantiotopiche La condensazione aldolica Quattro sono i possibili approcci fra enolato ed aldeide, presentando ciascuno due facce Ogni approccio genera due stereocentri, in totale quattro stereoisomeri. Reazione fra enolato Z del butanone ed acetaldeide Z OLi O O OH + H H O O Si 2 1 H O H OH 4 (R) H 4 1 2 5 3 (R) 3 Li Re 4 H O Li H 4 Re Re O O 5 1 2 1 2 3 (S) 2 4 5 O Li H 4 5 Si 1 2 H OH (S) 3 Re 5 3 (S) O O 4 1 H OH (R) OH (S) 3 5 5 Si 2 1 Si O O 3 Li O 1 2 3 (R) 4 5