Giuseppe Martorelli
SPECIALIZZAZIONE ECTOPLASMICA
potenziale bersaglio per lo sviluppo della contracezione maschile?
INTRODUZIONE
Sebbene esistano numerosisimi metodi contraccettivi, il numero di gravidanze
indesiderate nei paesi in via di sviluppo è in crescita. La ragione sottostante a
questo fenomeno è la mancanza di un contraccettivo effeciente, economico e
sicuro. Nei decenni precedenti sono stati effettuati molteplici studi utilizzando
modelli animali per capire se le giunzioni celullare delle cellule del Sertoli nei
testicoli possano essere un target per la regolazione della fertilità maschile.
Alcuni di questi studi erano basati sull'uso di ormoni e/o sostanze chimiche per
mandare in tilt l'asse ipotalamo-pituitario-gonadico e l'utilizzo di un gruppo di
molecole chimiche o peptidi sintetici per disturbare la spermatogenesi in modo
reversibile o irreversibile. Si è scoperto che un potenziale contraccetivo maschile,
è uno dei composti che esercita la sua azione su una giunzione aderente testicolospecifica conosciuta come specializzazione ectoplasmica (ES).
IL RUOLO DELL'ES
Nell'epitelio seminifero, nei testicoli di roditore ogni tipo di spermatogonio
(diploide, 2n) si differenzia in 256 spermatidi (aploidi, 1n) durante la
spermatogenesi. In più, durante lo sviluppo le cellule germinali devono migrare
progressivamente dalla lamina basale fino al margine luminale del
compartimento luminale quindi possono sviluppare completamente spermatidi
che possono essere rilasciati nel lume. Senza questi eventi di movimento
cellulare, la spermatogenesi non può arrivare alla conclusione e risulterà quindi
infertilità. Gli spermatidi in sviluppo devono rimanere attaccati all'epitelio
tramite una giunzione aderente basata su actina alle cellule Sertoli-germinali
conosciuta come specializzazione ectoplasmica (ES), la quale è cruciale non solo
per l'attaccamento alle cellule ma anche per l'orientamento e il movimento degli
spermatidi nell'epitelio. Comunque, la composizione biochimica e l'architettura
molecoloare delle proteine complesse che costituiscono ES sono state studiate
solamente di recente. Inoltre, la regolazione del processo che regola la dinamica
dell'ES è ancora sconosciuta. Si aspetta che, se si proseguono gli studi su ES, sia
possiible arrivare allo sviluppo di un nuovo contraccetivo che funziona
perturbando la funzione di ES nei testicoli. Il potenziale bersagliamento specifico
di ES può significare un azione contraccetiva che può essere raggiunta senza
perturbare l'asse IPOTALAMO-PITUITARIA-TESTICOLARE.
STRUTTURA BASE E FUNZIONE DELL'ES
ES è un tipo di giunzione aderente testicolo-specifica basata su actina tra cellule
del Sertoli nel compartimento basale nel sito della barriera sanguigna del
testicolo e tra cellule del Sertoli e germinali nel compartimento adluminale
dell'epitelio seminifero nel testicolo di ratto. Finora molti degli studi morfologici
di ES sono stati effettuati nei ratti, inclusi alcuni recenti studi biochimici, la
struttura dell'ES discussa in questo sede è basata principalmente sul modello del
ratto.
La funzione primaria di ES è di facilitare il movimento delle cellule germinali,
con una funzione addizionale di ancoraggio per mantenere le cellule germinali,
in particolare spermatidi, nell'epitelio fino al rilascio di spermatozoi maturi. In
più, esso gioca un ruolo nella regolazione della barriera sanguina del testicolo.
Per esempio, l'intima relatzione tra ES basale e giungione stretta è stata
dimostrata con la tecnica del congelamento-frattura, suggerendo che essi sono
presenti in ogni punto nella barriera sanguigna del testicolo. Sebbene ES è stata
per prima identificata nel testicolo quasi tre decadi fa, i meccanismi precisi che
regolano la dinamica di ES non sono stati ancora chiarito. Studi recenti hanno
fatto luce su l'architettura molecolare dei complessi di proteine costituenti del
sito apicale dell'ES. Inoltre, i meccanismi sottostanti che regolano questo tipo di
giunzione aderente nei testicoli sono state recentemente identificate e
parzialmente caratterizzate.
MODELLO MOLECOLARE PER LA DINAMICA
DELL'ES
La figura successiva mostra un modello molecolare corrente per la regolazioni di
giunzioni aderenti dinamiche in sede della specializzazione ectoplasmica (ES) nel
testicolo. In breve la giunzione aderente nel sito dell'ES può essere regolato da
chinasi, fosfatasti e GTPasi. In più, un livello ottimale di ioni calcio Ca2+ è
richiesto per la normale funzione delle caderine. Inoltre, le gelsoline, proteine ce
rompono l'actina, possono regolare le dinamiche dell'ES scindendo i filamenti in
sede dell'ES, causando l'apertura dell'ES. E' risaputo che l'integrità delle integrine
e dei complessi di proteine caderine-mediate e la funzionalità della loro rete di
actina sottostante in sede dell'ES è regolato da almeno tre componenti: (I)
integrine ß1/pFAK/PI 3-chinasi via chinasi associate ai microtubuli o p130, (II)
Strutturalmente, ES apicale consiste in uno stretto layer di pacchetti esagonali,
fasci paralleli di actina "schiacciati a sandwich" tra membrana plasmatica di una
cellula del Sertoli e una cisterna del reticolo endoplasmatico (ER) sul lato della
cellula del Sertoli e uno spermatide allungato / in allungamento (in figura).
integrine ß1 o ß2/RhoB/ROCK/LIMK/cofiline e (III) le Rab8B GTPasi
CONCLUSIONI
La ricerca, seppur richiederà molto tempo e tantissimi sforzi, promette bene e se
si continuerà a studiare su questo tipo di giunzione e la sua dinamica è probabile
che in futuro si avrà sul mercato un contraccettivo maschile che sia sicuro,
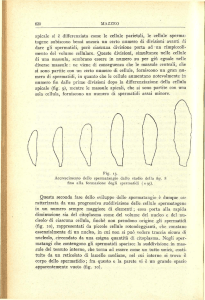
Un tipico ES apicale si trova tra una cellula del Sertoli e la testa di uno
affidabile ed economico e che non agisce sull'embrione e quindi prima che una
spermatide in allungamento è mostrato nella micrografia elettronica in figura. La
nuova vita sia stata creata.
figura successiva è un disegno schematico che illustra la caratteristica
ultrastruttura dell'ES apicale nell'epitelio seminifero di un testicolo di ratto RIFERIMENTI: Ectoplasmic specialization, a testis-specific cell–cell actin-based adherens junction type: is this
adulto.
a potential target for male contraceptive development?
Nikki P.Y. Lee and C. Yan Cheng
1