STEROIDI
Colesterolo, Corticosteroidi ed Ormoni sessuali
1. Classe di di composti naturali aventi matrice
comune
2. Categoria di sostanze aventi la medesima
struttura e nomenclatura chimica
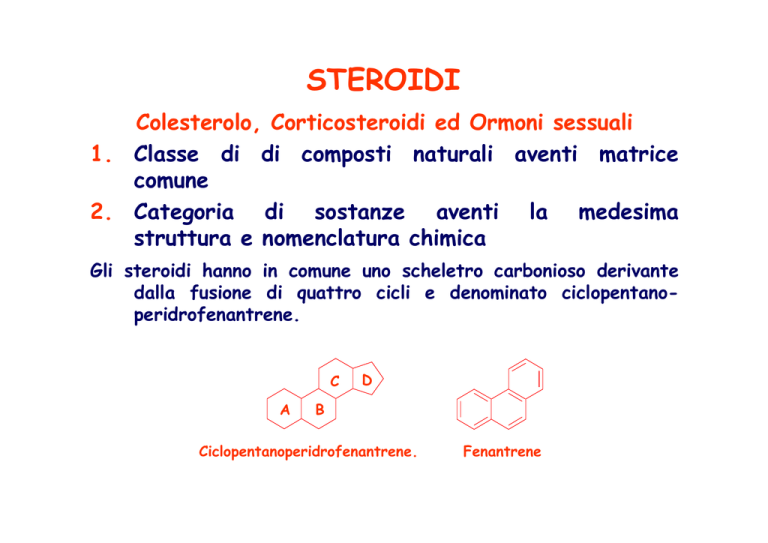
Gli steroidi hanno in comune uno scheletro carbonioso derivante
dalla fusione di quattro cicli e denominato ciclopentanoperidrofenantrene.
C
A
D
B
Ciclopentanoperidrofenantrene.
Fenantrene
STEROIDI 2
Tali anelli hanno una relazione stereochimica comune.
Modifiche alla tipologia di giunzione comporta la perdita di
attività indipendentemente dalla loro categoria biologica.
Anche l’introduzione di gruppi funzionali, atti a renderli
idrosolubili o assorbibili oralmente, sono simili per le varie classi.
I corticosteroidi e gli ormoni sessuali (androgeni, estrogeni e
progestinici) hanno come origine biogenetica comune il colesterolo
che deriva dal Acetil-CoA.
Il loro catabolismo avviene nel fegato attraverso la demolizione
ossidativa della catena laterale, la riduzione di doppi legami
presenti e l’epimerizzazione di atomi di carbonio recanti funzioni
alcoliche.
Nonostante questa elevata somiglianza a livello chimico e
stereochimico, ciascuna classe di steroidi ha una propria
peculiare attività che la differenzia dalle altre.
Adrenocorticoidi
STEROIDI 3
Glucocorticoidi – regolano metabolismo dei carboidrati, dei lipidi e
delle proteine.
Mineralcorticoidi – regolano il bilancio salino e la ritenzione idrica.
Ormoni sessuali
Ormoni femminili : comprendono Progestinici e Estrogeni
Ormoni maschili : androgeni.
STRUTTURA E NOMENCLATURA DEGLI STEROIDI
La numerazione degli atomi di carbonio dello scheletro ciclico e
della catena laterale è quella che qui vediamo riportata per il 5α
αColestano.
5α
α-Colestano
STEROIDI 4
La rappresentazione tridimensionale del 5a-Colestano evidenzia
una struttura rigida in virtù delle giunzioni trans tra i vari anelli
cisloesanici.
Esso è definito nel seguente modo trans-anti-trans-anti-trans e
ciò sta ad indicare che tutti gli anelli hanno fusione stereochimica
trans diequatoriale mentre il termine anti indica ancora una
disposizione trans dei legami 10 e 11.
Mentre la giunzione tra gli anelli A e B può essere cis, la
disposizione dei legami 10 e 11 resta anti e mai syn.
I sostituenti presenti possono essere β (sopra il piano) o α (sotto
il piano).
I metili angolari 18 e 19 sono solo β e pertanto assiali.
Anche la catena laterale in 17 è quasi sempre β (se diversa viene
indicata come 17α
α o con il tratteggio).
10
5α
α-Colestano
11
STEROIDI 5
HO
Colesterolo
(Colest-5-en-3β
β-olo)
OH
HO
H
OH
COOH
La presenza di insaturazioni viene
indicata con il simbolo ∆ portante come
apice il numero relativo al legame al
quale si riferisce (es. ∆5).
Gli
acidi
biliari
non
contengono
insaturazioni e appartengono alla serie
5β
β.
Anche i principali glucosidi cardioattivi
appartengono alla serie β.
Acido colico
(Acido 3α
α,7α
α,12α
α-triidrossi5β
β-colan-24-oico)
STEROIDI 6
CH3
CH3
H
CH3 H
H
CH3 H
H
H
H
5α
α-Pregnano
H
H
H
della
H
H
H
5α
α-Androstano
I corticosteroidi (ormoni
riferimento al Pregnano.
CH3
corteccia
5α
α-Estrano
surrenale)
fanno
Il Progesterone (ormone del corpo luteo) deriva anch’esso dal
Pregnano.
Gli ormoni sessuali maschili (androgeni) appartengono alla serie
dell’Androstano.
Gli estrogeni hanno l’anello A aromatico e derivano dall’estrano.
STEROIDI 7
I corticosteroidi e gli ormoni sessuali (androgeni, estrogeni e
progestinici) hanno come origine biogenetica comune il colesterolo.
:B
a) 3-Idrossi-3-metilglutarilCoA riduttasi - NADPH
STEROIDI 8
squalene
epossidasi (b) e delle 2,3-ossidosqualene-sterolo ciclasi(c).
La
ciclizzazione
ossidativa
avviene
ad
opera
delle
STEROIDI 9
Il colesterolo svolge due ruoli fondamentali nell’organismo umano:
1.
E’ un componente fondamentale della membrana plasmatica
di tutte le cellule.
2.
E’ un precursore della steroidogenesi a livello delle cellule
endocrine delle surrenali, delle ovaie, dei testicoli e della
placenta.
Tutte le cellule sono in grado di biosintetizzare il colesterolo
anche se la sua principale fonte è costituita dalle lipoproteine a
bassa densità (LDL) che lo contengono sottoforma di esteri.
Le cellule legano le LDL a recettori specifici ad alta affinità
quindi li inglobano per endocitosi e successivamente gli enzimi
lisosomiali liberano il colesterolo all’interno della cellula.
STEROIDI 10
Il colesterolo così liberato regola la biosintesi del colesterolo
stesso, sotto forma di oleato viene immagazzinato e costituisce il
precursore degli ormoni steroidei.
Per scissione enzimatica della catena viene trasformato in
Pregnenolone precursore di adrenocorticoidei e ormoni sessuali.
OH
Colesterolo
Colest-5en-3β
β,22R-diolo
HO
HO
OH
HO
O
Pregnenolone
HO
HO
Colest-5en-3β
β,20R,22R-diolo
STEROIDI 11
Il colesterolo viene anche trasformato, a livello epatico, in acido
colico che viene coniugato con la glicina o la taurina e, sotto
forma dei corrispondenti sali sodici, costituisce la bile.
L’acido colico rappresenta, nell’uomo, il principale metabolita del
colesterolo con una emivita di circa tre giorni.
Gli acidi biliari sono dei tensioattivi che si comportano da
detergenti anionici con la capacità di emulsionare i grassi e le
vitamine liposolubili facilitandone l’assorbimento attraverso la
mucosa intestinale.
OH
COR
Acido Colico R = OH
Acido glicocolico R = NHCH2COOH
HO
OH
Acido Taurocolico R = NHCH2CH2SO3H
STEROIDI 12
Meccanismo d’azione degli ormoni steroidei.
Gli ormoni steroidei sono presenti nel
concentrazioni molto basse (0,1-1,0 nM).
corpo
umano
in
I notevoli effetti fisiologici sui tessuti si possono manifestare sia
in pochi secondi sia in alcuni minuti e in alcuni casi (ormone della
crescita) in tempi assai più lunghi (mesi).
Essi, essendo lipofili, vengono trasportati nel sangue legati a
proteine trasportatrici mentre la frazione libera è minima.
Una volta nella cellula lo steroide entra nel nucleo dove si lega alle
proteine recettoriali attivandola. Come conseguenza la proteina
dimerizza.
STEROIDI 13
Questo dimero interagisce con particolari regioni
cellulare (HRE – Hormon Responsive Elements).
del
DNA
La conseguenza di questo legame è la trascrizione della sequenza
del DNA per dare mRNA che a sua volta incrementa la sintesi
proteica a livello del reticolo endoplasmastico.
Tra le proteine così sintetizzate troviamo enzimi, recettori ed
altri fattori che mediano la risposta all’ormone (funzioni cellulari,
crescita e differenziazione).
I meccanismi di base sono quindi simili per tutti gli ormoni
steroidei, quello che cambia è la specificità per certe proteine
recettoriali che, a loro volta, mettono in moto specifici processi
genetici.
STEROIDI 14
Corticosteroidi
I corticosteroidi vengono biosintetizzati e secreti dalle ghiandole
surrenali.
Glucocorticoidi - vengono prodotti in seguito a stimolazione da
parte di ormoni peptidici dell’ipotalamo (CRH – Corticotropin
releasing hormone originally named CRF corticotropin-releasing
factor) e della ipofisi (ACTH – corticotropina – ormone
adrenocorticotropo) con un meccanismo di feedback negativo.
Il CRF viene rilasciato dall’ipotalamo e trasportato nell’ipofisi
anteriore dove stimola il rilascio di ACTH nel sangue.
Questo a sua volta stimola la produzione di glucocorticolidi.
Mineralcorticoidi - vengono prodotti sotto l’influenza di octapeptide
l’angiotensina II a sua volta biosintetizzata per idrolisi
proteolitica,
operata
dalla
renina,
dall’angiotensinogeno
plasmatico ad angiotensimna I nel sangue e successiva azione
della ACE (enzima di conversione dell’angiotensina).
STEROIDI 15
Le surrenali sono costituite da due parti: la prima interna
(midollare) che secerne catecolamine; la seconda esterna
(corticale) che produce i corticosteroidi.
L’asportazione chirurgica di queste ghiandole in piccoli animali
porta alla morte.
L’unico steroide depositato nelle surrenali è il colesterolo in
forma di esteri.
L’ACTH agisce a livello della ghiandola surrenale legandosi ad
una proteina recettoriale situata sella superficie delle cellule
della corticale stimolando la secrezione dei glucocorticoidi.
L’interazione con il recettore (accoppiato con una proteina G e
all’adenilciclasi) induce un incremento di cAMP intracellulare che
a sua volta attiva un’esterasi che scinde il colesterolo dai suoi
esteri.
STEROIDI 16
Una volta liberato viene convertito, a livello dei mitocondri, in
Pregnenolone che a sua volta viene trasformato, mediante due
differenti sequenze di reazioni di ossidazione e di
isomerizzazioni, in Idrocortisone e Aldosterone.
Biosintesi Idrocortisone
O
O
OH
17-idrossilasi
(CYP17)
3-ossosteroide4,5-isomerasi
deidrogenasi
HO
HO
O
Pregnenolone
Colesterolo
17α
α-idrossiPregnenolone
OH
O
OH
O
OH
21-idrossilasi
CYP21
O
O
17α
α-Idrossiprogesterone
11-Desossicortisolo
OH
11β
β-idrossilasi
CYP11B1
HO
O
OH
O
Idrocortisone
(Glucocorticoide)
STEROIDI 17
La mancanza di CYP 21 impedisce la formazione di cortisolo e
favorisce
la
conversione
del
17α
α-idrossiprogesterone
incrementando la sintesi di testosterone.
Il Cortisone, metabolita inattivo, viene formato per ossidazione
del carbonio in 11 ad opera di una 11-idrossisteroide
deidrogenasi. Idrocortisone e Cortisone sono metabolicamente
interconvertibili come Estradiolo ed Estrone.
La formazione dell’ Aldosterone, nella zona glomerulare (parte
corticale esterna) è simile a quella del Cotisolo.
O
HO
HO
O
O
Pregnenolone
Colesterolo
Progesterone
OH
OH
OH
O
O
O
O
21-idrossiprogesterone
O
O
HO
HO
O
Corticosterone
Aldosteronee
(Mineralcorticoide)
STEROIDI 18
Il metabolismo del Cortisolo avviene nel fegato - presenta un
emivita di 1-1,5 h – viene escreto nelle urine prevalentemente
sotto forma di O-glucuronide e in minor quantità come estere
solforico dell’Urocortisolo (5β
β-diidrocortisolo) o dell’Urocortisone
(giunzione degli anelli di tipo Cis).
Oltre a questo metabolismo molti composti
l’ossidazione in 11 con inattivazione del prodotto.
subiscono
STEROIDI 19
Principali farmaci.
Cortisone, cortisolo e loro drivati – la sintesi venne pubblicata per
la prima volta nel 1946 da Sarett.
Gli sviluppi successivi si basarono sull’utilizzo di substrati di
partenza naturali:
da acidi Biliari (nel 1949 la Merck americana vendeva il
cortisone a circa 200 $/g poi sceso a 10$/g).
Da diosgenina (1955 la Upjohn mise sul mercato il Cortisone
acetato al prezzo di 3,5 $/g).
Il cortisone viene somministrato come 21-acetato e rappresenta il
farmaco di prima scelta per le persone con insufficienza
surrenale. Dopo somministrazione orali questi esteri vengono
idrolizzati rapidamente a dare cortisone e idrocortisone.
Il cortisolo e il suo 21-acetato vengono assorbiti rapidamente per
via orale con una biodisponibilità del 95% ed una emivita di1-2
ore.
STEROIDI 20
Sia il cortisolo che il cortisone sono assorbiti lentamente (24-48h)
dopo somministrazione intramuscolare.
Altri esteri:
Idrocortisone Cipionato (R = Ciclopentilpropionato);
Idrocortisone Butirrato (R = Butirrato);
Idrocortisone Buteprato (R1= Butirrato e R = propionato);
Idrocortisone Valerato (R1 = Valerato);
Idrocortisone 21-succinato sodico (R1 = H);
Idrocortisone Fosfato sodico (R1 = H);
Idrocortamato cloridrato
HO
CH3 H
H
CH3
O
O
OR
CH3 OR1
HO
CH3 H
O
O
CH3 OH
H
H
O
O
H
N
CH3
Idrocortamato
STEROIDI 21
Di
questi composti l’idrocortamato
impiegato come unguento.
cloridrato
idrosolubile
è
Mentre l’Idrocortisone fosfato e il sodio succinato essendo molto
idrosolubili
sono utilizzati per soluzioni endovena o
intramuscolo. In particolare il fosfato viene rapidamente
idrolizzato dalle fosfatasi con una emivita di 15’ mentre il sodio
succinato viene idrolizzato lentamente e non completamente.
Dopo l’introduzione del cortisone e dell’idrocortisone nella cura
dell’artrite reumatoide (1951), iniziarono le ricerche di nuove
sostanze più attive e con minori effetti collaterali (ritenzione di
sodio e potassio, bilancio negativo dell’azoto, acidità gastrica e
edemi).
Si cercò di separare
glucocorticoide.
l’azione
mineralcorticoide
da
quella
Già da tempo si sapeva, infatti, che l’attività glucorticoide era
vincolata a determinate funzioni quali la chetonica in 3, il
doppio legame 4-5, una funzione ossigenata (alcolica o
chetonica) in 11.
STEROIDI 22
Nel vari tentativi sintetici venne preparato ed isolato anche il
derivato del cortisolo avente un atomo di Br in posizione 9 che,
dalle prove di attività, risultò essere leggermente meno attivo
come glucocorticoide.
Vennero pertanto presi in considerazione altri alogenoderivati e
subito apparve chiara la relazione inversa esistente tra
dimensione dell’alogeno ed attività glucocorticoide.
Nacque così il Fludrocortisone (introdotto nel 1954) che è 11 volte
più attivo del idrocortisone. Incremento maggiore però lo sia
aveva a livello mineralcorticoide dove l’attività cresce
notevolmente (300-800 volte più attivo). Per questo motivo,
causa edemi, è utilizzato come antiinfiammatorio in lozioni ed
unguenti.
Un
anno dopo, le ricerche sempre più mirate portarono i
ricercatori della Schering alla scoperta dei derivati ∆O
O
corticoidi.
OR
OH
OH
HO
OH
HO
H
Br
O
H
H
F
O
H
Fludrocortisoone
STEROIDI 23
Venne così preparata una serie di prodotti aventi attività
leggermente differenziata tra i quali spiccano il Prednisone ed il
Prednisolone e tutti i loro esteri.
Questi ricercatori videro che i derivati ∆-1 sia del cortisone che
cortisolo risultavano possedere maggior attività antireumatica ed
antiallergica
associata
a
minori
effetti
collaterali
mineralcorticoidi.
Questi derivati possono essere preparati:
Mediante deidrogenazione microbiologica del Cortisone e
dell’Idrocortisone operata dal Corynebacterium simplex;
Con metodi sintetici (in particolare SeO2) a partire da
opportuni derivati Pregnanici.
Anche Prednisone e Prednisolone sono interconvertiti nel fegato
ad opera della 11β
β-idrossisteroide deidrogenasi.
O
O
Prednisone
O
OH
O
OH
HO
O
OH
OH
Prednisolone
STEROIDI 24
Essi attribuirono l’incremento dell’attività alla conformazione
assunta dall’anello A in seguito alla doppia insaturazione:
sedia
mezza sedia
barca appiattita.
Sono assorbiti completamente dopo somministrazione orale con
una biodisponibilità >80%.
Vengono metabolizzati in composti più idrofili e meno attivi senza
tuttavia riduzione dell’anello A.
Eliminazione attraverso le urine come glucuronidi.
Nella cura dell’artrite reumatoide sia il prednisone che il
Prednisolone
sono
utilizzati
a
dosi
minori
rispetto
all’Idrocortisone.
Il prednisolone acetato è utilizzato in sospensione o come
unguento. Il 3,3-dimetilbutirrato è utilizzato per soluzioni
parenterali in quanto, data l’insolubilità, forma un deposito
sottocutaneo a lento rilascio.
STEROIDI 25
Il Prednisolone fosfato (al C-21) viene usato per via endovena o
intramuscolo e svolge una rapida azione con emivita di 5’ (viene
idrolizzato rapidamente dalle fosfatasi).
I risultati sull’uso di questi ∆1 sembrano controversi nei primi
mesi di somministrazione ma per tempi di somministrazioni più
lunghi danno risposte significativamente migliori.
Nonostante la minima attività mineralcorticoide essi sono in
grado di dare ipopotassemia e ritenzione di sodio e acqua.
Metilprednisolone - nasce dalla ricerca condotta su metil derivati.
Inizialmente il metile venne introdotto in 2α
α- senza particolari
risultati. Successivamente si penso di bloccare con un metile la
posizione 6 per impedire l’attacco metabolico. Si arrivò cosi al
composto 6α
α-metil-11β
β,17α
α,21-triidrossipregna-1,4-dien-3,20dione (Metilprednisolone) dotato di attività glucocorticoide
aumentata e ridotti effetti sulla ritenzione idrica (1956).
O
OH
OH
O
O
CH3
STEROIDI 26
Il picco massimo della sua conc lo si raggiunge dopo30-60’.
In forma di acetato è utilizzato per uso topico mentre nelle
preparazioni iniettabili si usa il sodio emisucinato.
Triamcinolone - La conclusione logica delle ricerche non poteva che
essere l’abbinamento della ∆1-insaturazione con il Fluoro in
posizione 9 oltre alla presenta in 16α
α- di un idrossile.
Quest’ultima modifica deriva dall’osservazione che i metaboliti
ossidrilati in 16 possedevano ancora attività glucocorticoide con
ridotta attività mineralcorticoidi.
Ha una bassa biodisponibilità (più idrofilo) che ne riduce la
potenza antiinfiammatoria a seguito di somministrazione orale.
Viene utilizzato come 17,21-diacetato o di
[16α
α,17α
α-metilendiossi-21-(3,3-dimetilbutirrato)].
esacetonide
O
O
OH
O
OH
HO
OH
O
HO
O
OH
F
O
O
OAc
OAc
HO
F
F
O
O
O
STEROIDI 27
Il Triamcinolone ha una potenza superiore a quella
Prednisolone ma paragonabile a quella del Metilprednisolone.
del
Gli effetti sulla ritenzione idrica sono minimi anzi stimola la
diuresi ma presenta effetti collaterali quali anoressia, debolezza
muscolare e perdita di peso.
Il triamcinolone, usato per via intramuscolare, è un ottimo
rimedio per il trattamento delle dermatosi e in associazione con
antagonisti dell’acido folico è utile nella psoriasi.
Desametasone – l’introduzione di un metile in 16 deriva dall’intento
di stabilizzare la catena in 17 dall’azione del metabolismo.
Questo 16α
α-metile si è rivelato più efficace dell’analogo
ossidrilato come antiinfiammatorio. Ciò è attribuibile ad un
aumento della lipofilia.
Il picco massimo del Desametasone lo si ottiene dopo 10-20’
dalla somministrazione.
OH
O
Effetti collaterali sono aumento di peso,
eccessivo appetito, gonfiore e dilatazione
addominale.
OH
HO
CH3
F
O
STEROIDI 28
Betametasone – corrisponde all’epimero del Desametasone in 16 e
possiede un’attività leggermente superiore.
O
OH
OH
HO
CH3
F
O
Farmacocinetica dei corticosteroidi comunemente usati per via orale.
STEROIDI 29
Proprietà farmacologiche e Farmacocinetiche di alcuni corticosteroidi.
STEROIDI 30
Glucocorticoidi ad uso topico
Assorbiti in piccola quantità in funzione:
del tipo di crema o unguento utilizzato;
delle condizioni della pelle dove viene applicato;
del tipo di bendaggio usato.
Una volta assorbiti attraverso la cute, subiscono lo stesso
metabolismo da parte del fegato ed escreti nelle urine.
I corticosteroidi topici anche se assorbiti a livelli bassissimi
possono esporre a rischi sistemici.
I prodotti dermatologici possono essere:
A bassa potenza ed hanno effetti antiinfiammatori modesti e
sono i più sicuri per l’utilizzo cronico;
A potenza media e vengono utilizzati in dermatosi modeste con
cura di limitata durata;
Ad alta potenza utilizzati in dermatosi più gravi sempre per
trattamenti di breve durata e di piccole superfici.
STEROIDI 31
Corticosteroidi ad uso topico
STEROIDI 32
Tra i glucocorticoidi più recenti ricordiamo i derivati clorurati.
Tra essi ricordiamo il Beclometasone, analogo clorurato del
betametasone, che possiede un’attività 5000 volte superiore a
quella del cortisolo 550 più attivo del betametasone e
desametasone e solo 5 volte più potente del Fluocinonide.
Quest’ultimo è il derivato acetilato sull’ossidrile in
Fluocinolone che appartiene alla categoria dei
difluorurati (6α
α,9α
α-difluoro 16α
α,17α
α-acetonide) .
21 del
derivati
Questi derivati sono dei potenti antiinfiammatori utilizzati solo
topicamente (in particolar modo i derivati acetonidici più
lipofili).
La Psoriasi è una delle poche dermatiti infiammatorie che non
rispondono al trattamento routinario topico con corticosteroidi.
O
O
HO
OR
CH3
O
F
O
F
CH3
Fluocinolone R = H
Fluocinonide R = Ac
STEROIDI 34
Glucocorticoidi per via intranasale
Non potendo dissociare completamente l’attività antiinfiammatoria
dagli effetti collaterali è diventato estremamente importante
l’aspetto farmacocinetico ed in particolare:
il loro rapido assorbimento a livello sistemico;
la rapida clearance dopo assorbimento gastrico;
la breve emivita;
la formazione di metaboliti inattivi.
Per questo motivo sono state sviluppate:
tecnologie di somministrazione intranasale, data l’alta superficie
per l’assorbimento mostrata dal tessuto polmonare e nasale;
Nuovi farmaci aventi una maggior affinità per il recettore
glucocorticoide e una minor biodipsonibilità rispetto a quelli visti
precedentemente.
STEROIDI 33
La sostituzione in 21 dell’ossidrile con un atomo di Cloro porta al
Clobetasolo propionato e Mometasone furoato entrambi derivati
antiinfiammatori risultati più attivi del Betametasone.
Il
clobetasolo propionato e l’Alobetasolo
corticosteroidi per uso topico.
sono
i
più
potenti
In commercio vi sono anche molti analoghi non fluorurati del
Triamcinolone a dimostrazione che gli atomi di alogeno non
sempre sono indispensabili all’attività.
Cl
O
OR
HO
CH3
R1
O
Clobetasolo propionato R =-COEt R1 = F R2 = H
Mometasone furoato R = -CO-Furano R1 = Cl R2 = H
Alobetasolo propionato R =-COEt R1 e R2 = F
R2
OAc
O
HO
O
O
Amcinonide
O
STEROIDI 35
Il Mometasone furoato, il Budesonide e il Fluticasone
propionato sono i più lipofili e quindi quelli più usati nella
terapia orale e sistemica.
Il Budesonide viene rapidamente assorbito dalle mucose e
trasportato nel sangue ed altrettanto velocemente viene
metabolizzato nel fegato.
Della dose somministrata per via inalatoria solo il 30% max
viene depositata nel tratto respiratorio. La restante quantità
viene assorbita dalle mucose della bocca e della gola ed
assorbito nel tratto gastrointestinale.
Pertanto la loro attività e gli effetti collaterali dipendono dalla
frazione assorbita dai polmoni e dal tratto gastrointestinale.
FH2C
Cl
S
OH
O
OR
HO
HO
CH3
O H
O
O
F
R =-CO-CH2-CH3
Fluticasone propionato
CH3
O
F
O
OR
HO
Cl
O
O
Budesonide
R =-CO-Furoil
Mometasone furoato
STEROIDI 36
Relazione struttura attività
Essenziale per attività
glucocorticoide
Aumenta l’attività glucocorticoide
e ne rallenta la metabolizzazione
Essenziale per attività
mineralcorticoide
OH
O
OH
HO
CH3
F
Essenziale per attività
sia mineralcorticoide che
glucocorticoide
O
Non è essenziale ma
potenzia l’attività
glucocorticoide
Aumenta la durata d’azione ed
elimina attività mineralcorticoide
Aumento dell’attività glucocorticoide (x10) e di
quella mineralcorticoide (x125) e previene
l’ossidazione del OH in 11
STEROIDI 37
I mineralcorticoidi naturali sono privi di ossidrili in 11 e 17 la
cui presenza riduce l’effetto ritentivo sul sodio.
Nell’interazione con il recettore sembra giocare un ruolo
fondamentale la catena in 17 e la presenza di sostituenti sugli
anelli C e D.
Meno marcate sono le differenze a livello dei primi due anelli A
e B.
Interessante sembra la posizione dei sostituenti:
L’incremento di sostituenti in posizione β della struttura
abolisce l’attività glicogenica;
L’introduzione di sostituenti in α su anelli A, C e D
sembra essenziale per l’attività sodio ritentiva.
STEROIDI 38
Effetti fisiologici
Effetto glucocorticoide - regolano la biosintesi ed il metabolismo
di carboidrati, lipidi, proteine.
Innanzitutto servono a mantenere i livelli ematici del glucosio
critici per la vita.
Stimolano la formazione di glucosio diminuendone l’utilizzo da
parte dei tessuti periferici e promuovendo la sintesi di
glicogeno nel fegato mediante aumento di:
glicogeno sintetasi;
Fosfoenolpiruvato carbossichinasi;
Glucosio-6-fosfato chinasi.
Promuovono pertanto
aumentando la:
il
metabolismo
tirosina aminotransferasi;
triptofano ossidasi;
Alanina transamminasi.
degli
amminoacidi
STEROIDI 39
Nei tessuti periferici provocano la diminuzione dell’utilizzo del
glucosio mediante calo della fosfochinasi, indotta da
glucocorticoidi, che catalizza la formazione di D-fruttosio1,6-difosfato a partire dal D-fruttosio-1-fosfato durante la
glicolisi.
Prevengono e riducono le reazioni infiammatorie
inducono la produzione ed
il rilascio di macrocortine e
lipomodulina
Fosfolipasi
A2
Prostaglandine
trombossani
leucotrieni
Stabilizzazione degli enzimi
lisosomiali
Blocco del rilascio di
enzimi idrolitici
(collagenasi)
Distruzione del
collagene delle
articolazioni
Prevengono e riducono le reazioni immunitarie sopprimendo:
STEROIDI 40
l’espressione della Interleukina-1 (IL-1) a livello dei macrofagi
interferndo con la proliferazione dei linfociti B importanti per la
produzione di anticorpi e per l’attivazione di linfociti T necessari
al realizzarsi dell’immunità mediata da cellule
viene così ad essere ridotta anche l’espressione da parte delle
cellule T di Interleukina-2.
il fattore di necrosi tumorale (TNF).
Attività immunosoppressiva ed antiallergica – provocano la lisi dei
linfociti umani dopo attivazione autoimmune e sopprimono la
risposta dei linfociti T a mitogeni e antigeni.
Artrite reumatoide ed asma grave;
Anemia emolitica autoimmune,
Epatite cronica autoimmune.
Possono essere utilizzati nel trattamento antirigetto nei trapianti
d’organo.
STEROIDI 41
Effetti collaterali
Sono dovute alle loro azioni fisiologiche e richiedono un controllo
adeguato della terapia.
Disordini gastrointestinali;
Aumento della concentrazione plasmatica del glucosio e dei lipidi;
Bilancio negativo dell’azoto,
Ipocaliemia, edema, astenia e aritmie cardiache.
Soppressione asse ipotalamo-ipofisi-corteccia surrenale
Effetto mineralcorticoide – mantenere il bilancio elettrolitico
corporeo elevando il riassorbimento di Na+ e la secrezione di K+
e H+ soprattutto a livello dei reni ma anche di altri organi
secretori (ghiandole salivari, sudoripare e sulle mucose del tratto
gastrointestinale).
O O
OH
HO O
OH
OH
O
OH
O
OH
O
OH
O
O
Aldosterone
O
11-desossicortisolo
O
11-desossicorticosterone
STEROIDI 42
L’azione dell’aldosterone si esplica attraverso la trascrizione
genica, la biosintesi del mRNA e delle proteine.
In particolar modo viene sintetizzata la AIP (proteina indotta
da Aldosterone) che agisce da permeasi incrementando la
permeabilità della membrana al Na+.
si ha un rapido incremento di Na+ e si incrementa lo scambio
Na+/K+.
Fludrocortisone Acetato è l’unico mineralcorticoide utilizzato per
os in quanto il fluoro in 9 aumenta questa attività ed i suoi
effetti glucocorticoidi risultano trascurabili.
O
HO
OAc
OH
F
O
Fludrocortisone acetato
STEROIDI 43
Antagonisti
Corticosteroidi:
la
maggio
parte
degli
inibitori
degli
adrenocorticosteroidi agisce impedendone la biosintesi andando a
bloccare uno o più complessi dell’enzima citocromo P450. tra questi
ricordiamo:
Ketoconazolo - a concentrazioni elevate inibisce anche
gli enzimi legati al P450.
Metirapone – inibisce prevalentemente la 11β
β-idrossilasi
ma anche la 18-idrossilasi e la scissione della catena.
Aminoglutetimide – inibisce la scissione della catena
laterale ed è usata come adrenolectomizzante chimico.
Spironolattone è l’antagonista dell’aldosterone per uso orale. Esso
favorisce l’escrezione di Na+ impedendo l’eliminazione di K+ e H+.
O
O
O
Et
HN
O
Aminoglutetimide
O
N
N
NH2
Metirapone
H3C CH3
O
Spironolattone
S
O
STEROIDI 44
Ormoni sessuali femminili
L’ovulazione rappresenta uno degli stadi fondamentali del ciclo
riproduttivi femminile ed è regolato dai sistemi endocrino e
nervoso centrale.
Ormone di rilascio
ormone luteinizzante
Ormone luteinizzante
Ormone stimolazione
dei follicoli
Correlazione tra ipotalamo, ovaie ed apparato riproduttivo
Le due gonadotropine (FSH e LH) controllano l’attività delle
ovaie (la maturazione del follicolo) e la produzione di ormoni
sessuali (aumentare la produzione di estrogeni).
STEROIDI 45
Il tasso di ormone luteinizzante (LH) raggiunge il massimo a metà
del ciclo mestruale ed induce l’ovulazione mentre è basso durante
la mestruazione.
L’ormone FSH raggiunge i livelli massimi durante la mestruazione
e si riduce prima e dopo l’ovulazione.
Una volta avvenuta l’ovulazione, l’ormone LH trasforma il follicolo
in corpo luteo ed aumenta la disponibilità di Progesterone che a
sua volta inibisce LH.
Completato,
il
corpo
luteo degenera ed i livelli
di Progesterone e di
estrogeni diminuiscono.
Il ciclo
FSH-RF
ricomincia
da
STEROIDI 46
Se l’ovulo viene fecondato, il ciclo mestruale si interrompe per la
presenza di una quarta gonadotropina prodotta dalla placenta e
chiamata gonadotropina corionica.(HCG).
Questa gonadotropina mantiene e prolunga la vita del corpo luteo
e può essere rilevata nelle urine dopo 14 giorni.
Il corpo luteo, sotto lo stimolo di HCG produce una adeguata
quantità di ormoni steroidei che assicura, per le prime 9
settimane, il mantenimento della gravidanza.
La placenta provvede, dopo questo periodo, a produrre gli
estrogeni ed i progestinici necessari alla normale gestazione e
questi raggiungeranno il massimo pochi giorni prima del parto.
Nelle femmine il primo flusso mestruale compare nella pubertà
attorno ad un’età media di 13 anni.
Tali cicli riproduttivi si mantengono regolari per un periodo di
circa 30-40 anni e successivamente diventano irregolari.
Dopo 40-50 anni questi cessano e la donna entra in climaterio.
STEROIDI 47
ESTROGENI
Sono ormoni così chiamati in quanto in grado di produrre l’estro in
varie specie animali.
Svolgono anche l’importante ruolo di portare allo sviluppo dei
caratteri secondari delle femmine (crescita dei capelli,
ammorbidimento della pelle, ingrossamento del seno, deposizione
grasso su cosce, natiche e fianchi).
Gli estrogeni stimolano anche la crescita e lo sviluppo dell’apparato
riproduttivi femminile compresi ovidotto, collo dell’utero e vagina.
Vengono biosintetizzati principalmente nelle ovaie delle donne
sessualmente mature ma durante la gravidanza è la placenta la
fonte principale degli estrogeni attraverso una via biosintetica
diversa.
Nel maschio piccole quantità sono prodotte nei testicoli.
In entrambi i sessi si ha produzione nella corteccia surrenalica,
nell’ipotalamo e nell’ipofisi anteriore.
STEROIDI 48
La fonte principale degli estrogeni nell’uomo e nella donna in
menopausa sono i tessuti extraghiandolari ma soprattutto quello
adiposo.
Nell’ovaio il FSH agisce stimolando il follicolo alla biosintesi di
estrogeni attraverso la conversione del colesterolo in androgeni da
parte delle cellule tecali e le cellule granulose convertono questi
ultimi in estrogeni.
Dopo l’ovulazione, l’ormone LH agisce sul corpo luteo per stimolare la
biosintesi e la secrezione degli estrogeni e del progesterone.
STEROIDI 49
Dopo la conversione a Pregennolone questo può essere convertito in
progesterone da una 5-ene-3β
β-idrossisteroide deidrogenasi e
dalla 3-ossosteroide-4,5-isomerasi.
Più complessa è la trasformazione del Pregnenolone in estrogeni. La
17α
α-idrossilasi inizialmente ossida la posizione 17 e poi stacca la
catena
fornendo
il
deidrossiepiandrosterone
(17α
α-idrossi
Pregnenolone).
La conversione di questo nel
corrispondente
androstendione avviene ad
opera di una 5-ene-3β
βidrossisteroide.
Esso
è
convertibile
nello
intermedio
ridotto
Testostrone da una 17β
βidrossisteroide deidrogenasi.
La perdita del metile angolare e
l’aromatizzazione portano allo
Estrone e al 17 β-estradiolo
STEROIDI 50
L’Androstendione è il substrato preferito per l’aromatizzazione e a
tal fine sono necessarie 3 molecole di NADH e 3 di ossigeno.
Questi 3 passaggi sono tutti catalizzati dallo stesso complesso
enzimatico costituito dalla proteina CYP19 e dalla NADHcitocromo P450 reduttasi presenti nel reticolo endoplasmatico
della cellula.
Metabolismo – Estrone ed Estradiolo sono biochimicamente
interconvertibili da una estradiolo deidrogenasi e pertanto i
metaboliti sono gli stessi.
Vengono escreti come glucuronidi o come solfati idrosolubili.
Durante questo metabolismo epatico possono subire solfatazione e
desolfatazione al fine di creare una riserva di ormone.
STEROIDI 51
Gli estrogeni naturali sono poco attivi per os in quanto durante il
metabolismo epatico di primo passaggio sono subito coniugazione.
I metaboliti catecolici si possono legare ai recettori degli estrogeni
producendo effetti deboli o moderati.
STEROIDI 52
Estrogeni steroidei
Estradiolo – Estrogeno più potente possiede alta affinità per il
recettore e grande potenza per via parenterale. Viene
metabolizzato a 2-idrossi ed escreto come solfato.
Esteri dell’estradiolo – tra quelli in terapia ricordiamo il cipionato.
Etinilestradiolo – più potente(15-20 volte) dell’estradiolo per via
orale in quanto stabilizzato all’ossidazione metabolica in 17.
anche lui subisce metabolismo di primo passaggio nel fegato. Ha
una emivita di 26 ore.
Mestranolo – rappresenta un profarmaco e viene metabolizzato a
livello epatico ad etinilestradiolo.
Entrambi sono utilizzati principalmente nei contraccettivi orali.
OH
OH
OH
C CH
OH
HO
HO
Estradiolo
Estrotriolo
RO
Etinilestradiolo R = H
Mestranolo R = Me
STEROIDI 53
Estrogeni coniugati – sono miscele di sali sodici dei dolfati dei
metaboliti dell’Estradiolo e pertanto idrosolubili. Sono di origine
equina o sintetica.
Sono generalmente una miscela di Estrone solfato sodico (~60%)
e di equilina solfato sodico (~30%) o altri metaboliti minori.
I cavalli producono solo due estrogeni Equilina e Equileina.
O
HO
O
RO
Equilenina
O
RO
Equilina R = H
Equilina solfato sodico
R = SO3- Na+
Estrone R = H
Estrone sodio solfato
Estrone piperazina solfato
R = SO3-
HN
NH2+
STEROIDI 54
Dosaggio degli estrogeni
STEROIDI 55
Proprietà farmacocinetiche di alcuni principali Estrogeni
STEROIDI 56
Estrogeni non steroidei
La struttura steroidica non è fondamentale per l’attività
estrogenica tantè che esistono estrogeni non steroidei e quasi
tutti sono derivati del trans-stilbene.
Uno dei più importanti è il Dietilstilbestrolo o α,α
α’-dietil-4-4’stilbendiolo (DES).
Questo composto presenta isomeria cis-trans a livello del doppio
legame e l’siomero trans è il più attivo (sospetto cancerogeno).
L’Esestrolo nella sua forma meso è il più attivo dei derivati
idrogenati del DES ed è meno attivo.
Un composto pure lui attivo per os è il Dienestrolo ma viene
utilizzato solo per via intravaginale e comunque presenta effetti
sia farmacologici che tossici e le controindicazioni tipiche delle
terapia con estrogeni.
OH
HO
Trans-Stilbene
Dietilstilbestrolo
OH
HO
OH
HO
Esestrolo
Dienestrolo
STEROIDI 57
Relazione struttura attività
Fondamentale per l’attività è.
la presenza dell’anello A di tipo aromatico con ossidrile
in posizione 3.
OH
Il gruppo funzionale in 17β
β-OH.
La distanza tra i due ossidrili;
La planarità e idrofobicità della molecola. HO
Ne risulta che l’attività sia legata alla presenza dei due ossidrili,
sostituenti in grado di formare legami idrogeno e che la catena
carboniosa serva solo da spaziatore.
Nel DES e nell’Estrone la distanza varia da 12,1 a 10.3 Å.
Questa diversità nelle distanze fa ipotizzare un meccanismo
d’azione nel quale l’anello D interagisce con una zona
recettoriale sufficientemente flessibile da consentire questa
variabilità di distanze. In alternativa si pensa che una molecola
d’acqua possa porsi a ponte colmando la distanza.
STEROIDI 58
Inoltre:
L’introdusione di un sostiutente in 1 riduce l’attività;
Pochi sostituenti sono accettati in 2 o in 4;
Ossidrili in 6, 7 e 11 riducono l’attività;
Analoga diminuzione è provocata dalla singola rimozione
degli ossidrili,
dall’epimerizzazione in 17 e dalla
insaturazione dell’anello B.
Incrementi di attività si hanno con l’introduzione di sostituenti in:
17α
α - accetta gruppi etinile e vinile ma non gruppi
polari;
16 – sopporta la presenza di gruppi funzionali piccoli e di
modesta polarità.
L’anello D non può essere allargato ad esaatomico ma può essere
aperto in quanto l’acido Doisinolico derivante presenta una
discreta attività ormonale.
COOH
HO
STEROIDI 59
Impiego
Oltre che come contraccettivi, gli estrogeni trovano impiego in
una grande varietà di turbe mestruali. Inoltre sono efficaci
nella deficienza ovarica, nell’acne e nelle vaginiti senili.
Vengono anche usati per sopprimere la lattazione.
Sono spesso usati anche nella osteoporosi dopo la menopausa
quando l’assenza di estrogeni si pensa possa causare perdita di
calcio.
Anche alcune forme di turbe psichiche e fisiche nelle donne
dopo la menopausa sono controllate con estrogeni.
STEROIDI 60
Antagonisti degli estrogeni
Sono importanti perché possono essere impiegati per modificare
i processi riproduttivi e trattare il tumore del seno estrogenodipendente.
Esistono tre classi:
“Impeded” interagiscono con il recettore ma si dissociano da
esso prima che possa dare effetti rilevabili (Estriolo).
“Trifenilici” si legano saldamente ai recettori estrogenici
formando complessi molto stabili che sono però inattivi.
Inibitori della “aromatasi” enzima legato al citrocomo P450
responsabile dela conversione degli androgeni in estrogeni.
Derivati del Trifeniletilene – antiestrogeni
Sono correlati agli estrogeni non steroidei e si legano fortemente
ai recettori estrogenici formando complessi stabili ma inattivi.
Tra questi ricordiamo il Clomifene citrato (ha proprietà
estrogena come isomero cis ed antiestrogena come trans) usato
nel trattamento della sterilità.
STEROIDI 61
Il clomifene provoca aumento della secrezione delle gonadotropine
FSH e LH con conseguente sviluppo e maturazione del follicolo
ovarico, ovulazione e maturazione del corpo luteo.
L’attività deriva dall’interazione con i recettori nell’ipotalamo con
blocco dell’inibizione a feedback.
Il Tamoxifene è una agonistaantagonista
usato
nella
cura del tumore al seno
dipendente da estrogeni.
Antiestrogeni
Il metabolita 4 -idrossi è un
composto attivo.
Tutti questi derivati essendo
metabolizzati velocemente
nel
fegato,vanno
somministrati con cautela
in
pazienti
con
danni
epatici.
Fulvestrant
STEROIDI 62
Antagonisti “Impeded” - Tra questi composti dobbiamo ricordare lo
Estratriolo che qualora venga utilizzato in concetrazioni
elevate è in grado di bloccare il recettore ed impedire che
l’Estradiolo esplichi la sua attività.
Inibitori dell’aromatasi - Sono raggruppabili in due classi:
1.
Derivati dell’Androstendione – servono a bloccare la
conversione degli androgeni in estrogeni. Vengono utilizzati nel
trattamento della funzione riproduttiva e nella cura di forme
tumorali estrogeno-dipendenti.
Essi competono con l’Androstendione per il legame al sito
attivo dell’enzima aromatasi. L’analisi struttura attività su
questi derivati indica che essi devono essere analoghi al
substrato e differire da esso per piccole variazioni strutturali
O
O
all’anello A e in 19.
O
O
O
O
O
O
OH
O
4-idrossiandrostendione
O
O
S
O
6-metilenandrostendione
1-metilandrostandiendione
S
10β
β-propinilandrostendione
NH2
NH2
STEROIDI 63
2.
Derivati triazolici – essi inibiscono selettivamente in modo
competitivo la trasformazione del testosterone a estrogeni in
tutti i tessuti.
riducono la concentrazione di Estradiolo, Estrone
e
dell’Estrone solfato circolanti senza intaccare la sintesi di
ormoni corticosteroidi, dell’Aldosterone e degli ormoni tiroidei.
Dato che l’estrogeno agisce da fattore di crescita per il
tumore al seno, la riduzione delle concentrazioni plasmatiche
inibisce lo sviluppo della malattia.
Essi si legano con il triazolo al gruppo eme del complesso
enzimatico del CYP19.
N
N
N
N
N
N
N
N
OH
N
N
N
NC
CN
Anastrazolo
N
Cl
Vorozolo
CN
NC
Letrozolo
NC
C
N
Metabolita
STEROIDI 64
PROGESTINICI
Il Progesterone è l’ormone naturale che da solo è in grado di di
assicurare una gestazione normale.
Sintetizzato a livello del corpo luteo a partire dal Pregnenolone
nella fase luteale e serve a :
Sviluppare l’endometrio per accogliere eventualmente
l’ovulo fecondato;
Mantenere la gravidanza sopprimendo le mestruazioni.
Essendo indispensabile durante tutta la gravidanza per la
regolazione del ciclo endoteliale viene considerato un
contraccettivo naturale (inibisce l’ovulazione).
Questo ormone è inoltre il precursore di androgeni, estrogeni e
corticosteroidi.
STEROIDI 65
Analogamente a tutti i coritcosteroidi ed indipendentemente
dalla via di somministrazione, viene metabolizzato rapidamente,
emivita di 5-10’, a livello epatico con riduzione
del doppio legame (sia 5α
α- che 5β
β-diidro);
Del chetone in 3 (sia 3α
α- che 3β
β-olo);
Del chetone in 20 quasi solo in configurazione 20(S).
Principale
metabolita
STEROIDI 66
Lo steroide più abbondante nelle urine di donne gravide è il
glucuronide del 5α
α-pregnandiolo, Esso è anche il principale
metabolita che si ha dopo somministrazione di Progesterone
esogeno.
Progestinici Sintetici
Il progesterone Ha scarsa attività orale e va somministrato per
via parenterale.
La necessità di disporre in quantità elevate di questo ormone ha
stimolato la sintesi a partire da composti naturali ed in
particolare dalla Diosgenina.
Questa viene estratta dalle radici di una
pianta
spontanea,
la
Dioscorea
mexicana,
dove
è
contenuta
in
abbondanza.
H3C
CH3
CH3
HO
CH3
O
O
STEROIDI 67
Preparazione del Progesterone da Diosgenina
Diosgenina messicana
“barbasco”
H3C
CH3
O
CrO3
O
CH3
Py - HCl
H3C
CH3
CH3
H3C
CH3
(CH3CO)2O
O
CH3
AcO
CH3
O
O
CH3
O
CH3
AcO
HO
AcO
O
CH3
(CH3CO)2O
CH3
O
O
CH3
CH3
H2 - Pd/C
CH3
CH3
CH3
1) Saponificazione
CH3
2) Oppenauer
AcO
∆16-Prognenolone3-acetato
AcO
Prognenolone-3-acetato
OAc
O
Progesterone
CH3
STEROIDI 68
Progestinici derivanti dal progesterone.
per ovviare alla rapida metabolizzazione sono stati preparati
numerosi derivati tendenzialmente sostituiti in:
17α
α al fine di ridurre l’attacco metabolico in 20;
6 per rallentare il metabolismo del 3-cheto ∆4.
Sia l’acetato che il caproato del 17α
α-idrossiprogesterone sono
somministrati mediante iniezione oleosa, poco attivi per os, e
sono a lunga durata.
Medrossiprogesterone acetato - presenta un metile in posizione 6α
α
che ne accrescere la lipofilia e ne potenzia l’attività.
Possiede un’attività 25 volte superiore all’Etisterone
modesta attività estrogena e senza effetti androgeni.
con
Viene usato anche contro carcinoma al seno e all’endometrio.
17α
α-Idrossiprogesterone
17-acetato
17α
α-Idrossiprogesterone
17-caproato
O
O
CH3
CH3
CH3
OR
CH3
CH3
O
O
CH3
CH3
OAc
Medrossiprogesterone
17-acetato
STEROIDI 69
Il Megestrolo 17-acetato rappresenta il prosieguo delle ricerche
con l’introduzione di un doppio legame in 6 alla struttura
precedente.
Infine abbiamo Clormadinone 17-acetato che viene utilizzato sia
come progestinico che come antineoplastico.
Sempre tra i composti 17α
α-idrossi ricordiamo i 19-nor-derivati
Gestonorone - usato sia come progstinico che nel trattamento
dell’ipertrofia prostatica;
Normegestrolo – solo progestinico senza effetti androgenici.
Bisogna anche ricordare il Medrogestone che presenta un metile in
posizione 17α
α che ne accrescere la lipofilia e ne potenzia
l’attività.
O
Megestrolo 17-acetato
R= Me
Clormadione 17-acetato
R= Cl
CH3
O
CH3
OAc
CH3
CH3
OCOR
CH3
O
O
R
R
O
CH3
CH3
CH3
CH3
Medrogestone
O
CH3
Gestonorone 17-caproato
R= H
Normegestrolo 17-acetato
R= Me
STEROIDI 70
Preparazione dei derivati 17α
α-idrossi del progesterone
∆16-Prognenolone3-acetato”
O
CH3
O
O
CH3
CH3
H2O2
CH3
O
CH3
CH3
HBr in AcOH
CH3
CH3
CH3
OH
Br
NaOH
AcO
HO
HO
O
CH3
H2 Pd/C
O
O
CH3
OH
CH3
CH3
CH3
CH3
OAc
Oppenauer
O
HO
H
O
O
CH3
CH3
CH3
OAc
STEROIDI 71
Progestinici della serie 17α
α-etinil testosterone
Etisterone – primo progestinico di sintesi ottenuto nel tentativo
di rendere attivo per os il testosterone. Meno attivo per via
iniettabile ma molto più potente per os come progestinico.
Da lui deriva il Dimetisterone ma anche lo sviluppo di farmaci
privi della catena in 17 e del metile 19.
Nel 1944 Ehrestein stabilì che il metile angolare C19 in 10 non
è necessario per l’attività e si arrivò così al Norprogesterone
che differisce dal progesterone per la mancanza del metile e
rispetto al quale possiede un’attività 8 volte superiore. È il più
potente progestinico noto.
O
OH
C CH
O
OH
C C CH3
O
O
CH3
STEROIDI 72
La scoperta dei nor-steroidi portò allo sviluppo di nuovi
progestinici attivi per via orale ed in particolare di
Noretindrone (Noretisterone) e di Noretinodrel (∆
∆5-10) che
sono stati i primi composti utilizzati a livello clinico.
La loro azione come contraccettivi e nel trattamento delle
turbe mestruali ha stimolato la ricerca di altri 19-norsteroidi.
Per quanto concerne il chetogruppo in 3 si può dire che:
La riduzione a 3β
β-idrossi conduce all’Etinodiol diacetato un
progestinico particolarmente attivo ed utilizzato nella
contraccezione (+ estrogeno);
La sua rimozione conduce al Linestrenolo
CH3 OH
C CH
CH3 OH
C CH
CH3 OAc
C CH
H
O
Noretindrone
H
O
Noretinodrel
H
CH3 OH
C C
H
AcO
Etinodiol diacetato
Linestrenolo
STEROIDI 73
Infine si è scoprì che sostituendo nel Noretindrone il metile
angolare in C13 con un Etile si potenziava l’attività progestinica
aprendo la strada ai 18-omo derivati.
Tra questi ricordiamo:
Il Norgestrel o Levonorgestrel è 100 volte più potente del
precursore (usato in associazione come anticoncezionale);
Il Gestodene (un ∆15);
Il Norgestimato che è l’ossima del Norgestrel acetato;
Il Desogestrel che è privo del 3-cheto ma presenta un
metilene in 11. Modificata la stereochimica con perdita di
attività sia androgena che estrogena.
Sono
tutti
contraccettivi
orali
sono
assorbiti
quasi
completamente e vengono metabolizzati nella mucosa gastrica e
nel fegato.
H3C
H3C
OH
C CH
H3C
OH
C CH
H
O
Norgestrel
OAc
C CH
H3C
H2C
OH
C CH
H
O
Gestodene
HO
N
Norgestimato
Desogestrel
STEROIDI 74
Relazione struttura attività
L’attività è vincolata alla struttura steroidica.
Possono essere classificati in quattro gruppi:
1. Derivati del progesterone variamente sostituiti in 6 e in
17α
α;
2. Derivati del 19-nor-progesterone variamente sostituiti in 6
e in 17α
α;
3. Derivati del 19-nor-17
19-nor-17α
α-etiniltestosterone;
4. Derivati del 19-nor-18-omo-17α
α-etiniltestosterone.
O
1
R = H Clomadione;
O
2
OR
OAc
Megestrolo acetato
R = OAc Clomadione acetato
O
O
CH3
Cl
3
4
OH
C CH
Noretindrone
OH
C CH
Norgestrel
O
O
STEROIDI 75
Nel caso del progesterone e del suo nor-derivato sembrano
essenziali:
il chetone in 3 con l’insaturazione ∆4;
il chetogruppo in 20 (i 20 idrossi sono molto meno attivi).
L’introduzione di:
Un doppio legame in 16-17 riduce l’attività;
Un gruppo 17α
α-acetossi incrementa l’attività;
Un metile od un alogeno in 6 aumenta l’attività.
Il gruppo etinilico introdotto in 17α
α- rende il composto attivo per
via orale.
Nel noretindrone è possibile:
Ridurre il 3-cheto
(Etinodiolo);
a
3β
β-alcol
con
incremento
attività
OH
C CH
Eliminare il chetone in 3 (Linestrenolo);
Migrare il ∆4- in ∆5-10 (Noretinodrel);
Introdurre un metile in C18 (Norgestrel)
di
O
STEROIDI 76
Contraccetivi orali
Gli steroidi più utilizzati sono i contraccetivi orali
Il progesterone è usato in associazione con altri estrogeni come
contraccetivo.
La pillola per antonomasia attualmente è composta da un
estrogeno (etinilestradiolo o mestrenolo) in associazione con un
progestinico (Noretindrone acetato, norgestrel, etinodiolo
diacetato, desogestrel, norgestimato, ciproterone, gestodene e
Drospirenone).
Viene somministrata per 20-21 giorni e sospesa per 7-8 giorni
(comprendenti quelli del periodo mestruale).
O
O
OH
OH
C CH
H2C
OAc
C CH
OH
C CH
O
H
O
HO
O
N
Cl
ciproterone
H H
H
O
H
gestodene
desogestrel
norgestimato
Drospirenone
STEROIDI 77
Contraccetivi orali
STEROIDI 78
Contraccetivi orali
STEROIDI 79
Antiprogestinici
Per un utilizzo come contraccettivo o per favorire l’aborto si
può bloccare la biosintesi del Progesterone od utilizzare
inibitori dei suoi recettori.
Il più noto antagonista recettoriale è il Mifepristone o RU-486
(Roussel Uclaf) che può essere usato sia per la cura di tumori
endocrini che come abortivo.
Agendo come antagonista competitivo blocca il recettore del
progesterone a livello :
della ghiandola pituitaria o dell’ipotalamo prevenendo
l’ovulazione durante il periodo follicolare;
dell’utero con rilascio di prostaglandine dall’endometrio
inducendo così la mestruazione;
Dell’utero favorendo la luteolisi, la motilità uterina ed il
distacco dell’embrione bloccando una iniziale gravidanza.
H3C
CH3
N
CH3OH
C C CH3
O
Mifepristone
STEROIDI 80
Si somministrano per os 100-600 mg in dose singola o multipla per
2-4 giorni e successivamente si somministra una prostaglandina
(di solito il misoprostol) che provoca delle contrazioni uterine e
favorisce l'eliminazione
della mucosa
e dell'embrione,
(solitamente entro mezza giornata).
Viene metabolizzato dal CYP3A4 (mono- e di-demetilato) ed
eliminato nelle feci.
Effetti collaterali - dolore addominale e sanguinamento vaginale
associati a nausea, vomito e febbre.
Possiede anche una certa attività antiglucocorticoide che risulta
essere ridotta nel caso dei derivati Onapristone (della
Schering) e Organon 33,628.
COOMe
O
H3C
H3C
CH3
N
CH3
OH
HO
H3C
O
OH
CH2
H
O
Misoprostol
O
OH
H
O
Onapristone
Organon 33,628
STEROIDI 81
Ipotalamo
LHRH
(Ormone di rilascio
ormone luteinizzante)
Adenoipofisi
FSH e ICSH
(Ormne stimolante le
cellule interstiziali)
Androgeni
I meccanismi che controllano la crescita e
lo sviluppo delle gonadi maschili sono simili
a quelli descritti per gli estrogeni.
FSH – promuove la spermatogenesi
ICSH – attiva la produzione di androgeni
da parte delle cellule del Leydig.
Non è perfettamente noto il sistema di
controllo
di
Feedback
ma
certe
concentrazioni ematiche di testosterone
provocano
una
diminuzione
della
produzione
di
LHRH
ipotalamico
e
pertanto di FSH dall’ipofisi.
STEROIDI 82
Il Testosterone è l’androgeno per antonomasia ed è presente in
maggior quantità a livello ematico.
Viene sintetizzato nei testicoli, nelle ovaie e nella corteccia
surrenalica.
Il testosterone serve da pre-ormone per gli estrogeni e per il
5α
α-diidro-Testosterone (10 volte più affine ai recettori del
Testosterone stesso).
Prima della pubertà la conc plasmatica del Testosterone è di
20ng/100mL e sale a 300-1.000 ng/100mL nell’uomo adulto.
Gli ormoni testicolari hanno le seguenti funzioni:
Di controllo dello sviluppo e della funzionalità degli
organi sessuali;
Di sviluppo dei caratteri sessuali secondari del maschio;
Necessari per la spermatogenesi nei tubuli.
STEROIDI 83
Il testosterone causa ritenzione di azoto favorendo la sintesi
delle proteine e contemporaneamente riducendone il catabolismo.
In tal modo viene favorito lo sviluppo sia degli organi sessuali sia
della muscolatura scheletrica.
Stimola allungamento e ispessimento delle ossa e favorisce la
saldatura delle epifisi.
Gli ormoni sessuali maschili vengono biosintetizzati a partire dal
colesterolo nei testicoli e nella corteccia surrenale.
Nel fegato si formano dagli steroidi C21 (Pregnenolone).
Il suo metabolismo può portare a derivati attivi (5-DHT e
Androstendione) o a molecole inattive (Androsterone ed 5β
βAndrosterone).
Molti metaboliti vengono convertiti nei solfati o nei glucuronidi e
quindi eliminati nelle urine.
STEROIDI 84
Metabolismo
STEROIDI 85
•
•
Nei tessuti bersaglio degli androgeni (prostata) viene convertito
nel 5α
α-DiidroTestosterone (5α
α-DHT) dalla 5α
α-reduttasi, enzima
NADPH dipendente, presente nella frazione microsomiale degli
omogenati di membrana nucleare
Importante è l’interconversione testosterone androstendione
M
F
STEROIDI 86
ANDROGENI
Esteri del Testosterone
Tutti posseggono attività androgena e sono utilizzati per via
iniettabile intramuscolare in soluzioni oleose ad effetto
ritardato.
Sono tutti dei profarmaci che per idrolisi dell’estere (lenta)
liberano il Testosterone - hanno durata d’azione di 2-4
settimane.
I più interessanti sono il Propionato l’Enantato e il Cipionato
(Ciclopentilpropionato).
Altri composti ad attività androgena aventi un qualche utilizzo
terapeutico sono lo Stanolone (5α
α-DHT) e il Noretandrolone.
O
O
R
O
Testosterone
R = -CH2CH3
Propionato
R = -(CH2)5CH3
Enantato
R = -H2C
Cipionato
OH
Et
O
Noretandrolone
STEROIDI 87
Relazione struttura attività
La struttura steroidea di base è essenziale all’attività androgena:
17
Androstano ha una certa attività;
La giunzione 5β
β (cis) rende la sostanza priva di
attività ormonica.
A
3
5
Derivati nor- o omo-ciclici perdono di attività.
In posizione 3 la presenza di un chetone o di un β-ossidrile
potenziano notevolmente l’attività.
Particolarmente importante è l’ossidrile in 17:
È responsabile dell’interazione con il recettore per cui è attivo
solo in configurazione β;
L’esterificato varia l’efficacia che dipende dalla loro capacità di
idrolisi;
Un sostituente in 17α
α- (in particolare alchile) rende la molecola
metabolicamente stabile e somministrabile per os.
STEROIDI 88
La presenza di inasaturazione sull’anello A ne aumenta la planarità e
l’attività anabolizzante.
L’eliminazione del metile angolare 19 porta a derivati anabolizzanti.
La presenza di alogeni comporta riduzione di attività ad eccezione
delle posizioni 4 e 9
Androgeni sintetici ed anabolizzanti
L’obiettivo è quello di separare le due componenti anabolica e
androgena.
17a-Metiltestosterone (1) attività androgena ed anabolizzante
pari a quella del testosterone (interessanti il diidro- e il
dimetile).
L’Ossimesterone (2) e Stanozololo (4) hanno potenziata l’attività
anabolizzante (usati come androgeni ed anabolici)
Ossandrolone (3) anabolizzante
contro osteoporosi
senile. OH
OH
(ridotta
OH
CH3
CH3
CH3
androgenicità)
O
O
(1)
(2)
O
OH
O
H
(3)
usato
OH
CH3
HN
N
H
(4)
STEROIDI 89
OH
C2H5
OH
C2H5
OH
(5)
O
O
O
O
O
(6)
(7)
(8)
Il Nortestosterone (5), che sinteticamente deriva dagli
estrogeni, possiede attività anabolizzante con effetti androgeni
ridotti.
Noretandrolone (6) e Etilestrenolo (7) hanno ancora più marcata
la differenza di attività a favore di quella androgena.
Testolattone (8) possiede attività anabolizzante scevra
effetti androgeni e viene utilizzato contro il tumore al seno.
da
STEROIDI 90
Il più importante impiego di questi farmaci consiste nella terapia
sostitutiva in pazienti con deficit ormonale endogeno.
Nell’eunuchismo e nell’eunucoidismo vengono somministrati per
conservare i caratteri sessuali secondari.
Vengono impiegati anche nel Criptorchidismo, per correggere la
spermatogenesi difettosa e l’ipertrofia prostatica.
L’azione anabolizzante viene utilizzata in terapia su entrambi i
sessi per aumentare la massa tissutale di adulti e bambibi e
ripristinare le perdite proteiche da traumi (effetti collaterali
sono quelli virilizzanti).
In entrambi i sessi si osserva ritenzione di acqua e di elettroliti
con formazione di edemi.
STEROIDI 91
Antiandrogeni
Trovano impiego nel tarttamento dell’acne giovanile, delle sindromi
virilizzanti nella donna e contro il carcinoma della prostata.
Prostata
ingrossamento o Iperplasia Prostatica Benigna (BPH) frequente
dopo i 50-55 anni risolvibile chirurgicamente.
tumore della prostata – diffuso tra gli anziani e rappresenta il
secondo tumore più diffuso e il terzo come causa di morte.
Approcci:
Uso di antagonisti del recettore degli androgeni a struttura
steroidica (Ciproterone acetato, Zanosterone, Oxendolone e RU38,882) e non (Flutamide, Bilucamide, Nilutamide etc.)
O
OH
OH
OAc
O2S N
N
H3C
O
Cl
Ciproterone acetato
H
Zanosterone
O
OAc
O
Oxendolone
RU-38,882
STEROIDI 92
Uso di antagonisti del GnRH (Goserelina, Buserelina etc.)
Inibitori della 5a-reduttasi
Quest’ultimo è un enzima intracellulare, NADPH dipendente,
necessario per la conversione del Testosterone in DHT ed esiste
in due isoforme: quella di tipo 1 prevale nei tessuti normali (ruolo
catabolico) mentre quella di tipo 2 abbonda nei tessuti bersaglio
degli androgeni con effetto anabolico (prostata).
Il primo farmaco è la Finasteride, in commercio dal 1992, in grado
di inibire in modo selettivo la isoforma 2 dell’enzima.
È un 4-aza-steroide che agisce come inibitore competitivo del
testosterone del quale innalza i livelli ematici. Suoi analoghi sono
Turosteride e L-654,4066.
L’Epristeride non è un aza-steroide bensì un derivato di un acido
bicarbossilico ed agisce come inibitore non competitivo.
O
H
N
O
O
N
O
H
N
H
N
O
O
N
H H
Finasteride
O
N
H H
Turosteride
O
N
H H
L-654,4066
HOOC
Epristeride
STEROIDI 93
Preparazione della Finasteride
O
H
N
O
H
N
N aIO 4
N H3
KM n O 4
H OOC
O
H2 Pt
O
A m m id e d ell' acid o
3 -c h et o -∆
∆ 4-e tian ico
O
ch e to ac id o
O
H
N
D DQ
Cl
O
N
H
Cl
lat ta m e
O
O
CN
CN
O
N
H
F in as ter id e
H
N
STEROIDI 94
Preparazione della sostanza S
Cortexolone
Sostanza S di Reichstein
STEROIDI 95
Preparazione del Prednisolone
O
O
OH
HO
OH
OH
HO
Corinebacterium S.
Curvularia lunata
O
O
OH
O
oppure
Bacillus sphaericus
O
Cortexolone o
Sostanza S di Reichstein
Prednisolone
OH
OH