LA MEDICINA BIOLOGICA
GENNAIO - MARZO 2016
CLINICAL
G. Milani
RIASSUNTO
La maggiore eziologia del cervicocarcinoma uterino è il Papilloma Virus Umano
(HPV), soprattutto i genotipi ad alto rischio
oncogeno. Nel 2013-14 sono stati eseguiti 1129 prelievi colpocitologici, colorati
secondo Papanicolaou (Pap-test).
Tra questi sono state identificate 58
ASCUS (Atypical Squamous Cells of Undeterminated Significance), pari al 5,13%.
Di queste 58 pazienti, 32 erano positive al
HPV-DNA ad alto rischio oncogeno (genotipi
16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59,
66, 68) e sono state sottoposte a colposcopia e biopsia cervicale.
Tutte le 32 pazienti sono state sottoposte
a terapia microimmuno-omotossicologica
per 2 mesi con Galium-Heel® e 2LPAPI.
Al controllo a 3 mesi, 26 pazienti (81,25%)
erano HPV negative, mentre 6 (18,75%)
erano ancora HPV positive. Queste 6 sono
state sottoposte ad un secondo ciclo di
terapia biologica con Psorinoheel® N e
Guna-TNFa 4CH per 2 mesi; 3 di queste
6 pazienti si sono negativizzate.
In conclusione, la terapia biologica ha
prodotto, in 6 mesi, la scomparsa del
HPV dalla cervice uterina nel 90,6% dei
casi (29 su 32), mentre nel restante 9,4%
(3 casi su 32) si è registrata persistenza
del virus. In tutti questi 3 casi l’HPV era
di genotipo 16 con concomitante presenza di lesioni cervicali (CIN 1).
PAROLE CHIAVE HPV, MICROIMMUNOTERAPIA, OMOTOSSICOLOGIA,
PRM, CERVICOCARCINOMA, PAP-TEST
SUMMARY: The major cause of cervical cancer
is the presence of Human Papilloma Virus
(HPV), especially the high-risk oncogenic
genotypes. In 2013-2014, 1129 Pap smears
were performed, colored according to
Papanicolaou (Pap-tests) and 58 ASCUS
(Atypical Squamous Cells of Undeterminated
Significance) positive samples were identified
(5,13%). Among these 58 patients, 32 were
positive for the high-risk oncogenic HPV-DNA
(genotypes 16, 18, 31, 33, 35, 39, 45, 51, 52,
56, 58, 59, 66, 68) and subsequently underwent
colposcopy and cervical biopsy.
All 32 patients underwent microimmuno/homotoxicological therapy for 2 months with GaliumHeel ® and 2LPAPI. A follow-up at 3 months
showed that in 26 patients (81,25%) HPV was
not anymore present, while 6 patients
(18,75%) still showed evidence of HPV
infection. Those 6 patients were given a
second round of Biological Therapy with
Psorinoheel ® N and Guna-TNFa 4CH for 2
TERAPIA BIOLOGICA DEL
PAPILLOMA VIRUS UMANO
BIOLOGICAL THERAPY OF HUMAN PAPILLOMA VIRUS
INTRODUZIONE
La neoplasia della cervice uterina è al
terzo posto al mondo per frequenza e la
quarta causa di morte nelle donne, rappresentando circa il 9% del totale delle
neoplasie femminili (1).
– Il carcinoma della cervice uterina è la
prima neoplasia ad essere riconosciuta
dall’Organizzazione Mondiale della Sanità come riconducibile ad un agente
infettivo, il Papilloma Virus Umano
(HPV = Human Papilloma Virus) (2).
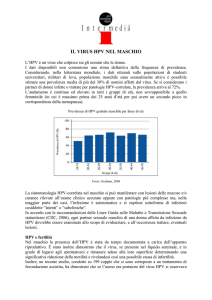
Il confronto dell’incidenza stratificata
per età della neoplasia della cervice (3)
ha evidenziato che le percentuali aumentano dai 25 ai 50 anni, per poi raggiungere un plateau fino ai 70 anni.
months; 3 out of the 6 patients were
subsequently found to be negative for HPV.
In conclusion, the Biological Therapy, in 6
months, produced the disappearance of HPV
from the cervix in 90,6% of the cases (29 out
of 32), while HPV persisted in the remaining
9,4% (3 cases out of 32).
– Questo andamento dei tassi di incidenza è inusuale per la maggior parte
delle neoplasie che, generalmente, aumentano con il progredire dell’età.
Ciò indica che le neoplasie della cervice
conseguono alla persistenza nell’Apparato genitale femminile dell’HPV, generalmente contratto con i rapporti sessuali, ed alla successiva evoluzione in lesione neoplastica in circa un decennio.
Attualmente i programmi di screening
danno evidenza di una diminuzione
dell’incidenza delle neoplasie della cervice nelle donne di età compresa tra i
30 e i 70 anni; i tassi di incidenza risultano relativamente invariati nelle donne
più giovani e più anziane.
Il ruolo degli agenti trasmessi sessualmente nell’eziologia della neoplasia
In the latter 3 cases, the HPV genotype was 16,
with the concomitant presence of cervical
lesions already underway (CIN 1).
KEY WORDS: HPV, MICROIMMUNOTHERAPY,
HOMOTOXICOLOGY,
PRM,
CERVICAL
CARCINOMA, PAP-TEST.
39
LA MEDICINA BIOLOGICA
% di neoplasie associate a diversi tipi di HPV
100
GENNAIO - MARZO 2016
+ 8 tipi di HPV aggiuntivi
95,7%
80
60
40
20
+ HPV tipo 18
71,7%
HPV tipo 16
57,6%
0
Fonte: International Agency for Research on Cancer (IARC).
TAB. 1
della cervice è stato sospettato da più di
un secolo, ma solo negli ultimi 25 anni
le conoscenze al riguardo sono rapidamente evolute, grazie ai progressi dei
metodi di indagine dell’HPV.
– Sono stati identificati e caratterizzati
120 genotipi HPV in grado di infettare
la specie umana; questi possono essere
suddivisi in mucosali (alfa) e cutanei
(beta) (4).
Gli alfa-HPV sono 50 genotipi, divisi in
14 specie ed infettano prevalentemente
la mucosa genitale.
– In base alla loro associazione con le
forme invasive di carcinoma della cervice, sono stati divisi in 4 gruppi (5, 6, 7):
1. HPV ad alto rischio oncogeno, associati ad un rischio maggiore di
provocare il carcinoma cervicale.
– Dodici tipi: HPV 16, 18, 31, 33,
35, 39, 45, 51, 52, 56, 58, 59.
2. HPV a basso rischio oncogeno, associati a lesioni epiteliali benigne.
– Dodici tipi: HPV 6, 11, 40, 42, 43,
44, 54, 61, 70, 72, 81, 89.
3. HPV con probabile alto rischio oncogeno, associati a carcinoma cervicale in alcuni studi.
– Sei tipi: HPV 26, 53, 66, 68, 73, 82.
40
4. HPV con rischio oncogeno indeterminato, virus dei quali non è stata
ancora studiata l’oncogenicità né in
studi epidemiologici, né in studi
molecolari in vitro.
– Venticinque tipi: HPV 2, 3, 7, 10,
27, 28, 29, 30, 32, 34, 55, 57, 62,
67, 69, 71, 74, 77, 83, 84, 85, 86,
87, 90, 91.
Una recente meta-analisi comprendente 423 studi ha analizzato la distribuzione dei genotipi ad alto rischio sia in
donne con citologia cervicale normale,
sia in donne con presenza o di neoplasia cervicale o di ASCUS (Atypical
Squamous Cells of Undeterminated Significance) ed ha concluso che la prevalenza di HPV è eterogenea nelle diverse aree geografiche ed aumenta con
la severità della lesione, dal 12% nelle
donne con citologia normale all’89% in
quelle con carcinoma invasivo.
L’HPV 16 è il genotipo più frequente in
tutti i tipi di lesione ed è associato a più
del 50% dei carcinomi invasivi in tutte
le aree geografiche, seguito in ordine di
prevalenza da HPV 18, 45, 33, 58, 31,
52, 35, 39, 59, 51, 56, 68. (8).
Gli HPV 16 e 18 contribuiscono al
70% circa delle neoplasie della cervice (9, 10, 11, 12, 13) (TAB. 1).
Inoltre, gli HPV ad alto rischio oncogeno,
e soprattutto l’HPV 16, sono stati associati
ad una frazione significativa di carcinomi
squamosi dell’epitelio mucoso-cutaneo,
non solo della cervice uterina, ma di
tutta la regione ano-genitale, interessando alcuni tipi di neoplasie della vulva,
della vagina, dell’ano e del pene (14).
Gli HPV sono presenti in notevole percentuale anche nelle neoplasie del collo, delle tonsille, della lingua, ecc. (15,
16, 17, 18, 19, 20, 21) (TAB. 2).
I prodotti proteici dei geni E6 ed E7 di
HPV ad alto rischio oncogeno interagiscono con gli oncosoppressori, regolano la proliferazione e promuovono la
trasformazione neoplastica delle cellule
epiteliali (22).
– Non vi è dubbio che il rischio di sviluppare un carcinoma in situ o invasivo della cervice in donne con persistenza di infezione HPV ad alto rischio sia da 11 a
49 volte superiore rispetto alle donne
negative per infezione HPV (22).
L’HPV non è sempre presente nelle lesioni maligne e premaligne della cervice uterina (23), per cui l’HPV non è
l’unica causa di neoplasie cervicali.
HPV è – quindi – l’agente eziologico responsabile delle forme di infezioni trasmesse sessualmente più frequenti nella
popolazione generale.
Si stima che oltre il 75% delle donne
sessualmente attive sia positiva all’infezione da HPV almeno una volta nel corso della vita.
– Studi epidemiologici condotti negli
USA (24) hanno rilevato che ogni anno
si registrano più di 6,2 milioni di casi di
infezione HPV.
Secondo un recente studio (25), il
26,8% delle donne statunitensi di età tra
14 e 59 anni è HPV positivo, vale a dire
24,9 milioni in tutto il Paese.
– In Europa la prevalenza di infezione
HPV in donne sane, cioè in assenza di
LA MEDICINA BIOLOGICA
alterazioni citologiche a carico dell’Apparato genitale, è pari al 14% e il tasso
di incidenza è pari al 7%, con 16 milioni di nuovi casi/anno in una popolazione di 230 milioni di persone (26).
– Una stima complessiva della prevalenza dell’infezione HPV nelle donne in
tutto il mondo oscilla tra il 2% e il 44%
(26). L’ampiezza dell’oscillazione è giustificata sia dalle variazioni di età delle
popolazioni incluse negli studi sia dalla
sensibilità dei metodi diagnostici utilizzati.
– In TAB. 3 sono riportati i dati riguardanti la prevalenza di HPV in alcune città
italiane campione.
La trasmissione dell’infezione avviene
soprattutto attraverso i rapporti sessuali
penetrativi, ma è possibile anche quella
legata ai rapporti sessuali non penetrativi, per contatto diretto cutaneo dell’area genitale (27).
L’incidenza dell’acquisizione di tipi di
HPV oncogeni sembra essere molto più
alta rispetto a quella dei tipi non oncogeni (28, 30).
Nella maggior parte dei casi (7090%) l’infezione HPV è autolimitante e transitoria, poichè il virus viene
eradicato grazie alla risposta immunitaria dell’individuo.
Se ciò non accade, l’infezione progredisce in infezione permanente e, secondo il tipo di virus infettante, può evolvere in lesione benigna o in lesione precancerosa e cancerosa.
HPV è un virus appartenente alla famiglia Papillomaviridae, costituito da un
capside formato da 72 capsomeri ed un
genoma formato da una molecola di
DNA, che in genere si associa a proteine istoniche derivanti dalla cellula in
cui il virus si replica.
Sono state identificate due regioni del
genoma virale:
una regione codificante per le proteine
precoci E1, E2, E4, E5, E6 e E7, ed una
codificante per le proteine tardive.
Il genoma virale contiene anche una regio-
Patologie
GENNAIO - MARZO 2016
HPV genotipi
Prevalenza
Cancro della vulva/vagina
16 (81.8%), 35, 33, 52
30-86%
Cancro del pene
16 (60%), 45, 35, 18, 52, 68,
31, 53, 6
Lesioni ano-genitali
15-71%
51, 54, 70 in infezioni
multiple con HPV 16
Lesioni displastiche del pene
HPV high-risk (81.5%):
HPV 16 il più frequente
Carcinoma verrucoso del pene
e della vulva (lesioni rare)
6, 11
Cancro anale e perianale
16 (80%), 18 (10%), 31, 33
90%
86-100%
Lesioni cutanee
Epidermodisplasia
verruciforme
5, 8, 9, 12, 14, 15, 17,
19-25, 36-38, 47, 49
Carcinoma non melanomatoso
della cute (carcinoma a cellule
squamose [SCC])
gli stessi associati
all’Epidermodisplasia
verruciforme
69-88% in individui
immunosoppressi;
0-55% in individui
immunocompetenti
Carcinoma non melanomatoso
della cute (carcinoma a cellule
basali [BCC])
gli stessi associati
all’Epidermodisplasia
verruciforme
31- 43.5% in individui
immunocompetenti
Carcinoma periungueale a
cellule squamose
16
Lesioni del Distretto testa-collo
Papillomatosi laringea
6, 11
Cancro della laringe
6, 11, 16
20-25%
Cancro della cavità orale e del
faringe
16 (più frequente), 18, 6,
11, 2
20-50%; 50% dei casi di
carcinoma delle tonsille
Carcinoma dei seni paranasali
6, 18, 57
Cancro dell’esofago
16, 18
15-45%
TAB. 2
ne non codificante (LCR = Long Control
Region) in cui sono presenti gli elementi
regolatori coinvolti nella replicazione e
nella trascrizione del DNA virale (31).
Studi centrati su HPV 16 e 18, hanno
chiaramente dimostrato che le proteine
TAB. 3
Popolazione generale (1990-2004)
Roma – 753 donne, 17- 57 anni
controlli ginecologici
Prevalenza 18,3%
Genova – 503 donne
screening
Prevalenza 15,9%
Torino – 1025 donne, 25 -70 anni
screening
Prevalenza 8,8%
Brescia – 1500 donne, 18 - 63 anni
controlli ginecologici
Prevalenza 6,6%
Donne con citologia anormale (1995-2001)
Catania
Prevalenza 53,9%
Vicenza 15-60 anni
screening
Prevalenza 35,3%
41
LA MEDICINA BIOLOGICA
GENNAIO - MARZO 2016
essenziali nella carcinogenesi-HPV mediata.
5,13
%
– La caratterizzazione di E6 e E7 di molti tipi HPV ha evidenziato importanti
differenze tra i tipi virali a basso e ad alto rischio e chiarito il ruolo di alcuni fenomeni virus-mediati del ciclo virale
e/o della trasformazione cellulare.
totale
ASCUS
FIG. 1
Ricerca di HPV-DNA
ad alto rischio
26 pz
32 pz
positive
negative
FIG. 2
E6 e E7 sono le maggiori oncoproteine
virali e che queste sono coinvolte nel
promuovere la trasformazione cellulare
e l’alterazione delle vie legate all’induzione della risposta immunitaria, mediante l’interazione con le proteine cellulari (32, 33).
– Altri studi (34, 35) hanno chiarito che,
oltre alla capacità di indurre trasformazione cellulare, E6 e E7 di HPV ad alto
rischio hanno la proprietà di deregolare
l’Immunità innata ed acquisita.
– Le onco-proteine E6 e E7 cooperano
nella trasformazione cellulare e nella
immuno-evasione del virus, due eventi
19 pz
(59,4%)
– È noto che le citochine e le chemochine, soprattutto quelle che hanno come
bersaglio il Sistema Immunitario, sono
molecole fondamentali per l’organizzazione della risposta immunitaria verso i
patogeni.
Gli HPV, come gli altri virus, hanno promosso molte strategie per aggirare la
sorveglianza immunitaria, alterando il
pattern di espressione delle citochine.
La down-regulation del TNF-a e la concomitante risposta attenuata di questa
citochina pro-infiammatoria è stata osservata nella progressione di lesioni
cancerose cervicali, mentre l’Interleuchina 10 sembra essere up-regolata, li-
10 pz
(76,9%)
ZTA
cervicite cronica
negativo
CIN 1
FIG. 3
– Esprimiamo alcune osservazioni:
1. HPV ha una grande diffusione.
2. HPV è presente in molte forme carcinomatose.
3. Focalizzazione del nostro interesse
sui genotipi HPV ad alto rischio di
lesioni della cervice uterina.
4. Non vi sono attualmente terapie atte
all’eradicazione di HPV ad alto rischio presente nella cervice uterina
di donne affette.
5. Vengono attualmente effettuate terapie distruttive sull’epitelio anomalo
della cervice: conizzazione chirurgica, laser-vaporizzazione, diatermocoagulazione, crioterapia, ecc.
6. L’unica arma attualmente in uso è la
vaccinazione transgenica che prende in considerazione solo alcuni genotipi virali e che necessiterà di parecchi anni per chiarire efficacia e limiti su vasta scala.
Da queste osservazioni è scaturito il nostro lavoro.
MATERIALI E METODI
Negli anni 2013-2014 abbiamo eseguito 1129 prelievi colpocitologici per
screening delle neoplasie cervicali uterine (Pap-test).
Tra i 1129 prelievi, sono state rilevate
58 ASCUS (5,13%), numero leggermente inferiore rispetto a quello riportato in letteratura (39) (FIG. 1).
– A queste 58 pazienti è stata effettuata
la ricerca di HPV-DNA, da prelievo dalla cervice uterina, con tipizzazione dei
genotipi virali ad alto rischio, con estrazione mediante pompa a vuoto secondo il protocollo del kit Macherey-Nagel:
Genomic DNA.
3 pz
(23,1%)
13 pz
(40,6%)
ZTA = Zone di Trasformazione Atipica
42
Il ruolo di molti onco-sopressori e onco-proteine cellulari è stato chiarito studiando le onco-proteine E6 e E7.
• Le conoscenze sugli HPV e sulla loro
associazione con il cancro sono state
avvalorate negli ultimi decenni in tutto
il mondo, fornendo indicazioni per il
raggiungimento di importanti applicazioni cliniche, quali la realizzazione, la
determinazione della composizione, la
produzione, la commercializzazione e
la diffusione di vaccini anti HPV ad alto
rischio associati al cancro della cervice
uterina (36).
mitando la migrazione delle cellule
immunitarie non-residenti verso il sito
d’infezione (37, 38).
FIG. 4
Delle 58 pazienti sottoposte ad analisi,
32 sono risultate positive alla ricerca di
HPV-DNA ad alto rischio e 26 sono risultate negative (FIG. 2).
LA MEDICINA BIOLOGICA
Le 32 pazienti positive alla ricerca di
HPV-DNA ad alto rischio sono state sottoposte a colposcopia con biopsia,
quando opportuna, e successiva terapia
biologica omotossicologica.
In TABB. 4, 5 sono esposte la classificazione
e la descrizione dettagliata dei casi clinici.
Le pazienti considerate hanno età compresa tra 21 e 60 anni.
Sono state tutte sottoposte a colposcopia con i seguenti risultati:
– presenza di ZTA (Zone di Trasformazione Atipica) in 13 casi (40,6%);
– assenza di lesioni visibili alla colposcopia (buona visione della portio,
iodio-positività alla colorazione con
liquido di Lugol e assenza di lesioni
al test con acido acetico al 5%) nei
rimanenti 19 casi (59,4%) (FIG. 3).
Tutte le pazienti con ZTA sono state sottoposte a biopsia mirata nella zona di
lesione della cervice uterina, individuata dalla colposcopia.
Risultati: 3 cerviciti croniche (23,1%) e
10 CIN 1 (76,9%) (FIG. 4).
– Secondo la Tavola delle Omotossicosi
abbiamo inquadrato la presenza dell’HPV a livello della cervice uterina secondo i seguenti criteri:
1. Il virus viene a contatto con la mucosa cervicale uterina: è la prima Fase, Fase di Escrezione, nella quale il
virus potrebbe essere eliminato
spontaneamente.
In questa Fase vi è omeostasi.
2. Il virus evoca una reazione da parte
della mucosa cervicale:
Fase di Infiammazione.
– È la Fase della reazione acuta; l’organismo mette in atto strategie difensive contro il virus.
3. Il virus non viene eliminato ed irrita
cronicamente la mucosa:
Fase di Deposito.
– L’infiammazione si cronicizza; si
verifica una iper-reazione, una produzione cellulare eccessiva, ma le
difese organiche continuano a mettere in atto le proprie forze.
4. L’infiammazione cronica perdura:
Fase di Impregnazione.
– In questa Fase si registrano le alterazioni anatomo-patologiche, come
la condilomatosi, la CIN 1.
Termini citologici (Pap-test)
GENNAIO - MARZO 2016
Termini istologici (biopsia)
Sistema Bethesda
Classificazione CIN
Classificazione WHO
Normale
Normale
Normale
ASCUS – cellule squamose
atipiche di significato
indeterminato
Risposte
infiammatorie/riparative
Risposte
infiammatorie/riparative
LSIL – lesioni intraepiteliali
squamose di basso grado
CIN 1
Displasia lieve
CIN 2
Displasia moderata
HSIL – lesioni intraepiteliali
squamose di alto grado
CIN 3
Displasia grave:
carcinoma in situ
Carcinoma cervicale
invasivo
Carcinoma cervicale
invasivo
Carcinoma cervicale
invasivo
CIN = Cervical Intraepitelial Neoplasia. WHO = World Health Organization
TAB. 4
TAB. 5
Paziente
Età
aa
HPV
genotipo/i
Colposcopia
Istologia
Controllo
a 3 mesi
T.P.
A.M.
G.M.
M.A.
S.A.
A.C.
P.M.
P.C.
D.M.
V.C.
G.G.
Z.P.
M.I.
O.A.
P.P.
V.F.
F.A.
B.G.
T.G.
S.G.
A.M.
M.V.
F.S.
M.P.
F.R.
G.A.
E.P.
N.D.
C.P.
O.W.
Z.L.
P.D.
47
35
27
50
22
26
32
58
32
29
37
60
48
28
37
28
36
29
31
33
49
56
52
31
29
43
25
27
21
29
39
45
56
16
35,39
31,33
18
18
56,68
16
33,35
16
16
56
45,66
18
45
68
16
52,56
18
52
45
66
35
18
16
51,56
18
16
18
51,52
18
31,35
ZTA
Neg.
Neg.
Neg.
ZTA
ZTA
Neg.
ZTA
Neg.
Neg.
ZTA
Neg.
Neg.
ZTA
Neg.
Neg.
ZTA
Neg.
ZTA
Neg.
Neg.
Neg.
Neg.
ZTA
Neg.
Neg.
ZTA
ZTA
ZTA
Neg.
ZTA
Neg.
Cervicite cron.
Normale
Normale
Normale
CIN 1
Cervicite cron.
Normale
CIN 1
Normale
Normale
CIN 1
Normale
Normale
CIN 1
Normale
Normale
CIN 1
Normale
CIN 1
Normale
Normale
Normale
Normale
Cervicite cron.
Normale
Normale
CIN 1
CIN 1
CIN 1
Normale
CIN 1
Normale
Negativa
Negativa
Negativa
Negativa
Persistenza
Negativa
Negativa
Persistenza
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Persistenza
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Persistenza
Persistenza
Persistenza
Negativa
Negativa
Negativa
43
LA MEDICINA BIOLOGICA
GENNAIO - MARZO 2016
medicinale per il drenaggio della matrice extracellulare, in modo da poterlo
prescrivere ad entrambi i Gruppi, unitamente alla Microimmunoterapia.
6 pz
(18,75%)
A tutte le pazienti è stato somministrato
Galium-Heel®, 20 gtt sublinguali mattino
e sera x 2 mesi e 2LPAPI, 1 capsula/die,
secondo numerazione, x 2 mesi.
26 pz
(81,25%)
2.
guarigione
persistenza
– Galium-Heel® è un efficace drenante
della matrice extra-cellulare, composto
da 21 unitari (40).
– 2LPAPI Labo’Life è un preparato di
Microimmunoterapia, un Immunoterapico low dose.
FIG. 5
5. La Fase di Impregnazione progredisce verso la Fase di Degenerazione;
la struttura propria della mucosa viene alterata e compaiono le lesioni
anatomo-patologiche maggiori, come la CIN 2 e la CIN 3.
6. La progressione evolve verso la Fase
di Dedifferenziazione; è la Fase dello
sconvolgimento neoplastico dell’epitelio squamoso della cervice.
– È la Fase del cervico-carcinoma
che diventerà invasivo e, successivamente, metastatico.
L’Immunoterapia low dose utilizza sostanze immunocompetenti (Citochine,
Acidi Nucleici Specifici, Fattori della
Regolazione Immunitaria) che favoriscono la modulazione della risposta immunitaria dell’organismo al fine di ristabilirne l’equilibrio biologico.
Tutti i componenti di 2LPAPI sono in diluizione 10 CH e 16CH o 17CH o
18CH: queste diluizioni sono per la regolazione delle stesse sostanze presenti
nell’organismo cui vengono somministrate.
1. Interleuchina 1 10 CH e 17CH.
Prima interleuchina scoperta, IL-1 è
una citochina secreta dalle cellule
del Sistema Immunitario e viene
prodotta in seguito ad infezioni.
È la citochina che viene prodotta subito dopo le infezioni acute e che
determina aumento della temperatura corporea in seguito alla vasodilatazione mediata dalle prostaglandine.
La IL-1 – inoltre – favorisce l’adesione all’endotelio vascolare con con-
Abbiamo collocato la presenza virale
nelle Fasi Infiammazione-Deposito,
quando il virus è presente ma non ha
ancora prodotto mutamenti cellulari,
ovvero nei casi in cui la colposcopia è
negativa a conferma della presenza della mucosa originaria (59,4%); si ritiene
siano Fasi di Infiammazione-Deposito
perché si tratta – comunque – di virus
ad alto rischio oncogeno.
La virosi è collocata nelle Fasi Deposito-Impregnazione, quando si è constatata la presenza di lesioni, anche se minime, come la cervicite cronica e la
CIN 1 (40,6%).
Abbiamo – pertanto – individuato un
TAB. 6
Paziente
Età
aa
HPV
genotipo
Colposcopia
Istologia
Controllo
a 3 mesi
S.A.
E.P.
C.P.
P.C.
F.A.
N.D.
22
25
21
58
36
27
18
18
18
16
16
16
ZTA
ZTA
ZTA
ZTA
ZTA
ZTA
CIN 1
CIN 1
CIN 1
CIN 1
CIN 1
CIN 1
Persistenza
Persistenza
Persistenza
Persistenza
Persistenza
Persistenza
44
3.
4.
5.
6.
7.
seguente ancoraggio dei leucociti
alle pareti vascolari e loro migrazione verso i tessuti (41).
In ultima analisi, IL-1 stimola i processi infiammatori, i processi difensivi dell’organismo (42).
Interleuchina 2 10CH e 17CH.
La IL-2 viene prodotta principalmente dai linfociti T; promuove lo sviluppo, la sopravvivenza e le funzioni
dei linfociti T-regolatori e stimola la
proliferazione e l’attivazione dei Natural Killer (NK).
Interferone-a 10CH e 17CH.
L’interferone-a, prodotto dalle cellule dendritiche plasmocitoidi e dai
macrofagi, ha attività antivirale ed
attiva le cellule NK.
Acido ribonucleico 10CH e 18CH.
Depositario del trasporto dell’informazione genetica dal nucleo al citoplasma.
Ciclosporina A7 10CH e 17CH.
La ciclosporina A7 è un noto inibitore del PTP (poro di transizione della permeabilità mitocondriale).
– L’apertura del PTP determina la
depolarizzazione della membrana
mitocondriale interna, seguita da
perdita dell’omeostasi ionica.
Se il PTP rimane aperto per lungo
tempo, si produce la deplezione dei
substrati e dei nucleotidi (43) con
conseguente inibizione della respirazione e cessazione della produzione di ATP (44).
Acido Nucleico Specifico SNA-PAPI
10CH e 16CH.
Oligonucleotidi di regolazione della
manifestazione del gene virale.
Acido nucleico specifico SNA-HLA
II 10CH e 16CH.
HLA (Human Leucocyte Antigen) è
un Sistema di istocompatibilità formato da molecole localizzate sulla
superficie cellulare, che agiscono da
antigeni, generando una risposta immunitaria (42).
Le 32 pazienti, positive alla ricerca di
HPV-DNA ad alto rischio e sottoposte
a 2 mesi di terapia, dopo 3 mesi hanno
eseguito una nuova ricerca di HPVDNA ad alto rischio sulla cervice uterina.
LA MEDICINA BIOLOGICA
In 6 casi si è registrata persistenza virale
(18,75 %) (FIG. 5; TAB. 6), mentre in 26
casi (81,25 %) non è stata rilevata presenza virale (FIG. 5; TAB. 7).
Abbiamo preso in considerazione la
possibilità di agire in modo differente
sui 6 casi che presentavano ancora persistenza del virus dopo terapia.
Considerata la down-regulation del
TNF-a e la up-regulation della IL-10,
descritta nei casi di lesioni cervicali in
presenza di HPV (37, 38) è stato somministrato TNF-a 4CH, sia per il potenziamento del TNF down-regolato, sia
per la sua azione di regolazione della
IL-10 up-regolata.
La scelta della diluizione 4CH è dovuta
alla diluizione fisiologica del TNF-a
nell’organismo umano.
Inoltre abbiamo associato Psorinoheel® N
gocce, medicinale indicato in tutte le
malattie croniche.
Psorinoheel® N, medicinale multinosodico, è composto da 11 unitari (40).
GENNAIO - MARZO 2016
Paziente
Età
aa
HPV
genotipo/i
Colposcopia
Istologia
Controllo
a 3 mesi
T.P.
A.M.
G.M.
M.A.
A.C.
P.M.
D.M.
V.C.
G.G.
Z.P.
M.I.
O.A.
P.P.
V.F.
B.G.
T.G.
S.G.
A.M.
M.V.
F.S.
M.P.
F.R.
G.A.
O.W.
Z.L.
P.D.
47
35
27
50
26
32
32
29
37
60
48
28
37
28
29
31
33
49
56
52
31
29
43
29
39
45
56
16
35,39
31,33
18
56,68
33,35
16
16
56
45,66
18
45
68
52,56
18
52
45
66
35
18
16
51,56
51,52
18
31,35
ZTA
Neg.
Neg.
Neg.
ZTA
Neg.
Neg.
Neg.
ZTA
Neg.
Neg.
ZTA
Neg.
Neg.
Neg.
ZTA
Neg.
Neg.
Neg.
Neg.
ZTA
Neg.
Neg.
Neg.
ZTA
Neg.
Cervicite cron.
Negativa
Negativa
Negativa
Cervicite cron.
Negativa
Negativa
Negativa
CIN 1
Negativa
Negativa
CIN 1
Negativa
Negativa
Negativa
CIN 1
Negativa
Negativa
Negativa
Negativa
Cervicite cron.
Negativa
Negativa
Negativa
CIN 1
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
TAB. 7
Entrambi i preparati low dose sono stati
somministrati 20 gtt mattino e sera, sublinguali x 2 mesi.
TNF-a (Tumor Necrosis Factor-a) 4CH
ha attività antibatterica ed antitumorale; è una glicoproteina, appartenente al
gruppo delle linfochine, prodotta dai
linfociti T e – soprattutto – dai macrofagi.
Esistono 2 TNF: il TNF-a, prodotto dai
macrofagi (cachessina) e il TNF-b, prodotto dai linfociti (linfotossina).
I TNF hanno evidenziato attività antitumorale in vitro e in vivo ; essi distruggono le cellule tumorali, stimolano i macrofagi ad inglobare le cellule tumorali
e danneggiano le pareti dei vasi della
neoplasia, che, così, perde il nutrimento
necessario per la sua crescita (45).
È stato eseguito un ulteriore controllo
per verificare la presenza del HPV a distanza di 3 mesi dall’inizio della terapia.
RISULTATI E DISCUSSIONE
Il risultato globale ottenuto dalla terapia
microimmuno-omotossicologica-PRM
sulla presenza del HPV a livello della
cervice uterina, valutato a 6 mesi dopo
i 2 step di terapia sopradescritti, è di assenza di HPV (guarigione) nel 90,6%
dei casi e di persistenza di HPV nel
9,4% (possibile progressione della malattia): 29 casi di guarigione e 3 casi di
persistenza del virus (FIG. 6).
RISULTATO FINALE
FIG. 6
DOPO TERAPIA
MICROIMMUNO-OMOTOSSICOLOGICA-PRM
9,4%
90,6%
guarigione
persistenza HPV
45
LA MEDICINA BIOLOGICA
GENNAIO - MARZO 2016
Paziente
Età
aa
T.P.
A.C.
G.G.
O.A.
T.G.
M.P.
Z.L.
47
26
37
28
31
31
39
HPV
genotipo
Colposcopia
Istologia
Controllo
a 3 mesi
ZTA
ZTA
ZTA
ZTA
ZTA
ZTA
ZTA
Cervicite cron.
Cervicite cron.
CIN 1
CIN 1
CIN 1
Cervicite cron.
CIN 1
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
Negativa
56
18
16
18
18
18
18
TAB. 8
La negativizzazione della presenza del
virus nei 29 casi descritti ci ha permesso
di reimmettere le pazienti coinvolte nella
cronologia usuale per lo screening preventivo del cervicocarcinoma uterino.
Abbiamo analizzato i casi di persistenza
del virus dopo il primo step di terapia ed
abbiamo notato che si trattava di 3 casi
con presenza di HPV-DNA genotipo 18
e 3 casi genotipo 16.
Tutti questi 6 casi avevano una diagnosi
istologica di CIN 1 (TAB. 6).
Dopo il secondo step di terapia si sono
negativizzati tutti e 3 i casi di HPV-DNA
18 e non negativizzati i 3 casi di HPVDNA 16.
Rivalutando i risultati a 3 mesi, dopo il
primo step di terapia, abbiamo rilevato
che vi era stata guarigione anche in 4 casi di CIN 1, dei quali 3 erano HPV 18 e
1 HPV 16 (TAB. 7).
Nei 3 casi di cervicite cronica (diagnosi istologica), guariti, si aveva presenza
di HPV 18 (2 casi) e HPV 56 (1 caso)
(TAB. 7).
Nei 7 casi con alterazioni patologiche
alla biopsia (4 CIN 1 e 3 cervicite cronica), nei quali non è stata più trovata la
presenza di HPV dopo il primo step di
terapia, si trattava di 5 casi di HPV 18,
1 caso di HPV 16 e 1 caso di HPV 56
(TAB. 8).
La negativizzazione della presenza di
HPV si è ottenuta:
– nel 100% dei casi in cui non erano
presenti zone di trasformazione atipica
all’esame colposcopico (19 casi).
46
4.
5.
6.
7.
Nel gruppo delle pazienti guarite da
HPV senza lesioni erano presenti anche
3 casi di HPV 16.
– nel 100 % dei casi in cui erano presenti più genotipi contemporaneamente
(9 casi).
8.
9.
CONCLUSIONI
I risultati finali ottenuti in 6 mesi in termini di eradicazione del HPV dalla cervice uterina (90,6%), permettono di affermare l’efficacia della terapia microimmuno-omotossicologica-PRM prescritta.
– In questo studio manca un Gruppo di
controllo, con caratteristiche simili al
Gruppo sottoposto a terapia, ma un
Gruppo di controllo con placebo non
sarebbe stato etico e – pertanto – non
considerato.
Possiamo – inoltre – rilevare che la terapia è stata inefficace quando si è presentato contemporaneamente il binomio: HPV-DNA genotipo 16 e lesioni
anatomopatologiche evidenziate con
esame istologico da biopsia mirata in
왎
colposcopia.
10.
11.
12.
13.
14.
15.
Bibliografia
1. Jemal A., Bray F. et Al. – Global cancer statistics. CA Cancer J. Clin. 2011; 61(2): 69-90.
2. IARC Working Group on the Evaluation of
carcinogenic risks to human. Human papillomaviruses. IARC Monogr. Eval. Carcinog.
Risks Hum. 1995.
3. Schiffman M.H., Hildesheim A. – Cervical
Cancer in Schottenfeld D., Fraumeni J.F.
editors. Cancer epidemiology and preven-
16.
17.
18.
tion. Third ed. Oxford University Press.
2006: 1044-1067.
Bernard H.V., Burk R.D. et Al. – Classification
of papillomaviruses based on 189 PV types
and proposal of taxonomic amendments. Virology. 2010; 401(1): 70-79.
Bouvard V., Baah R. et Al. – WHO International Agency for Research on Cancer. Monograph Working Group. A review of human
carcinogens. Part B: biological agents.
Lancet Oncol. 2009; 10(4): 321-322.
Baseman J.C., Koutsky L.A. – The epidemiology of human papillomavirus infections.
J.Clin.Virol. 2005; 32: 16-24.
Chen Z., De Freitas L.B., Burk R.D. – Evolution and classification of oncogenic human
papillomavirus types and variants associated
with cervical cancer. Methods in Molecular
Biol. 2015; 1269: 3-26.
Guan P., Howel-Jones R. et Al. – Human papillomavirus types in 115.789 HPV-positive
women: A meta analysis from cervical infection to cancer. Int. J. Cancer. 2012; 10: 10021009.
De Sanjosè S., Quint W.G. et Al. – Retrospective international survey and HPV time
trends Study Group. Human papillomavirus
genotype attribution in invasive cervical cancer: a retrospective cross-sectional wordwide
study. Lancet Oncol. 2010; 11(11): 10481056.
Wang L., Wu B. et Al. – Prevalence of human
papillomavirus and its genotype among 1336
invasive cervical cancer patients in Hunan
province, central south China. J. Med. Virol.
2015; 87(3): 516-521.
Wheeler C.M., Hunt W.C. et Al. – Human papillomavirus genotype distributions: implications for vaccination and cancer screening in
the United States. J. Nat. Cancer Inst. 2009;
101(7): 475-487.
Darwich L., Canadas M.D. et Al. – Human papillomavirus genotype distribution and human
papillomavirus 16 and human papillomavirus
18 genomic integration in invasive and in situ
cancer carcinoma in human immunodeficiency virus-infected women. Int. J. Gyn. Cancer.
2011; 21(6): 1486-1490.
Schiffman M., Burk R.D. et Al. – A study of
genotyping for management of human papillomavirus-positive, cytology-negative cervical
screening results. J. Clin. Microb. 2015;
53(1): 52-59.
Parkin D.M., Bray F. – The burden of HPV-related cancers. Chapter 2. Vaccine. 2006; 24
Suppl.3: 11-25.
Abogunrin S., Di Tanna G.L. et Al. – Prevalence of human papillomavirus in head and
neck cancers in European populations: a
meta-analysis. BCM Cancer. 2014; 14(1):
968-976.
zur Hausen H. – Papillomavirus infections: a
major cause of human cancers. Bioch. Bioph:
Acta. 1996; 1288: 55-78.
Daling J.R., Madeleine M.M. et Al. – A population-based study of squamous cell vaginal
cancer: HPV and cofactors. Gyn. Oncol.
2002; 84(2): 263-270.
Rubin M.A., Kleter B. et Al. – Detection and
typing of human papillomavirus DNA in penile
LA MEDICINA BIOLOGICA
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
carcinoma: evidence for multiple independent patways of penile carcinogenesis. Am. J.
Pathol. 2001; 159(4): 1211-1218.
Clark M.A., Hartley A. et Al. – Cancer of the
anal canal. Lancet Oncol. 2004; 5(3): 149-157.
Karagas M.R., Nelson H.H. et Al. – Human
papillomavirus infection and incidence of
squamous cell and basal cell carcinoma of
the skin. J. Nath. Cancer Inst. 2006; 98(6):
389-395.
Gillison M.L., Shah K.V. – Role of mucosal
human papillomavirus in non genital cancer.
Chapter 9. J. Nat. Cancer Inst. Monogr. 2003;
31: 57-65.
Chen H.C., Schiffman N., A. – HPV Study
Group persistence of type-specific human
papillomavirus infection and increased long
term risk of cervical cancer. J. Nat. Cancer
Inst. 2011; 109(8): 1387-1396.
Thabet M., Hermida R. et Al. – Human Papillomavirus is not the main cause of preinvasive and invasive cervical cancer among patients in Delta Region, Egypt. J. Exp. Therap.
and Oncol. 2014; 10(4): 247-253.
Weinstock H., Berman S., Cases W. Jr. –
Sexually trasmitted diseases among American youth: incidence and prevalence estimates. Perspect Sex Reprod Health. 2004;
36: 6-10.
Epicentro. Centro Nazionale di Epidemiologia, Sorveglianza e Promozione della Salute.
Istituto Superiore di Sanità. Online.
Signorelli C. – Human Papillomavirus: Infezione, Tumore della Cervice, Vaccinazione.
Società Editrice Universo, Roma; 2007.
Richardson H., Kelsall G., Tellier P., Voyer H.,
Abrahamowics M., Ferenczy A. – The natural
history of type specific Human Papilloma
Virus: infections in female university students. Cancer Epidemiol Biomarkers Prev.
2003: 12: 485-490.
Trottier H., Franco E.L. – The epidemiology
of genital Human Papilloma Virus infection.
Vaccine. 2006; 24S1: 4-15.
Working Group AIRT. Italian cancer figures
report 2006: incidence, mortality and estimates. Epidemiol Prev. 2006, 30(1 Suppl 2):
8-10, 12-20, 30-101.
Baseman J.G., Koutsky L.A. – The epidemiology of human papilloma virus infections. J
Clin Virol. 2005; 32S: 16-24.
Baker T.S., Newcom W.W., Olson N.H.,
Cowset L.M., Olson C., Brown J.C. – Structures of bovine and human papillomaviruses.
Analisys by cryoelectron microscopy and
three dimensional image reconstruction. Biophys J. 1991; 60: 1445-1456.
Ghittoni R., Accardi R., Hasan U., Gheit T.,
Sylla B., Tommasino M. – The biological
properties of E6 and E7 oncoproteins from
human papillomaviruses. Virus Genes. 2010;
40: 1-13.
O’Brien P.M., Campo M.S. – Papillomaviruses:
a correlation of immune evasion and oncogenicity. Trend Microbiol. 2003; 11:300-305.
Park J.S., Kim E.J., Kwon H.J., Hwang E.S.,
Nam Koong S.E., Um S.J. – Inactivation of interferon regulatory factor-1 tumor suppressor
protein by HPV E7 oncoprotein. Implication
for the E7-mediated immune evasion mech-
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
GENNAIO - MARZO 2016
anism in cervical carcinogenesis. J Biol
Chem. 2000; 275: 6764-6769.
Perea S.E., Massimi P., Banks L. – Human
papilloma virus type 16 E7 impairs the activation of the interferon regulatory factor-1. Int
J Mol Med. 2000; 5: 661-666.
Rahma O.E., Herrin V.E. et Al. – Pre-immature dendritic cells pulsed with HPV 16 E6 or
E7 peptide are capable of cliciting specific immune response in patients with advanced
cervical cancer. J. Translat. Med. 2014; 12:
353-358.
Mota F., Rayment N., Chong S., Singer A.,
Chain B. – The antigen presenting environment in normal and human papilloma virus
(HPV)-related premalignant cervical epithelium. Clin Exp Immunol. 1999; 116: 33-40.
Villa L.L., Vieira H.B., Pei X.F., Schlegel R. –
Differential effect of tumor necrosis factor on
proliferation of primary human keratinocytes
and cell lines containing human papilloma
virus types 16 and 18. Mol Carcinog. 1992; 6:
5-9.
Paesi S., Correa L. et Al. – Human papillomavirus among women with atypical squamous cells of undetermineted segnificance in
southern Brazil. Int. J. Gyn. Obst. 2015;
128(1): 23-26.
Reckeweg H.H. – Materia Medica Omeopatica. 3a Edizione Italiana 2009. Guna Ed., Milano.
Dinarello C.A. – The IL-1 family and inflammatory diseases. Clin. Exp. Rheumatol.
2002; 20 (5): 27-31.
Abbas A.K., Lichtman A.H., Pillai S. – Le basi
dell’immunologia. EDRA LSWR Ed. 2015:
295-298.
Vinogradov A., Scarpa A. – Calcium and pyridine nucleotide interaction in mitochondrial
membranes. Arch Biochem. Biophys. 1972;
152: 646-654.
Di Lisa F., Bernardi P. – Mitochondrial function as a determinant of recovery or death in
all response to injury. Nat. Cell. Biochem.
1998; 184: 379-391.
Enciclopedia della Scienza e della Tecnica
Treccani. Voce “TNF”.
Riferimento bibliografico
MILANI G. – Terapia biologica del
Papilloma Virus Umano.
La Med. Biol., 2016/1; 39-47.
autore
Dott. Guido Milani
– Specialista in Ostetricia, Ginecologia e in Patologia della Riproduzione Umana
– Professore a contratto c/o Università degli Studi di Milano – Corso di
Laurea in Ostetricia
Via Cavour, 96
I – 46100 Mantova
47