LLA
A NNUUOOVVA
A
IINNFFOOR
RM
MA
AZ
ZIIOONNEE CCA
AR
RDDIIOOLLOOG
GIICCA
A
A
Annnnoo 2288°° ­­ M
Maarrzzoo ­­ 22000088 F
FO
OG
GLLIIO
O E
ELLEETTTTRRO
ON
NIIC
CO
O D
DO
OM
MIIC
CIILLIIA
AR
REE N
N.. 8
8
INDICE: Immagine di ponte muscolare coronarico, pag.1. Editoriale: Embolismo cerebrale
cardiogenico, pag. 2-8. Leading articles: Dissincronia intraventricolare, pag. 9-14. Reattività
piastrinica, pag.14-20. Medicina e morale: L’Errore medico, pag. 20-25
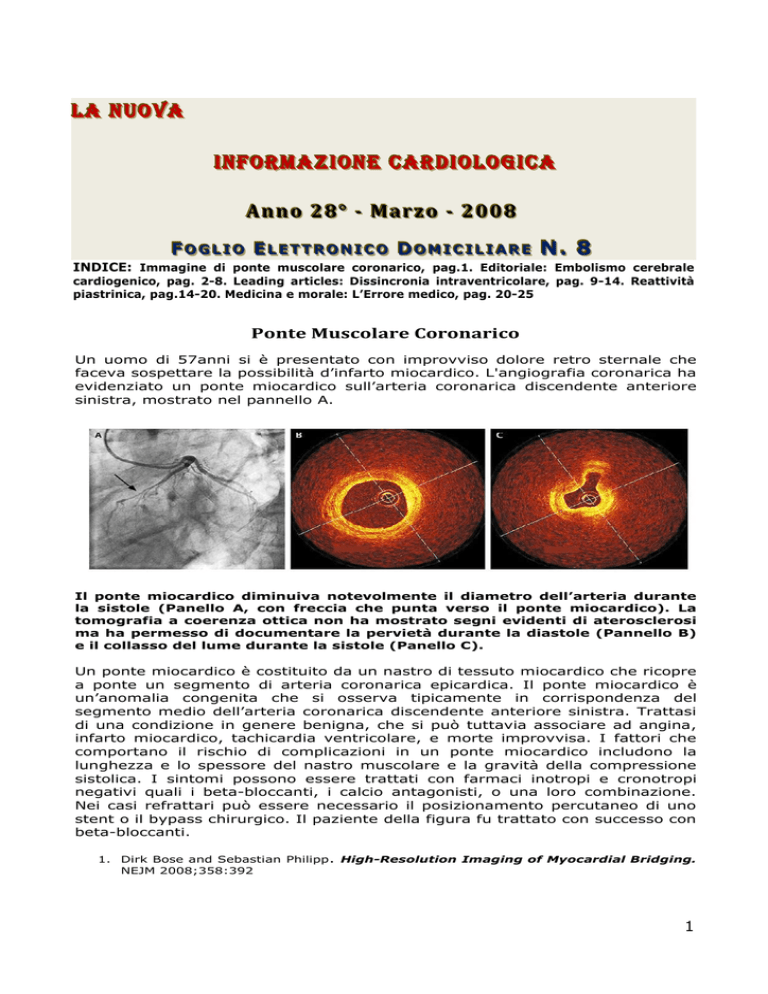
Ponte Muscolare Coronarico Un uomo di 57anni si è presentato con improvviso dolore retro sternale che
faceva sospettare la possibilità d’infarto miocardico. L'angiografia coronarica ha
evidenziato un ponte miocardico sull’arteria coronarica discendente anteriore
sinistra, mostrato nel pannello A.
Il ponte miocardico diminuiva notevolmente il diametro dell’arteria durante
la sistole (Panello A, con freccia che punta verso il ponte miocardico). La
tomografia a coerenza ottica non ha mostrato segni evidenti di aterosclerosi
ma ha permesso di documentare la pervietà durante la diastole (Pannello B)
e il collasso del lume durante la sistole (Panello C).
Un ponte miocardico è costituito da un nastro di tessuto miocardico che ricopre
a ponte un segmento di arteria coronarica epicardica. Il ponte miocardico è
un’anomalia congenita che si osserva tipicamente in corrispondenza del
segmento medio dell’arteria coronarica discendente anteriore sinistra. Trattasi
di una condizione in genere benigna, che si può tuttavia associare ad angina,
infarto miocardico, tachicardia ventricolare, e morte improvvisa. I fattori che
comportano il rischio di complicazioni in un ponte miocardico includono la
lunghezza e lo spessore del nastro muscolare e la gravità della compressione
sistolica. I sintomi possono essere trattati con farmaci inotropi e cronotropi
negativi quali i beta-bloccanti, i calcio antagonisti, o una loro combinazione.
Nei casi refrattari può essere necessario il posizionamento percutaneo di uno
stent o il bypass chirurgico. Il paziente della figura fu trattato con successo con
beta-bloccanti.
1.
Dirk Bose and Sebastian Philipp. High-Resolution Imaging of Myocardial Bridging.
NEJM 2008;358:392
1
E
Em
mb
bo
olliissm
mo
oC
Ce
erre
eb
brra
alle
eC
Ca
arrd
diio
og
ge
en
niicco
o
Circa il 20% degli ictus ischemici dipendono da anormalità cardiache a rishio
elevato 1,2. In un altro 30%, la eziologia non può essere determinata, ma la
gran parte degli ictus ischemici così detti "criptogenetici" presentano
caratteristiche emboliche 3, di possibile origine cardio-aortica 2. Il cervello, che
riceve il 15% della gettata cardiaca, è estremamente sensibile all’ischemia.
Così, materiale rimosso prossimamente ai grandi vasi spesso percorre le
arterie cervico-cefaliche, dove l’impatto tende a manifestarsi in termini clinici
bruschi. Comunemente, il materiale embolico è un trombo 4, la cui propensione
alla dissoluzione spontanea aumenta il rischio di conversione emorragica 5.
Invece, i tromboemboli di origine centrale frequentemente occludono piccole
arterie cerebrali o rami maggiori 4; microemboli, di aria, grasso, e cristalli di
colesterolo, possono raggiungere i più piccoli rami terminali, provocando infarto
lineare 6.
La presentazione clinica non permette la distinzione dell’ictus embolico
cardiogenico da quello non embolico. L’embolia cardiogenica cerebrale si
presenta in modo brusco caratteristico con deficit neurologici che sono massimi
all’esordio, in seguito all’improvvisa interruzione del flusso ematico 7. Ciò
contrasta con il decorso a gradini progressivi tipico dell’ictus trombotico
aterosclerotico 8, tuttavia, poiché l’embolo può spostarsi o frammentarsi dopo
l’impatto iniziale 2, in circa un quinto degli ictus embolici cardiogenici la
presentazione clinica non è brusca 7,8. Inoltre, l’aterosclerosi con trombosi di
arteria principale causa non solo ipoperfusione 6, ma anche embolie da arteria
ad arteria 2; di conseguenza, caratteristiche di tipo embolico cardiogenico
possono presentarsi in oltre i due quinti degli ictus non embolici 8. Le
caratteristiche più specifiche dell’embolia cardiogenica sono infarti in molti
territori ed embolie sistemiche concomitanti 7,9. La diagnosi di infarto cerebrale
cardiogenico dipende dalla dimostrazione dettagliata delle patologie cardiache
come possibile sorgente di embolie elencate nella tabella I e dall’appoggio
clinico di neuro-immagini, o di reperti di laboratorio.
Neuro-immagini. La risonanza magnetica nucleare (RMN) permette di
ottenere una risoluzione superiore a quella della tomografia computerizzata
(TC), insieme con la capacità di rilevare l’ischemia cerebrale entro pochi minuti
dall’inizio 10. Le immagini vascolari non invasive, della tomografia
computerizzata, dell’ecocardiografia e della risonanza magnetica nucleare,
hanno praticamente sostituito l’angiografia convenzionale, e possono essere di
aiuto per riconoscere una sorgente cardiogenica, specialmente se usate
2
precocemente 11. Le tecniche d’immagini più utilizzate sono la tomografia
computerizzata (TC) e l’ecocardiografia trans-toracica e trans-esofagea.
Tabella I Sorgenti Prossimali di Embolie Cardiogeniche
Rischio Elevato
Rischio Moderato o Incerto
Disritmie atriali
Anormalità del setto interatriale
• Fibrillazione atriale
• Forame ovale pervio
• Sindrome del nodo del seno
• Difetto del setto atriale
• Flutter atriale
• Aneurisma del setto atriale
Trombo atriale sinistro
Malformazione artero-venosa polmonare
• Disritmie atriali
• Stenosi valvolare mitralica
Trombo ventricolare sinistro
Eco contrasto spontaneo ("fumo")
• Infarto miocardico acuto
• Cardiomiopatia dilatativa
Tumori cardiaci primari
Prolasso valvolare mitralico
• Mixoma
• Fibroelastoma papillare
Metastatisi tumorali nel cuore
Calcificazioni valvolari
• Calcificazione dell’anello mitralico
• Stenosi/sclerosi della valvola aortica
Vegetazioni
Corde valvolari
• Infettive
• Non infettive (marantiche)
Protesi valvolari cardiache
Ateroma aortico complicato
3
Il reperto di un’arteria cerebrale iperdensa in una TC dell’encefalo senza mezzo
di contrasto 12, denota un trombo (Fig. 1), nell’assenza di una patologia
arteriosa prossimale.
Figura 1 Trombo nell’Arteria Cerebrale Media Destra
Figura 1: Scansione tomografica computerizzata dell’encefalo in un paziente con
fibrillazione atriale, che dimostra una iperdensità in arteria cerebrale media destra
compatibile con trombo-embolia (freccia). Illustrazioni nella figura di Rob Flewell.12
Il precoce impiego in ictus acuti della tomografia computerizzata a sezioni
sottili, senza mezzo di contrasto, è più efficiente delle sezioni convenzionali,
permettendo l’identificazione di circa il 90% dei trombi intracranici 13. La
presenza di trombo intracranico può anche essere riconosciuta con altre
tecniche non invasive come l’angiografia magnetica nucleare 14, o la CT
convenzionale 15, o il Doppler trans-cranico 16. Recentemente, la RMN è stata
applicata per identificare trombi ricchi di eritrociti, che costituiscono la prova
diretta di embolia cardiogenica 17. In definitiva, tuttavia, la diagnosi di ictus
cardiogenico si basa sul riconoscimento proprio della sorgente cardiologica
dell’embolia (tab I), per cui si richiede l’immagine ecocardiografica del cuore e
dell’aorta e il monitoraggio elettrocardiografico.
Ecocardiografia. In pazienti con cardiopatia clinicamente evidente, la
dimostrazione di sorgente cardiaca di embolie con la ecocardiografia trans
toracica convenzionale (ETC) e l’iniezione di soluzione salina agitata (come eco
contrasto) può superare il 25% 18, ma altrimenti cade sotto il 10% 11. Invece,
la superiore risoluzione dell’immagine della ecocardiografia trans esofagea
4
(ETE) permette la identificazione di possibile sorgente cardiaca di embolie in
più del 50% di pazienti senza cardiopatia clinicamente evidente 18 o con
inspiegati eventi cerebro vascolari 19. L'ecocardiografia trans toracica di elevata
qualità è ritenuta sufficiente se positiva per la diagnosi di: ● protesi valvolari, ●
cardiomiopatia dilatativa, ● aneurisma e/o trombo ventricolare sinistro, ●
prolasso valvolare mitralico, ● vegetazione endocardica, ● difetto del setto
atriale, ● shunt interatriale, ● aneurisma del setto atriale. L’iniezione di
soluzione salina agitata (come eco contrasto) può rivelare uno shunt
interatriale da destra a sinistra, ma la diagnosi definitiva di forame ovale
pervio, distinto dal piccolo difetto del setto atriale, richiede l’ecocardiografia
trans esofagea. 20.
L’ecocardiografia trans esofagea non è indicata in tutti i pazienti, ma è
necessaria per la diagnosi di: ● trombo atriale sinistro 21(fig. 2),
Fig. 2 Trombo nell’Appendice Atriale Sinistra
Figura 2: Ecocardiogramma trans esofageo nella proiezione longitudinale che
evidenzia materiale eco-denso (teste di freccia) entro l’appendice dell’atrio sinistro
(LA) (freccia), attribuibile a trombo; reperto osservato con la fibrillazione atriale o
con la stenosi mitralica. Illustrazioni nella figura di Rob Flewell. 21
● eco contrasto spontaneo in atrio sinistro, ● ateroma aortico, ● forame ovale
pervio, la cui presenza si correla specialmente con l’ictus criptogenetico. Il
meccanismo presunto è basato su rari esempi di trombo che attraversano" il
forame in pazienti con ictus (Fig. 3). L’evento congiunto di trombo-embolia
venosa e forame ovale è sufficiente per una diagnosi circostanziata di embolia
paradossa 22. L’embolia paradossa è anche molto importante nella patogenesi
di alcune forme di emicrania causata da microinfarti cerebrali clinicamente
silenti che vengono efficacemente curati con l’occlusione protesica del forame
ovale ● corde valvolari.
Se l'ecocardiografia trans toracica è negativa, tuttavia, l’ecocardiografia trans
esofagea può aumentare l’accuratezza diagnostica, specialmente per quanto
riguarda vegetazioni e difetto del setto atriale. In particolare, la ecocardiografia
trans esofagea permette la diagnosi di ateroma aortico "complesso", che
consiste in una placca protrudente, mobile, o ulcerata 23. Tecniche più nuove
hanno portato l’accuratezza diagnostica della ecocardiografia trans toracica
5
convenzionale per gli shunts interatriali destra-sinistra più vicina a quella della
ecocardiografia trans esofagea 24-26. La seconda armonica della ecocardiografia
trans toracica convenzionale permette di raggiungere sensibilità dal 62.5% al
90% rispetto alla ecocardiografia trans esofagea 24,25.
Figura 3: Trombo in Transito
Fig. 3: Visualizzazione ecocardiografica trans esofagea sull’asse corto del cuore, che
mostra una eco-densità rettangolare con 2 estensioni distali intrappolata nel forame
ovale (freccia), prodotta da trombo in movimento. La testa di freccia indica il septum
primum. Le illustrazioni della figura di Rob Flewell.22
L’ecocardiografia trans esofagea è l’indagine di prima scelta nei pazienti più
giovani con ictus inspiegato, nei quali è più elevata la prevalenza di potenziali
sorgenti cardiogeniche di emboli che sono difficili a rilevare con
l'ecocardiografia trans toracica, insieme con la presenza di patologia occulta
potenzialmente a rischio di gravi conseguenze. Benché il Doppler trans cranico
con iniezione di contrasto permetta accuratezza diagnostica degli shunts
destra-sinistra comparabile a quella della ecocardiografia trans esofagea 27,
non fornisce però informazione diretta sulla struttura cardiaca.
Il decorso dell’ictus embolico cardiogenico è peggiore di quello di altri sottotipi
di ictus 28. Studi clinici non hanno dimostrato alcun beneficio della terapia
anticoagulante acuta endovenosa, complicata invece da maggiori emorragie
intracraniche sintomatiche rispetto alla terapia antiaggregante piastinica, ora
raccomandata 29. La scelta di un agente antitrombotico dipende dal bilancio tra
rischio trombo-embolico e rischio emorragico sia nei trattamenti acuti che in
quelli cronici. L’incidenza di trasformazione emorragica nell’ictus embolico
cardiogenico, che può variare da formazione di petecchie ad ematoma nel
contesto dell’infarto cerebrale, raggiunge in media il 42% 5. Il picco d’inizio è
tra 2 e 4 giorni, per cui nella fibrillazione atriale, l’anticoagulazione dovrebbe
essere iniziata 4 giorni dopo l’ictus 30. Rispetto al trattamento antiaggregante,
l’anticoagulazione di lunga durata raddoppia il rischio di emorragia intracranica
(da 0.3% a 0.6% per anno) 31. Il rischio emorragico acuto si correla con
l’estensione dell’infarto 5, ma l’entità dei rischi acuti e cronici sono anche
6
determinati
da
età,
dell’anticoagulazione 31.
pressione
arteriosa,
intensità
e
stabilità
Bibliografia
1. Albers GW, Amarenco P, Easton JD, Sacco RL, Teal P. Antithrombotic and thrombolytic
therapy for ischemic stroke Chest 2004;126:483S-512S.
2. Kistler JP. Cerebral embolism Compr Ther 1996;22:515-530.
3. Sacco RL, Ellenberg JH, Mohr JP, et al. Infarcts of undetermined cause: the NINCDS
Stroke Data Bank Ann Neurol 1989;25:382-390.
4. Marder VJ, Chute DJ, Starkman S, et al. Analysis of thrombi retrieved from cerebral
arteries of patients with acute ischemic stroke Stroke 2006;37:2086-2093.
5. Moulin T, Crepin-Leblond T, Chopard JL, Bogousslavsky J. Hemorrhagic infarcts Eur
Neurol 1994;34:64-77.
6. Momjian-Mayor I, Baron JC. The pathophysiology of watershed infarction in internal
carotid artery disease: review of cerebral perfusion studies Stroke 2005;36:567-577.
7. Kittner SJ, Sharkness CM, Price TR, et al. Infarcts with a cardiac source of embolism in
the NINCDS Stroke Data Bank: historical features Neurology 1990;40:281-284.
8. Arboix A, Oliveres M, Massons J, Pujades R, Garcia-Eroles L. Early differentiation of
cardioembolic from atherothrombotic cerebral infarction: a multivariate analysis Eur J
Neurol 1999;6:677-683.
9. Bogousslavsky J, Cachin C, Regli F, Despland PA, Van Melle G, Kappenberger L. Cardiac
sources of embolism and cerebral infarction—clinical consequences and vascular
concomitants: the Lausanne stroke registry Neurology 1991;41:855-859.
10. Chalela JA, Kidwell CS, Nentwich LM, et al. Magnetic resonance imaging and computed
tomography in emergency assessment of patients with suspected acute stroke: a
prospective comparison Lancet 2007;369:293-298.
11. Lee LJ, Kidwell CS, Alger J, Starkman S, Saver JL. Impact on stroke subtype diagnosis
of early diffusion-weighted magnetic resonance imaging and magnetic resonance
angiography Stroke 2000;31:1081-1089.
12. Pressman BD, Tourje EJ, Thompson Jr. An early CT sign of ischemic infarction:
increased density in a cerebral artery AJR Am J Roentgenol 1987;149:583-586.
13. Kim EY, Lee SK, Kim DJ, et al. Detection of thrombus in acute ischemic stroke: value of
thin-section noncontrast-computed tomography Stroke 2005;36:2745-2747.
14. Beauchamp Jr. NJ, Barker PB, Wang PY, vanZijl PC. Imaging of acute cerebral ischemia
Radiology 1999;212:307-324.
15. Tomandl BF, Klotz E, Handschu R, et al. Comprehensive imaging of ischemic stroke with
multisection CT Radiographics 2003;23:565-592.
16. Demchuk AM, Saqqur M, Alexandrov AV. Transcranial Doppler in acute stroke
Neuroimaging Clin N Am 2005;15:473-480ix.
17. Cho KH, Kim JS, Kwon SU, Cho AH, Kang DW. Significance of susceptibility vessel sign
on T2*-weighted gradient echo imaging for identification of stroke subtypes Stroke
2005;36:2379-2383.
18. Rahmatullah AF, Rahko PS, Stein JH. Transesophageal echocardiography for the
evaluation and management of patients with cerebral ischemia Clin Cardiol
1999;22:391-396.
19. Kizer JR, Silvestry FE, Kimmel SE, et al. Racial differences in the prevalence of cardiac
sources of embolism in subjects with unexplained stroke or transient ischemic attack
evaluated by transesophageal echocardiography Am J Cardiol 2002;90:395-400.
20. Cheitlin MD, Armstrong WF, Aurigemma GP, et al. ACC/AHA/ASE 2003 guideline update
for the clinical application of echocardiography: summary article: a report of the
American College of Cardiology/American Heart Association Task Force on Practice
Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the Clinical
Application of Echocardiography) J Am Coll Cardiol 2003;42:954-970.
21. Agmon Y, Khanderia BK, Gentile F, Seward JB. Clinical and echocardiographic
characteristics of patients with left atrial thrombus and sinus rhythm Circulation
2002;105:27-31.
7
22. Meacham RR, Headley AS, Bronze MS, Lewis JB, Rester MM. Impending paradoxical
embolism Arch Intern Med 1998;158:438-448.
23. The Stroke Prevention in Atrial Fibrillation Investigators Committee on
Echocardiography Transesophageal echocardiographic correlates of thromboembolism in
high-risk patients with nonvalvular atrial fibrillation Ann Intern Med 1998;128:639-647.
24. Ha JW, Shin MS, Kang S, et al. Enhanced detection of right-to-left shunt through patent
foramen ovale by transthoracic echocardiography using harmonic imaging Am J Cardiol
2001;87:669-671.
25. Souteyrand G, Motreff P, Lusson JR, et al. Comparison of transthoracic
echocardiography using second harmonic imaging, transcranial Doppler and
transesophageal echocardiography for the detection of patent foramen ovale in stroke
patients Eur J Echocardiogr 2006;7:147-154.
26. Kerr AJ, Buck T, Chia K, et al. Transmitral Doppler: a new transthoracic contrast
method for patent foramen ovale detection and quantification J Am Coll Cardiol
2000;36:1959-1966.
27. Droste DW, Silling K, Stypmann J, et al. Contrast transcranial Doppler ultrasound in the
detection of right-to-left shunts: time window and threshold in microbubble numbers
Stroke 2000;31:1640-1645.
28. Grau AJ, Weimar C, Buggle F, et al. Risk factors, outcome, and treatment in subtypes of
ischemic stroke: the German stroke data bank Stroke 2001;32:2559-2566.
29. Paciaroni M, Agnelli G, Micheli S, Caso V. Efficacy and safety of anticoagulant treatment
in acute cardioembolic stroke: a meta-analysis of randomized controlled trials Stroke
2007;38:423-430.
30. Hart RG, Palacio S, Pearce LA. Atrial fibrillation, stroke, and acute antithrombotic
therapy: analysis of randomized clinical trials Stroke 2002;33:2722-2727.
31. Hart RG, Tonarelli SB, Pearce LA. Avoiding central nervous system bleeding during
antithrombotic therapy: recent data and ideas Stroke 2005;36:1588-1593.
Prof. Paolo Rossi
Primario Cardiologo, Novara. E-mail: [email protected]
LLA
AN
NIIC
NU
UO
C))
OV
VA
A IIN
NF
FO
OR
RM
MA
AZZIIO
ON
NE
EC
CA
AR
RD
DIIO
OLLO
OG
GIIC
CA
A ((N
è inviata gratuitamente secondo una mailing list predisposta; si può
essere cancellati o essere iscritti per riceverla, inviando la richiesta
a:
[email protected]
L’ARCHIVIO DEI NUMERI PRECEDENTI SI TROVA NEL SITO:
http://www.foliacardiologica.it
Direttore Responsabile: Prof. Paolo Rossi - [email protected]
Direttore Scientifico: Dott. Eraldo Occhetta – [email protected]
Segretario Scientifico: Dott. Gabriele Dell’Era - [email protected]
8
D
Diissssiinnccrroonniiaa iinnttrraavveennttrriiccoollaarree vvaalluuttaattaa m
meeddiiaannttee rriissoonnaannzzaa m
maaggnneettiiccaa
ccaarrddiiaaccaa ccoom
moorrbbiilliittàà ee m
mee ffaattttoorree pprreeddiittttiivvoo ddii m
moorrttaalliittàà ddooppoo iim
mppiiaannttoo
ddii rreessiinnccrroonniizzzzaattoorree ccaarrddiiaaccoo.
Chalil S, Stegemann B, Muhyaldeen S, et al. Intraventricular dyssynchrony predicts mortality and
morbidity after cardiac resynchronization therapy. A study using cardiovascular magnetic resonance
tissue synchronization imaging. J Am Coll Cardiol 2007; 50: 243-252.
Introduzione
La
terapia
di resincronizzazione
miocardica
mediante stimolazione
biventricolare, si è affermata, nell’ultimo decennio, come una valida ed efficace
alternativa terapeutica nei pazienti con scompenso cardiaco refrattario e
dissincronia ventricolare (1-4). E’ noto, tuttavia, che circa il 20-30 % dei pazienti
non rispondono positivamente all’impianto sottolineando la necessità di
ottimizzare la selezione dei pazienti candidati a tale procedura (5).
La dissincronia miocardica è, nella stragrande maggioranza dei casi, valutata
mediante tecnica ecocardiografica che però è in grado di esplorare solamente
parte del ventricolo sinistro; la risonanza magnetica cardiaca, al contrario,
permette una valutazione globale di tutto il cuore.
In questo studio (6) , gli Autori hanno valutato un nuovo indice di dissincronia
miocardica:l’indice di sincronizzazione tissutale (CMR-TSI) ottenuto proprio
mediante risonanza magnetica.
Metodi e risultati
Questo studio prevedeva due fasi: nella prima, il CMR-TSI è stato correlato alla
durata del QRS in 66 pazienti consecutivi (età media 60.8 ± 10.8 anni) affetti
da scompenso cardiaco in classe funzionale NYHA III o IV e frazione di eiezione
del ventricolo sinistro < 35%; 53 pazienti erano affetti da cardiomiopatia postischemica e 13 da cardiomiopatia dilatativa idiopatica. Questi soggetti sono
stati comparati con 20 individui sani di controllo.
Nella seconda fase, lo stesso indice è stato correlato alla capacità funzionale,
alla qualità di vita, al rimodellamento ventricolare sinistro, al tasso di
ospedalizzazioni ed alla mortalità in 77 pazienti (42 dei quali erano già stati
inclusi nella prima analisi) con insufficienza cardiaca e durata del QRS ≥ 120
msec, sottoposti ad impianto di PM biventricolare.
Il CMR-TSI è stato ottenuto mediante impiego di scanner 1.5 T durante una
fase di respiro trattenuto per 8 secondi, con acquisizione in asse corto di
immagini di 8 mm di spessore dall’anello atrioventricolare all’apice. Il
movimento parietale radiale è stato valutato semiautomaticamente
suddividendo il ventricolo sinistro in 6 segmenti per costruire mappe polari di
sincronizzazione tissutale e per ottenere una misura globale di dissincronia
corrispondente proprio all’indice di sincronizzazione tissutale. (Fig.1).
Nella sottoanalisi 1 i pazienti con insufficienza cardiaca presentavano una
frazione di eiezione media del ventricolo sinistro di 23.9 ± 12.1 % e una durata
9
Figura 1
Fig. 1: Movimento parietale miocardico in un soggetto sano di controllo ed in un
paziente con insufficienza cardiaca. (A) Suddivisione del ventricolo sinistro in fette e
segmenti. (B) La giunzione tra il setto interventricolare e la parete libera del
ventricolo destro (RV) delimita l’inizio del segmento 1 e la fine del segmento 6 del
ventricolo sinistro (LV). (C e D) Rappresentazione grafica del movimento di parete
dei 6 segmenti del ventricolo sinistro durante un ciclo cardiaco in una porzione
basale del ventricolo sinistro in un soggetto di controllo (C) ed in un paziente con
scompenso cardiaco e blocco di branca sinistro (D) .
media del QRS di 147.8 ± 25.0 msec. Il CMR-TSI è risultato più elevato nei
pazienti con scompenso cardiaco e durata del QRS < 120 msec (79.5 ± 31.2
msec; p = 0.0003), nei pazienti con scompenso cardiaco e durata del QRS
compresa tra 120-149 msec (98.5 ± 36.2; p < 0.0001) e nei pazienti con
insufficienza cardiaca e durata del QRS ≥ 150 msec (112.1 ± 68.7 msec; p <
0.0001) rispetto ai 20 soggetti di controllo (21.2 ± 8.1 msec).
Nella sottoanalisi 2, è emerso come i pazienti che presentavano un CMR-TSI ≥
110 msec avevano una durata del QRS mediamente superiore (157.0 ± 28.0
msec), maggiori volumi telediastolici e telesistolici (282.6 ± 102.9 e 236.8 ±
97.6) e minore FE (17.2 ± 5.9 %) rispetto ai pazienti con CMR-TSI < 110 msec
10
(rispettivamente 145.1 ± 21.4 msec; p = 0.0372, 203.8 ± 69.4; p = 0.0002,
158.0 ± 72.1; p = 0.0002, 26.6 ± 13 %; p = 0.0004). Durante un follow-up
medio di 764 giorni (range da 85 a 1602 gg), i pazienti con CMR-TSI ≥ 110
msec avevano una probabilità di 5.2 volte superiore di morte per tutte le cause
o di essere ospedalizzati per un evento cardiovascolare maggiore (HR 2.45;
95% IC 1.51-4.34; p = 0.0002), di 11 volte superiore di morte per tutte le
cause o di essere ospedalizzati per scompenso cardiaco (HR 2.15; 95% IC
1.23-4.14; p = 0.006) e di 19 volte superiore di morte per causa
cardiovascolare (HR 3.82; 95% IC 1.63-16.5; p = 0.0007) rispetto ai pazienti
con CMR-TSI < 110 msec.
Inoltre, durante un follow-up medio di 557 giorni (range da 59 a 1144 gg), un
significativo miglioramento della classe funzionale NYHA e della distanza
percorsa durante test del cammino di 6 min sono stati osservati in tutti i
pazienti, indipendentemente dal valore di CMR-TSI dopo impianto di
resincronizzatore cardiaco; al contrario, un aumento significativo della frazione
di eiezione dopo stimolazione biventricolare è stato osservato solo nei pazienti
con CMR-TSI < 110 msec (da 26.5 ± 12 a 31.8 ± 12.1; p < 0.01) ma non nei
pazienti con CMR-TSI ≥ 110 msec ( da 24.1 ± 10.3 a 24.4 ± 0.09) (tab. I).
Tabella I
CMR-TSI <110 ms (n = 43) CMR-TSI 110 ms (n =
34)
Baseline
Follow-Up
Baseline
Follow-Up
NYHA functional class, n
(%)
I
0
II
0
III
29 (67)
IV
14 (33)
6-min walk test, m
273.6
±
106.2
Quality-of-life score
61.7 ± 18.1
Echocardiography
LVESV, cm3
150.7 ± 60.3
12 (28)*
21 (49)*
8 (19)*
2 (5)*
355.1
±
122.2*
28.2 ± 25.8*
0
0
28 (82)
6 (18)
254.2
±
99.8
47.1 ± 18.3
6 (18)*
19 (56)*
9 (26)*
0*
326.1 ± 97.8
136.1 ± 58.1
LVEDV, cm3
190.8 ± 60.5
170.0
± 163.1 ± 49.2
58.8
221.8
± 209.7 ± 53.4
57.9
24.1 ± 10.3 24.4 ± 0.09
197.3 ± 62.0
29.0 ± 21.0
LVEF, %
26.5 ± 12.0
31.8 ± 12.1
p
<
0.0001
*
p < 0.001
p < 0.01. p values refer to differences from baseline values within the group.
NYHA = New York Heart Association
Tab. I: Variabili cliniche ed ecocardiografiche durante il follow-up nei pazienti
sottoposti a stimolazione biventricolare divise a seconda del grado di dissincronia in
condizioni basali.
11
Identificando un cut-off di 110 msec, questo indice di sincronizzazione tissutale
è risultato un fattore predittivo di morte cardiovascolare con una sensibilità del
93% ed una specificità del 67% (p < 0. 0001).
Gli Autori concludono pertanto sottolineando l’importanza del CMR-TSI come
potente fattore predittivo indipendente di morbilità e mortalità dopo terapia di
resincronizzazione cardiaca.
Commento
I risultati di questo studio sono indubbiamente interessanti e sembrano aprire
nuove prospettive per una più corretta identificazione e selezione dei pazienti
da sottoporre a resincronizzazione cardiaca. Fino a questo momento, la scelta
dei candidati all’ impianto di device biventricolare è stata subordinata alla
conferma di una reale desincronizzazione ventricolare valutata attraverso
l’ecocardiografia che, mediante una serie di molteplici quanto complicati indici
di dissincronia pare essere in grado di predire se un determinato paziente si
gioverà di una stimolazione biventricolare. In realtà, come già detto sopra,
l’ecocardiografia è una metodica che non è in grado di valutare globalmente
tutto il ventricolo sinistro e che comunque non è in grado di predire con una
accuratezza del 100% i pazienti che trarranno reali benefici dall’impianto.
Peraltro, come ben sottolineato dagli stessi Autori, anche la valutazione
dell’indice di sincronizzazione tissutale ottenuto mediante risonanza magnetica,
pur con una bassa variabilità inter- ed intraosservatore (riportata < 9%), non
è una metodica scevra da errori. E’ noto, come una ridotta contrattilità del
ventricolo sinistro si associ ad una minor variazione del movimento parietale
durante il ciclo cardiaco; di conseguenza, il CMR-TSI può essere indice di
discinesia o di “rumore” piuttosto che di reale dissincronia.
E’ altresì indiscutibile che la risonanza magnetica non è certo una metodica alla
portata di tutti i centri e diffusa quanto l’ecocardiografia. Inoltre, il suo utilizzo,
nonostante quanto riportato da studi recenti (7,8) , è allo stato attuale ancora
precluso ai pazienti portatori di PM o defibrillatore. Questo ne limita fortemente
l’utilità nel follow-up o nella valutazione dell’eventuale upgrading da sistemi di
stimolazione cardiaca convenzionale a sistemi biventricolari nei soggetti con
scompenso cardiaco refrattario.
Nonostante questi limiti, i risultati di questo studio sono decisamente
importanti. Innanzitutto, sembra emergere come tutti i pazienti affetti da
scompenso cardiaco presentino una certa quota di dissincronia ventricolare,
indipendentemente dalla durata del QRS all’ECG di superficie, questo dato che
era già emerso da uno studio di Yu e Coll. (9) potrebbe modificare
l’atteggiamento terapeutico anche in quei soggetti senza indicazione classica
all’impianto di uno stimolatore biventricolare.
Il dato più saliente che però emerge da questo lavoro è che nei pazienti con
scompenso cardiaco avanzato, l’indice CMR-TSI è risultato altamente predittivo
di aumentata mortalità (globale o per cause cardiovascolari) e di
ospedalizzazioni per scompenso cardiaco o per eventi cardiovascolari maggiori
e che i pazienti che presentano un ventricolo sinistro più dilatato, più
compromesso e dissincrono sono quelli che peggio rispondono alla
resincronizzazione. Questi risultati dovrebbero indurci ad una attenta
12
riflessione prima di sottoporre un paziente in classe funzionale NYHA IV
all’impianto di un dispositivo biventricolare.
Conclusioni
Numerosi trials clinici hanno dimostrato l’importante ruolo della stimolazione
biventricolare nei pazienti con scompenso cardiaco refrattario e dissincronia
inter- ed intraventricolare. E’ esperienza comune, tuttavia, che alcuni pazienti,
pur presentando indicazioni classiche non rispondono ad una terapia di
resincronizzazione elettrica.
Questo studio, seppure limitato dall’esiguità della casistica presa in esame,
sembra documentare come una valutazione preliminare dell’indice di
sincronizzazione tissutale mediante risonanza magnetica, possa meglio
identificare i pazienti che trarranno reali benefici dall’impianto ed i pazienti
non-responders.
Sono ovviamente necessari ulteriori studi , condotti su popolazioni più ampie
per confermare definitivamente la validità di questo nuovo e promettente
parametro.
Bibliografia
1)
2)
3)
4)
5)
6)
7)
8)
9)
Abraham WT, Fisher WG, Smith AL, et al. for the MIRACLE Study Group: Multicenter
InSync Randomized Clinical Evaluation. Cardiac resynchronization in chronic heart
failure. N Engl J Med 2002; 346: 1845-1853.
Linde C, Leclercq C, Rex S, et al. Long-term benefits of biventricular pacing in
congestive heart failure: results from the Multisite Stimulation in Cardiomiopathy
(MUSTIC) study. J Am Coll Cardiol 2002; 40: 111-118.
Bristow MR, Saxon LA, Boehmer J, et al. Comparison of Medical therapy, Pacing, and
Defibrillation in Heart failure (COMPANION) Investigators. Cardiac resynchronization
therapy with or without an Impantable Defibrillator in advanced chronic heart failure.
N Eng J Med 2004; 350: 2140-2150.
Cleland JGF, Daubert JC, Erdmann E, et al, for the Cardiac Resynchronization-Heart
Failure (CARE-HF) Study Investigators. The effect of cardiac resynchronization on
morbidity and mortality in heart failure. N Engl J Med 2005; 352: 1539-1549.
Leclercq C, Kass DA, Retiming the failing heart : principles and current clinical status
of cardiac resynchronization. J Am Coll Cardiol 2002; 39: 194-201.
Chalil S, Stegemann B, Muhyaldeen S, et al. Intraventricular dyssynchrony predicts
mortality and morbidity after cardiac resynchronization therapy. A study using
cardiovascular magnetic resonance tissue synchronization imaging. J Am Coll Cardiol
2007; 50: 243-252.
Sommer T, Naehle CP, Yang A, et al. Strategy for safe performance of extrathoracic
magnetic resonance imaging at 1.5 tesla in the presence of cardiac pacemakers in
non-pacemaker-dependent patients: a prospective study with 115 examinations.
Circulation 2006; 114: 1285-1292.
Nazarian S, Roguin A, Zviman MM, et al. Clinical utility and safety of a protocol for
noncardiac and cardiac magnetic resonance imaging of patients with permanent
pacemakers and implantable-cardioverter defibrillators at 1.5 tesla. Circulation 2006;
114: 1277-1284.
Yu CM, Lin H, Zhang Q, et al. High prevalence of left ventricular systolic and diastolic
asynchrony in patients with congestive heart failure and normal QRS duration. Heart
2003; 89: 54-60.
Miriam Bortnik
Divisione Clinicizzata di Cardiologia
13
Azienda ospedaliera Maggiore della Carità-Novara
Fax 0321 3733407
e-mail: [email protected]
IIm
mppaattttoo ddeellllaa rreeaattttiivviittaa’’ ppiiaassttrriinniiccaa ssuuggllii oouuttccoom
meess ccaarrddiioovvaassccoollaarrii nneeii
ppaazziieennttii ccoonn ddiiaabbeettee ddii ttiippoo 22 ee m
maallaattttiiaa ccoorroonnaarriiccaa..
Impact of platelet reactivity on cardiovascular outcomes in patients with type 2
diabetes mellitus and coronary artery disease.
Angiolillo DJ, Bernardo E, Sabate’ M, et al. J Am Coll Cardiol, 2007; 50:1541-1547
Scopo dello studio
Lo studio è stato disegnato in modo da determinare l’impatto prognostico di
un’elevata reattività piastrinica sull’incidenza di eventi cardiovascolari maggiori
in un lungo periodo di follow up in pazienti con diabete mellito di tipo 2 , affetti
da malattia coronarica.
Metodi
Furono inseriti nello studio pazienti con diabete mellito di tipo 2(T2DM) e
malattia coronarica (CAD) in trattamento cronico con una doppia antiaggregazione con clopidogrel 75 mg/die per 12 mesi ed aspirina 100 mg/die
indefinitamente. La terapia doveva essere iniziata da almeno 6-9 mesi. Al
momento dell’ingresso nello studio fu valutata la funzione piastrinica e quindi i
pazienti furono suddivisi in 4 gruppi secondo il quartile di distribuzione in
funzione dell’aggregabilità massima (Aggmax) dopo infusione di 20 μmol/l di
adenosina difosfato (ADP). Il quartile superiore di Aggmax indotta dall’ADP
determinava i soggetti ad elevata aggregabilità piastrinica (HPR). Criteri di
esclusione furono la comparsa di un evento cardiovascolare acuto od il ricorso
ad una procedura interventistica percutanea . I prelievi di sangue, per studiare
la funzione piastrinica, furono prelevati da 2 a 4 ore dopo l’assunzione della
terapia antiaggregante.
L‘aggregazione piastrinica fu valutata utilizzando un aggregometro a
trasmissione di luce, dopo uno stimolo con 20 μmol/l di ADP su un campione di
plasma arricchito di piastrine. L’aggregazione fu misurata al picco (Aggmax) ed
a 5 min (Agglate). La percentuale di disaggregabilità piastrinica (D) tra
Aggmax e Agglate fu definita da: D(%)= 100 x (1- Agglate/Aggmax). Furono
utilizzati altri stimoli per valutare l’aggregabilita’ piastrinica quali il collagene (6
μg/ml), l’epinifrina (20 μmol/l) ed il peptide agonista del recettore per la
14
trombina (25 μmol/l). L’attivazione piastrinica fu valutata attraverso la
valutazione dell’espressione sulla superficie delle piastrine delle glicoproteine
attivate GP IIb/IIIa e della P-selectina.
Gli eventi cardiovascolari maggiori (MACE) furono definiti in accordo con
quanto proposto dall’American College of Cardiology e comprendevano: la
morte secondaria ad una causa cardiovascolare, l’infarto del miocardio con
elevazione del tratto ST (STEMI), la sindrome coronarica acuta senza
elevazione del tratto ST (NSTEMI), l’angina instabile (UA) e lo stroke. Il follow
up fu condotto per via telefonica ogni 6 mesi ed i pazienti furono sottoposti ad
una visita medica ogni anno.
Le variabili continue furono analizzate con il test di Kolmogorov-Smirnov. I
confronti fra le variabili furono studiati con il test del chi-quadro. Le curve di
sopravvivenza furono costruite secondo il metodo di Kaplan-Meier. La
sopravvivenza libera da eventi fra i diversi gruppi fu confrontata utilizzando il
test log-rank. Le correlate indipendenti degli end-point cardiovascolari furono
valutate con l’analisi di regressione del rischio proporzionale di Cox. La ROC
analisi fu utilizzata per la valutazione sperimentale del punto di cutoff di
Aggmax dopo stimolo con ADP quale fattore predittivo dei MACE.
Risultati
Furono arruolati 173 pazienti consecutivi dal gennaio 2003 al febbraio 2005. La
Aggmax dopo stimolo con ADP fu 52.0± 14% e fu estremamente variabile nei
singoli pazienti distribuendosi secondo una curva a distribuzione gaussiana. La
reattivita’ piastrinica al 25th, 50th e 75th percentile fu 44.0%, 52.0% e
62.0% rispettivamente. Il quartile maggiore fu definito quale HPR. La Aggmax
fu 34.2±8%, 47.6±3%, 56.8±3% e 68.6±6%, dal quartile inferiore a quello
superiore,rispettivamente (p ‹0.0001). Il maggior numero di eventi MACE fu
rappresentato da UA/NSTEMI, che si manifestarono nel 9.8%, 10.9%, 12.2%,
e 33.3% dei pazienti dal quartile minore al maggiore, rispettivamente
(p=0.007). Non si manifestarono invece differenze significative per gli altri
eventi cardiovascolari maggiori considerati separatamente. Sei pazienti
presentarono piu’ di un evento ischemico. Quattro di questi pazienti
presentavano HPR; 1 paziente con 3 eventi aveva una HPR. La sopravvivenza
libera da eventi Cardiovascolari maggiore fu significativamente piu’minore nei
pazienti con HPR se confrontata con gli altri gruppi (p=0.002). Pazienti con
MACE avevano un valore maggiore di Aggmax (56.8 ± 13.8% vs 50.9±
13.6%, p=0.03) rispetto a quelli che non presentarono eventi nel follow-up. L’
analisi multivariata di regressione Cox dimostro’ che la HPR (HR 3.35, 95% CI
1.68 to 6.66, p=0.001), l’insufficienza renale (HR 2.98, 95% CI 1.44 to 6.17,
p=0.005) e la classe funzionale III e IV NYHA (HR 2.87, 95% CI 1.38 to 5.98,
p=0.005) sono fattori predittivi indipendenti di MACE. La ROC analisi dimostro’
che un valore di cutoff del 62% di Aggmax fu il miglior predittore di MACE nella
popolazione dello studio. I MACE furono significativamente maggiori nei
pazienti con HPR rispetto a coloro che presentavano un valore inferiore al
cutoff del 62% con sensibilita’ del 37% e specificita’ del 84%. Il valore
predittivo positivo e negativo del 62% di Aggmax fu rispettivamente del 41% e
del 86%. L’incidenza di MACE fu maggiore nella popolazione con HPR sia prima
15
(13.3% vs 3.9%,p=0.03) che dopo (24.4% vs 9.4%, p=0.01) la sospensione
del clopidogrel.
I pazienti con HPR dimostrarono un’alterata funzione in tutti i parametri
valutati. I pazienti con HPR presentavano anche un’aumentata Agglate (24.7 ±
11.3%, 36.8± 11.4%, 48.2±
7.0%, 65.1±
8.4% dal primo al quarto
quartile, rispettivamente (p
0.0001) ed una diminuita disaggregazione
piastrinica (30.5± 26.2%, 22.9 ± 23.3%, 15.4± 10.3%, 5.4± 7.0% dal primo
al quarto quartile rispettivamente (p‹0.0001).L’aggregazione piastrinica,
valutata con agonisti non-specifici dei recettori purinergici (collagene,
epinefrina, e peptide agonista dei recettori della trombina) ed i markers di
attivazione piastrinica (espressione di P-selectina ed attivazione dei recettori
GP IIb/IIIa) erano aumentati nei pazienti con HPR. Tutti i parametri di funzione
piastrinica furono significativamente maggiori nei pazienti con reattività
superiore al cutoff ROC-determinato (p ‹ 0.0001 per tutti i dosaggi).
Discussione
Lo studio dimostra l’impatto prognostico nel lungo termine dell’aumentata
reattività piastrinica (HPR), in risposta all’ADP, nei pazienti con diabete di tipo
2 e CAD. In particolare i pazienti con HPR, determinata nella fase di steady
state della doppia antiaggregazione, presentano un rischio cardiovascolare a 2
anni 3 volte superiore se confrontato con i pazienti senza HPR. Inoltre nei
pazienti con HPR sono up-regulated molte vie di attivazione delle piastrine,
indicando pertanto uno stato di iper-reattività globale. La variabilità della
risposta individuale alla doppia antiaggregazione e’ un’entità’ clinica emergente
(1,2). Recentemente alcuni studi hanno valutato le implicazioni prognostiche di
un’adeguata inibizione dell’aggregabilita’ piastrinica in pazienti sottoposti ad
interventi di rivascolarizzazione percutanea e/o nella fase iniziale della doppia
antiaggregazione, momento ove esiste un’elevata proporzione di soggetti che
presentano un’inadeguata inibizione (3,4). Inoltre gli studi sulla funzione
piastrinica condotti in questa fase della terapia anti-aggregante comprendono
anche pazienti con sindrome coronarica acuta che presentano spesso
un’elevata reattività piastrinica, confermata da livelli elevati di fattore di von
Willebrand (5). Lo studio di Angiolillo et al. dimostra per la prima volta
l’impatto sfavorevole nel lungo termine della HPR, misurata durante lo steady
state di una terapia cronica con antiaggreganti, senza i fattori confondenti
legati da un lato alle complicanze delle procedure percutanee e dall’altro
all’aumentata reattività piastrinica frequente durante gli eventi ischemici acuti.
L’analisi funzionale è in grado di identificare un subset di pazienti con marcata
reattivita’ piastrinica caratterizzata da una up-regulation di molte vie di
attivazione piastrinica compresi i recettori purinergici. Questa caratteristica
puo’ spiegare perche’ molti pazienti con T2DM presentano un’elevata reattività
piastrinica anche dopo elevate dosi di mantenimento di clopidogrel (6). Questa
osservazione fornisce un elemento di riflessione sugli effetti della sospensione
del clopidogrel nei pazienti con HPR, potendo cosi’ aumentare il loro rischio
cardiovascolare. Pertanto questi soggetti ad alto rischio potrebbero avere un
beneficio o da una doppia antiaggregazione piu’ prolungata o utilizzando
farmaci piu’ potenti, o in grado di inibire differenti target quali ad esempio i
recettori attivati dalle proteasi piastriniche. I pazienti con T2DM sono ad alto
16
rischio di sviluppare eventi cardiovascolari (7) e sono caratterizzati, in
generale, da un’aumentata reattività piastrinica se confrontati con i soggetti
non diabetici. I pazienti con T2DM con HPR rappresentano un sottogruppo di
pazienti ancora a più alto rischio, suggerendo l’utilità’ di uno stretto
monitoraggio clinico degli stessi. Potrebbe pertanto essere utile studiare e
valutare in questi casi una terapia antiaggregante personalizzata, adattata alle
caratteristiche del singolo paziente, in analogia con quanto gia’ si effettua con
la terapia ipolipemizzante o ipoglicemizzante. Una delle maggiori difficolta’ in
questo senso e’ la mancanza di un metodo standardizzato per valutare la
funzione piastrinica cosi’ come l’identificazione di un valore di cut-off ottimale
(1,2). L’ aggregometro a trasmissione di luce e’ considerato il gold standard
per valutare la funzione piastrinica (1) ed e’ la metodica utilizzata per definire il
grado di reattivita’ piastrinica in questo studio. I pazienti nei terzi quartili piu’
bassi presentano simili outcomes, mentre MACE sono marcatamente aumentati
nel quartile maggiore (e.g. HPR).
Gli autori dimostrano che circa il 90% dei pazienti con eventi presentano una
Aggmax › 40%, mentre solo circa il 10% dei pazienti senza eventi ha una
Aggmax › 62%. La ROC analisi dimostra che una Aggmax del 62% e’ il
migliore predittore di eventi ischemici nella popolazione con T2DM. Questo
valore presenta un buon valore predittivo negativo, supportando il concetto
che i pazienti con T2DM con reattivita’ piastrinica inferiore a questa soglia sono
a basso rischio, con un’incidenza di MACE del 13.3% in un periodo di 2 anni.
Commento
Il lavoro di Angiolillo DJ et al. e’ di particolare interesse in quanto individua un
sottogruppo di pazienti con T2DM con HPR che presentano una prognosi
particolarmente sfavorevole nel lungo periodo per l’elevato rischio di sviluppare
MACE nonostante una corretta doppia antiaggregazione. Questo riscontro
riveste chiaramente una notevole importanza clinica in quanto individua
nell’ambito della popolazione diabetica i soggetti che devono essere valutati
con particolare attenzione e rigore. Due considerazioni paiono fondamentali. La
prima e’ che i pazienti con HPR devono essere sicuramente sottoposti ad
un’attenta correzione dei fattori di rischio tradizionali quali il controllo della
glicemia, dell’ipertensione e dei lipidi. Il trattamento farmacologico dovra’
essere particolarmente aggressivo al fine di raggiungere target terapeutici
ambiziosi e difficili quali ad esempio valori di C-LDL inferiori a 70 mg/dl,
facendo ricorso spesso all’interazione di piu’ farmaci. La seconda riflessione
riguarda il trattamento antiaggregante. Dallo studio infatti emerge che
nonostante una doppia antiaggregazione con clopidogrel ed aspirina alcuni
pazienti diabetici presentano ancora una HPR. E’ noto che in generale i pazienti
diabetici rispetto ai non diabetici presentano un’aumentata reattivita’
piastrinica. Infatti le piastrine dei diabetici di tipo I e di tipo II (8-11) sono
ipersensibili agli agenti aggreganti quali l’ADP, il collagene, l’acido arachidonico
e la trombina. Non e‘ chiaramente dimostrata una correlazione fra il compenso
metabolico e l’aumentata aggregabilita’ piastrinica.
Esistono dati, inoltre, di una maggiore liberazione del contenuto di alfa-granuli
dalle piastrine quali il fattore 4 e la beta-tromboglobulina (11) cosi’ come un
17
aumento dell’attivita’ della via dell’acido arachidonico con un’aumentata
formazione di trombossano A2 in risposta alla trombina (11).
Quando le piastrine sono stimolate da agenti agonisti viene espresso sulla
superficie piastrinica il complesso della glicoproteina IIb/IIIa, che rappresenta
il recettore per il fibrinogeno. E’ stato dimostrato che le piastrine di pazienti
diabetici non stimolate presentano comunque un numero aumentato di
molecole di glicoproteina IIb/IIIa, attribuibile al maggior volume di queste
piastrine (11). L’iperesensibilita’ delle piastrine alla trombina e’ confermata
anche da una aumentata idrolisi del fosfoinositide, da una maggiore
mobilizzazione del Ca intracellulare e da una maggiore fosforilazione chinasidipendente delle catene leggere della miosina (12). E’ stato proposto che la
glicosilazione delle proteine di membrana abbia un ruolo nell’ipersensibilita’
delle piastrine che si osserva nei diabetici, sebbene altri studi non abbiano
confermao questo dato (11). Questi elementi spingono pertanto a considerare
come nei diabetici si debba cercare di adeguare la terapia anti-aggregante
alle caratteristiche cliniche del singolo soggetto. D’altro canto questa e’ una
prassi comune per quanto riguarda la terapia antiipertensiva o ipolipemizzante.
La HPR puo’ almeno in parte spiegare anche la cosiddetta resistenza agli
antipiastrinici che e’ argomento spesso dibattuto in letteratura. Ritengo che
questo termine sia spesso abusato e vada ricondotto a due situazioni
fondamentali:
•
•
La resistenza clinica intesa come recidiva di eventi cardiocerebrovascolari nonostante la somministrazione regolare di una dose
terapeutica considerata efficace
La resistenza biochimica o persistente attivazione piastrinica nonostante
la somministrazione di una dose terapeutica dei farmaci
La HPR di alcuni pazienti con T2DM puo’ spiegare entrambe queste condizioni
e pertanto ritengo che sia opportuno parlare non tanto di resistenza agli antipiastrinici ma di variabilita’ nella risposta agli antitrombotici. Anche la
necessita’, in alcuni casi di utilizzare la doppia antiaggregazione con aspirina e
clopidogrel, parte proprio da questa considerazione. Infatti in alcune situazioni
cliniche, quali ad esempio nelle procedure percutanee con posizionamento di
stent coronarici, e’ stata dimostrata una marcata attivazione piastrinica
suggerendo il razionale di un trattamento antiaggregante piu’ aggressivo con
l’associazione di farmaci con diverso meccanismo d’azione. D’altro canto e’
noto che l’attivazione piastrinica avviene attraverso molteplici vie quali l’ADP, i
recettori GP IIb/IIIa, il collagene, la trombina ed il trombossano. Un solo
antiaggregante, ma anche l’associazione di due antiaggreganti va ad
interessare solo una parte delle vie di attivazione piastrinica. E’ comunque
dimostrato che la terapia con aspirina piu’ clopidogrel e’ piu’ efficace rispetto
alla sola aspirina nel ridurre l’infarto del miocardio non fatale nei pazienti con
angina instabile (UA) e con NSTEMI (13), nei pazienti sottoposti a procedura
interventistica coronarica percutanea (14), nei pazienti con elevato rischio di
malattia vascolare aterosclerotica (15) e nell’infarto del miocardio con ST
sopraslivellato (STEMI) (16,17). Questo vantaggio clinico si associa pero’ ad un
aumentato rischio di complicanze emorragiche.
18
Altro problema che pone lo studio e’ la durata del trattamento antiaggregante
con clopidogrel associato all’aspirina nei pazienti con T2DM, suggerendo la
possibilita’ che in soggetti ad alto rischio quali sono i diabetici con HPR debba
essere proseguita per un lungo
periodo. Attualmente gli unici dati che
abbiamo a disposizione sono quelli dello studio CHARISMA (15) che dimostrano
che, nei pazienti con malattia cardiovascolare cronica e stabile, la valutazione
del rapporto rischio/beneficio sconsiglia un trattamento prolungato. I dati dello
studio di Angiolillo DJ et al sembrano pero’ indicare che debba essere fatto uno
sforzo ulteriore in modo da identificare, nelle singole categorie di pazienti,
quelli ad elevato rischio cardiovascolare valutato non solo attraverso i comuni
fattori di rischio cardiovascolare ma anche attraverso lo studio della reattivita’
piastrinica. Se e’ presente HPR si determina un’aumentata trombogenicita’ del
sangue, introducendo accanto al concetto di “placca vulnerabile” anche quello
di “sangue vulnerabile” un fattore meno consolidato e meno considerato dalla
letteratura medica ma che espone i pazienti ad un elevato rischio di eventi
cardiovascolari acuti.
Bibliografia
1. Angiolillo DJ, Fernandez-Ortiz A, Bernardo E, et al. Variabilità in individual
responsiveness to clopidogrel: clinical implication, management and future
perspectives. J Am Coll Cardiol 2007;14:1505-16
2. Alfonso F, Angiolillo DJ. Platelet function assessment to predict outcomes after
coronary interventions: hype or hope? J Am Coll Cardiol 2006;48:1751-4
3. Gurbel PA, Blinden KP, Hiatt BL, O’Connor CM. Clopidogrel for coronary stenting:
response variability, drug resistance, and the effect of pretreatment platelet reactivity.
Circulation 2003;107:2908-13
4. Angiolillo DJ, Fernandez-Ortiz A, Bernardo E, et al. Identification of low responders to a
300-mg clopidogrel loading dose in patients undergoing coronary stentino. Thromb Res
2005;115:101-08
5. Goto S, Sakai H, Goto M, et al. Enhanced shear-induced platelet aggregation in acute
myocardial infarction. Circulation 1999;99:608-13
6. Angiolillo DJ, Shoemaker SB, Desai B,et al. A randomized comparison of a high
clopidogrel maintenance dose in patients with diabetes mellitus and coronary artery
disease: results of the OPTIMUS study. Circulation 2007;115:708-16
7. Colwell JA, Nesto RW. The platelet in diabetes: focus on preservation of ischemic
events. Diabetes Care 2003;26:2181-8
8. Brownlee , Cerami A.the biochemistry of the complications of diabetes mellitus. Ann
Rev Biochem 1981;50:385-432
9. Ostermann H, van di Loo J. Factors of the hemostatic system in diabetic patients. A
survey of controlled studies. Haemostasis 1986; 16:386-416
10. Hendra T, Bettridge DJ. Platelet function, platelet prostanoids and vascular prostacyclin
in diabetes mellitus. Prostaglandins Leukot Essent Fatfy Acids 1989;35:197-212
11. Colwell JA, Winocour PD, Lopes-Virella MF. Platelet function and platelet-plasma
interaction in atherosclerosis and diabetes mellitus, in Rifkin H, Porte D (eds):
Ellemberg and Rifkin’ s Diabetes Mellitus Theory and Practice ed 4 Amsterdam, Elsevier
Science Publishers BV, 1990, 249-256
12. Ishii H, Umeda F, Hashimoto T, et al. Changes in phosphoinositide turnover, Ca
mobilization of protein phosphorylation in platelet from NIDDM patients. Diabetes
1990;39:1561-1568
13. Clopidogrel in Unstable Angina to Prevent Recurrent Events Trial Investigators. Effect
of clopidogrel in addition to aspirin in patients with acute coronary syndrome without
ST-segment elevation. N Engl J Med 2001;345:494-502
19
14. CREDO Investigators. Clopidogrel for the reduction of Events During Observation. Early
and sustained dual oral antiplatelet therapy following percutaneous coronary
intervention: a randomized controlled trial. JAMA 2002;288:2411-20
15. CHARISMA Investigators. Clopidogrel and aspirin versus aspirin alone for the
prevention of atherothrombotic events. N Engl J Med 2006; 3564:1706-17
16. CLARITY-TIMI 28 Investigators. Addition of clopidogrel to aspirin and fibrinolytic
therapy for myocardial infarction with ST-segment elevation. N Engl J Med
2005;352:1179-89
17. COMMIT (CLOpidogrel and Metoprolol in Myocardial Infarction Trial) Collaborative
Group. Addition of clopidogrel to aspirin in 45,852 patients with acute myocardial
infarction: randomized placebo-controlled trial. Lancet 2005;366:1607-21
Mauro Campanini
Medicina Interna e d’Urgenza, Dipartimento Emergenza ed Accettazione
ASOU “ Maggiore della Carita’ – Novara
Presidente Regione Piemonte FADOI ( Federazione Associazione Dirigenti
Ospedalieri Internisti). Responsabile Nazionale Area Emostasi e Trombosi
CENTRO STUDI FADOI
[email protected]
LL’’EErrrroorree M
Meeddiiccoo Nella polis
L’ottuagenaria aspettativa di vita, enfatizzata dai “media”, raccontata come
una bella favola dalla pubblicità televisiva che ci somministra immagini
ripetitive di longevi e sani centenari, non è più qualcosa di cui si deve
ringraziare la natura, ma viene - assunta - da tutti come la normalità della
propria esistenza. Malattie croniche e invalidanti, morti anticipate, percorsi di
vita segnati dalla necessità delle cure, vengono vissuti come un diritto negato
di una felicità promessa, e si procede subito alla ricerca del presunto errore
medico. Oggi il medico e la medicina non curano più il paziente ma la malattia.
E’ invece lo Stato che si prende cura del paziente. Il potere centrale fissa
i livelli minimi ed essenziali di assistenza (L.A.R.), definisce gli obiettivi di
intervento, determina dall’alto le scelte di tutti, di fatto impera “senza alcuna
assunzione reale di responsabilità” che invece viene riversata sempre sui
medici.
Crolla il rapporto di fiducia con i pazienti: un camice bianco su tre è sotto
inchiesta. Eppure i processi li vedono quasi sempre assolti. E il decreto Bersani
incentiva i ricorsi. Lo «stato d’emergenza socio sanitaria della Regione
Calabria», dichiarato nei giorni scorsi dal Consiglio dei ministri dopo la tragica
morte di una sedicenne nell’ospedale di Vibo Valentia, è niente al confronto con
quest’altra emergenza che ha colpito l’Italia dalle Alpi a Lampedusa.
Un terzo dei medici italiani e l’80 per cento dei chirurghi hanno ricevuto almeno
una richiesta di risarcimento o un avviso di garanzia per presunta malpractice
20
(o malasanità). La categoria ormai trascorre un terzo della propria vita
lavorativa sotto processo. Due sanitari su tre vengono poi riconosciuti
innocenti, o con un’assoluzione o con il rigetto dell’istanza per infondatezza. Ma
intanto chi è stato accusato non ha nessun modo di rivalersi e subisce un
vulnus morale e d’immagine incalcolabile. Se si considera che 12 milioni di
persone, cioè poco meno di un quarto della popolazione italiana, vengono
ricoverate ogni anno negli ospedali dove lavorano 650.000 operatori, andrebbe
proclamato lo stato di calamità nazionale. Chi sta male non nutre alcuna
fiducia, o ne nutre assai poca, in chi cura. Chi cura s’è stufato, non ci sta a
essere additato al pubblico disprezzo come causa d’ogni guaio, ha paura di
finire alla sbarra sui giornali e nelle aule di giustizia.
Il risultato è grottesco: 4 errori su 10 sono causati dal mancato intervento del
camice bianco titubante, come emerge dall’esame di 1.286 sentenze della
Cassazione (emesse fra il 1995 e il 2006) condotto dall’Università di Bari. Dallo
studio si rileva come la ritardata prestazione (5%) e l’errata prescrizione,
trascrizione e somministrazione di un farmaco (1,5%) si attestino su
percentuali decisamente più basse rispetto all’inadeguata (43,2%) od omessa
prestazione (39,7%). Secondo Alessandro Dell’Erba, professore associato di
medicina legale nell’ateneo pugliese, questa situazione è da ascriversi
all’atteggiamento «difensivo» del medico, «che, per il timore di sbagliare, evita
d’intervenire, commettendo in tal modo un errore». Il più grave. In un
decennio il numero degli incidenti denunciati nella sanità è aumentato del
278%, passando dai 3.154 del 1994 agli 11.932 del 2004.
Una spiegazione la si rintraccia fra le novità del decreto Bersani, che ha reso
possibili a costi ridottissimi le valutazioni mediche e legali nei casi di sospetta
malasanità, accordando il cosiddetto ‘patto in quota lite’. In sostanza il cliente
che si ritenga vittima di malpractice non deve anticipare alcuna parcella ai
professionisti da cui si fa assistere. Solo alla fine della causa o a seguito di un
accordo stragiudiziale devolverà all’avvocato e ai periti una percentuale del
risarcimento incassato. Questa appare essere una malevola sollecitazione
legalitaria alla lite sconsiderata e alle rivendicazioni ingiuste. Non si contano le
associazioni a favore delle vittime di errori medici che valutano gratuitamente con tanto di numero verde - l’opportunità di azioni legali. Una che va per la
maggiore presenta la sanità come «il killer silenzioso» (sic). Poi vai a leggerti
le storie di malasanità raccolte nel suo sito e scopri che sono appena 9 in due
anni.
Ma è giustificato l’allarmismo sulle negligenze ospedaliere? Molto, a leggere i
quotidiani e a guardare i telegiornali. Poco, a scorrere il Protocollo sperimentale
di monitoraggio degli «eventi sentinella» del ministero della Salute (chiamasi
«evento sentinella» un episodio «di particolare gravità, potenzialmente
evitabile, che può comportare morte o grave danno al paziente e che
determina una perdita di fiducia dei cittadini nei confronti del servizio
sanitario»). Nel periodo settembre 2005-febbraio 2007 le segnalazioni di
«eventi sentinella» pervenute da un centinaio di strutture ospedaliere sono
state 123. 1Tenuto conto dei circa 18 milioni di ricoveri registrati in quei 18
mesi, stiamo parlando di una percentuale di incidenti pari allo 0,00068; e il
68% degli «eventi sentinella » hanno portato al decesso.
21
Nella scienza.
Nelle scienze sperimentali non è presente “un criterio di verità” o di certezza in
base al quale si possa stabilire una volta per tutte l’accordo fra una teoria ed i
fatti. Privata del requisito della certezza, la verità della scienza sarà sempre
aperta alla possibilità di essere corretta. Anzi, proprio per questo la conoscenza
non arriverà mai ad esaurirsi ed è teoricamente, senza limiti precostituiti. Nella
scienza, si può parlare di “dottrina della fallibilità”, senza alcun intento
pessimistico: infatti l’idea della fallibilità umana e dell’errore non possono
essere disgiunte da quella della verità, una verità da cercare nella
consapevolezza di sapere di non sapere, ma al tempo stesso di essere capaci di
migliorare il livello attuale di conoscenza. Nell’ambito della medicina, quale
scienza sperimentale, l’atteggiamento critico è quindi il primum movens per
accrescere la conoscenza. Insigni clinici del passato hanno dedicato all’errore
medico grande attenzione, 2 con l’intento preciso di utilizzare gli errori come
fonte di conoscenza. Il bolognese Augusto Murri alla fine dell’Ottocento
scriveva: “nella clinica bisogna avere un preconcetto, uno solo ma inalienabile,
il preconcetto che tutto ciò che si afferma e che par vero, può essere falso:
bisogna farsi una regola costante di criticar tutto e tutti prima di credere”.3 Da
buon razionalista, teneva ben presente che “la pretesa di non errare mai è
un’idea da matti”, ma nella consapevolezza della fallibilità della ragione, la
considerava l’unica via per giungere al sapere scientifico in medicina. Con il suo
aiuto infatti “ogni giorno si corregge un errore, ogni giorno si migliora una
verità, ogni giorno si impara a saper meglio quello che possiamo fare di bene e
quello che siamo condannati ancora a lasciar avvenire di male. Ogni giorno
erriamo meno della vigilia e impariamo a sperare di far meglio la dimane.
Errare, sì. È una parola che fa paura al pubblico. Errare a nostre spese? Errare
a costo della nostra vita? La meraviglia pare giustissima, l’accusa pure grave!
Eppure, o avventurarsi al pericolo d’un errore o rinunciare ai benefizi del
sapere. Non c’è altra strada. L’uomo che non erra, non c’è”.4
Considerando questo contesto concettuale, i concetti di verità e certezza in
medicina vengono sostituiti dal concetto di probabilità, quale misura del grado
di affidabilità delle conclusioni a cui si è pervenuti. Una distinzione di
particolare interesse epistemologico è quella compiuta da Ettore de Benedetti
tra gli errori del medico e gli errori della medicina, “i primi sono ascrivibili
all’incapacità del medico di giungere ad una diagnosi fattibile alla luce delle
conoscenze, anche terapeutiche, che all’epoca si possedevano, mentre i
secondi sono determinati esclusivamente dalle lacune o dalle insufficienze delle
conoscenze mediche del momento”.5
Dal punto di vista della responsabilità, ciò che interessa non sono gli errori
contenuti nelle teorie mediche vigenti, ma gli sbagli compiuti dai medici. Nella
Guida all'Esercizio Professionale troviamo questa caratterizzazione dell'errore
clinico: "L'errore clinico si verifica quando, essendo presenti, manifesti e non
equivoci i sintomi fondamentali, un caso non sia correttamente inquadrato a
causa di negligenza, imprudenza o imperizia dal medico nell'ambito di una
delle malattie attualmente note alla scienza medica". Esistono due tipi di errore
medico: l'errore cognitivo e l'errore operativo. L’errore cognitivo ha un confine
tracciato dallo stato dell’arte della conoscenza medica, la cui imperfezione
22
strutturale è causa dell’errore della medicina, ed un limite inferiore legato
all’ignoranza del medico in merito a quanto noto alla medicina del suo tempo.
Gli errori possono essere classificati per responsabilità prevalente come:
1. Forme da ricondurre nella catena dell’errore al rapporto uomo/sistema.
2. Forme da ricondurre nella catena dell’errore al rapporto paziente/medico.
Nel primo caso è l’organizzazione che gioca il ruolo prevalente nella genesi
dell’errore, perché se pur commesso da una sola persona va riconosciuta
l’importanza della concomitanza di altri fattori di tipo organizzativo. Si
inquadrano in queste forme alcuni errori in ambienti connotati da:
• disattenzione per la qualità del servizio
• scarsa attenzione alla valutazione della sicurezza
• scadente organizzazione
• mancanza di chiare regole con norme conflittuali
• interazioni tra gruppi non coordinate.
Nel secondo caso si riconducono gli errori in ambienti caratterizzati da:
¾ forzature da stress
¾ elevata dinamica lavorativa
¾ condizioni di mutamenti frequenti di obiettivi
¾ coesistenza di differenti priorità
¾ presenza di competitività di più leader
¾ troppe e diverse fonti informative anche indirette o riferite
¾ uso di tecnologie complesse e avanzate.6
L'errore operativo è quasi sempre legato alla terapia. Quando deve prescrivere
una terapia al proprio paziente un medico si trova spesso di fronte a diverse
strade possibili. In questa situazione appare ovvio che scelga, fra le diverse
decisioni, quella che avrà il miglior esito o almeno l'esito meno negativo per il
proprio malato. Il medico si trova quindi sempre di fronte ad un certo numero
di esiti possibili, ognuno dei quali è caratterizzato da una certa probabilità di
verificarsi. Il curante non può quindi limitarsi a considerare la bontà delle
conseguenze dei suoi atti, ma deve contemporaneamente valutare la
probabilità che questi hanno di verificarsi. Ancora una volta l'operare del
medico si trova davanti al problema della probabilità. In ogni sua decisione si tratti della scelta di un'indagine rischiosa, o di rassicurare un malato e di
dimetterlo dall'Ospedale o di iniziare una terapia- il medico deve sempre
calcolare una probabilità. La probabilità domina da cima a fondo tutta la
Medicina. Ma parlando di probabilità, si parla anche di probabilità dell'errore.
Quando si afferma che esiste una certa probabilità di cogliere nel segno - cioè
di fare un'affermazione "vera" o di prendere una decisione "corretta"- si
afferma contemporaneamente che esiste un'altra probabilità, che è l'inverso
della prima, di non cogliere nel segno, cioè di fare un'affermazione non vera o
di prendere una decisione non corretta.7 L’errore cognitivo è un evento in linea
di principio ineliminabile dalla scienza medica e quindi statisticamente
misurabile. Considerando l’ipotesi “il malato x è affetto da malattia y”, con le
diverse fasi del procedimento diagnostico il medico può arrivare a confermare
l’ipotesi “x ha la malattia y”, oppure a negare l’ipotesi “x non ha la malattia y”.
Dal momento che il ragionamento si basa su probabilità e non su certezze, si
può verificare che x erroneamente venga ritenuto affetto (falso positivo),
oppure al contrario erroneamente ritenuto non affetto (falso negativo).
23
L’errore cognitivo di tipo alfa è l’errore causato dal rifiuto dell’ipotesi che in
realtà è vera; è cioè un giudizio sbagliato il cui errore consiste nel negare
l’ipotesi. L’errore cognitivo di tipo beta è l’errore causato dal mancato rifiuto
dell’ipotesi che in realtà è falsa; è un giudizio sbagliato il cui errore consiste
nel rimanere ancorati all’ipotesi.
In bioetica
Se in medicina, passiamo dall’aspetto conoscitivo, più squisitamente
scientifico, a quello della prassi, la distinzione tra verità ed errore non è più
semplicemente un giudizio di carattere gnoseologico, ma implica un giudizio di
valore: questo ci introduce direttamente nell’ambito della morale. Gli errori
cognitivi di tipo alfa e di tipo beta hanno un corrispettivo negli errori operativi,
che sono errori di comportamento del medico con una forte valenza morale. Il
medico che erroneamente nega l’ipotesi di una malattia che invece è presente
sottostimando un certo indizio clinico incorre nell’errore operativo di omissione
curativa, al contrario il medico che erroneamente ritiene che ci sia una
malattia sovrastimando i segni ed sintomi del paziente incorre nell’errore
operativo di esagerazione curativa. Dal punto di vista oggettivo sia l’assenza
di cura dovuta che la cura esagerata sono un male morale. Dal punto di vista
soggettivo dell’agente morale, sia l’errore di omissione che di accanimento
terapeutico hanno una radice cognitiva che si inscrive tuttavia nella totalità
della persona. L’atto del conoscere, applicato all’arte medica, assume quindi
una valenza morale, anche in virtù della natura stessa della medicina.8
Cogliere l’uomo nella pienezza delle sue dimensioni, ci permette da una parte
di rispettare la verità della sua natura, dall’altra di coglierne meglio la sua
umanità, cioè quanto è a lui proprio, in ciò che compie. Agere sequitur ad esse
in actu: l’uomo agisce in virtù di ciò che è. 9 Questo significa che, nell’analisi
di un atto umano, non si può privilegiare una dimensione piuttosto che
un’altra, per comprenderne fino in fondo il significato: bisogna sempre fare
riferimento alla realtà umana nella sua interezza, alla completezza che lo
caratterizza, alla molteplicità delle dimensioni che lo costituiscono. Il medico
conosce, decide, ed opera non solo in virtù di ciò che sa o sa fare ma
soprattutto in virtù di ciò che sa essere. Il medico “precauzionista” tenderà ad
essere sempre eccessivamente conservativo per evitare di fare troppo, ad
astenersi di fronte al minimo dubbio. È l’atteggiamento di chi interpreta in
modo estremo l’ippocratico primum non nocere, messo in pratica mediante un
processo ‘difensivo’ per cui rifiuta di percepire i falsi negativi. Il medico
“scientista” all’opposto tenderà a fare troppo, ad operare sempre anche nel
forte dubbio. È l’atteggiamento di chi nel profondo nutre una fiducia cieca
nelle possibilità della medicina di cambiare il corso degli eventi, messo in
pratica mediante un processo ‘aggressivo’ per cui rifiuta di percepire i falsi
positivi. Sia l’errore del precauzionista che quello dello scientista non denotano
un fatto meramente cognitivo, sono errori che affondano le radici nel modo di
essere del medico, nelle sue qualità umane.10 È immediatamente evidente
infatti che il medico precauzionista è un medico “non coraggioso”, pusillanime;
al contrario il medico scientista è incosciente e temerario. Il medico che evita
entrambi gli eccessi è colui che sa veramente essere medico virtuoso e
24
prudente. La virtù della prudenza consente al medico in ordine al bene del
paziente come fine, di individuare i mezzi proporzionati nell’hic et nunc. La
virtù della prudenza è la perspicacia clinica finalizzata al bene del paziente,
che non si esprime come qualità solo occasionale e saltuaria, quanto piuttosto
come abito, stile di comportamento per il medico. La prudenza richiede una
ricca esperienza clinica, ma ancora di più richiede che il medico sia dotato di
una solida formazione morale.
Bibliografia
1. Lorenzetto S. Medici nel mirino sale la febbre da denuncia. Il Giornale
02/12/2007
2. POLI E. Metodologia medica, Principi di logica e pratica clinica (p. 139), ripreso
da: BALDINI M. La logica della diagnosi clinica in FERRO FM (a cura di). Passioni
della mente e della storia. Milano: Vita e Pensiero; 1989: 545-554, p. 546.
3. MURRI A. Lezioni di Clinica Medica, Anno Accademico MCMV-VI. Milano: Società
Editrice Libraria; 1920: 21.
4. MURRI A. Il pensiero scientifico (p. 41), ripreso da: BALDINI M. La logica della
diagnosi…, p. 549. P.45-46.
5. BALDINI M. Gli errori della medicina e gli sbagli dei medici. L’Arco di Giano
1994; 6: 92-100, p. 94.
6. Costa Angeli M. L’errore nella pratica medica ospedaliera e ambulatoriale.
S.N.A.M.I. Ospedalieri.
7. Federspil G. Limiti della medicina, errore, probabilismo e linee guida.
www.studiomedico.it .
8. K. Jaspers ritiene che la medicina abbia per sua natura una dimensione, o una
valenza morale. Cfr. JASPERS K. Essenza e critica della psicoterapia in ID.
Psicopatologia generale. Roma: Il Pensiero Scientifico Editore; 1952.
9. TOMMASO D’AQUINO. Summa Contra Gentiles. lib. 3, cap. 69, n. 20.
10.Vincenza Mele V, Mangione MA. Per una lettura antropologica dell’errore
medico. Medicina e Morale 2007;6: 1247-1257
Prof. Paolo Rossi, primario cardiologo, Novara.
e-mai: [email protected]
25