
EMERGENCY MEDICINE PRACTICE
AN EVIDENCE-BASED APPROACH TO EMERGENCY MEDICINE
Ipotensione sintomatica:
la stabilizzazione nel DEA
e il ruolo emergente
dell’ecografia
Edizione italiana
con patrocinio della S.I.M.E.U.
(Società Italiana Medicina d’Emergenza-Urgenza)
Delibera del Consiglio Direttivo 20/06/2001
Autori
Avete appena eseguito una facile intubazione endotracheale su una donna anziana portata dal servizio d’emergenza sanitaria. Durante il trasporto, la paziente
era vigile ma è arrivata diaforetica e letargica con una pressione arteriosa di
82/45 mmHg, un polso irregolare di 120, una temperatura rettale di 38,2 °C,
tachipnoica con 32 respiri al minuto. Inaspettatamente, la sua saturazione di
ossigeno, che inizialmente era dell’82%, diminuisce al 76% dopo l’intubazione.
La radiografia del torace al letto dimostra che il tubo è posizionato in modo
appropriato, non vi sono infiltrati, non vi è pneumotorace e l’ombra cardiaca è
normale. La paziente è anurica. Gli esami di laboratorio mostrano una creatinina di 2,1, un conteggio dei globuli bianchi di 18.000, un ematocrito del 22% e
livelli elevati del lattato e delle transaminasi. I toni cardiaci e i rumori respiratori sono normali, l’addome è soffice ed entrambe le gambe sono edematose. La
paziente sta male e vi rendete conto che la chiave della sua sopravvivenza è trovare la causa del suo stato di ipotensione.
Prima che si trovi una risposta, arrivano due nuovi pazienti, entrambi con
insufficienza renale all’ultimo stadio, diabete mellito, ipotensione e malattia
coronarica. Iniziate a domandarvi perché mai avete accettato un lavoro che prevede un unico medico di guardia…
Il paziente numero 2 sembra stare peggio, ha un colorito cinereo e diaforetico e una pressione arteriosa di 60/40 mmHg. È apiretico e ha un polso di 100
al braccio senza la fistola AV. Ha un’anamnesi di scarsa compliance alla propria terapia. Descrive l’esordio improvviso di un dolore toracico non irradiato
che persiste da due ore. Tre compresse di nitroglicerina sublinguale somministrate dal servizio d’emergenza sanitaria non hanno migliorato il dolore ed è
possibile che abbiano contribuito all’ipotensione. All’esame obiettivo polmonare
sentite dei rantoli. Ordinate dei liquidi per l’ipotensione ma vi rendete conto che
potrebbe essere un errore.
Editor-in-Chief
Andy Jagoda, MD, FACEP,
Professor and Vice-Chair
of Academic Affairs, Department
of Emergency Medicine; Mount Sinai
School of Medicine; Medical Director,
Mount Sinai Hospital, New York, NY.
Associate Editor
John M. Howell, MD, FACEP,
Clinical Professor of Emergency
Medicine, George Washington
University, Washington, DC;
Director of Academic Affairs, Best
Practices, Inc, Inova Fairfax
Hospital, Falls Church, VA.
Editorial Board
William J. Brady, MD, Associate
Professor and Vice Chair,
Department of Emergency
Medicine, University of Virginia,
Charlottesville, VA.
Peter DeBlieux, MD, Professor of
Clinical Medicine; LSU Health
Science Center, New Orleans, LA.
Wyatt W. Decker, MD, Chair and
Associate Professor of Emergency Medicine, Mayo Clinic
College of Medicine, Rochester,
MN.
Francis M. Fesmire, MD, FACEP,
Director, Heart-Stroke Center,
Erlanger Medical Center;
Assistant Professor, UT College
of Medicine, Chattanooga, TN.
Michael J. Gerardi, MD, FAAP,
FACEP, Director, Pediatric
Emergency Medicine Children’s
Medical Center, Atlantic Health
System; Department of
Emergency Medicine, Morristown
Memorial Hospital, NJ.
Gregory L. Henry, MD, FACEP,
CEO, Medical Practice Risk
Assessment, Inc; Clinical Professor of Emergency Medicine, University of Michigan, Ann Arbor.
Keith A. Marill, MD, Instructor,
Department of Emergency
Medicine, Massachusetts General
Hospital, Harvard Medical School,
Boston, MA.
Charles V. Pollack, Jr, MA, MD,
FACEP, Professor and Chair,
Department of Emergency
Medicine, Pennsylvania Hospital,
University of Pennsylvania
Health System, Philadelphia, PA.
Michael A. Gibbs, MD, FACEP,
Chief, Department of Emergency
Medicine, Maine Medical Center,
Portland, ME.
Michael S. Radeos, MD, MPH,
Assistant Professor of Emergency
Medicine, Lincoln Health Center,
Bronx, NY.
Steven A. Godwin, MD, FACEP,
Assistant Professor and
Emergency Medicine Residency
Director, University of Florida
HSC/Jacksonville, FL.
Robert L. Rogers, MD, FAAEM,
Assistant Professor and
Residency Director, Combined
EM/IM Program, University of
Maryland, Baltimore, MD.
Anthony J. Weekes, MD, RDCS, RDMS, FAAEM
Emergency Ultrasound Program Director, Montefiore
Medical Center; Assistant Professor of Emergency Medicine, Albert Einstein College of Medicine, Bronx, NY
Ryan J. Zapata, MD, FACEP
Attending Physician, Montefiore Medical Center; Assistant Professor of Emergency Medicine, Albert Einstein
College of Medicine, Bronx, NY
Antonio Napolitano, MD, FACEP
Attending Physician, Montefiore Medical Center; Assistant Professor of Emergency Medicine, Albert Einstein
College of Medicine, Bronx, NY
Revisori
Corey M. Stovis, MD, FACP, FACEP, FAAEM
Professor and Chair, Department of Emergency Medicine, Vanderbilt University Medical Center, Nashville, TN
Scott D. Weingart, MD
Director, Division of Emergency Critical Care, Department of Emergency Medicine, Mount Sinai School of
Medicine, New York, NY
Obiettivi ECM
Dopo avere completato questo articolo dovrete essere
in grado di:
1. identificare le cause comuni dell’ipotensione pericolose per la vita;
2. conoscere l’approccio clinico per l’identificazione
rapida delle cause pericolose dell’ipotensione;
3. spiegare il ruolo dell’ecografia mirata al letto del
paziente nella diagnosi non invasiva e nel trattamento rapidi dei pazienti ipotesi;
4. rendersi conto dell’importanza dell’intervento precoce nel trattamento dell’ipotensione, incluso il ruolo
dei liquidi per via endovenosa, degli inotropi e dei
vasopressori;
5. decidere i vantaggi e gli svantaggi pratici e basati
sulle evidenze delle varie analisi point of care, delle
modalità per immagini e dei trattamenti nell’ipotensione.
Alfred Sacchetti, MD, FACEP,
Assistant Clinical Professor,
Department of Emergency
Medicine, Thomas Jefferson
University, Philadelphia, PA.
Corey M. Slovis, MD, FACP,
FACEP, Professor and Chair,
Department of Emergency
Medicine, Vanderbilt University
Medical Center, Nashville, TN.
Jenny Walker, MD, MPH, MSW,
Assistant Professor; Division
Chief, Family Medicine,
Department of Community and
Preventive Medicine, Mount Sinai
Medical Center, New York, NY.
Ron M. Walls, MD, Professor and
Chair, Department of Emergency
Medicine, Brigham & Women’s
Hospital, Boston, MA.
Research Editors
Nicholas Genes, MD, PhD, Mount
Sinai Emergency Medicine
Residency.
Beth Wicklund, MD, Regions
Hospital Emergency Medicine,
Residency, EMRA Representative.
International Editors
Valerio Gai, MD, Senior Editor,
Professor and Chair, Department
of Emergency Medicine,
University of Turin, Italy.
Peter Cameron, MD, Chair,
Emergency Medicine, Monash
University; Alfred Hospital,
Melbourne, Australia.
Amin Antoine Kazzi, MD, FAAEM,
Associate Professor and Vice
Chair, Department of Emergency
Medicine, University of California,
Irvine; American University, Beirut,
Lebanon.
Hugo Peralta, MD, Chair of
Emergency Services, Hospital
Italiano, Buenos Aires, Argentina.
Maarten Simons, MD, PhD,
Emergency Medicine Residency
Director, OLVG Hospital,
Amsterdam, The Netherlands.
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
La paziente numero 3 ha una pressione arteriosa di 100/60 e
non sembra in condizioni critiche. Ha assunto la sua dose
regolare di clonidina al mattino e ha eseguito la dialisi completa il giorno precedente dopo di che si è sentita “stordita”.
Appare ben idratata. Non ha distensione delle giugulari ma
vi sono rantoli bibasali. I toni cardiaci sono lontani ma non
vi sono sfregamenti o soffi. Sospettate l’ipotensione ortostatica. La radiografia del torace non dimostra alcuna congestione e l’ombra cardiaca è leggermente ingrandita. L’ECG
non dimostra alcun segno evidente di IMA. Una seconda
misurazione della pressione è 96/58 e vi sembra che qualcosa non vada bene…
di sopra dell’arteria brachiale usando i metodi auscultatori. Gli studi sulla popolazione hanno dimostrato
che questi numeri variano fra i 109-137 mmHg per la
pressione arteriosa sistolica (PAS) e i 66-87 mmHg per
la pressione arteriosa diastolica (PAD).1 Un altro studio ha trovato che la PA varia da 115-145 mmHg per la
PAS e da 66-84 mmHg per la PAD negli uomini e da
107-137 mmHg per la PAS e da 61-78 mmHg per la
PAD nelle donne.2 Tenete presente che questi numeri
variano con la costituzione e con il peso corporeo ideale del paziente.
La pressione arteriosa media (MAP) riflette
maggiormente la pressione effettiva nelle arteriole e
nei vasi più piccoli rispetto alle misurazioni standard
della pressione arteriosa e può essere più utile per la
valutazione dell’ipotensione. La MAP si calcola come
segue:
N
on vi è alcuna definizione chiara dell’ipotensione basata sui valori pressori. Al contrario, la
pressione arteriosa deve essere valutata nel contesto
dell’età e dello stato clinico e fisiologico di base attuali del paziente. Per esempio, quella che sembra essere
una pressione arteriosa “normale” può in effetti essere una pressione pericolosamente bassa nel paziente
che è generalmente iperteso. L’ipotensione è un
segno, non una diagnosi e da sola non è patognomonica di alcuna patologia. Si può trovare sia in patologie critiche acute sia in patologie croniche stabili. Il
medico d’urgenza deve stabilire quale delle due sia
presente e adeguare l’aggressività degli interventi
all’eziologia sottostante.
Nei pazienti in condizioni critiche, le prime ore di
trattamento hanno un impatto diretto sulla morbilità e
sulla mortalità. In questi casi, qualche volta l’approccio
all’ipotensione non è strutturato e si focalizza sulla
“correzione dei numeri” mentre si ricerca la causa.
Meno emergenti, ma ugualmente problematici sono
quei pazienti con pressione arteriosa bassa che sono in
equilibrio, ma non sono in condizioni critiche (ad
esempio i pazienti con scompenso cardiaco congestizio
in fase terminale). Tentare di rialzare la pressione arteriosa in questo gruppo di pazienti non è generalmente
indicato e può essere pericoloso.
I casi presentati all’inizio di questo articolo illustrano i problemi posti dai pazienti con ipotensione e
dimostrano che il medico d’urgenza deve restringere
accuratamente la diagnosi differenziale. Il trattamento
implica un approccio a tridente che include simultaneamente la stabilizzazione, gli esami diagnostici e la terapia. Poiché la diagnosi differenziale è così vasta, la maggior parte delle linee guida è diagnosi-specifica e non
fornisce un approccio sistematico al trattamento dell’ipotensione. Questo numero di Emergency Medicine Practice è progettato per fornire un approccio algoritmico
basato sulle evidenze al trattamento e alla diagnosi delle
patologie che causano ipotensione. Verrà posta specifica attenzione al ruolo dell’ecografia nel processo diagnostico clinico implicato nella cura di questi pazienti.
MAP = 2/3 PAD + 1/3 PAS
oppure
MAP = PAD + (PAS – PAD) / 3
oppure
[(2 x PAD) + PAS] / 3
La definizione standard di ipotensione in un
adulto include i reperti di una PAS < 90 mmHg, una
MAP < 60 mmHg, una diminuzione di più di 40
mmHg rispetto alla pressione di base della persona o
qualunque combinazione dei parametri sopraddetti.3
In alcuni studi, la definizione di ipotensione usa una
PAS < 100 mmHg.4,5
Un adulto sano avrà delle variazioni naturali
delle misurazioni della pressione arteriosa durante un
periodo di routine di 24 ore.6,7 Una lettura numerica
della pressione arteriosa assume significato clinico
quando la MAP è al di sotto della solita pressione
di regolazione per la perfusione degli organi di un paziente. Per esempio, una pressione arteriosa di 140/90
mmHg può provocare sintomi di ipoperfusione d’organo (come stordimento e stanchezza) se la pressione
arteriosa cronica del paziente è di solito persistentemente molto più alta. Questo paziente dovrebbe essere considerato “clinicamente acutamente ipoteso”. Lo
shock si può manifestare con letture della pressione
arteriosa “normali”.8-10
Ipotensione refrattaria si riferisce a misurazioni
persistentemente ipotensive dopo la somministrazione
di un bolo di soluzione di cristalloidi endovena di 2040 ml/kg.
Pseudo-ipotensione si riferisce alla sottostima
della PA effettiva del paziente secondaria a un’occlusione arteriosa o ad altre anormalità. Se l’estremità
indenne ha una perfusione adeguata, la lettura reale
della pressione arteriosa è notevolmente più elevata
che nell’estremità colpita. I deficit del polso, o pseudoipotensione, possono essere un forte indicatore dell’occlusione di un ramo collaterale aortico e aumentare
così il sospetto di un’emergenza vascolare.
Terminologia
L’insegnamento medico generale cita che la pressione
arteriosa normale (PA) è di 120/80 mmHg misurata al
Emergency Medicine Practice
2
re stati in piedi per tre minuti, definisce la PA ortostatica.11 I parametri dell’aumento ortostatico anormale
della frequenza cardiaca non sono ben definiti ma
molti hanno una FC più elevata di 20-30 battiti al
minuto. I pazienti con una pressione arteriosa ipertensiva in posizione supina possono essere sintomatici in
ortostatismo con una diminuzione abbastanza elevata
della PA in posizione eretta.
Un’analoga caduta della pressione arteriosa associata con l’assunzione di cibo viene detta ipotensione
postprandiale.
La deplezione di volume può aggravare i sintomi
di una risposta neurocircolatoria simpatica anormale
ma può anche essere un fattore indipendente che
causa l’ipotensione ortostatica. Fino al 20% dei pazienti di età superiore ai 65 anni può soffrire di ipotensione ortostatica. Particolarmente notevole è il paziente
con morbo di Parkinson che può avere una disfunzione autonomica primaria facilmente esacerbata dalla
disidratazione o dalla politerapia.
La determinazione dell’ortostatismo dovrebbe
essere diretta dalla presentazione clinica del paziente.
Se egli è sintomatico a riposo e in posizione supina, i
parametri vitali ortostatici non sono necessari poiché il
paziente è già “ipoteso” indipendentemente dai numeri. Se l’anamnesi suggerisce una lipotimia o sintomi
analoghi nei cambiamenti di posizione prima della
presentazione nel DEA, l’ipotensione ortostatica è già
diagnosticata e possono essere più utili i parametri
vitali dopo il trattamento.
Valutazione critica della letteratura
Ipotensione ortostatica
Stare in piedi o seduti con la gambe penzoloni può far
sì che fino a 1 litro del volume ematico ristagni nel circolo venoso delle gambe. La conseguenza immediata
dell’abbassamento del volume ematico intratoracico è
la riduzione sia della gittata cardiaca sia della pressione arteriosa. Attraverso la risposta autonomica normale, un aumento della frequenza cardiaca di circa 25 battiti al minuto e un aumento delle resistenze periferiche
dovrebbero mantenere la pressione arteriosa a livelli
normali. Una caduta di 5-10 mmHg della PA si può
osservare negli individui normali entro tre minuti dal
cambiamento di posizione. Questa modificazione è clinicamente insignificante.
L’abbassamento sintomatico della pressione arteriosa in posizione eretta è detto ipotensione posturale
o ortostatica. I sintomi di solito sono dovuti a un
danno della risposta autonomica. Tradizionalmente, le
misurazioni della pressione e della frequenza cardiaca
in ortostatismo vengono effettuate a paziente supino e
ripetute in posizione eretta. Una diminuzione della
PAS di 20 mmHg o della PAD di 10 mmHg, dopo esse-
3
Le ricerche nella letteratura sono state eseguite usando
Ovid MEDLINE e PubMed nella National Library of
Medicine per le raccomandazioni per la diagnosi e il
trattamento come pure per gli aggiornamenti riguardanti le patologie che implicano l’ipotensione. Inoltre,
è stata fatta una ricerca sul Cochrane Database of Systemic Rewiews per le revisioni su argomenti analoghi.
Questa ricerca ha fornito un enorme numero di studi,
benché pochi fossero studi prospettici ben progettati.
Un’altra fonte di informazioni è stata la National Guideline ClearinghouseTM che ha fornito le linee guida per
il trattamento della sepsi e per il posizionamento ecoguidato della linea venosa centrale.
Sono sorte difficoltà per trovare studi specifici sul
trattamento dell’ipotensione indifferenziata poiché
questo argomento comprende un segno clinico che si
manifesta in molte differenti situazioni cliniche (inclusi la sepsi, la disidratazione, la patologia cardiaca, i
traumi e molte altre condizioni patologiche). I sottoargomenti del trattamento con i liquidi, del trattamento
della sepsi, del supporto pressorio, delle applicazioni
dell’ecografia, dell’Advanced Cardiac Life Support
(ACLS) e dell’Advanced Trauma Life Support (ATLS) e
altri sono stati revisionati e associati per produrre le
raccomandazioni per la diagnosi e il trattamento, specialmente negli stadi precoci dell’ipotensione.
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
Lo shock si riferisce a uno stato di disfunzione
d’organo o anche all’insufficienza d’organo dovuta a
un’inadeguata perfusione tessutale. Sono descritte
molteplici eziologie dello shock e più di un tipo può
essere presente in un singolo paziente. I vari tipi di
shock sono elencati di seguito:
• cardiogenico: deriva dalla perdita della gittata cardiaca;
• ipovolemico: deriva dalla diminuzione del volume
intravascolare;
• ostruttivo: deriva dall’ostruzione intrinseca (ad
esempio embolia polmonare) o estrinseca (ad esempio tamponamento pericardico) dell’efflusso vascolare;
• distributivo: deriva dall’interruzione della regolazione vasomotoria (ad esempio shock anafilattico, settico e neurogenico).
Lo shock è la causa più temuta dell’ipotensione;
non è una diagnosi ma una via finale comune attraverso la quale molti processi patologici producono un’insufficienza multiorgano e la morte. L’adulto sano è in
grado di compensare le normali variazioni della perfusione d’organo. Nello shock l’insulto è di dimensioni
tali che i normali meccanismi compensatori vengono
sopraffatti e si sviluppano l’ipoperfusione e la disfunzione degli organi. Questo porta all’insufficienza irreversibile degli organi bersaglio se la rianimazione non
viene iniziata e realizzata in tempo. La cosa importante
da capire è che lo sviluppo dell’ipotensione è una manifestazione tardiva dello shock e che la rapidità della
progressione attraverso la sequenza degli stadi di preshock, di shock e di disfunzione multiorgano dipende
da molti fattori. La gravità dell’insulto iniziale, le condizioni cliniche preesistenti del paziente (specialmente
la funzione cardiopolmonare) e il suo stato immunitario e nutrizionale svolgono tutti un loro ruolo.
elevati. Di conseguenza, la rapida identificazione dell’eziologia dello stato ipotensivo ha potenzialmente un
impatto critico sugli esiti a breve o a lungo termine del
paziente.
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
Epidemiologia
Sebbene sia difficile stabilire con accuratezza l’incidenza dell’ipotensione in una popolazione generale o
anche in una popolazione selezionata del DEA o di
pazienti ospedalizzati, gli studi hanno esaminato i dati
sui pazienti critici e gli effetti dell’ipotensione sugli
esiti.
La durata dell’ipotensione di origine traumatica,
settica, anafilattica e cardiogenica è una determinante
critica della morbilità, della prognosi e della sopravvivenza in questi gruppi di pazienti ipotesi.3
Jones et al. hanno effettuato un’analisi secondaria dei dati raccolti da un trial randomizzato controllato sull’ecografia mirata al letto rapida in confronto
a quella differita sui pazienti con shock sintomatico,
non traumatico. In questo studio, l’ipotensione è
stata definita come una misurazione della pressione
arteriosa sistolica iniziale nel DEA inferiore a 100
mmHg. Lo shock era definito dalla presenza dell’ipotensione con uno o più segni o sintomi predeterminati. La mortalità ospedaliera dei 190 pazienti in
shock del DEA di questo studio è stata del 15%. Gli
esiti avversi in ospedale comprendevano l’insufficienza d’organo, la necessità del ricovero in terapia
intensiva e la mortalità intra-ospedaliera. Il 50% dei
pazienti con una PAS < 80 mmHg ha avuto un esito
ospedaliero avverso. Il 40% dei pazienti con un esito
avverso ha presentato misurazioni della pressione
arteriosa costantemente al di sotto dei 100 mmHg per
più di 60 minuti.12,13
Il tasso di mortalità un mese dopo l’insorgenza
dello shock ipovolemico dipende dalla causa sottostante e dalle comorbilità del paziente. Uno studio del
2002 di Moore et al. sui pazienti del DEA con ipotensione non traumatica (definita come PAS < 100
mmHg) ha dimostrato un tasso di mortalità intraospedaliera del 18%.4 In uno studio prospettico di
coorte pubblicato di recente di Jones et al., i pazienti
del DEA con una PAS < 80 mmHg hanno avuto un
aumento di sei volte dell’incidenza dei decessi intraospedalieri. I pazienti con una PAS < 100 mmHg per
più di 60 minuti hanno avuto un’incidenza quasi tre
volte superiore della mortalità intra-ospedaliera.14
Entro un mese dalla diagnosi di shock settico, il tasso
globale della mortalità può arrivare fino al 40%.
La mortalità da shock cardiogenico può raggiungere
il 60%.15,16
Usare la presenza della sola ipotensione come
predittore della mortalità dei pazienti del DEA è
incompleto e rischia di ignorare l’importanza del contesto clinico associato. In certe entità patologiche ben
definite (come la dissezione aortica o lo scompenso
cardiaco) l’ipotensione è associata con i pazienti
più gravi; così vi sono tassi di mortalità più elevati del
50-80%.17
L’ipotensione nei pazienti con patologia renale in
fase terminale e/o con malattia aterosclerotica cardiovascolare è altresì associata con tassi di mortalità più
Emergency Medicine Practice
Ipotensione nel trauma
I protocolli ATLS sostengono la pratica di usare l’ipotensione come marcatore solo tardivo dello shock a
causa della sua scarsa sensibilità. Prima del 1989, le
linee guida ATLS insegnavano che l’assenza o la presenza dei polsi carotidei, femorali e radiali poteva
essere correlata con la pressione arteriosa sistolica.
Quando si è fatto il paragone con le misurazioni della
pressione arteriosa ottenute in modo invasivo, tuttavia, si è scoperto che le correlazioni fatte in precedenza erano sovrastimate.18,19 L’ATLS non insegna più le
correlazioni fra i polsi e la PAS nel contesto decisionale clinico.
La National Trauma Data Bank (n = 115.830), in cui
lo shock emorragico era la causa principale dell’ipotensione, riporta che la PAS è correlata con il deficit di
basi nel siero (considerato un marcatore dello shock
circolatorio). La PAS media e mediana diminuivano a
meno di 90 mmHg quando il deficit di basi era inferiore a -20.20 La Data Bank conferma la conclusione che la
PAS sia un marcatore tardivo per la mortalità e che,
nello scenario dello shock emorragico, la PAS non
dovrebbe essere usata come punto decisionale principale per la scelta di quali pazienti debbano essere sottoposti ai tentativi di rianimazione. I pazienti con ipotensione e deficit di basi significativo hanno avuto una
mortalità del 65%.
Fisiopatologia
La PA normale deriva dall’equilibrio fra le resistenze
vascolari periferiche e la gittata cardiaca (GC), e il
volume ematico totale influenza entrambe. La gittata
cardiaca è il prodotto del volume d’eiezione ventricolare (stroke volume, SV) per la frequenza cardiaca (FC).
GC = VS x FC
L’ipotensione si verifica quando o il volume
d’eiezione ventricolare o la frequenza cardiaca diminuisce. Inoltre, il volume ematico fornisce il “substrato” contro cui “spingono” le resistenze vascolari allo
scopo di regolare la PA. Perciò, anche la vasocostrizione massima sarà inefficace se lo stato del volume è inadeguato. Questo punto chiave riaffiora nel trattamento
di molti pazienti ipotesi.
Le resistenze vascolari periferiche (RVP) sono
regolate da vari meccanismi. Solo una piccola parte
del volume ematico è coinvolta nella perfusione dei
tessuti a ogni dato tempo. La maggior parte del volume ematico totale è contenuta nel sistema venoso. Le
vene servono come riserva di sangue che in caso di
necessità viene mobilizzato dal sistema neuroendocrino. Certi organi, come il cuore e il cervello, sono dotati di un’autoregolazione. La loro perfusione è influen-
4
zata da fattori metabolici e non dal sistema neuroendocrino. Perciò, il flusso ematico è preservato e può
effettivamente essere aumentato nella perdita di volume iniziale.
I recettori adrenergici sono localizzati negli organi in base alla loro funzione nella risposta “fight or flight” (“combatti o scappa”) allo stress. Gli organi non
essenziali negli eventi dello stress acuto (come il tratto
gastrointestinale) hanno un’alta concentrazione di
recettori vasocostrittori alfa-1 (A1), mentre quelli
essenziali per la sopravvivenza nello stress acuto (il
cuore, i polmoni e i muscoli scheletrici) hanno un’alta
concentrazione di recettori vasodilatatori beta-2 (B2). I
recettori cardiaci beta-1 (B1) producono l’aumento del
cronotropismo e dell’inotropismo con conseguente
aumento della richiesta di ossigeno. I recettori dopaminergici sono localizzati principalmente nei distretti
splancnico e renale.
Questi recettori sono stimolati dal rilascio di
mediatori dalle terminazioni nervose (noradrenalina)
e dal sistema endocrino (adrenalina). Il rilascio dei
mediatori è stimolato dai centri vasomotori localizzati
nel midollo e nell’ipotalamo. Gli output inibitori da
parte dei barocettori cardiaci, renali e vascolari
influenzano questi centri. Crolli patologici della pressione arteriosa causano la diminuzione degli output
inviati dai barocettori, disinibendo i centri vasomotori.
L’output o tono del sistema nervoso simpatico così
aumenta; il “tono vagale” al contrario diminuisce.
Nelle condizioni di bassa pressione, come l’ipovolemia, vi è uno stimolo inferiore dei barocettori che
porta al rilascio dell’ADH. Il rilascio dell’ADH determina: 1. un aumento dell’assorbimento dell’acqua nei
tubuli renali distali e poi un aumento del volume
vascolare e 2. una vasocostrizione periferica. Altri mediatori che aumentano il tono adrenergico includono
l’anidride carbonica e gli idrogenioni.
I reni svolgono un ruolo nella regolazione della
pressione arteriosa attraverso i seguenti meccanismi:
• nell’ipotensione, il tasso di filtrazione glomerulare
diminuisce, il che fa diminuire il tempo di transito
del sodio nei tubuli e aumenta il suo assorbimento. A
sua volta, questo aumenta l’assorbimento dell’acqua;
• l’aumentato assorbimento dell’acqua mediato dall’ADH nel tubulo distale;
• il rilascio della renina dalle cellule granulari delle
arteriole afferenti stimolate dall’escrezione adrenergica, dall’emissione della macula densa e dall’azione diretta della bassa pressione sulle cellule granulari stesse. Nel fegato, la renina catalizza l’angiotensinogeno ad angiotensina-1, che nel polmone viene
convertita ad angiotensina-2 da parte dell’enzima
convertente l’angiotensina (ACE). L’angiotensina-2
è un vasocostrittore diretto ma stimola anche la corteccia surrenale a produrre l’aldosterone, favorendo
ulteriormente la ritenzione di sodio;
• l’ipotensione causa una diminuzione del rilascio dei
peptidi natriuretici atriali, il che diminuisce la perdita di sodio e di acqua nelle urine.
Diagnosi differenziali
La diagnostica differenziale dell’ipotensione è ampia.
La Tabella 1 fornisce una struttura di cui avvalersi
quando ci si accosta a questi pazienti.
La scoperta dell’ipotensione consiglia il trasporto
urgente al DEA più vicino o più appropriato con concomitante accesso venoso e, se possibile, la somministrazione di liquidi. L’avviso anticipato mette in allarme il DEA e facilita la cura veloce quando il paziente
arriva. Si dovrebbe somministrare ossigeno ai pazienti, posizionare un monitor per la saturazione dell’ossigeno e iniziare la monitorizzazione dell’elettrocardiogramma (ECG). Se è possibile, si deve eseguire un
ECG a 12 derivazioni in tutti i pazienti ipotesi che
siano a rischio di una sindrome coronarica acuta. La
traccia del monitor cardiaco e i parametri vitali ripetuti devono essere registrati in modo chiaro e trasferiti
dal personale pre-ospedaliero a quello del DEA.
Jones et al. hanno condotto uno studio trasversale di valutazione di rischio sui trasporti in ambulanza dei pazienti non traumatizzati negli USA e in
Canada.5 I pazienti che hanno sofferto di episodi ipotensivi (una singola misurazione inferiore a 100
mmHg) con uno o più sintomi o segni predeterminati di insufficienza circolatoria sono stati denominati
“esposizioni”. Le “non esposizioni” erano quei
pazienti con sintomi di insufficienza circolatoria ma
le cui misurazioni della pressione arteriosa erano
sempre superiori a 100 mmHg. Nella sezione degli
USA, vi sono state 395 esposizioni e 395 non esposizioni; la mortalità ospedaliera è stata del 26% per le
esposizioni e dell’8% per le non esposizioni. Nella
sezione multicentrica canadese, la mortalità intraospedaliera è stata del 32% per le esposizioni in confronto all’11% per le non esposizioni. Questi dati supTabella 1. Diagnosi differenziali dell’ipotensione.
Ipovolemica
Emorragica
Disidratazione
Ridotta pressione oncotica intravascolare (terzo spazio)
Cardiogenica
Infarto miocardico acuto
Aritmie
Basso volume d’eiezione ventricolare
Gittata cardiaca inadeguata
Distributiva
Shock settico
Reazioni anafilattiche e anafilattoidi
Trasfusioni di prodotti ematici (generalmente durante la
trasfusione)
Interazione di farmaci
Sovradosaggio di farmaci
Danno neurogenico delle risposte simpaticomimetiche
Insufficienza surrenalica
5
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
Cura pre-ospedaliera
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
portano l’associazione dell’ipotensione extra-ospedaliera con la mortalità intra-ospedaliera.
Uno dei gruppi di pazienti ipotesi a rischio maggiore è quello dei pazienti con l’infarto miocardico
acuto. È interessante che, anche in questo gruppo a
rischio elevato, uno studio abbia riportato una diminuzione della mortalità dal 69% nella fase di controllo al 10% quando si è reso disponibile il livello di cura
del personale del servizio d’emergenza sanitaria.21
L’aumentata disponibilità del DEA risparmia minuti
vitali nei tempi dall’ingresso all’ECG, all’ago o al palloncino. Si devono comunicare al con- trollo medico i
pazienti con reperti ECG ischemici e si deve prendere in considerazione il trasporto di questi pazienti a
un centro fornito di risorse per il trattamento percutaneo.
La letteratura sui traumi è colma di studi che
sostengono la notifica da parte dell’ambulanza e l’attivazione del DEA e dei trauma team nei casi di ipotensione o di emorragia non controllata. È stato dimostrato che l’attivazione del trauma team migliora gli
esiti nei pazienti con trauma penetrante. In uno studio
retrospettivo di 180 pazienti, Hooker et al. hanno
dimostrato che il 61% dei pazienti con ipotensione
pre-ospedaliera (definita in questo studio come PAS <
100 mmHg) ha richiesto la trasfusione in confronto
all’11% dei pazienti senza il riscontro di ipotensione
sul territorio.22 Franklin et al. hanno dimostrato che
non solo l’ipotensione nel DEA ma l’ipotensione preospedaliera era un indicatore effettivo per attivare il
trauma team.23 Più della metà dei pazienti con ipotensione ha richiesto il controllo operatorio urgente dell’emorragia. Un altro studio ha dimostrato che una
misurazione pre-ospedaliera isolata di ipotensione,
anche con valori della PA normali nel DEA, segnalava
i pazienti traumatici con un aumento della mortalità e
necessità di intervento chirurgico per lesioni toraciche
o addominali.24
Un’interessante area per la diagnostica preospedaliera è l’uso di dispositivi portatili per l’ecografia per valutare la gittata cardiaca e il sanguinamento interno. Le immagini acquisite possono essere
trasmesse all’ospedale ricevente. Garrett et al. hanno
recentemente dimostrato che la trasmissione senza
fili delle immagini è efficace per permettere a un cardiologo ospedaliero di fare una valutazione preliminare della funzione del ventricolo sinistro e della
presenza o dell’assenza di versamento pericardico.25
La trasmissione delle immagini ecografiche è andata
a buon fine l’88% delle volte. La potenzialità nella
valutazione dei traumi e nello screening dell’aorta
addominale nei pazienti sintomatici durante il trasporto verso i centri di cura terziaria è un’area di
ricerca in corso.
seguenza, è responsabilità del medico d’urgenza identificare velocemente le cause sottostanti. Un
ampio studio prospettico su 6303 pazienti condotto
attraverso cinque reparti ospedalieri in Australia ha
identificato l’ipotensione (PA < 90 mmHg), una diminuzione di due o più punti nella Glasgow Coma Scale,
l’insorgenza del coma, la frequenza respiratoria inferiore a 6 atti al minuto, la saturazione di ossigeno
< 90% e la bradicardia per più di 30 minuti come predittori di mortalità.26 Di questi predittori, l’ipotensione e la desaturazione di ossigeno sono state identificate come le evenienze più comuni prima dell’arresto
cardiaco, e l’ipotensione è associata con un aumento
della mortalità di quasi sette volte.
In generale, i pazienti con ipotensione dovrebbero essere sistemati nell’area critica del DEA. Si dovrebbe massimizzare l’ossigenazione somministrando al
paziente ossigeno al 100% attraverso una maschera
facciale non rebreather. Si dovrebbe assicurare un accesso venoso di grosso calibro, ricorrendo all’accesso centrale se necessario. Si deve ottenere una serie accurata
di parametri vitali e ripeterla di frequente mentre si
eseguono l’anamnesi, l’esame obiettivo e gli esami
diagnostici.
Le cause più comuni dell’ipotensione – ipovolemia, shock cardiogenico e sepsi – possono sovrapporsi. Occorre usare precocemente e di frequente i metodi non invasivi per misurare il debito di ossigeno, la
performance cardiaca e lo stato globale del flusso sanguigno; si vedano le discussioni che seguono. Ugualmente importante è la necessità di monitorizzare la
risposta delle condizioni cardiache e del flusso sanguigno alla terapia. Data la scarsa sensibilità della
pressione arteriosa per valutare la gittata cardiaca, la
correzione della pressione arteriosa non è l’unico
obiettivo.27
Parametri vitali
La pressione arteriosa è un “parametro vitale” e deve
essere misurata accuratamente. La pressione arteriosa
standard viene misurata al di sopra dell’arteria brachiale alla fossa anticubitale. Si deve avere cura di selezionare un bracciale appropriato per il paziente e di
assicurare la giusta posizione della camera d’aria del
bracciale al di sopra dell’arteria brachiale. Quando la
pressione nel bracciale scende al di sotto della PAS, il
sangue passa in modo udibile a ogni sistole, producendo i suoni di Korotkoff. Quando la pressione scende al di sotto della PAD, questi suoni scompaiono perché il sangue può ora passare sia durante la sistole sia
durante la diastole.
La pressione arteriosa viene spesso registrata
con bracciali automatici e il posizionamento scorretto
della camera d’aria del bracciale darà una lettura falsamente bassa che può portare a un errore di trattamento se non viene riconosciuta.6 Ogni pressione
bassa che incida sulle cure cliniche dovrebbe essere
confermata con una misurazione manuale della PA.
Le misurazioni degli apparecchi automatici sono sta-
Valutazione nel DEA
L’ipotensione è un predittore dell’esito negativo indipendentemente dall’eziologia sottostante. Di con-
Emergency Medicine Practice
6
te testate in confronto agli sfigmomanometri manuali e in confronto alle misurazioni della pressione intrarteriosa diretta. Sono stati ottenuti risultati variabili.28,29 In uno studio di Lehman et al., le misurazioni
automatiche della PA sono state paragonate con le
registrazioni della pressione arteriosa centrale in 120
pazienti.29 Vi sono state imprecisioni clinicamente
significative (± 10 mmHg) nel 24% dei dispositivi
automatici e imprecisioni gravi (± 20 mmHg) nel 3,2%
delle registrazioni dei dispositivi automatici. Studi
più recenti hanno dimostrato che questi dispositivi
hanno un’accuratezza accettabile quando vengono
usati correttamente. Cavalcanti et al. hanno studiato
le misurazioni ottenute con i bracciali manuali in confronto alle misurazioni con i bracciali automatici in 92
pazienti; vi è stata una correlazione elevata (entro i 10
mmHg) in tutti i pazienti.30 Imprecisioni maggiori
sono state rilevate con bracciali troppo piccoli, che
causano letture erroneamente elevate. 31-34 Alcuni
studi hanno inoltre esaminato le differenze nella
pressione arteriosa rispetto alla posizione del corpo,
alla posizione del braccio e alla relativa condizione di
riposo del paziente.35-38 Purtroppo, questi studi sono
basati sul monitoraggio dell’ipertensione e si possono
trarre soltanto conclusioni molto vaghe sui pazienti
ipotesi. Le migliori evidenze disponibili suggeriscono
che le misurazioni della pressione arteriosa siano
effettuate con il paziente in posizione sdraiata con la
fossa anticubitale a livello dell’atrio destro e che le
misurazioni successive avvengano sempre in questa
posizione.
Gli altri parametri vitali offriranno indizi sul grado e sulla fonte dell’ipotensione. È probabile che la frequenza cardiaca sia aumentata in un paziente ipoteso
ma può essere influenzata dalla posizione del corpo,
dall’attività precedente alla misurazione o dalla terapia (ad esempio beta bloccanti). I parametri vitali ortostatici sono raramente necessari o indicati nel paziente
già ipoteso. La frequenza respiratoria, la temperatura
rettale e la pulsossimetria sono fondamentali per la
valutazione del paziente. Da notare che l’ipoperfusione può interferire con una valutazione accurata della
saturazione dell’ossigeno.
Malgrado l’importanza di ottenere parametri
vitali accurati, è importante notare che i parametri
vitali da soli hanno dei limiti nell’identificare gli stati
di shock. Ander et al. hanno esaminato l’uso del livello dell’acido lattico e della saturazione venosa centrale di ossigeno continua per identificare la gravità della
patologia dei pazienti con scompenso acuto di una
grave insufficienza cardiaca cronica (frazione di eiezione [FE] < 30%).10 I parametri vitali non erano d’aiuto per distinguere i pazienti con stati di shock inapparenti (definiti come livelli elevati di acido lattico e
saturazione venosa centrale di ossigeno bassa) da
quelli con insufficienza cardiaca lievemente scompensata o stabile. Nei pazienti in stato di shock si è reso
necessario un trattamento più aggressivo per l’insufficienza cardiaca con conseguente diminuzione dei
livelli di acido lattico e aumento della saturazione
venosa centrale di ossigeno.
Anamnesi
Esame obiettivo
A causa della vasta diagnostica differenziale, per la
valutazione del paziente ipoteso è necessario un esame
obiettivo approfondito e globale. Si dovrebbero valutare le condizioni generali di nutrizione e di idratazione. Durante l’esame della testa e del collo, si devono
annotare segni come gli occhi infossati, la depressione
bitemporale e l’umidità delle membrane mucose.
L’esame del collo può rivelare la presenza o l’assenza della distensione delle vene giugulari e dare un
indizio precoce delle condizioni del precarico. La presenza di congestione delle vene giugulari in un
paziente con ipotensione è un reperto serio che deve
essere investigato aggressivamente. La distensione
delle vene del collo è causata di solito da un inadeguato ritorno venoso del sangue al lato destro del
cuore o da una pressione significativamente elevata
del cuore destro. Le patologie che possono causare
questo includono il tamponamento pericardico, la
Tabella 2. Potenziali sintomi di ipoperfusione
d’organo.
Debolezza
Affaticamento
Ansia
Senso di morte imminente
Disturbo toracico (qualunque descrizione)
Confusione (riferita dal paziente o
dimostrata in altro modo)
7
Stordimento
Sincope
Sete
Dispnea
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
La valutazione del paziente con ipotensione deve
essere globale. Idealmente, si dovrebbe stabilire la
pressione arteriosa basale del paziente come pure le
condizioni cliniche complessive. I sintomi che indicano una causa cardiopolmonare includono, ma non vi
si limitano, i sintomi prodromici (come il dolore toracico, le palpitazioni e la dispnea). La nausea, il vomito, la diarrea o il dolore addominale, come pure l’ematemesi e la melena, possono indicare un’eziologia
gastrointestinale. La febbre, la tosse o la disuria possono indicare un’eziologia infettiva. Occorre valutare
la possibilità di una reazione allergica come pure lo
stato di gravidanza delle donne in età fertile. Uno
screening delle condizioni mentali valuterà la probabilità di un’overdose da farmaci come eziologia. Si
vedano le Tabelle 2 e 3 per i possibili sintomi e per le
domande anamnestiche chiave.
La ricerca della pressione basale nelle Cartelle cliniche
e il ritrovamento di molteplici misurazioni basse della
PA durante precedenti ricoveri o visite nel DEA non
dovrebbero far abbassare la guardia. Questi pazienti
stavano abbastanza male da avere bisogno di cure e
ricoveri frequenti. Le visite mediche di routine sono
una fonte migliore per stabilire le condizioni di base.
re le petecchie, che suggeriscono una disfunzione piastrinica (come si osserva nelle vasculiti) o la porpora
(come si vede nei disordini della coagulazione).
L’esame obiettivo neurologico sarà molto significativo per evidenziare la risvegliabilità e lo stato mentale anormale, ma possono essere presenti altri segni
più focali se aree importanti del cervello vengono colpite dalla riduzione della pressione di perfusione cerebrale. L’esame obiettivo rettale e pelvico sono raccomandati in base al sospetto clinico.
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
Tabella 3. Domande critiche veloci: indicatori anamnestici determinanti.
Eventi immediatamente precedenti
Richiesta di aiuto
Valutazione e decorso del
servizio d’emergenza sanitaria
Precedenti episodi di ipotensione
Nessuno
Disidratazione
Correlati con terapie
Di origine gastrointestinale
Cardiaci
Sepsi
Allergici
Patologie mediche note
Cardiache
Renali
Accidenti cerebrovascolari
Trapiantati
Malattie autoimmuni
Psichiatriche
Esami diagnostici
Polmonari
Epatiche
Gravidanza
HIV/AIDS
Cancro
Deterioramento cognitivo
Emocromocitometrico completo
Conteggio dei globuli bianchi
Il conteggio dei globuli bianchi contribuisce raramente
al trattamento dell’ipotensione patologica. Benché
conteggi elevati e bassi dei globuli bianchi possano
suggerire l’infezione, essi possono anche essere semplicemente correlati con la gravità del danno che ha
come conseguenza l’ipotensione. Nel 1992, l’American
College of Chest Physicians (ACCP) e la Society of Critical
Care Medicine (SCCM) hanno introdotto le definizioni
per la sindrome da risposta infiammatoria sistemica
(SIRS).15 L’ipotensione e la presenza di un conteggio
dei globuli bianchi superiore a 12.000 o inferiore a 4000
erano due dei quattro reperti clinici usati per diagnosticare la presenza di questa sindrome ed entrambi
possono essere presenti nelle eziologie non infettive
(ad esempio il politrauma). Un singolo conteggio dei
globuli bianchi entro i limiti normali non esclude una
causa infettiva dell’ipotensione. Il riscontro di conteggi dei globuli bianchi estremamente elevati o estremamente bassi può anche riflettere la presenza di patologie ematologiche, oncologiche e immunitarie. La presenza di neutropenia (conteggio assoluto dei neutrofili
inferiore a 1000) non indica soltanto le patologie sopra
elencate, ma anche la necessità del trattamento antibiotico empirico quando è presente la febbre.
Esposizione a farmaci
Prescritti
Non prescritti, inclusi i fitoterapici
Modifiche della terapia farmacologica
Sovradosaggio di farmaci (intenzionale o accidentale)
Droghe illecite
Somministrati dal servizio d’emergenza sanitaria o nel
DEA (es. intubazione a sequenza rapida, sedazione)
Storia di allergie
Esposizione recente o sospetta (cibo, farmaci, lattice ecc.)
Coagulopatie
Warfarin (dopo trauma o sanguinamento spontaneo
dovuto alla tossicità da parte del farmaco)
Emofilia A e B
Trombocitopenia < 20 K
Sindromi da disfunzione piastrinica: malattia di
Von Willebrand, uremia ecc.
pericardite costrittiva, lo pneumotorace iperteso, l’infarto del ventricolo destro, l’embolia polmonare massiva e l’intrappolamento di aria nella ventilazione
meccanica. La deviazione tracheale con dispnea può
indirizzare verso lo pneumotorace.
Durante l’esame obiettivo del torace, notate la
presenza o l’assenza dei suoni polmonari, i crepiti, i
sibili e le aree di ottusità o di timpanismo alla percussione. L’esame obiettivo cardiaco può rivelare tachicardia, i soffi del flusso sanguigno che indicano un’iperattività cardiaca, soffi diastolici e sistolici che possono indicare disfunzioni valvolari o i rumori cardiaci
ovattati che indicano il versamento pericardico.
L’esame obiettivo addominale può rivelare
suoni intestinali anormali, rumori, ascite, masse palpabili, distensione, rigidità e aree di dolorabilità che
orientano verso patologie che indicano la disidratazione, la sepsi, il terzo spazio o il sanguinamento
intraddominale.
Le estremità possono essere fredde e umide e
mostrare un riempimento capillare o polsi periferici
deboli. L’edema può indicare il terzo spazio o endocrinopatie come l’ipotiroidismo o la patologia surrenalica. Un esame obiettivo accurato della cute può rivela-
Emergency Medicine Practice
Emoglobina/ematocrito (Hb/Ht)
Nello scenario della sospetta emorragia, il reperto di
un valore ridotto rende il medico più sicuro della
propria diagnosi. Tuttavia, nello scenario dell’emorragia rapida massiva, l’Hb/Ht appare normale anche
quando il paziente è in condizioni terminali. Se il
sospetto clinico è alto, è necessario ripetere l’esame
nel tempo. L’Hb/Ht è utile anche per le decisioni
terapeutiche in quanto la trasfusione diventa una
considerazione quando l’ematocrito è inferiore a 30 e
si sospetta che il paziente abbia una sepsi o un’ischemia miocardica.
Gli indici dei globuli rossi (GR) utili includono il
volume corpuscolare medio (MCV), l’ampiezza del
raggio di distribuzione (RDW) e il conteggio dei reticolociti. L’MCV è una misura delle dimensioni medie
dei globuli rossi in circolo. Valori elevati o bassi riflettono carenze nutrizionali, effetti di farmaci o disfunzioni ematopoietiche dei globuli rossi. Quando è pre-
8
Piastrine
Nei pazienti ipotesi devono essere valutati anche il
conteggio e la funzionalità delle piastrine. La trombocitosi è raramente di interesse clinico immediato
in quanto l’aumento delle piastrine si osserva comunemente in molti processi infiammatori o infettivi,
tanto da diventare pseudonimo, fra i reumatologi, di
velocità di sedimentazione dei poveri. Il numero
delle piastrine è elevato anche nell’anemia da carenza di ferro.
La trombocitopenia è associata a diverse malattie serie ed è un segno inquietante quando è presente
con l’ipotensione. La trombocitopenia nello scenario
dell’anemia necessita della valutazione dello striscio
periferico per rilevare se sia veramente basso e se
siano presenti gli schistociti (GR periferici frammentati), in questi casi si deve sospettare un’anemia emolitica microangiopatica (MAHA). Quando la MAHA
non è dovuta a una coagulopatia da consumo (che
verrà discussa in seguito) è causata dall’attivazione
patologica delle piastrine che aderiscono al letto
capillare con conseguente emolisi dei GR e anemia.
Le tossine elaborate nella sepsi e nella porpora trombotica trombocitopenica (PTT) possono causare questa patologia.
Esami ematochimici
Urea e creatinina
L’urea e la creatinina forniscono indicatori della funzionalità renale. Un rapporto urea/creatinina > 1:20
suggerisce la disidratazione.
Elettroliti
L’aumento del sodio sierico riflette più accuratamente
il bilancio idrico che non la concentrazione effettiva del
sodio.
L’iponatriemia, in assenza di terapia diuretica o
delle rare nefropatie sodio-dispersive, riflette la ritenzione idrica in eccesso di sodio, qualunque ne sia la
causa. Può essere cronica (come nella sindrome da
inappropriata secrezione dell’ormone antidiuretico
[SIADH]) o acuta (come si osserva quando vi è una
perdita di volume del 10% o più). L’ipernatriemia
riflette quasi sempre una grave disidratazione ma con
la perdita di acqua che eccede quella di sali. L’aumento del potassio riflette l’aumento o la diminuzione dell’introito o dell’escrezione del potassio o l’improvviso
rilascio del potassio intracellulare da danno tessutale
massivo.
Il bicarbonato e il cloro sono utili principalmente
per il calcolo del gap anionico che può essere usato per
generare la differenziazione dell’acidosi a gap anionico elevato o senza gap anionico.
Profilo coagulativo
Vi sono tre motivi principali per richiedere l’International Normalised Ratio (INR) con il tempo di protrombina
(PT) e il tempo di tromboplastina parziale (PTT):
• per documentare la presenza di una coagulopatia
da consumo, usate l’INR/PT e il PTT più il D-dimero, i prodotti di degradazione della fibrina e i livelli
del fibrinogeno;
• per valutare la funzione coagulativa in presenza di
anticoagulanti come il warfarin (Coumadin®) usate
l’INR/PT;
• per valutare la funzione di sintesi del fegato (ad
esempio l’albumina, i fattori della coagulazione
vitamina K-dipendenti) usate il PT;
La coagulopatia intravascolare disseminata (CID)
produce la MAHA per inappropriata attivazione del
sistema coagulativo. I prodotti della fibrina si depositano nel letto capillare e distruggono i GR e le piastrine. Dopo di che, l’attivazione patologica del sistema
fibrinolitico produce la porpora, l’emorragia e le anor-
Glucosio
9
Nei pazienti con ipotensione patologica i livelli di glucosio sierico tendono ad aumentare secondariamente
agli eccessivi livelli di catecolamine. La glicemia elevata è stata identificata come marcatore prognostico nelle
patologie gravi.39-41
L’ipoglicemia senza una causa indotta da farma-
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
malità del PT/PTT che sono diagnostiche della patologia. Gli altri esami (come i prodotti di degradazione
della fibrina, il D-dimero e i livelli del fibrinogeno)
vengono richiesti quando la patologia è altamente
sospetta anche di fronte a risultati normali del PT e
PTT.
L’aumento dei tempi del PT può essere dovuto a:
• patologie epatiche (ostruzione dei dotti biliari, cirrosi ed epatite);
• coagulazione intravascolare disseminata;
• carenza di vitamina K;
• terapia con warfarin (Coumadin®);
• carenza dei fattori I, II, V, VII e X.
L’aumento del PTT valuta il sistema coagulativo
intrinseco e può essere usato per:
• il monitoraggio della terapia eparinica e per aiutare
a rilevare le classiche emofilie A e B e altre carenze
fattoriali congenite;
• lo screening della presenza di ipo- o disfibrinogenemia, di coagulazione intravascolare disseminata, di
insufficienza epatica e di carenza di vitamina K.
Il D-dimero è molto specifico per la coagulazione
intravascolare disseminata.
sente, questa anormalità non elimina la possibilità di
un evento acuto; essa suggerisce soltanto la presenza
di un problema cronico che esisteva prima di quello
acuto. Quando sono presenti molte linee cellulari di
dimensioni diverse, l’MCV può essere erroneamente
normale; nel qual caso, diventa utile la RDW. Questa è
una misura della gamma delle differenti dimensioni
dei GR presenti nel flusso sanguigno; il suo aumento
suggerisce una patologia anche di fronte a un MCV
normale. Il conteggio dei reticolociti è utile per determinare se un’anemia è iperproliferativa (conteggio elevato) o ipoproliferativa (conteggio basso).
tardi a causa della diminuzione della clearance da parte
del fegato e dei reni. L’ipoperfusione prolungata degli
organi porta all’aumento dell’ipossia e della produzione di lattato. Livelli elevati di lattato suggeriscono la
scarsa perfusione d’organo e avvertono il medico dell’imminente insufficienza d’organo. In uno studio di
Ander et al., i parametri vitali e l’impressione clinica
non sono stati in grado di distinguere i pazienti con
insufficienza cardiaca congestizia stabile in classe IV di
Killip da quelli con scompenso lieve o acuto; tuttavia,
i livelli di lattato sono stati in grado di stratificare la
gravità della patologia dei pazienti.10
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
ci è preoccupante e denota la presenza di un’endocrinopatia o di una disfunzione molto grave della gluconeogenesi epatica. È un evento preterminale nelle
malattie epatiche in stadio terminale.
Test di funzionalità epatica
Le transaminasi misurano l’integrità epatocellulare.
L’albumina e il PT/PTT riflettono la funzione di
sintesi del fegato; la fosfatasi alcalina e la bilirubina
riflettono la funzione escretoria del fegato. È importante conoscere le comorbilità (ad esempio una storia
di epatite) quando si interpretano questi esami.
Elettrocardiogramma (ECG)
Acido lattico
Un ECG e il monitoraggio cardiaco sono fondamentali per la gestione del paziente con ipotensione. La
Tabella 4 elenca le possibili eziologie dell’ipotensione
che possono essere rivelate dall’ECG.
I valori normali dell’acido lattico nel siero sono di solito inferiori a 0,7 mmol/dl. Livelli di lattato superiori a
2,1 mmol/dl indicano una grave disfunzione multiorgano o l’ischemia estesa di un singolo sistema organico (ad esempio l’ischemia mesenterica).42,43
Non importa se il lattato sierico sia misurato su
un campione venoso o arterioso. In uno studio su 48
pazienti del DEA, Younger et al. hanno dimostrato che
livelli del lattato venoso di 1,6 mmol/dl e oltre hanno
una sensibilità del 100% e una specificità dell’86% nel
determinare i livelli elevati del lattato arterioso.44,45
Uno studio recente di Jones et al. ha inoltre stabilito
che i livelli di lattato venoso non sono influenzati se il
prelievo è effettuato con o senza l’uso di un laccio o è
inviato in laboratorio con o senza ghiaccio, se il campione viene esaminato entro 15 minuti.46 La clearance
rapida del lattato è associata con un miglioramento dei
tassi di mortalità e del decorso clinico.47
I livelli di lattato aumentano negli stadi precoci
della sepsi a causa dell’incremento della glicolisi e più
Esami radiologici
Gli esami semplici (come la radiografia del torace)
sono utili come strumenti di screening per confermare
diagnosi già sospette di polmonite o di aria libera e per
confermare l’anamnesi remota (come l’insufficienza
cardiaca). La TC e altri esami sono giustificati in base
al processo patologico in questione. Vedere il paragrafo Utilizzo nel Dipartimento d’Emergenza dell’ecografia
al letto a pag. 16 per una discussione sull’ecografia nella valutazione del paziente ipoteso.
Trattamento nel Dipartimento d’Emergenza
La gravità dell’ipotensione non si basa soltanto sulla
profondità delle misurazioni numeriche. La presenza
di segni e sintomi di ipoperfusione d’organo e il nu-
Tabella 4. Diagnosi di ipotensione che si possono riscontrare nell’ECG.
Potenziali reperti ECG incontrati
Ritardi della conduzione, blocchi atrio-ventricolari di vario
grado, anormalità della frequenza sinusale, aritmie ventricolari,
aritmie sopraventricolari, funzionamento e malfunzionamento
del pace maker
Diagnosi da prendere in considerazione
Aritmie (principale causa elettrofisiologica)
Morfologia di sopraslivellamento del segmento ST
(può essere simile alle cause non ischemiche di
sopraslivellamento del segmento ST come la ripolarizzazione
precoce benigna), depressione del segmento ST, depressione
delle onde T
Infarto miocardico acuto o segni di ischemia
Complessi QRS di basso voltaggio, alternanza elettrica
Tamponamento
Sopraslivellamento del segmento ST con depressione del
segmento PR (relativa al segmento T-P)
Pericardite (prendere in considerazione il versamento
o la disfunzione miocardica)
Ingrandimento atriale: suggerisce sovraccarico cronico di
pressione e/o di volume
Disfunzione valvolare cardiaca
Bradicardia o AV nello scenario dell’ipotensione dovuta
all’uso/abuso di farmaci bloccanti il nodo AV, onde R
terminali nel sovradosaggio di antidepressivi triciclici,
tachicardia sinusale o tachiaritmia
Esposizione/tossicità da farmaci
Iperkaliemia
Complessi QRS larghi che diventano sinusoidali
Emergency Medicine Practice
10
i pazienti con la sepsi. I pazienti con PVC misurata in
modo invasivo superiore a 8 mmHg possono ancora
avere segni o evidenze dirette di ipoperfusione. I pazienti settici con misure dalla PVC entro il “range prefissato”, utilizzato nello studio EGDT spesso citato, possono
essere ancora ipoperfusi e rispondere ai liquidi; essi non
dovrebbero essere privati del ripristino dei liquidi.
Il liquido di scelta rimane la soluzione isotonica
di cristalloidi (la soluzione fisiologica o il ringer lattato).48 Benché una volta fossero in voga, le evidenze
attuali non sostengono l’uso di routine delle soluzioni
colloidali (albumina o hetastarch) nella rianimazione in
acuto.49,52-54 Benché esista una pletora di letteratura
riguardo l’uso della soluzione salina ipertonica nel
trattamento dei pazienti traumatici o ustionati, i vantaggi rispetto alla soluzione fisiologica nel trattamento
dei pazienti medici non sono stati dimostrati. In una
metanalisi di 14 studi su 956 pazienti traumatici, ustionati e sottoposti a interventi chirurgici, non era chiaro
se esistesse qualche vantaggio con la somministrazione della soluzione salina ipertonica.55
Traumi
Nei pazienti sanguinanti con trauma chiuso, evidenze
recenti suggeriscono che si devono impiegare volumi
inferiori di soluzioni di cristalloidi per prevenire l’eccessiva diluizione del sangue e dei fattori della coagulazione.56,57 Sebbene in uno spazio chiuso si possa
verificare il tamponamento dell’emorragia, esiste il
timore che il sanguinamento possa aumentare in un
secondo tempo se si verifica un’eccessiva diluizione.
Benché i dati non siano conclusivi, in questi casi si
dovrebbero prendere in considerazione i globuli rossi
concentrati e il plasma fresco congelato per il trattamento del paziente.
Nei traumi penetranti, sono stati recentemente
sostenuti termini come “ipotensione permissiva” o
“rianimazione ipotesa”.58-62 Essenzialmente, le pressioni arteriose numericamente basse (circa 70-80
mmHg) sono preferite durante le prime fasi della rianimazione di questi pazienti per non “far saltare il
coagulo” prima dell’intervento chirurgico. Che ciò sia
dovuto alla pura pressione intravascolare o alla diluizione dei fattori della coagulazione, si è stabilita una
preferenza per l’infusione di un minor quantitativo di
liquidi. Si dovrebbe, tuttavia, fare attenzione poiché
le PA poste come obiettivo non sono una misura
accurata della perfusione degli organi terminali e
qualunque segno di ipoperfusione dovrebbe essere
trattato aggressivamente. Inoltre, in questi casi è
necessario il trasferimento tempestivo in sala operatoria per il trattamento definitivo, poiché i meccanismi compensatori possono influenzare le condizioni
cliniche del paziente e potrebbero cedere se il trattamento fosse ritardato.
Liquidi
Il punto fondamentale del trattamento precoce dell’ipotensione rimane il trattamento con liquidi endovena. La
diminuzione del tono vascolare può nascere da una
miriade di fattori, ma il tentativo iniziale di correzione
dovrebbe essere quello di aumentare il volume intravascolare nella maggior parte dei casi, con eccezioni che
scaturiscono tipicamente dallo scompenso cardiaco
(come nell’insufficienza del ventricolo sinistro). Il carico
endovena di almeno 1-1,5 l o di 20-40 ml/kg48-50 deve
essere somministrato a bolo e monitorato sulla risposta.
Il protocollo Surviving Sepsis raccomanda l’uso “aggressivo” dei liquidi ev senza un volume specifico, sottolineando il fatto che ogni paziente necessita di una terapia
individualizzata.51 L’adeguatezza dell’idratazione può
essere valutata soggettivamente con l’approssimazione
della PVC tramite la distensione delle vene giugulari
(misurata a 8-10 cm al di sopra dell’atrio destro) o oggettivamente con la pressione venosa centrale.
L’ammonimento riguardo a questa linea guida è che gli
obiettivi della PVC non sono sempre chiaramente definiti. Nell’articolo sulla Early Goal Directed Therapy
(EGDT) di Rivers et al., l’obiettivo della PVC di 8-12
mmHg per i pazienti in sepsi non è stato valutato in
modo prospettico. La maggior parte dei pazienti, sia nel
gruppo di controllo sia in quello di trattamento, ha raggiunto valori della PVC che erano più alti del range prefissato. La valutazione del precarico viene fornita dalle
misurazioni della PVC e non parla accuratamente di
adeguare o ottimizzare la perfusione degli organi in tutti
Vasopressori
Se la rianimazione con i liquidi non riesce a correggere l’ipotensione, si prendono in considerazione i
11
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
mero degli organi interessati sono caratteristiche critiche che devono essere riconosciute precocemente
dal medico curante. Malgrado il nostro desiderio di
fare una diagnosi finale corretta e di iniziare il trattamento definitivo, vi sono situazioni in cui il tempo
trascorso ad aspettare quella diagnosi rappresenterebbe un pericolo per l’esito del paziente. Perciò, il
trattamento aggressivo dell’ipotensione si deve effettuare parallelamente al suo iter diagnostico. Oltre al
riconoscimento dell’ipotensione sintomatica, esiste il
problema dell’adeguatezza del trattamento. Nello
studio di Shoemaker citato in precedenza, il 76% dei
pazienti aveva pressioni arteriose medie al di sotto
degli 80 mmHg dopo il ricovero.12 Il 24% dei pazienti ammessi era normoteso ma in seguito ha presentato ricadute dell’ipotensione. Il trattamento dei pazienti è stato considerato sub-ottimale nella maggior
parte dei casi perché:
• l’entità patologica sottostante associata con l’ipotensione non era stata ancora identificata;
• la patologia sottostante era stata erroneamente attribuita a un’altra eziologia;
• gli sforzi per la rianimazione erano stati tardivi o
non sufficientemente aggressivi.
Nel trattamento del paziente ipoteso sintomatico
sono necessari alcuni provvedimenti di base che sono
evidenziati nella Figura 1.
Emergency Medicine Practice
12
Monitorare per una PVC/pressione
atriale destra adeguata
(almeno 8-12 cm H2O) come segno
di un'adeguata rianimazione con
liquidi. Si possono impiegare
l'osservazione della DVG,
l'ecografia al letto o il
monitoraggio diretto della pressione
venosa centrale (Classe I)
Somministrare almeno 20-40 ml/kg
(tipicamente 1-2 litri) di soluzioni
cristalloidi ev come bolo/fluid challenge. Le velocità di “mantenimento” non sono adeguate. Le soluzioni di cristalloidi sono uguali ai colloidi in termini di esito e molto
meno costose (Classe I)
ANCORA
IPOTESO?
(nonostante la dose
massima del primo
farmaco)
SÌ
Il paziente
è settico?
poi
Adrenalina 1-4 µg/min (Classe IIb). Adrenalina è il farmaco di scelta
nello shock anafilattico (Classe I)
Fenilefrina 100-180 µg/min, poi titolato a una dose di mantenimento di 4060 µg/min (Classe IIa). Agisce esclusivamente sui recettori alfa-1. Considerare in caso di grave tachicardia con altri pressori
Si possono aggiungere altri vasopressori:
Agenti di prima linea: aggiungere noradrenalina o dopamina (Classe IIa)
poi
Early goal-directed therapy (terapia precoce
diretta al raggiungimento dell'obiettivo)
e
Se ipotensione refrattaria considerare:
Dose stress di steroidi: desametasone preferito per
preservare il successivo test di stimolazione
all'ACTH (Classe IIb)
e
Vasopressina 0,04 unità/min (range 0,01-0,04
unità/min) può permettere la riduzione di altri
agenti vasopressori (Classe IIb)
Noradrenalina 8-12 µg/min come dose iniziale (max 12 µg/min) e titolare
fino alla PA desiderata. Si può ridurre di 2-4 µg/min quando la PA desiderata è raggiunta (Classe I)
Oppure
Dopamina 10-20 µg/kg/min e titolare fino a un massimo di 50 µg/kg/min
(Classe I). Considerare con maggior forza se si desidera un supporto
cardiaco cronotropo e inotropo poiché la dopamina ha una maggior
attività recettoriale beta-1 della noradrenalina. La dopamina a “dosi renali” (cioè strettamente utilizzata per “preservare la funzione renale”) non è
più raccomandata (5 µg/kg/min)
Supporto vasopressorio: qualsiasi vena grande è accettabile per la
somministrazione in emergenza di questi farmaci, ma l'accesso venoso
centrale è preferibile per diminuire il rischio di stravaso. L'ecografia al
letto può migliorare il successo della procedura e ridurre il disagio del paziente (Classe I)
Presenti
SHOCK CARDIOGENICO con
insufficienza del cuore sinistro
Umidi
Rumori polmonari:
assenti o umidi?
Gittata cardiaca/Indice
cardiaco diminuiti?
Trattamento per una
funzione cardiaca
insufficiente (può
verificarsi negli stadi
più tardivi di altri tipi
di shock)
- Ipotensione post-intubazione dovuta
all'elevate pressioni intratoraciche e al
ridotto ritorno venoso
- IMA della parete inferiore con infarto
ventricolare destro (Classe I)
- Tamponamento cardiaco (Classe I)
- Embolia polmonare massiva (Classe IIb)
- Pneumotorace iperteso (Classe IIa)
Assenti
Considerare l'eziologia OSTRUTTIVA
e trattarla di conseguenza; l'uso
dell'ecografia al letto è particolarmente
utile nella diagnosi.
Dobutamina 0,5-1 µg/kg/min titolato fino a un massimo di 40
µg/kg/min. Dose di mantenimento tipicamente 2,5-20 µg/kg/min.
Ha la maggior potenzialità aritmogena essendo un agente
adrenergico (Classe IIa)
Oppure
Inamrinone (in precedenza amrinone, rinominato per evitare
confusione con amiodarone) (Classe IIb) 0,75 mg/kg a bolo in 2-3
minuti. Può essere ripetuto una volta, poi dose di mantenimento a
5-15 µg/kg/min. Inibitore della fosfodiesterasi (PDE): teoricamente meno aritmogeno
Oppure
Milrinone 50 µg/kg a bolo in 10 minuti, poi dose di mantenimento di
0,375-0,75 µg/kg/min (Classe IIb). Il più nuovo inibitore della
PDE negli USA. Può avere rischi minori di vasodilatazione
periferica
Supporto inotropo della funzione cardiaca: ciascuno di questi
farmaci può provocare vasodilatazione periferica e perciò potrebbe richiedere un supporto vasopressorio periferico durante la
somministrazione nel paziente già ipoteso
Primo passo:
sono presenti la distensione delle vene giugulari (DVG) o l'evidenza ecografica di
un aumento della PVC?
Consultare l’ultima pagina per le definizioni di Classe di Evidenza
In un paziente con emorragia,
considerare la precoce somministrazione
di sangue e prodotti ematici in associazione a un utilizzo piuttosto limitato
di cristalloidi in
infusione per evitare una potenziale
diluizione dell'ematocrito e dei
fattori della coagulazione
ANCORA
IPOTESO?
Trattamento per
la RIDUZIONE
DEL TONO
VASCOLARE,
cioè SHOCK
DISTRIBUTIVO
Se la PVC non è adeguata, continuare
a somministrare cristalloidi ev fino a
una PVC adeguata. Considerare
l'impiego di pressori come “ponte” fino
al raggiungimento della completa
rianimazione con i liquidi
Se la PVC è adeguata, utilizzare
i pressori come indicato dalla
patologia sottostante
Assenti
Diagnosi da considerare:
Danno polmonare acuto (ARDS)
Polmonite/alveolite
Umidi
Il trattamento iniziale dell'ipotensione non
cardiogenica è la rianimazione con liquidi
Diagnosi da considerare:
Ipovolemia
Shock distributivo:
Sepsi
Spinale
Anafilattico
Assenti
Rumori polmonari: assenti o umidi?
La stabilizzazione iniziale del paziente include il supporto delle vie aeree se necessario, il trattamento immediato delle cause ovvie di ipotensione (es. sanguinamento franco, trauma ecc.) e i protocolli ACLS per le aritmie o l'arresto.
Altrimenti, alcuni reperti chiave dell'esame obiettivo (cioè distensione delle vene giugulari e rumori respiratori) possono essere d'aiuto nell'indirizzare ulteriormente la diagnosi e il trattamento dell'ipotensione in questo paziente
Paziente ipoteso definito come: PA sistolica < 90 o MAP < 60 o riduzione della PA (MAP) di base > 30% o 40 mmHg
Segni e sintomi di insufficiente perfusione tessutale, tramite esame obiettivo, esami diagnostici, o monitoraggio invasivo e non invasivo, che indica uno shock per il quale sono necessari trattamenti energici
Figura 1. Algoritmo per la valutazione e il trattamento dell’ipotensione.
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
Tabella 5. Farmaci per tipo di recettore adrenergico: indicazioni, vantaggi e svantaggi.
Vasopressore Indicazioni
• La dopamina è indicata dalla
Dopamina
FDA per tutte le forme di
shock e per il trattamento della
ridotta gittata cardiaca
• Scarsa funzionalità cardiaca
con scarsa perfusione
• Ipotensione/miocardio stordito
post-arresto
Vantaggi
• Efficace su recettori multipli
• Attività recettoriale graduata
dose-dipendente (non “tutto o
nulla”)
• Titolata alla risposta specifica
del paziente e al monitoraggio
emodinamico
Noradrenalina
• Shock settico dovuto a basse
Eccellente per aumentare le
resistenza vascolari periferiche
Fenilefrina
La FDA ne indica l’uso
nell’ipotensione
Buona scelta se tachicardia/
aritmie limitano l’uso
resistenze vascolari periferiche
• Può essere usata nello shock
anafilattico
Svantaggi
• Le dosi “dopaminergiche”
possono migliorare la diuresi
ma non migliorano la funzione
renale e generalmente non
sono utili nei confronti
dell’ipotensione
• Può essere aritmogena alle
alte dosi “alfa”
• Le alte dosi possono compromettere la diuresi (considerate
di usarla con la dobutamina)
Aumenta il rischio di aritmie e di
ischemia miocardica; aumenta
il consumo di ossigeno; può
diminuire la perfusione intestinale
e aumentare i livelli del lattato
Nessun effetto sulla gittata
cardiaca
Dobutamina
• Indicata dalla FDA per la
• Agente inotropo: aumenta la
Adrenalina
• La FDA ne indica l’uso nello
Il dosaggio non necessita della
rianimazione con liquidi prima
dell’uso (per le cause di shock
puramente anafilattiche)
Vasopressina
Da considerare nello shock settico refrattario all’espansione del
volume e alle catecolamine di
prima linea
Può diminuire il quantitativo
• Non è un farmaco di prima
necessario degli altri vasopressori
linea
• Inizio d’azione ritardato
• Il suo uso nello shock settico e
per l’arresto cardiaco è fuori
protocollo
gittata cardiaca diminuita e
l’insufficienza cardiaca
congestizia
• Meglio se usata quando ci
sono segni/sintomi di shock
senza ipotensione severa
(< 90 mmHg)
shock anafilattico
• La forma endovenosa è indicata dalla FDA per l’arresto
cardiaco
gittata cardiaca
• Buona per l’insufficienza
cardiaca congestizia senza
ipotensione
13
Può diminuire le resistenze
vascolari periferiche; può
provocare ipotensione. Potenziali
soluzioni: aggiungere la
dopamina o la noradrenalina per
aumentare le resistenza vascolari
periferiche o considerare il
passaggio a un’altra classe di
farmaci inotropi, come gli inibitori
della fosfodiesterasi (cioè
inamrinone e milrinone)
Aumentato rischio di aritmie e di
ischemia miocardica
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
per il trattamento della sepsi raccomandano l’uso
della noradrenalina o della dopamina come farmaci
vasopressori di prima linea, con una leggera propensione verso la noradrenalina per evitare tachicardia
sinusale e aritmie indesiderate.63-70 Se l’ipotensione è
associata con bradicardia relativa o è di origine principalmente cardiaca, allora la dopamina può essere il
vasopressore preferenziale. La dobutamina può essere aggiunta se è necessario il supporto cardiaco (ad
esempio il supporto inotropo) ma può peggiorare il
tono vascolare periferico e l’ipotensione. Se è necessario un supporto ulteriore nello scenario dello shock
cardiogenico, può essere necessario l’uso di un contropulsatore aortico.
L’infusione continua di vasopressina sta guadagnando consensi come aggiunta agli altri farmaci
vasopressori specificamente nella sepsi. È stato di-
vasopressori. Gli effetti emodinamici di questi farmaci derivano dalla loro differente affinità con i vari
recettori delle catecolamine endogene. L’azione del
farmaco può anche variare da paziente a paziente e
vari dosaggi dello stesso farmaco possono avere azioni differenti. Il medico deve essere attento a monitorare il paziente in terapia con questi farmaci. Il
miglioramento della perfusione globale degli organi
(determinato dal miglioramento clinico dei sintomi,
dalla diuresi, dalla pressione venosa centrale, dalla
clearance del lattato e dalla saturazione di ossigeno
dei tessuti) dovrebbe essere l’obiettivo principale
della terapia, piuttosto che il mero rialzo della pressione arteriosa. Le affinità recettoriali e le azioni di
questi farmaci sui vari parametri emodinamici sono
elencati nella Tabella 5.
Le attuali linee guida per la terapia intensiva e
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
mostrato che nei pazienti settici esiste una carenza
relativa di vasopressina, sebbene questo fenomeno
possa in effetti non essere presente fino alla 24esima48esima ora del decorso clinico.71-75 Malay et al.
hanno condotto uno studio in doppio cieco controllato con placebo su 10 pazienti in shock a cui sono stati
somministrati o vasopressina a base dosi o placebo,
oltre all’uso standard dei liquidi e di altri vasopressori o inotropi.57 I pazienti del braccio vasopressina
dello studio hanno avuto un aumento dell’indice cardiaco e della MAP che ha permesso la sospensione
degli altri vasopressori e inotropi in quell’ordine. La
MAP, l’indice cardiaco e le resistenze vascolari periferiche non sono stati influenzati statisticamente nel
gruppo placebo. Due dei cinque pazienti del braccio
placebo dello studio sono deceduti prima delle 24
ore, ma tutti i pazienti del braccio vasopressina sono
sopravvissuti oltre le 24 ore e sono stati in grado di
mantenere una MAP superiore a 70 mmHg soltanto
con l’infusione di vasopressina: Landry et al. hanno
studiato 19 pazienti con shock settico con vasodilatazione e 12 pazienti con shock cardiogenico.76 In 10
dei pazienti con stati di shock a basse resistenze
vascolari periferiche, la pressione arteriosa media è
aumentata da 92/52 a 146/66 mmHg; le resistenze
vascolari periferiche sono aumentate da 644 a 1187.
Sei pazienti cui veniva somministrata solamente
vasopressina a basse dosi in infusione hanno avuto
una ricaduta dell’ipotensione dopo la sospensione
della vasopressina e un miglioramento verso lo stato
di normotensione quando la vasopressina è stata
ripresa.
Quando un’infusione di vasopressina di 0,04
U/min è stata aggiunta al trattamento dello shock, la
reattività agli altri farmaci vasopressori è aumentata;
gli Autori hanno concluso che il ripristino di vasopressina permette la sospensione degli altri vasopressori.
L’uso acuto della vasopressina nel DEA è ancora controverso ma può essere preso in considerazione.
La fenilefrina è anche un vasopressore che agisce
in periferia ma i consensi al suo utilizzo sono limitati
e non è considerato un farmaco di prima linea. L’adrenalina ha la reputazione di poter peggiorare la perfusione degli organi vitali e non è un farmaco di prima
linea, benché essa rimanga il farmaco di scelta per il
trattamento dell’anafilassi. Un abstract presentato
recentemente da Annane al 36° Congresso di Critical
Care della Society of Critical Care Medicine paragona
l’adrenalina alla noradrenalina per il trattamento dell’ipotensione. Al contrario di quanto si pensa tradizionalmente, non è stata trovata alcuna differenza significativa negli esiti favorevoli o negli effetti avversi
dopo 28 giorni.
La cosiddetta “dose renale” della dopamina non
è più raccomandata poiché è stato dimostrato che non
migliora la funzione renale e probabilmente gli incrementi della diuresi sono dovuti alla condizione di aumentato flusso e non a effetti benefici specifici sul letto
renale.
Emergency Medicine Practice
Altri trattamenti aggiuntivi
Altri agenti farmacologici usati nella sepsi includono gli
steroidi a dosi stress e la proteina C attivata. Entrambi
sono raccomandati negli attuali protocolli della
sepsi.51,77 La consulenza e la cooperazione con la medicina di area critica faciliteranno l’uso di questi farmaci.
L’insufficienza surrenalica si trova in più della
metà dei pazienti in shock settico e viene definita
come la mancata risposta al test con 250 microgrammi
di corticotropina (il cortisolo aumenta meno di 9
µg/dl). Il cortisolo mantiene la sensibilità vascolare
alle catecolamine e aiuta ad attutire l’effetto delle tossine sul cuore.
Solo alcuni decenni fa, la somministrazione di
steroidi ad alte dosi era comunemente utilizzata nei
pazienti con shock settico. Ora si pensa che gli steroidi
a basse dosi aumentino la pressione arteriosa e diminuiscano la durata della shock. Tuttavia, la maggior
parte degli studi randomizzati controllati non indica
alcuna diminuzione delle percentuali di mortalità
dello shock settico nei pazienti a cui sono state somministrate dosi stress di steroidi.78 Detto questo, non è
neppure stata portata alla luce alcuna pericolosità. La
bassa dose di corticosteroidi raccomandata dalle linee
guida per il trattamento della sepsi è di 300 mg di idrocortisone.51 In uno studio di Kortgen et al., vi è stato un
significativo miglioramento del tasso di mortalità
quando è stato usato un protocollo della sepsi che
impiegava dosi ancora più basse di steroidi (150 mg di
idrocortisone).79 Al momento attuale, in base alle
migliori evidenze disponibili, l’idrocortisone, 150-300
mg, è indicato nei pazienti in presunto shock settico
che rimangono ipotesi malgrado l’adeguata somministrazione di liquidi e vasopressori. Nel DEA, l’uso del
desametasone invece dell’idrocortisone offre il vantaggio di non interferire con il test di stimolazione con
corticotropina dopo il ricovero.
Il ruolo della proteina C attivata (APC) (Xigris®)
nel trattamento dello shock settico è controverso. Questo composto ha proprietà antitrombotiche, pro-fibrinolitiche e antinfiammatorie. Uno studio multicentrico, randomizzato, controllato con placebo su più di
1600 pazienti ha dimostrato che i pazienti con shock
settico sottoposti al trattamento con la APC hanno
avuto una relativa riduzione del rischio di morte, ma
un aumento statisticamente significativo del sanguinamento.80 La APC è stata approvata dalla FDA per il
trattamento dei pazienti con sepsi grave, definita come
un APACHE score ≥ 25 o con disfunzione multi-organo refrattaria (calcolatore per l’APACHE score: http://
www.icumedicus.com/icu_scores/apacheIV.php [ultimo
accesso 9 giugno 2007])
Situazioni particolari del trattamento nel DEA
Anafilassi
L’anafilassi è un vero shock distributivo puro con
mediatori che causano il danneggiamento dei capillari
terminali e la conseguente perdita di liquidi nello spa-
14
Shock cardiogenico
Lo shock cardiogenico si manifesta acutamente quando il miocardio perde improvvisamente il 40% della
sua funzione nel cuore in precedenza normale o quando il cuore già malato perde una percentuale minore
nel tempo. I criteri clinici per la diagnosi dello shock
cardiogenico includono:
• pressione sistolica < 90 mmHg (più elevata se cronicamente iperteso);
• diuresi < 0,5 cc/kg/h;
• evidenze di disfunzione degli organi terminali che
si manifestano come insufficienza renale, confusione o ipoperfusione periferica;
• pressione di incuneamento capillare > 18;
• indice cardiaco < 1,8 l/min/m2.
I livelli del peptide natriuretico cerebrale (BNP)
sono spesso marcatamente elevati nell’ipotensione cardiogenica severa e l’aumento è correlato con la gravità
e con la prognosi, benché il trattamento nello scenario
del DEA si basi raramente su questi livelli.
Il trattamento è focalizzato sull’alleggerimento
dell’eccessivo carico idrico sul cuore sovraccarico e
sugli interventi emodinamici per incrementare la funzione di pompa del miocardio (sia farmacologicamente sia meccanicamente quando necessario). In un
paziente ipoteso, piccoli boli di liquidi (nell’ordine di
250-500 cc) sono accettabili quando la diagnosi è dubbia o per mantenere la perfusione come ponte per altri
interventi.
Quando è presente ipossia da insufficienza
respiratoria, l’intubazione endotracheale precoce è
un intervento chiave. L’ipotensione nello shock cardiogenico preclude l’uso dei mezzi standard per l’in-
Considerazioni sulle vie aeree e sul periodo
post-intubazione
15
L’intubazione precoce in un paziente critico è un fondamento dell’attività della medicina d’urgenza. Sebbene fornisca una protezione delle vie aeree, un supporto respiratorio e l’ossigenazione ematica, questa procedura può avere un effetto deleterio sulle pressioni
periferiche a causa della somministrazione di farmaci
e degli effetti collaterali della ventilazione a pressione
positiva. I pazienti precedentemente normotesi che
sono intubati possono in seguito sviluppare un’ipotensione.
Un ampio studio in un DEA metropolitano ha
associato l’ipotensione successiva al 29% degli 84
pazienti che avevano richiesto l’intubazione medica.81
Benché la mortalità non fosse aumentata, il 13% di questi pazienti ha richiesto farmaci vasopressori e un
paziente ha avuto un arresto cardiaco. Non sono state
riscontrate associazioni specifiche con i farmaci, ma la
BPCO ipercapnica e l’insufficienza respiratoria ipossiemica hanno dimostrato correlazioni statistiche. Queste
serie statistiche attribuiscono ai medici del DEA la
responsabilità di sorvegliare il verificarsi dell’ipoten-
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
sufficienza cardiaca congestizia (ad esempio il lasix e
i nitrati). Oltre ai suoi ovvi vantaggi respiratori, l’intubazione endotracheale ha dei vantaggi emodinamici distinti. La ventilazione a pressione positiva diminuisce il ritorno venoso intratoracico e il precarico.
Con la diminuzione delle dimensioni della camera
del ventricolo destro, l’espansione del ventricolo sinistro viene aumentata e di conseguenza aumenta la
funzione di pompa. La richiesta miocardica di ossigeno viene così diminuita. L’intubazione da sola può
migliorare le prestazioni cardiache fino al 30%. Gli
aspetti distintivi della ventilazione, come la pressione
positiva di fine espirazione (PEEP), mentre rimuovono il liquido dagli alveoli polmonari, possono anche
attenuare l’ipossia. Le pressioni intratoraciche positive derivanti da questi interventi possono peggiorare
l’ipossia.
Il supporto pressorio nello shock cardiogenico
può causare un dilemma nel trattamento. L’uso della
dopamina o della noradrenalina per mantenere le
pressioni periferiche può causare un pericoloso
incremento della frequenza cardiaca in un momento
in cui diminuire il carico di lavoro del miocardio è un
obiettivo fondamentale. La somministrazione di altri
farmaci vantaggiosi per la funzionalità cardiaca (ad
esempio i beta-bloccanti, gli ACE-inibitori, i diuretici) può peggiorare l’ipotensione. Gli inotropi (come
la dobutamina o gli inibitori della fosfodiesterasi
inamrinone e milrinone), usati per sostenere la funzione cardiaca, possono causare vasodilatazione
periferica e peggiorare anch’essi l’ipotensione. Può
essere necessaria un’associazione di vasopressori e
inotropi per trattare questi pazienti e per colmare
l’intervallo di tempo mentre viene iniziato il trattamento definitivo.
zio extravascolare. Questi mediatori sono responsabili
della vasodilatazione scoordinata incontrollata che si
osserva nell’anafilassi. Un paziente in collasso cardiovascolare in seguito a un’anafilassi veramente pericolosa per la vita può sequestrare l’equivalente del 50%
del volume ematico effettivo nello spazio extravascolare entro pochi minuti dell’esordio.
Il trattamento di una reazione allergica implica di
solito l’uso dei farmaci antistaminici e degli steroidi,
ma, nello scenario dello shock anafilattico, è necessaria
la somministrazione precoce dell’adrenalina (alla
diluizione di 1:1000 1 mg/ml). L’iniezione intramuscolare (0,2-0,5 ml) di questa soluzione nella coscia ogni
cinque minuti secondo necessità è la via di somministrazione preferenziale, ma può anche venire somministrata per via sottocutanea. Se il collasso circolatorio
persiste, si dovrebbe iniziare un’infusione di adrenalina a 1-4 µg/min. Se non è disponibile l’accesso ev e il
paziente è in fase terminale, l’adrenalina può essere
somministrata anche attraverso il tubo endotracheale a
una dose due volte superiore a quella ev (soluzione
1:10.000). Se la risposta iniziale all’adrenalina è transitoria, possono essere necessarie ripetute dosi a bolo o
può essere iniziata la già descritta infusione ev a 1-4
µg/min.
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
sione post-intubazione e di prendere le decisioni
appropriate per prevenirla.
L’ampia approvazione dei protocolli di intubazione a sequenza rapida (RSI) nel DEA ha considerevolmente facilitato il trattamento sicuro ed efficace
delle vie aeree. Il pericolo nei pazienti ipotesi è il possibile uso arbitrario di farmaci che possono peggiorare il loro stato emodinamico. Per esempio, l’induzione
con benzodiazepine, propofol o barbiturici può contribuire all’ipotensione e tali farmaci non sono raccomandati in questa popolazione di pazienti. Due utili
agenti d’induzione sono l’etomidate e la ketamina.
L’etomidate produce un importante effetto sedativoipnotico ma i suoi effetti sui parametri cardiaci e su
altri parametri emodinamici sono meno significativi
che con molti altri farmaci. Purtroppo, l’etomidate
sopprime il rilascio del cortisolo che può avere ripercussioni significative sui pazienti critici.82-84 La ketamina rappresenta un’opzione molto buona in questi
pazienti. In quanto agente dissociativo, si evitano gli
effetti depressori degli altri farmaci della RSI mentre
la sua attività adrenergica può aiutare il supporto
della PA. Sebbene le raccomandazioni attuali per l’intubazione sostengano l’utilizzo dell’etomidate più la
succinilcolina, è in corso un trial che confronta direttamente la morbilità associata all’utilizzo dell’etomidate contro la ketamina.85
Il trattamento post-intubazione è di importanza
critica nella rianimazione del paziente ipoteso. I
pazienti che siano parzialmente compensati possono
crollare precipitosamente durante questo periodo.
Questo perché l’intubazione può compromettere ulteriormente il precarico a causa delle elevate pressioni
intratoraciche associate alla ventilazione meccanica a
pressione positiva. La pressione positiva di fine espirazione (PEEP) può ulteriormente aumentare la pressione intratoracica e, nei pazienti con una malattia polmonare ostruttiva, l’“auto-PEEP” può salire fino a livelli
pericolosamente elevati. Se l’intrappolamento d’aria
diventa un problema, permettere ai polmoni di decomprimersi disconnettendo temporaneamente il ventilatore può avere come risultato un deciso miglioramento
della pressione arteriosa. Siate consapevoli che una
simile fisiopatologia si può verificare anche nelle
modalità di ventilazione non invasiva, come la ventilazione a pressione positiva continua nelle vie aeree e la
ventilazione bi-level.
interventi terapeutici come l’infusione di liquidi e di
catecolamine. La terapia si focalizza nel sospettare
un’endocrinopatia sottostante, che consiglia la richiesta di test diagnostici (per esempio, test funzionali del
cortisolo e della tiroxina), e/o nell’instaurare precocemente la terapia sostitutiva. La terapia dell’ipotiroidismo severo (coma mixedematoso) include non solo la
somministrazione dell’ormone tiroideo ma anche dosi
stress di glucocorticoidi. Siate attenti ai pazienti in
terapia steroidea cronica o che abbiano un’inibizione
surrenalica. In questi casi, la somministrazione esogena di dosi stress di steroidi è imperativa. Come menzionato in precedenza, i pazienti settici possono avere
un’insufficienza surrenalica relativa e devono altresì
ricevere dosi stress di steroidi.
Utilizzo nel Dipartimento d’Emergenza
dell’ecografia al letto
Il concetto di golden hour si fonda sulla forte evidenza
che la rapida identificazione delle condizioni pericolose per la vita e l’inizio precoce dei trattamenti specifici
e tempo-dipendenti sono critici per l’esito clinico del
paziente.3-5,13,14,23,51,86-98 Questo paragrafo esplora il
ruolo emergente dell’ecografia nella diagnosi e nel
trattamento dei pazienti con ipotensione.
Ecografia nel protocollo dell’ipotensione
L’ecografia è stata utilizzata dai medici per individuare situazioni di ridotto volume intravascolare, per
valutare la funzione cardiaca, per analizzare l’aorta e
per rilevare versamenti pleurici e peritoneali. In uno
studio, sono stati necessari in media sei minuti (± due
minuti) per eseguire un’insieme di applicazioni ecografiche mirate a determinare un’ipotensione inspiegabile.99 Infatti, l’utilizzazione dell’ecografia sta diventando più diffusa e si sta estendendo alle squadre di
risposta alle emergenze intra-ospedaliere e alle squadre che effettuano assistenza ACLS sul territorio.100
Differenziare se l’ipotensione con o senza i reperti obiettivi di edema polmonare sia causata da un problema cardiaco (di pompa) o non cardiaco è uno dei
passi principali verso uno scrupoloso adeguamento
del trattamento medico durante la rianimazione. Il
metodo invasivo dell’inserimento e del monitoraggio
di un catetere in arteria polmonare (CAP) è stato confrontato con le informazioni ottenute effettuando un’ecocardiografia non invasiva in uno studio del 1994 di
Kaul et al.101 Sono stati valutati quarantanove pazienti
consecutivi che si sono presentati con ipotensione e/o
edema polmonare. I dati precoci di un’ecocardiografia
transtoracica sono stati confrontati con quelli delle letture di un catetere polmonare acquisiti entro due ore
gli uni dagli altri. Sono stati utilizzati due o tre osservatori ciechi per ciascuno studio. Una completa concordanza tra le informazioni del CAP e dell’ecocardiografia è stata ritrovata in 36 (86%) dei 42 pazienti. Era
presente una totale concordanza nei pazienti esclusivamente con ipotensione e nel 90% dei 20 pazienti uni-
Endocrinopatie
Le endocrinopatie possono avere un intenso effetto sia
sull’insorgenza rapida dell’ipotensione sia sul suo trattamento quando questa si verifica. La tiroxina e il cortisolo giocano ruoli importanti nel regolare il livello
del metabolismo corporeo basale. A livello vascolare,
nei pazienti ipotesi, ciò si manifesta con un’incapacità
del muscolo liscio vascolare a rispondere a stress improvvisi, producendo un collasso cardiovascolare precoce. Il problema persiste durante la terapia poiché
questi pazienti dimostrano risposte insufficienti agli
Emergency Medicine Practice
16
presenti 80 controlli, 65 pazienti con patologia documentata del cuore destro e 30 pazienti con patologia
cardiaca ma senza anormalità del cuore destro.107 I
pazienti con anormalità/patologie del cuore destro
avevano diametri della VCI mediamente maggiori e
una collassabilità respiratoria decisamente inferiore
rispetto ai soggetti normali o a quelli con patologie
cardiache senza coinvolgimento del cuore destro.
Nonostante 30 pazienti fossero in fibrillazione atriale,
gli Autori non hanno trovato una correlazione delle
dimensioni e della dinamica della VCI con il sesso, l’area della superficie corporea, l’età e il ritmo cardiaco
del paziente. Il diametro della VCI era utile nell’ulteriore stratificazione delle misurazioni della PVC. La
combinazione di un diametro piccolo e di un collasso
maggiore ha confermato una PVC bassa. La combinazione di un diametro della VCI maggiore di 2,5 cm e
un indice cavale molto ridotto (quasi nessuna variazione respiratoria) è definita pletora della VCI. In questo studio la pletora della VCI è stata associata con
misurazioni della PVC superiori a 15 mmHg (Figure
3, 4 e 5).
Le pressioni atriali destre elevate, determinate
dai metodi invasivi, si associano a una prognosi scarsa nei pazienti con ipertensione polmonare, insufficienza cardiaca congestizia, cardiopatia congenita e
trapianto cardiaco. I reperti ecografici di pletora della
VCI sono stati altresì associati a una ridotta sopravvivenza in uno studio di 4385 pazienti maschi stabili in
regime ambulatoriale. È stato stabilito che questi sono
importanti reperti prognostici nella percentuale di
sopravvivenza dei pazienti a un anno ma meno nella
percentuale di sopravvivenza a 90 giorni. Questo era
indipendente dalla funzione ventricolare, dall’anamnesi di insufficienza cardiaca, da altre patologie e
dalle misurazioni delle pressioni in arteria polmonare.108 Rimane da stabilire l’impatto prognostico della
pletora della VCI nel paziente instabile con ipotensioFigura 3. VCI dilatata con variazione respiratoria
del diametro pressoché assente: pletora della VCI.
Figura 2. (A) Schema della proiezione longitudinale
sottocostale della vena cava inferiore. (B) Dimensione della VCI e correlazione delle variazioni respiratorie con le misurazioni della pressione venosa
centrale.
Sottocostale
(longitudinale)
A
VCI (cm)
Diaframma
Cuore
Fegato
B
Collasso
respiratorio
durante
l’inspirazione (%)
< 1,5 cm
> 50%
1,5-2,5 cm > 50%
1,5-2,5 cm < 50%
VCI > 2,5 cm
PVC (mmHg)
0-5 mmHg
5-10 mmHg
10-15 mmHg
Si noti il versamento pericardico (freccia corta) tra la parete dell’atrio destro e il
diaframma. Le vene epatiche (diagonali) che si diramano dalla VCI prossimale
sono dilatate
Minima variazione 15-20 mmHg
respiratoria
17
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
camente con edema polmonare. Il tempo impiegato
per il posizionamento del catetere in arteria polmonare era di 63 ± 45 minuti in confronto ai 19 ± 7 minuti
per un’ecocardiografia bidimensionale completa.
Gli studi nei pazienti ipotesi sostengono il ruolo
diagnostico dell’esame ecografico della vena cava inferiore (VCI) come indicatore dello stato di volume. Uno
studio prospettico di 50 pazienti condotto da Adler et
al. ha identificato un’ipovolemia, un’insufficienza cardiaca destra misconosciuta e una condizione di ipervolemia sulla base delle proiezioni ecografiche longitudinali della VCI.102 Osservando il diametro anteroposteriore della VCI e la variazione respiratoria delle
dimensioni, si può stimare in modo attendibile la pressione venosa centrale. Un altro studio ha esaminato la
correlazione tra i diametri della VCI inferiore prossimale misurati ecograficamente, le variazioni delle
dimensioni della VCI durante il ciclo respiratorio
(indice cavale) e le pressioni venose centrali (PVC)
misurate in modo invasivo. Questo studio ha dimostrato una correlazione definitiva tra l’indice cavale e
la pressione venosa centrale.103 Un collasso respiratorio della VCI maggiore del 50% rappresenta un indice
cavale superiore a 0,5. L’89% dei pazienti con un indice cavale superiore a 0,5 aveva una pressione in atrio
destro maggiore di 10 mmHg. L’86% dei pazienti con
un indice cavale inferiore al 50% aveva una pressione
in atrio destro minore di 10 mmHg (Figura 2).
Utilizzando un campione di convenienza, Randazzo et al. hanno trovato che nonostante un considerevole accordo tra medici sulla frazione d’eiezione (FE)
del ventricolo sinistro, nei pazienti con livelli di PVC
ridotti l’accordo era scarso mentre nel gruppo con PVC
elevate era notevole.104 In questo studio, la PVC era
annotata e poi il reperto era confrontato con ecocardiografie ufficiali eseguite entro poche ore. Bendjelid
et al. hanno studiato 20 pazienti ventilati meccanicamente sottoposti a misurazioni ecografiche della VCI
acquisite mentre contemporaneamente veniva stimata
la pressione atriale destra (RAP); il diametro della VCI
a fine espirazione aveva una correlazione lineare con
le letture della RAP.105,106
Moreno et al. hanno studiato il diametro della
VCI e le variazioni respiratorie in 175 soggetti; erano
Barbier et al. hanno condotto uno studio prospettico di 23 pazienti ventilati meccanicamente in una
unità di terapia intensiva con un’insufficienza circolatoria correlata alla sepsi.109 La presenza delle variazioni respiratorie nel diametro della VCI in condizioni
basali e dopo i boli di liquidi ha dimostrato che la
distensibilità della VCI potrebbe distinguere i pazienti
responsivi ai liquidi da quelli non responsivi con una
sensibilità del 90% e una specificità del 90%.
La stima visiva della FE del ventricolo sinistro
può essere riferita qualitativamente e quantitativamente come aumentata, normale o ridotta (lievemente,
moderatamente, gravemente) (Tabella 6). Una valutazione della FE del ventricolo sinistro nel DEA è stata
dimostrata utile in un certo numero di studi .4,99,104
L’identificazione del versamento pericardico si
effettua meglio con l’ecocardiografia che fornisce informazioni dinamiche in tempo reale sulla motilità e la
fisiologia miocardica. La maggior parte dei versamenti
pericardici non è raccolta in sede atipica. La velocità di
accumulo del liquido, le dimensioni della raccolta di
liquido e la compliance del sacco pericardico definiranno congiuntamente quando la pressione intrapericardica (IPP) supera la pressione della parete dell’atrio
destro. L’accumulo rapido di liquido pericardico porterà a un tamponamento con un volume di liquido
inferiore (per esempio, taglio di pugnale) in confronto
al lento accumulo nell’arco di mesi (per esempio, versamenti uremici). Quando la IPP supera la pressione in
atrio destro, essa provocherà un’invaginazione della
parete dell’atrio destro o, ancor peggio, un collasso
della parete del ventricolo destro durante la diastole
(fisiologia del tamponamento) (Figura 6 e 7).
In sintesi, alcune delle raccomandazioni di Classe I
per l’ecocardiografia dell’American College of Cardiology/American Heart Association Task Force on Practice Guidelines for the Clinical Application Echocardiography concernono i pazienti seguiti nel DEA; si veda la Tabella 7.
Queste indicazioni includono, ma non sono limitate a:
• pazienti con ipotensione inspiegabile;
• pazienti con dispnea e segni clinici di elevazione
della pressione venosa centrale quando un’eziologia cardiaca sia possibile o quando una misurazione della pressione venosa centrale non sia possibile o interpretabile con attendibilità, specialmente
quando si sospetti clinicamente una patologia cardiaca;
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
Figura 4. Ipovolemia. VCI con diametro piccolo e
ampie variazioni respiratorie.
Proiezione sottocostale longitudinale della VCI. La VCI prossimale era al massimo di 0,5 cm con un completo collasso durante gli sforzi espiratori del paziente.
L’indice cavale è suggestivo per ridotte pressioni atriali destre o venose centrali.
Si può osservare il versamento pericardico tra il diaframma e le contrazioni del
miocardio atriale.
Effettuate le misurazioni a circa 4 cm dalla VCI/giuntura diaframmatica. Il fegato
serve da finestra acustica per la VCI. Distinguete la VCI dall’aorta adiacente. Una
pressione costante del trasduttore è normalmente necessaria per rimuovere l’interferenza del gas intestinale nella proiezione dell’aorta addominale ma è importante ridurre la pressione del trasduttore sull’addome per evitare la compressione
della VCI
ne. La pletora della VCI dovrebbe spronare a una
rapida ricerca della causa di una pressione atriale
destra elevata nel paziente ipoteso.
Oltre all’impiego del diametro ecografico della
VCI come determinante dello stato volemico, è stato
dimostrato il suo contributo nel giudicare la risposta
alla terapia.
Figura 5. Caratteristiche cardiache dell’ipovolemia:
proiezione sottocostale quattro camere.
Tabella 6. Stima della frazione d’eiezione del ventricolo sinistro.
Ecocardiografia
È presente un piccolo versamento pericardico (frecce), ma è clinicamente significativo il reperto ecografico della difficoltà nel distinguere le quattro camere cardiache
poiché le superfici endocardiche sono molto ravvicinate. Questo è causato da un’ipovolemia grave. Il cuore è riuscito a diventare iperdinamico ma gli scarsi volumi di
riempimento hanno causato una gittata cardiaca molto ridotta. La perdita di liquidi
può essere evidente da indizi anamnestici o da segni obiettivi, ma un’ulteriore ecografia mirata può essere utilizzata per determinare se ci siano significative raccolte
liquide interne nello spazio toracico, peritoneale o pericardico o potenziali fonti di
ipovolemia cardiovascolare (come il reperto di un aneurisma dell’aorta addominale
o la rottura di una gravidanza ectopica tubarica). In questo caso, il paziente aveva
un grave sanguinamento gastrointestinale connesso alla tossicità da warfarin
Emergency Medicine Practice
Cuore ipercinetico ben
riempito
Cuore ipocinetico ben
riempito
Cuore ipercinetico
scarsamente riempito
18
Diagnosi clinica
Shock distributivo: sepsi,
anafilassi
Shock cardiogenico:
sepsi, sindrome tossicologica
metabolica/ischemica
Ipovolemia: emorragia,
disidratazione
Figura 6. Proiezione apicale del cuore con un versamento e un tamponamento.
Tabella 7. Domande cliniche chiave affrontate dall’ecografia nel paziente gravemente ipoteso.
Qual è la dimensione del VS?
È presente un collasso
della VCI?
È presente un AAA?
È presente liquido peritoneale?
Risposta
Sì o No
Sì o No
Normale o dilatato
Iperdinamica/normale/
moderatamente ridotta/
severamente ridotta
Dilatato/normale/piccolo
Sì o No
Sì o No
Sì o No
do i sintomi di presentazione includono un improvviso
dolore addominale e un’irradiazione al dorso, la sincope o altri segni di shock clinico. La presenza di un aneurisma aortico è rilevata in modo attendibile dall’ecografia (Figure 8 e 9). Studi non risolutivi sono possibili a
causa dell’interferenza dei gas intestinali. L’ecografista
può applicare una pressione decisa e costante sull’addome per dislocare il gas intestinale così che si possa
visualizzare l’aorta che è situata posteriormente. La presenza di una rottura o di uno spandimento aortico non
è individuabile dall’ecografia a meno che la rottura non
avvenga nella cavità peritoneale, liberando liquido libero. La maggior parte degli episodi di rottura addominale si verifica nel retroperitoneo; questo può contenere e
ridurre la velocità dello spandimento di sangue. L’ecografia al letto non identifica il sito della rottura.
Questa immagine è stata scattata in fase sistolica. È presente inoltre una riduzione moderata della frazione d’eiezione del ventricolo sinistro (determinata tramite
una valutazione visiva). Questo paziente ha due cause per il suo stato ipotensivo
sintomatico: un versamento con tamponamento e una ridotta contrattilità miocardica. Sebbene il precarico del lato destro sia compromesso dal versamento pericardico, è improbabile che l’ipotensione sia dovuta all’ipovolemia (il volume ventricolare sembra adeguato). Uno sguardo alla proiezione sottocostale asse-lungo
può fornire più informazioni specifiche del paziente; possono esserci un diametro
ridotto della VCI e variazioni respiratorie esagerate oppure un diametro elevato
della VCI e scarse variazioni respiratorie
• pazienti con il sospetto di versamento, tamponamento e/o di una fisiologia costrittiva;
• la valutazione delle dimensioni e della funzione del
ventricolo sinistro con cardiomiopatia sospetta o il
sospetto di insufficienza cardiaca.
Ecografia al letto applicata nel DEA
Dissezioni dell’aorta
L’area più letale di dissezione aortica è l’aorta toracica.
Il coinvolgimento dell’aorta toracica ascendente può
Aneurisma dell’aorta addominale (AAA)
Quando è presente ipotensione nei pazienti in fase preoperatoria con una rottura dell’AAA, di solito la mortalità è elevata.110 Il sospetto di AAA è accresciuto quan-
Figura 8. Liquido libero nell’addome.
Figura 7. Versamento pericardico di dimensioni
moderate.
In questo paziente, il liquido libero è stato rilevato tra il rene e il fegato cirrotico
rimpicciolito. Questa immagine è stata eseguita utilizzando gli stessi principi della
Focused Applications of Sonography in Trauma. In questa situazione apparentemente non traumatica, il paziente ipoteso – con una storia nota di ascite lieve –
aveva un addome più disteso, dolente e dolorabile (dati nuovi). In seguito a ulteriori domande, il paziente aveva riferito di essere caduto tre giorni prima. L’emoperitoneo era la causa della sua ipotensione
Notare il liquido nel sacco pericardico che si assottiglia nel solco atrioventricolare. Il cuore ha una lieve oscillazione all’interno del sacco pericardico che non si è
manifestata con un’alternanza elettrica nell’elettrocardiogramma. Non è presente
una fisiologia del tamponamento
19
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
Domanda clinica ecografia
È presente liquido pericardico?
Se sì, è tamponante?
Qual è la dimensione del VD?
Com’è la funzione del VS?
variabilità antero-posteriore crea degli impedimenti
per l’esecuzione di un esame completo. L’approccio
transtoracico parasternale offre un’immagine molto
limitata di una porzione dell’aorta discendente; le
immagini del tratto di efflusso ventricolare sinistro
forniscono indicazioni degli 1-2 cm più prossimali
della porzione dell’AT ascendente; l’immagine apicale
a due camere può mostrare un’immagine longitudinale di una piccola porzione della AT discendente; le
immagini soprasternali mostrano l’arco aortico. L’ecocardiografia transesofagea è la modalità preferita per
visualizzare l’aorta toracica.
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
Figura 9. Aneurisma dell’aorta addominale con
trombosi.
Embolia polmonare (EP): ruolo limitato
all’embolia polmonare massiva (EPM)
Nel paziente in shock, la valutazione ecocardiografica
transtoracica al letto è utilizzata per determinare se
sono presenti segni di disfunzione (strain) ventricolare destra; le cause più probabili sono l’embolia polmonare massiva o l’infarto ventricolare destro.111-113
La dilatazione della cavità ventricolare destra è l’iniziale compenso del cuore destro alla grave occlusione
delle arterie polmonari. Il ventricolo destro è disteso e
anche ipocinetico. L’apice della superficie interna del
ventricolo destro è usualmente acuto, ma con la
disfunzione acuta del ventricolo destro diventa ottuso. Il ventricolo destro è di solito il 60% del diametro
del ventricolo sinistro quando è misurato in diastole.
Quando il rapporto tra il diametro del ventricolo
destro e il diametro del ventricolo sinistro si avvicina
o supera 1,0, la certezza diagnostica di disfunzione del
ventricolo destro è aumentata. Il segno di McConnell
(ipocinesia della parete libera del ventricolo destro
con risparmio del segmento apicale) è stato impiegato
come caratteristica ecografica relativamente peculiare
di una significativa EP (Figura 11).
L’incremento delle pressioni nel ventricolo
destro può superare quello del ventricolo sinistro, provocando un bulge della parete settale nella cavità del
ventricolo sinistro. Il sovraccarico pressorio vero è
distinto dal sovraccarico di volume del ventricolo
destro tramite lo studio della distorsione settale durante la sistole e la diastole. Nel sovraccarico di volume
del ventricolo destro, la parete del setto si appiattisce
durante la diastole, ma la maggiore pressione sistolica
del ventricolo sinistro riporta la parete settale al suo
aspetto normale. Nel sovraccarico di pressione del
ventricolo destro, la parete del setto interventricolare
può essere appiattita o spinta nel ventricolo sinistro
durante la diastole. Durante la sistole, il setto interventricolare rimane piatto o deviato nel ventricolo sinistro. Un elevato stress di parete del ventricolo destro
successivamente compromette il flusso sanguigno
coronarico diretto alla superficie interna del miocardio
e all’endocardio. Il danno ischemico miocardico del
ventricolo destro pregiudica ulteriormente la gittata
del ventricolo destro già ridotta. Il riempimento diastolico del ventricolo sinistro è ridotto dal bulging
verso sinistra della parete settale del ventricolo. Il
L’anamnesi di questo paziente era considerevole per l’insorgenza improvvisa di
dolore addominale, diaforesi e lipotimia. L’ecocardiografia aveva rivelato un cuore
parzialmente vuoto, una contrazione cardiaca normale e l’assenza di versamento pericardico. Era molto probabile che lo shock ipovolemico fosse l’eziologia ed
è stata ricercata l’evidenza di un’emorragia. Le cavità pleuriche e peritoneale non
hanno evidenziato liquido libero. L’ecografia addominale ha diagnosticato un
aneurisma dell’aorta addominale. Una formazione trombotica era adesa alle pareti interne anteriore e laterale. Dopo la comunicazione urgente al chirurgo vascolare, il paziente era in camera operatoria 12 minuti dopo l’arrivo nel DEA
estendersi attraverso l’avventizia con un rapido accumulo di sangue nel sacco pericardico e un precoce
tamponamento. La dilatazione della radice aortica può
provocare un’insufficienza aortica severa. Le dissezioni che coinvolgono l’aorta addominale o le arterie iliache prossimali sono più facili da riconoscere. I flaps
intimali sono riconosciuti come righe ecogeniche che si
muovono indipendentemente dalle pulsazioni della
parete aortica (Figura 10).
L’aorta toracica (AT) presenta una difficile sfida
nell’esecuzione di una valutazione ecografica accurata.
La presenza dei polmoni, delle coste e della naturale
Figura 10. Immagine trasversale dell’aorta addominale.
Il diametro dell’aorta addominale in questo paziente è meno di 2 cm. Non ci sono
trombi, ma notate il sottile flap intimale ecogenico che si estende dalle ore 12 alle
ore 6. Un tale reperto deve esortare il medico a uno studio per immagini dell’aorta con l’ecocardiografia e/o la TC per verificare se è necessario un intervento
urgente del chirurgo cardiotoracico
Emergency Medicine Practice
20
VD
VS
Figura 12. Accesso vascolare con guida ecografica.
Questa immagine mostra le dimensioni del ventricolo destro (freccia) confrontate
con il ventricolo sinistro (misurate al livello dove i lembi mitralici si toccano) durante la sistole. Il ventricolo destro è dilatato e più grande del ventricolo sinistro. La
parete libera del ventricolo destro si muove appena mentre il ventricolo sinistro si
contrae; la riduzione del diametro e del volume telesistolico ventricolare dimostra
una buona performance del ventricolo sinistro. L’ipocinesia del ventricolo destro
è causata dagli aumenti pressori della porzione destra e/o da un infarto ventricolare destro. Sebbene non sia stata diagnosticata in modo definitivo un’embolia
polmonare, la disfunzione acuta del ventricolo destro senza i segni di una preesistente disfunzione del cuore destro o sinistro è causata da ben poche patologie.
Per gentile concessione di Sarah Stahmer, MD
volume ridotto di un sangue già scarsamente ossigenato determina una diminuzione della perfusione e
del trasporto di ossigeno ai diversi organi.
La disfunzione del ventricolo destro dell’ecocardiografia non è specifica per l’EP in quanto si può reperire nell’ipertensione polmonare primitiva, nell’infarto
del ventricolo destro, nell’esacerbazione acuta della
BPCO e in alcune cardiomiopatie. Inoltre, la disfunzione del ventricolo destro è stata segnalata dall’ecocardiografia nel 40% dei pazienti con EP ma senza stabilità
emodinamica significativa. Il 20% dei casi di EP con
conferma diagnostica aveva reperti ecocardiografici
normali. La dilatazione e l’ipocinesia ecografiche del
ventricolo destro in un paziente instabile suggeriscono
l’EP e consigliano la necessità di uno studio definitivo.114,115 L’esecuzione di un’ecografia al letto può essere
difficile nei pazienti obesi, con polmoni iperdistesi e in
quelli immobili o con supporto ventilatorio meccanico.
L’ipotensione che risulta da un’embolia polmonare è usualmente responsiva agli incrementi del precarico e all’impiego dei vasopressori per aumentare la
perfusione coronarica del ventricolo destro. Il miglior
trattamento si realizza con una riduzione dell’occlusione dell’arteria polmonare tramite la trombolisi relativa, la prevenzione di ulteriori eventi tromboembolici
con l’eparina e più efficacemente con l’utilizzo di farmaci trombolitici o con la tromboendoarteriectomia
polmonare.
Una sonda con fodera sterile e il gel permettono una guida ecografica diretta dell’accesso vascolare e dell’incannulamento. La proiezione asse corto dei vasi bersaglio permette il posizionamento dell’ago. Un’altra opzione è l’approccio con
asse lungo. L’accesso vascolare con guida ecografica può essere utilizzato anche
per l’incannulamento venoso periferico, per il prelievo di sangue arterioso e venoso e per l’inserzione e il posizionamento del catetere di un pacemaker transvenoso.
Figura 13. Immagine trasversale della vena giugulare interna.
Accesso vascolare
Studi controllati, randomizzati e ben progettati hanno
confrontato l’incannulamento con guida ecografica
agli accessi vascolari tradizionali basati sui punti di
repere anatomici.116 L’accesso vascolare è più difficile
In questa proiezione trasversale della vena giugulare interna (e della carotide proprio dietro a essa) la faccia anteriore della vena giugulare interna è frastagliata.
Gli artefatti da riverbero, causati dall’ago metallico che incrocia il fascio di ultrasuoni, smorzano lo schermo del monitor. Per gentile concessione di Resa Lewiss,
MD, RDMS
21
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
in particolare nel paziente ipoteso o in arresto cardiaco.117 Le pulsazioni arteriose possono essere ormai
troppo deboli per fornire una guida. Inoltre, le relazioni anatomiche tra le vene femorali e del collo possono
variare creando la possibilità di errori. I tentativi prolungati e ripetuti, lo sviluppo di complicanze e l’incapacità di reperire un accesso ritarderanno la somministrazione di farmaci e di liquidi la cui efficacia varia
con il tempo. L’accesso vascolare periferico con guida
ecografica può essere migliore e più sicuro dell’incannulamento venoso centrale, specialmente nei pazienti
con coagulopatie dove la compressione dei vasi può
essere di importanza critica (Figure 12 e 13).
Figura 11. Dilatazione del ventricolo destro.
ventricolo sinistro diverse ore dopo, specialmente se il
paziente ha una cardiopatia preesistente. La disfunzione del ventricolo destro può essere altresì presente
in almeno un terzo dei pazienti con sepsi. Il monitoraggio continuo della funzione del ventricolo destro è
estremamente utile per la valutazione della funzione
cardiorespiratoria e la risposta ai trattamenti e agli
interventi.
Le misurazioni delle pressioni di riempimento
cardiaco e delle pressioni di occlusione dell’arteria
polmonare sono generalmente utilizzate in un
ambiente di terapia più intensiva e richiedono procedure altamente invasive (ad esempio, misurazioni
della pressione venosa centrale e cateterizzazione del
cuore destro). Con misurazioni normali della PVC tra
6 e 12 cm H2O, le misurazioni basse o elevate possono
aiutare a differenziare tra gli stati ipovolemici, l’insuf-
Controversie/Avanguardia
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
Monitoraggio emodinamico
La letteratura inerente alla rianimazione è indirizzata
verso un trattamento precoce energico come strategia
per modificare gli esiti dei pazienti con ipotensione
patologica. Da questa consapevolezza è scaturita una
pressione accresciuta a iniziare la terapia nel DEA e a
fornire un monitoraggio accurato. I dati emodinamici
stabili non predicono in modo accurato la risposta del
paziente alla somministrazione di liquidi o il loro
reale miglioramento clinico.118,119 Per esempio, sebbene la maggior parte dei pazienti con la sepsi sia identificata in uno stato iperdinamico, questa può essere
una risposta compensatoria precoce.99 Il paziente con
shock settico e un ventricolo sinistro iperdinamico
nell’ecografia al letto può avere una disfunzione del
Trabocchetti nella gestione del rischio per l’ipotensione
La pressione arteriosa è un parametro singolo e imperfetto nella stima del volume ematico e dello stato circolatorio del paziente. Possono essere necessari
diversi strumenti per stabilire la perfusione tessutale e
i cambiamenti nella gittata cardiaca. In alcuni pazienti
si verificano un miglioramento della pressione arteriosa, una normalizzazione della frequenza del polso e la
risoluzione delle vertigini posturali dopo la somministrazione di liquidi per una patologia diarroica autolimitantesi. Un altro paziente può avere un miglioramento
della pressione arteriosa fino a 120/80 ma sentirsi
ancora debole e dispnoico perché la FE del ventricolo
sinistro è pari al 20%, o il versamento pericardico non
è stato diagnosticato, o il debito di ossigeno tessutale
rimane aperto.
7. Permettere che esami lenti guidino il trattamento.
Non aspettate il risultato della creatinina e del D-dimero per chiedere la TC; non aspettate la radiografia del
torace per vedere se il mediastino è allargato o se il
cuore è ingrandito.
1. Presumere che un paziente letargico, dal colorito
cinereo, non sia ipoteso perché ha una buona pressione arteriosa di 120/80 mmHg.
Trattare i numeri invece del paziente può indurvi a non
notare lo stato ipotensivo. Trattate il paziente; questo
paziente è ipoteso. La pressione arteriosa è ben al di
sotto dei valori di base e lui adesso ha un aspetto terribile. La situazione potrebbe peggiorare. La disfunzione cardiaca e l’ischemia tessutale possono persistere
nonostante la normalizzazione della pressione arteriosa, della frequenza cardiaca e della PVC.
2. Valutazioni diagnostiche inadeguate dell’eziologia
sottostante.
Stabilire un adeguato output urinario con boli di liquidi
non fermerà il sanguinamento di un’ulcera gastrica o di
un’aorta rotta. La prescrizione di antibiotici per l’ipertermia non sarà efficace se una colecisti gangrenosa
non è diagnosticata.
3. Carico di liquidi inadeguato.
Ricercate i segni di una PVC ridotta, valutate l’output
urinario e monitorizzate la risposta della gittata cardiaca alla somministrazione di liquidi. La perfusione tessutale è il vostro obiettivo e la gittata cardiaca è di solito il punto cardine per raggiungerlo. Un cuore iperdinamico sta cercando di compensare un volume ventricolare diminuito.
8. Scartare la possibilità dell’ipotensione ortostatica
come causa principale nel paziente anziano con misurazioni elevate di pressione in posizione supina.
9. Ignorare l’utilizzo dell’ecografia al letto nella riani-
mazione dell’ipotensione.
L’impiego automatico di liquidi, poi di vasopressori e di
agenti inotropi potrebbe non essere utile e potrebbe
peggiorare alcuni processi clinici. L’ipotensione non è
una malattia e nemmeno una sindrome che debba
essere curata. È il segno che qualcosa sta andando
storto. Voi dovete solo riuscire a capirlo velocemente e
attentamente. L’ecografia mirata all’obiettivo individua
in modo accurato molti problemi clinici pericolosi e
tempo-dipendenti.
4. Ritardare l’assistenza ventilatoria.
Il miglioramento della ventilazione e del trasporto di
ossigeno ai polmoni e in definitiva agli organi richiede un
minor impegno al cuore e riduce il debito di ossigeno.
5. Una rianimazione troppo energica senza tenere in
considerazione la volontà del paziente o dei familiari.
Un programma terapeutico rispettoso ed economicamente efficace potrebbe dipendere dall’acquisizione di
questi importanti elementi di informazione.
10. Non riesaminare i profili emodinamici.
La funzione del ventricolo destro e sinistro e le condizioni di precarico possono cambiare anche quando
avete fatto le cose giuste.p
6. Interrompere la monitorizzazione dopo aver rag-
giunto una “buona pressione arteriosa”.
Emergency Medicine Practice
22
raggio invasivo è severamente limitata dal flusso di
pazienti, dall’enorme quantità di tempo della procedura e dai problemi del personale; perciò non è raccomandata.
Fortunatamente, alcune tecniche non invasive si
dimostrano promettenti; essendo subito disponibili,
queste tecniche consentiranno al medico d’urgenza di
somministrare più facilmente un trattamento diretto
all’obiettivo. I monitor della bioimpedenza per la gittata cardiaca, l’ossimetria transcutanea e la capnometria per la perfusione tessutale insieme alle misurazioni della pulsossimetria e della pressione arteriosa
hanno dimostrato di essere accurati quando si confrontano alle stesse informazioni che tipicamente si
acquisiscono tramite il catetere nel cuore destro.8,123-125
Shoemaker et al. hanno studiato l’impiego di
metodi non invasivi in 151 pazienti gravemente malati
che si avvalevano del monitoraggio continuo di alcuni
parametri di scambio cardiopolmonare e di perfusione
tessutale. L’indice cardiaco e la perfusione tessutale
misurati in questo modo erano significativamente più
alti e ben oltre i livelli “ottimali” (così come definiti nello
studio) nei sopravvissuti in confronto ai non sopravvissuti.126
Uno studio di 680 pazienti critici ha fornito un
ulteriore sostegno all’utilizzo più diffuso e più precoce
del monitoraggio emodinamico non invasivo. I nuovi
metodi di bioimpedenza per la misurazione della gittata cardiaca associati alla pressione arteriosa, la pul-
Punti chiave per l’ipotensione
6. Ripetete i profili emodinamici regolarmente, in risposta
1. È necessario utilizzare/acquisire gli strumenti al letto
del paziente che stimano in modo non invasivo e accurato la gittata cardiaca, la PVC e l’ossigenazione tessutale come parte della rianimazione nel paziente ipoteso. L’ecografia è la modalità ideale, sono necessari
solo pochi minuti per acquisire informazioni cruciali
sulla funzione cardiaca e l’integrità dei vasi principali.
Essa permette anche un accesso sicuro e veloce per
la somministrazione dei farmaci e una guida alle procedure invasive.
ai cambiamenti, specialmente i deterioramenti, e dopo
l’attuazione di interventi terapeutici importanti (inclusi i
boli di liquidi).
7. Scoprire la fonte del sanguinamento o dell’infezione è
il primo passo del trattamento:
a. toracico: considerate un drenaggio toracico, un tamponamento endobronchiale, un coinvolgimento della
radiologia interventistica per l’identificazione, l’embolizzazione dei vasi ecc., e l’intervento chirurgico
se è indicata la lobectomia;
b. gastrointestinale: considerate il tamponamento
endoscopico delle varici;
c. considerate la chirurgia per la rottura aortica, la rottura splenica e il sanguinamento massivo del colon;
d. eliminate le predisposizioni al sanguinamento.
2. Considerate come “bandiera rossa” i casi in cui i pazienti hanno episodi pre-ospedalieri di ipotensione.
3. Il vostro principale obiettivo è quello di migliorare l’ossigenazione tessutale multi-organo. Controllate i segni
di un debito di ossigeno: ipossia, acidosi metabolica,
deficit d’ossigeno transcutaneo e livelli elevati di acido
lattico. Il livello di emoglobina può richiedere un supplemento se inadeguato.
8. La somministrazione di ossigeno nel paziente critico
con ipotensione spesso richiede l’intubazione. Utilizzate farmaci come l’etomidate e il fentanyl che non causano un deterioramento dell’emodinamica. Considerate la ketamina per migliorare la pressione sistolica.
Somministrate attentamente gli agenti di induzione
(prevedete di ridurre la dose) in qualsiasi paziente con
un profilo emodinamico delicato.p
4. I pazienti con ipotensione di solito non rientrano soltanto in una categoria eziologica di ipotensione o di
shock. Perciò, il trattamento è diversificato.
5. Il tempo è essenziale. L’ipotensione è un reperto tardivo e migliorarla non significa che abbiate corretto la
condizione di disfunzione d’organo che si è instaurata.
23
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
ficienza cardiaca, le eziologie ostruttive e/o gli stati
ipervolemici.
La cateterizzazione del cuore destro (RHC) e i
cateteri in arteria polmonare (PAC) sono più complicati e sono utilizzati per le misurazioni delle pressioni
occlusive. Con questa modalità si possono acquisire
ulteriori dati, specialmente quando si determina se l’insufficienza di pompa coinvolge principalmente il cuore
sinistro (ad esempio, insufficienza cardiaca congestizia
scompensata) o il cuore destro (ad esempio, infarto
miocardico del ventricolo destro o un’altra patologia
ostruttiva). Una metanalisi di numerosi trials controllati, randomizzati, ha dimostrato che l’impiego precoce
(profilattico) della terapia PAC-guidata, finalizzata
alla perfusione tessutale, ha dato come risultato un
miglioramento dell’esito dei pazienti.120 Altri studi
controllati, randomizzati nella metanalisi, tuttavia,
hanno dimostrato che non ci sono stati miglioramenti
degli esiti quando la terapia PAC-guidata è stata
impiegata nei pazienti in unità di terapia intensiva
dopo l’instaurarsi dell’insufficienza d’organo e della
sepsi. Questo è stato avvalorato in altri studi.121 In uno
studio di coorte prospettico di 5735 pazienti critici, non
c’è stato nessun gruppo di pazienti nel quale la RHC
abbia dimostrato un miglioramento dell’esito. Tuttavia, la RHC è stata associata con un aumento della
mortalità, della lunghezza del ricovero, del costo assistenziale e dell’utilizzazione delle risorse.122 In un
DEA affollato, la praticità dell’utilizzo di un monito-
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
sossimetria, la PO2 e la PCO2 transcutanee erano equivalenti ai dati invasivi della termodiluizione. Il monitor della bioimpedenza era in grado di rilevare più
precocemente le condizioni di flusso ridotto e di scarsa ossigenazione. I livelli più bassi di ossigenazione
tessutale e più elevati di CO2 tessutale erano significativamente prevalenti nei non sopravvissuti.124
Le limitazioni delle apparecchiature per la
bioimpedenza toracica possono includere l’errato
posizionamento degli elettrodi, gli artefatti da movimento causati dai tremori, i movimenti del paziente
irrequieto e le condizioni del paziente correlate alle
patologie come l’edema polmonare, i versamenti
pleurici, le malattie valvolari e le aritmie. Con l’adeguata implementazione di questi strumenti, tuttavia,
si possono conseguire esiti migliori tramite una diagnosi e un trattamento più precoci degli individui a
rischio di sviluppare un’ipotensione e lo shock prima
di osservare gli effetti tardivi sui parametri vitali. Con
la maggior diffusione di questa tecnologia, sarà necessario un addestramento supplementare per questo
monitoraggio per i medici d’urgenza, gli infermieri e
gli altri operatori sanitari del DEA.
la mortalità, una permanenza più breve nell’unità di
terapia intensiva (UTI) e un tempo complessivo inferiore trascorso in ospedale. I pazienti con gravi
comorbilità erano più inclini a soccombere alle complicanze. In molti altri studi, sono stati raggiunti esiti
migliori in termini di durata dell’ipotensione, di permanenza in UTI e in ospedale e di mortalità globale
con l’utilizzo degli algoritmi.50,127-129
Fattore ricombinante VIIa
C’è stato uno studio recente dell’uso del Fattore VIIa
ricombinante per controllare il sanguinamento durante
gli interventi chirurgici. Di particolare importanza per i
medici d’urgenza è il suo utilizzo nei pazienti traumatici sanguinanti. Questo farmaco è impiegato per favorire la formazione del coagulo specificamente nel sito
di sanguinamento e trova una particolare indicazione
nel trauma chiuso e nell’emorragia intracerebrale, due
entità che non sono così rare nell’ambito del DEA.
L’impiego corrente è raccomandato solo nell’emorragia
refrattaria e la maggior parte dei casi clinici dimostra
che il suo utilizzo è un estremo tentativo di controllare
il sanguinamento.130-133 A causa delle sue proprietà
pro-coagulanti e della mancanza relativa di studi completi controllati, randomizzati, sul suo utilizzo, il Fattore VIIa può essere raccomandato solo con una definizione di Classe III fino a che non si ricevano ulteriori
informazioni.134 Non esiste una letteratura significativa
che sostenga il suo utilizzo nei pazienti con sanguinamento medico e può essere in realtà controindicato a
causa della tipica patologia multisistemica di questi
pazienti.
Trattamento algoritmico dell’ipotensione e
dello shock
Con l’accurato monitoraggio dei parametri emodinamici e della perfusione tessutale, si possono sviluppare algoritmi per individuare direttamente i segni
sub-clinici di scarsa perfusione tessutale. L’utilizzo di
algoritmi nel trattamento dell’ipotensione non è un
concetto nuovo. Nel 1983, è stato individuato uno
studio retrospettivo sulla rianimazione con liquidi di
603 pazienti.12 Si è trattato di una serie di casi di
pazienti con ipotensione che sono stati trattati sia con
un algoritmo di somministrazione dei liquidi sia sulla
base delle preferenze individuali dei medici. Una
revisione delle Cartelle cliniche ha mostrato che
anche con queste linee guida specifiche la compliance
all’algoritmo è stata subottimale. Ci sono stati significativi ritardi nell’inizio della somministrazione di
fluid challenge e molti passi dell’algoritmo non sono
stati seguiti. Ci sono stati 114 decessi (19% mortalità)
nel gruppo di studio. Significative comorbilità erano
presenti in 265 (44%) dei pazienti ipotesi. Quarantaquattro pazienti in questo sottogruppo hanno sviluppato una severa disfunzione d’organo correlata allo
shock. Questi pazienti hanno avuto una percentuale
di mortalità più alta, un’ipotensione più grave (pressione arteriosa media inferiore) e rianimazioni più
difficili e prolungate. Pare inoltre che i pazienti abbiano avuto un inizio notevolmente ritardato dei tentativi rianimatori dopo il riconoscimento dell’ipotensione. Gli Autori concludono che nelle circostanze in cui
ci sono state minori deviazioni (o maggiore compliance) dalle linee guida sulla rianimazione con liquidi, i
tentativi rianimatori sono stati più brevi e ci sono
stati minori problemi correlati allo shock. Il miglioramento dell’esito clinico ha incluso una riduzione del-
Emergency Medicine Practice
Strategie economiche efficaci e
tempestive nella valutazione diagnostica
dell’ipotensione inspiegabile
24
Tenete disponibile l’ecografia al letto per rispondere a
domande focalizzate sulla funzione cardiaca globale e
lo stato del volume ematico. I segni di una catastrofe
vascolare, di un’embolia polmonare massiva e di uno
pneumotorace iperteso possono essere ricercati senza
interrompere gli sforzi rianimatori:
• non utilizzate la radiografia del torace per escludere la dissezione aortica, il versamento/tamponamento pericardico o una cardiomiopatia sulla base
di un mero profilo;
• non aspettate la TC e la creatininemia per stabilire
se un elevato sospetto di AAA è presente o assente.
Valutate le dinamiche cardiache e i valori di PVC
prima, durante e dopo il supporto di liquidi e catecolamine. Studi ben disegnati sostengono l’utilizzo dell’ecocardiografia diretta all’obiettivo nel paziente ipoteso del DEA.
Utilizzate le soluzioni di cristalloidi per la rianimazione con liquidi. Non esistono nella letteratura
attuale miglioramenti negli esiti che giustifichino,
negli USA, l’utilizzo di soluzioni colloidi molto più
care. Gli obiettivi possono includere: miglioramento
Disposizioni
A causa della morbilità e della mortalità elevate associate con l’ipotensione indipendentemente dall’eziologia, deve esserci una soglia bassa per il ricovero. L’ecografia può rappresentare un utile strumento per dirigere i provvedimenti. L’applicazione del Focused
Assessment of Sonography in Trauma (FAST) permette il
triage diretto dei pazienti traumatici con reperti FAST
positivi alla laparotomia terapeutica senza l’utilizzo
dello studio per immagini TC.135
Nella nuova era dei DEA super-super-affollati (e
questo non è un errore tipografico) la soluzione all’acuzie e al volume ingente dei pazienti non deve prolungare la terapia intensiva nel DEA. Unità di terapia
semintensiva e unità di terapia intensiva ampliate aiutano a reindirizzare le risorse e l’esperienza del medico d’urgenza al paziente successivo che chiede una
risposta alla sua inspiegabile ipotensione. L’Acute Physiology and Chronic Health Evaluation (APACHE) II, il
Simplified Acute Physiology Score (SAPS) e il Punteggio
dell’Ipotensione sono stati tutti ideati come predittivi
dell’esito del paziente o della severità della malattia e
hanno la potenzialità di guidare l’assistenza in unità di
terapia intensiva.136
Sommario
In un’epoca in cui siamo vincolati allo standard elevato dell’essere “migliori, più veloci e più sicuri”, il volume inconsueto, la complessità crescente e la maggiore
acuità dei pazienti del DEA rende il trattamento dei
pazienti più che mai difficile. Il precoce riconoscimento dell’ipotensione clinica, il rapido inizio della rianimazione mirata all’obiettivo e l’utilizzo anticipato di
accurati strumenti diagnostici rimangono le pietre
angolari per la riduzione della morbilità e mortalità
dei pazienti ipotesi. La rapida identificazione dell’ipotensione clinica deve essere seguita da una sollecita e
sicura diagnosi delle eziologie principali e concorrenti.
La correzione dei disturbi principali deve avvenire in
parallelo all’iter diagnostico per evitare esiti avversi
per il paziente: una bella pretesa per il medico d’urgenza. L’utilizzo precoce degli strumenti che abbiamo a
disposizione, prima di un ulteriore peggioramento del
paziente critico, ci avvicina al raggiungimento dell’obiettivo.
Conclusione dei casi
La prima paziente ha avuto un’ipossia ingravescente (nonostante la corretta intubazione endotracheale) e le sono
stati somministrati antibiotici a causa della febbre e dell’elevato conteggio dei leucociti. Non era evidente alcuna
fonte ovvia di infezione. L’ecocardiografia al letto ha dimostrato l’assenza di versamento pericardico ma ha rilevato
un’aumentata funzione del ventricolo sinistro, un ventricolo destro disteso con pareti sottili e una deviazione della
parete del setto verso sinistra. La VCI era distesa e mostrava uno scarso movimento respiratorio. Non erano presenti
ovvi coaguli o masse nelle cavità cardiache o nella VCI. La
pressione arteriosa era resistente a 2 litri di cristalloidi ev
e, dopo una discussione con il team di terapia intensiva,
l’embolia polmonare è stata considerata come causa probabile del sovraccarico acuto del cuore destro. L’ecocardiografia transesofagea ha confermato il reperto di un trombo
nell’arteria polmonare e sono stati somministrati i farmaci trombolitici.
Il secondo paziente aveva dei rantoli e l’infusione di
Bibliografia
La medicina evidence-based richiede un esame critico
della letteratura basata sulla metodologia e sul numero di soggetti. Non tutte le referenze sono ugualmente
solide. I risultati di un ampio studio prospettico, randomizzato, in cieco, dovrebbero avere maggior peso
rispetto a un caso clinico. Per aiutare il lettore a valutare la forza di ciascuna voce bibliografica, informazioni pertinenti lo studio, come il tipo, il numero di
25
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
liquidi ha determinato un respiro ancor più faticoso e in più
un’altra intubazione endotracheale. La furosemide non è
servita e il centro dialisi non ha risposto. L’ECG non era
significativo e il paziente, che era paralizzato e sedato, è
rimasto ipoteso e tachicardico. Voi avete considerato un
supporto con inotropi o vasopressori ma poi vi siete ricordati che il giorno prima era stato consegnato il nuovo ecografo. L’aorta addominale non sembrava essere maggiore di
2 cm di diametro ma voi avete notato un flap intimale. Il
cuore aveva altresì un piccolo versamento pericardico e un
flap intimale vicino alla valvola aortica. Il paziente è stato
condotto in sala operatoria dove è sopravvissuto a una riparazione dell’aorta toracica.
Anche la terza paziente aveva dei rantoli. Il cuore era
ingrandito alla radiografia del torace. I polmoni erano lievemente congesti. L’ecografia ha dimostrato un piccolo versamento pericardico e nell’insieme quasi nessuna attività cardiaca con una frazione d’eiezione al massimo del 10%. La
VCI era spessa ed è rimasta invariata dopo che la paziente ha
respirato velocemente e profondamente. La paziente è stata
rapidamente posta in terapia con dobutamina e si è addormentata un’ora più tardi per la prima volta da alcune settimane. Un’ecografia ripetuta ha mostrato un FE del 20% e la
paziente stava notevolmente meglio; voi avete terminato il
turno esausti ma convinti sostenitori del valore dell’ecografia al letto.
della PVC, miglioramento dell’indice cardiaco, output
urinario adeguato e clearance dell’acido lattico.
L’ipoperfusione d’organo può essere occulta;
ricercate in modo energico degli indizi utilizzando il
monitoraggio non invasivo come la saturazione d’ossigeno tessutale, l’ossimetria venosa centrale e i livelli di
lattato.
Utilizzate l’ipotensione come punto soglia, non
come un obiettivo. Individuate i diversi fattori che
possono incidere sull’ipotensione e, ancor più importante, sulla perfusione d’organo.
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
pazienti coinvolti, saranno incluse nei dati in grassetto
che seguono le referenze, se disponibili. Inoltre, le referenze più esplicative citate in questo articolo, come stabilito dagli Autori, saranno evidenziate da un asterisco
(*) vicino al numero della voce bibliografica.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
Weisser B, Grune S, Burger R, et al. The Dubendorf
Study: a population-based investigation on normal
values of blood pressure selfmeasurement. J Hum
Hypertens. Apr 1994;8(4):227-231. (Trial controllato,
randomizzato; studio comparativo; 503 pazienti)
Rasmussen SL, Torp-Pedersen C, Borch-Johnsen K,
Ibsen H. Normal values for ambulatory blood pressure and differences between casual blood pressure
and ambulatory blood pressure: results from a Danish
population survey. J Hypertens. Oct 1998;16(10):141524. (Trial controllato, randomizzato; studio comparativo; studio di popolazione; 2656 pazienti)
Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/
ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Intensive Care Med. Apr 2003;29(4):
530-538. (Dichiarazione di consenso; revisione)
Moore CL, Rose GA, Tayal VS, Sullivan DM, Arrowood
JA, Kline JA. Determination of left ventricular function
by emergency physician echocardiography of hypotensive patients. Acad Emerg Med. Mar 2002;9(3):186-193.
(Trial osservazionale prospettico; 51 pazienti)
Jones AE, Stiell IG, Nesbitt LP, et al. Nontraumatic
out-of-hospital hypotension predicts inhospital mortality. Ann Emerg Med. Jan 2004;43(1):106-113. (Multicentrico; revisione retrospettiva delle Cartelle
cliniche; 10.807 pazienti in totale)
Pickering TG, Hall JE, Appel LJ, et al. Recommendations for blood pressure measurement in humans and
experimental animals: part 1: blood pressure measurement in humans: a statement for professionals from
the Subcommittee of Professional and Public Education of the American Heart Association Council on
High Blood Pressure Research. Circulation. Feb 8
2005;111(5):697-716. (Linea guida pratica)
Zhao ZY, Zhao ZY, Wang YQ, Yan ZH, Cui J, Li YY.
Quantitative study of circadian variations of ambulatory blood pressure in Chinese healthy, hypertensive,
and diabetes subjects. Clin Exp Hypertens. Feb-Apr
2005;27(2-3):187-194. (Studio comparativo; osservazionale; 150 pazienti)
Van De Water JM, Dalton ML, Parish DC, Vogel RL,
Beatty JC, Adeniyi SO. Cardiopulmonary assessment:
is improvement needed? World J Surg. 2005;29 Suppl
1:S95-98. (Trial clinico controllato; 186 pazienti)
McGee S, Abernethy WB, 3rd, Simel DL. The rational
clinical examination. Is this patient hypovolemic?
Jama. Mar 17 1999;281(11):1022-29. (Metanalisi)
Ander DS, Jaggi M, Rivers E, et al. Undetected cardiogenic shock in patients with congestive heart failure
presenting to the emergency department. Am J Cardiol.
Oct 1 1998;82(7):888-891. (Studio osservazionale,
prospettico; 44 pazienti)
Streeten DH. Variations in the clinical manifestations
of orthostatic hypotension. Mayo Clin Proc. Jul 1995;70
(7):713-714. (Commento)
Shoemaker WC, Hopkins JA. Clinical aspects of resus-
Emergency Medicine Practice
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
26
citation with and without an algorithm: relative
importance of various decisions. Crit Care Med. Aug
1983;11(8):630-639. (Retrospettivo; revisione di Cartelle cliniche; 603 pazienti)
Jones AE, Aborn LS, Kline JA. Severity of emergency
department hypotension predicts adverse hospital
outcome. Shock. Nov 2004;22(5):410-414. (Trial controllato, randomizzato; 202 pazienti)
Jones AE, Yiannibas V, Johnson C, Kline JA. Emergency department hypotension predicts sudden unexpected in-hospital mortality: a prospective cohort
study. Chest. Oct 2006;130(4):941-946. (Studio di coorte
prospettico; 4790 pazienti)
Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of
innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of
Chest Physicians/Society of Critical Care Medicine.
Chest. Jun 1992;101(6):1644-55. (Dichiarazione di consenso; linea guida pratica)
Hochman JS, Buller CE, Sleeper LA, et al. Cardiogenic
shock complicating acute myocardial infarction-etiologies, management and outcome: a report from the
SHOCK Trial Registry. Should we emergently revascularize Occluded Coronaries for cardiogenic shocK? J
Am Coll Cardiol. Sep 2000;36(3 Suppl A):1063-70. (Revisione)
Hollenberg SM, Kavinsky CJ, Parrillo JE. Cardiogenic
shock. Ann Intern Med. Jul 6 1999;131(1):47-59. (Articolo di revisione)
Johnson DR, Douglas D, Hauswald M, Tandberg D.
Dehydration and orthostatic vital signs in women
with hyperemesis gravidarum. Acad Emerg Med. Aug
1995;2(8):692-697. (Prospettico, osservazionale; 23
pazienti)
Deakin CD, Low JL. Accuracy of the advanced trauma
life support guidelines for predicting systolic blood
pressure using carotid, femoral, and radial pulses:
observational study. BMJ. Sep 16 2000;321(7262):673674. (Studio osservazionale)
Parks JK, Elliott AC, Gentilello LM, Shafi S. Systemic
hypotension is a late marker of shock after trauma: a
validation study of Advanced Trauma Life Support
principles in a large national sample. Am J Surg. Dec
2006;192(6):727-731. (Revisione di database; 11.5830
pazienti)
Pressley JC, Severance HW, Jr., Raney MP, et al. A
comparison of paramedic versus basic emergency
medical care of patients at high and low risk during
acute myocardial infarction. J Am Coll Cardiol. Dec
1988;12(6):1555-61. (Studio prospettico, comparativo)
Hooker EA, Miller FB, Hollander JL, Bukowski EM.
Do all trauma patients need early crossmatching for
blood? J Emerg Med. Jul-Aug 1994;12(4):447-451. (Revisione retrospettiva delle Cartelle cliniche; 180 pazienti; protocollo clinico prospettico; 136 pazienti)
Franklin GA, Boaz PW, Spain DA, Lukan JK, Carrillo
EH, Richardson JD. Prehospital hypotension as a valid
indicator of trauma team activation. J Trauma. Jun
2000;48(6):1034-37; discussion 1037-39. (Analisi retrospettiva di database; 6976 pazienti)
Shapiro NI, Kociszewski C, Harrison T, Chang Y,
Wedel SK, Thomas SH. Isolated prehospital hypoten-
25.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
49.
50.
27
pressure measurement. J Hum Hypertens. Mar 1998;12
(3):157-160. (Studio comparativo; 16 pazienti)
Netea RT, Smits P, Lenders JW, Thien T. Does it matter
whether blood pressure measurements are taken with
subjects sitting or supine? J Hypertens. Mar 1998;16
(3):263-268. (Studio comparativo; 245 pazienti)
Christiansen C, Toft P, Jorgensen HS, Andersen SK,
Tonnesen E. Hyperglycaemia and mortality in critically ill patients. A prospective study. Intensive Care Med.
Aug 2004;30(8):1685-88. (Prospettico)
Laird AM, Miller PR, Kilgo PD, Meredith JW, Chang
MC. Relationship of early hyperglycemia to mortality
in trauma patients. J Trauma. May 2004;56(5):1058-62.
(Prospettico; 516 pazienti)
Sung J, Bochicchio GV, Joshi M, Bochicchio K, Tracy K,
Scalea TM. Admission hyperglycemia is predictive of
outcome in critically ill trauma patients. J Trauma. Jul
2005;59(1):80-83. (Prospettico; 1003 pazienti)
Lange H, Jackel R. Usefulness of plasma lactate concentration in the diagnosis of acute abdominal disease.
Eur J Surg. Jun-Jul 1994;160(6-7):381-384. (Prospettico;
85 pazienti)
Murray MJ, Gonze MD, Nowak LR, Cobb CF. Serum
D(-)-lactate levels as an aid to diagnosing acute intestinal ischemia. Am J Surg. Jun 1994;167(6):575-578.
(Prospettico; 31 pazienti)
Younger JG, Falk JL, Rothrock SG. Relationship
between arterial and peripheral venous lactate levels.
Acad Emerg Med. Jul 1996;3(7):730-734. (Studio comparativo; 48 pazienti)
Lavery RF, Livingston DH, Tortella BJ, Sambol JT, Slomovitz BM, Siegel JH. The utility of venous lactate to
triage injured patients in the trauma center. J Am Coll
Surg. Jun 2000;190(6):656-664. (Studio comparativo;
375 pazienti)
Jones AE, Leonard MM, Hernandez-Nino J, Kline JA.
Determination of the effect of in vitro time, temperature, and tourniquet use on whole blood venous pointof-care lactate concentrations. Acad Emerg Med. Jul
2007;14(7):587-591. (Studio prospettico; 80 pazienti)
Nguyen HB, Rivers EP, Knoblich BP, et al. Early lactate clearance is associated with improved outcome in
severe sepsis and septic shock. Crit Care Med. Aug
2004;32(8):1637-42. (Studio prospettico, osservazionale; 111 pazienti)
Upadhyay M, Singhi S, Murlidharan J, Kaur N,
Majumdar S. Randomized evaluation of fluid resuscitation with crystalloid (saline) and colloid (polymer
from degraded gelatin in saline) in pediatric septic
shock. Indian Pediatr. Mar 2005;42(3):223-231. (Prospettico; randomizzato; open label; 60 pazienti)
Yokoyama N, Nishikawa K, Saito Y, Saito S, Goto F.
[Comparison of the effects of colloid and crystalloid
solution for volume preloading on maternal hemodynamics and neonatal outcome in spinal anesthesia for
cesarean section]. Masui. Sep 2004;53(9):1019-24. (Trial
controllato, randomizzato; 32 pazienti)
Trzeciak S, Dellinger RP, Abate NL, et al. Translating
research to clinical practice: a 1-year experience with
implementing early goaldirected therapy for septic
shock in the emergency department. Chest. Feb
2006;129(2):225-232. (Retrospettivo; 32 pazienti in
totale)
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
26.
sion after traumatic injuries: a predictor of mortality? J
Emerg Med. Aug 2003;25(2):175-179. (Retrospettivo;
545 pazienti)
Garrett PD, Boyd SY, Bauch TD, Rubal BJ, Bulgrin JR,
Kinkler ES Jr. Feasibility of real-time echocardiographic evaluation during patient transport. J Am Soc
Echocardiogr. Mar 2003;16(3):197-201. (Studio comparativo)
Buist M, Bernard S, Nguyen TV, Moore G, Anderson J.
Association between clinically abnormal observations
and subsequent in-hospital mortality: a prospective
study. Resuscitation. Aug 2004;62(2):137-141. (Prospettico; raccolta di dati; 564 pazienti)
Jones AE, Tayal VS, Sullivan DM, Kline JA. Randomized, controlled trial of immediate versus delayed
goal-directed ultrasound to identify the cause of nontraumatic hypotension in emergency department
patients. Crit Care Med. Aug 2004;32(8):1703-08. (Trial
controllato, randomizzato; 184 pazienti)
De Jong JR, Ros HH, De Lange JJ. Noninvasive continuous blood pressure measurement during anaesthesia:
a clinical evaluation of a method commonly used in
measuring devices. Int J Clin Monit Comput. Feb
1995;12(1):1-10. (Trial clinico controllato; 15 pazienti)
Lehmann KG, Gelman JA, Weber MA, Lafrades A.
Comparative accuracy of three automated techniques
in the noninvasive estimation of central blood pressure in men. Am J Cardiol. Apr 15 1998;81(8):1004-12.
(Trial controllato, randomizzato; 120 pazienti)
Cavalcanti S, Marchesi G, Ghidini C. Validation
of automated oscillometric sphygmomanometer
(HDBPM) for arterial pressure measurement during
haemodialysis. Med Biol Eng Comput. Jan 2000;38(1):98101. (Trial clinico controllato; 92 pazienti)
Van Montfrans GA, Van der Hoeven GM, Karemaker
JM, Wieling W, Dunning AJ. Accuracy of auscultatory
blood pressure measurement with a long cuff. Br Med
J (Clin Res Ed). Aug 8 1987;295(6594):354-355. (Trial
controllato, randomizzato; 37 pazienti)
Gomez-Marin O, Prineas RJ, Rastam L. Cuff bladder
width and blood pressure measurement in children
and adolescents. J Hypertens. Oct 1992;10(10):12351241. (Studio comparativo; 1582 pazienti)
Banner TE, Gravenstein JS. Comparative effects of cuff
size and tightness of fit on accuracy of blood pressure
measurements. J Clin Monit. Oct 1991;7(4):281-284.
(Studio comparativo; 6 pazienti)
Stolt M, Sjonell G, Astrom H, Rossner S, Hansson L.
Improved accuracy of indirect blood pressure measurement in patients with obese arms. Am J Hypertens.
Jan 1993;6(1):66-71. (Trial controllato, randomizzato;
20 pazienti)
Sala C, Santin E, Rescaldani M, Magrini F. How long
shall the patient rest before clinic blood pressure measurement? Am J Hypertens. Jul 2006;19(7):713-717. (Studio comparativo; 55 pazienti)
Lategola MT, Busby DE. Differences between seated
and recumbent resting measurements of auscultative
blood pressure. Aviat Space Environ Med. Aug
1975;46(8):1027-29. (Trial controllato, randomizzato;
100 pazienti)
Netea RT, Bijlstra PJ, Lenders JW, Smits P, Thien T.
Influence of the arm position on intra-arterial blood
51.
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62
63.
64.
65.
66.
Dellinger RP, Carlet JM, Masur H, et al. Surviving Sepsis Campaign guidelines for management of severe
sepsis and septic shock. Crit Care Med. Mar 2004;32
(3):858-873. (Dichiarazione di consenso; linea guida
pratica)
Sand IC, Jagoda A, Vukich D. Maintenance fluids in
prehospital care: crystalloid versus dextrose solutionsis there a difference? J Emerg Med. Nov-Dec 1994;12
(6):803-809. (Studio comparativo)
Roberts I, Alderson P, Bunn F, Chinnock P, Ker K,
Schierhout G. Colloids versus crystalloids for fluid
resuscitation in critically ill patients. Cochrane Database
Syst Rev. 2004(4):CD000567. (Metanalisi)
Alderson P, Bunn F, Lefebvre C, et al. Human albumin
solution for resuscitation and volume expansion in
critically ill patients. Cochrane Database Syst Rev.
2004(4):CD001208. (Metanalisi)
Bunn F, Roberts I, Tasker R, Akpa E. Hypertonic versus near isotonic crystalloid for fluid resuscitation in
critically ill patients. Cochrane Database Syst Rev.
2004(3):CD002045. (Metanalisi)
Kwan I, Bunn F, Roberts I. Timing and volume of fluid
administration for patients with bleeding following
trauma. Cochrane Database Syst Rev. 2001(1):CD002245.
(Metanalisi; revisione)
Kwan I, Bunn F, Roberts I. Timing and volume of fluid
administration for patients with bleeding. Cochrane
Database Syst Rev. 2003(3):CD002245. (Metanalisi;
revisione)
Dutton RP, Mackenzie CF, Scalea TM. Hypotensive
resuscitation during active hemorrhage: impact on inhospital mortality. J Trauma. Jun 2002;52(6):1141-46.
(Studio controllato, randomizzato; 110 pazienti)
Mapstone J, Roberts I, Evans P. Fluid resuscitation
strategies: a systematic review of animal trials. J Trauma. Sep 2003;55(3):571-589. (Metanalisi)
Capone AC, Safar P, Stezoski W, Tisherman S, Peitzman AB. Improved outcome with fluid restriction in
treatment of uncontrolled hemorrhagic shock. J Am
Coll Surg. Jan 1995;180(1):49-56. (Studio animale)
Owens TM, Watson WC, Prough DS, Uchida T,
Kramer GC. Limiting initial resuscitation of uncontrolled hemorrhage reduces internal bleeding and subsequent volume requirements. J Trauma. Aug
1995;39(2):200-207; discussion 208-209. (Studio animale)
Bickell WH, Wall MJ, Jr., Pepe PE, et al. Immediate
versus delayed fluid resuscitation for hypotensive
patients with penetrating torso injuries. N Engl J Med.
Oct 27 1994;331(17):1105-09. (Studio prospettico; 598
pazienti)
Cao L, Weil MH, Sun S, Tang W. Vasopressor agents
for cardiopulmonary resuscitation. J Cardiovasc Pharmacol Ther. Jun 2003;8(2):115-121. (Revisione)
Tran TP, Panacek EA, Rhee KJ, Foulke GE. Response
to dopamine vs norepinephrine in tricyclic antidepressant-induced hypotension. Acad Emerg Med. Sep
1997;4(9):864-868. (Studio comparativo; retrospettivo;
26 pazienti)
Holmes CL. Vasoactive drugs in the intensive care
unit. Curr Opin Crit Care. Oct 2005;11(5):413-417.
(Revisione)
Holmes CL, Patel BM, Russell JA, Walley KR. Physi-
Emergency Medicine Practice
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
28
ology of vasopressin relevant to management of septic shock. Chest. Sep 2001;120(3):989-1002. (Revisione)
Beale RJ, Hollenberg SM, Vincent JL, Parrillo JE. Vasopressor and inotropic support in septic shock: an evidence-based review. Crit Care Med. Nov 2004;32(11
Suppl):S455-465. (Revisione)
Kellum JA, Pinsky MR. Use of vasopressor agents in
critically ill patients. Curr Opin Crit Care. Jun
2002;8(3):236-241. (Revisione)
Ogawa R. [Distributive shock and it’s therapy by cardio-vascular acting drugs]. Nippon Geka Gakkai Zasshi.
Oct 1999;100(10):679-682. (Revisione)
Mullner M, Urbanek B, Havel C, Losert H, Waechter
F, Gamper G. Vasopressors for shock. Cochrane Database Syst Rev. 2004(3):CD003709. (Revisione; metanalisi)
Malay MB, Ashton RC, Jr., Landry DW, Townsend
RN. Low-dose vasopressin in the treatment of
vasodilatory septic shock. J Trauma. Oct 1999;47
(4):699-703; discussion 703-695. (Trial controllato, randomizzato; 10 pazienti)
Iwai A, Sakano T, Uenishi M, Sugimoto H, Yoshioka T,
Sugimoto T. Effects of vasopressin and catecholamines
on the maintenance of circulatory stability in braindead patients. Transplantation. Oct 1989;48(4):613-617.
(Trial clinico; studio comparativo; 25 pazienti)
Leone M, Albanese J, Delmas A, Chaabane W, Garnier
F, Martin C. Terlipressin in catecholamine-resistant
septic shock patients. Shock. Oct 2004;22(4):314-319.
(Prospettico; open label; 17 pazienti)
Hall LG, Oyen LJ, Taner CB, et al. Fixed-dose vasopressin compared with titrated dopamine and norepinephrine as initial vasopressor therapy for septic
shock. Pharmacotherapy. Aug 2004;24(8):1002-12. (Studio comparativo; 150 pazienti)
Lim TW, Lee S, Ng KS. Vasopressin effective in reversing catecholamine-resistant vasodilatory shock.
Anaesth Intensive Care. Jun 2000;28(3):313-317. (Caso
clinico)
Landry DW, Levin HR, Gallant EM, et al. Vasopressin
deficiency contributes to the vasodilation of septic
shock. Circulation. Mar 4 1997;95(5):1122-25. (Comparativo, osservazione clinica; 19 pazienti)
Annane D, Bellissant E, Bollaert PE, Briegel J, Keh D,
Kupfer Y. Corticosteroids for treating severe sepsis
and septic shock. Cochrane Database Syst Rev. 2004(1):
CD002243. (Revisione; metanalisi)
Prigent H, Maxime V, Annane D. Clinical review: corticotherapy in sepsis. Crit Care. Apr 2004;8(2):122-129.
(Revisione)
Kortgen A, Niederprum P, Bauer M. Implementation
of an evidence-based “standard operating procedure”
and outcome in septic shock. Crit Care Med. Apr 2006;
34(4):943-949. (Coorte retrospettiva; 60 pazienti)
Abraham E, Laterre PF, Garg R, et al. Drotrecogin alfa
(activated) for adults with severe sepsis and a low risk
of death. N Engl J Med. Sep 29 2005;353(13):1332-41.
(Trial controllato, randomizzato; 2640 pazienti)
Franklin C, Samuel J, Hu TC. Life-threatening
hypotension associated with emergency intubation
and the initiation of mechanical ventilation. Am J
82.
84.
85.
86.
87.
88.
89.
90.
91.
92.
93.
94.
95.
96.
97.
98.
99.
100.
101.
102.
103.
104.
105.
106.
107.
29
phase of ischemic stroke is associated with brain injury
and poor stroke outcome. Stroke. Feb 2004;35(2):520526. (Prospettico; 304 pazienti)
Bourgoin A, Leone M, Delmas A, Garnier F, Albanese
J, Martin C. Increasing mean arterial pressure in
patients with septic shock: effects on oxygen variables
and renal function. Crit Care Med. Apr 2005;33(4):780786. (Trial controllato, randomizzato; 28 pazienti
Fine MJ, Smith MA, Carson CA, et al. Prognosis and
outcomes of patients with community-acquired pneumonia. A meta-analysis. Jama. Jan 10 1996;275(2):134141. (Metanalisi)
2005 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. Dec 13 2005;112(24 Suppl):
IV1-203. (Linea guida clinica; dichiarazione di consenso)
Jones AE, Craddock PA, Tayal VS, Kline JA. Diagnostic accuracy of left ventricular function for identifying
sepsis among emergency department patients with
nontraumatic symptomatic undifferentiated hypotension. Shock. Dec 2005;24(6):513-517. (Trial controllato,
randomizzato; 103 pazienti)
Niendorff DF, Rassias AJ, Palac R, Beach ML, Costa S,
Greenberg M. Rapid cardiac ultrasound of inpatients
suffering PEA arrest performed by nonexpert sonographers. Resuscitation. Oct 2005;67(1):81-87. (Studio
comparativo; 5 pazienti)
Kaul S, Stratienko AA, Pollock SG, Marieb MA, Keller
MW, Sabia PJ. Value of two-dimensional echocardiography for determining the basis of hemodynamic compromise in critically ill patients: a prospective study. J
Am Soc Echocardiogr. Nov-Dec 1994;7(6):598-606. (Studio comparativo, prospettico; 49 pazienti)
Adler C, Buttner W, Veh R. [Relations of the ultrasonic image of the inferior vena cava and central venous
pressure]. Aktuelle Gerontol. Nov 1983;13(6):209-213.
(Studio comparativo, prospettico; 50 pazienti)
Kircher BJ, Himelman RB, Schiller NB. Noninvasive
estimation of right atrial pressure from the inspiratory
collapse of the inferior vena cava. Am J Cardiol. Aug 15
1990;66(4):493-496. (Studio comparativo, prospettico;
83 pazienti)
Randazzo MR, Snoey ER, Levitt MA, Binder K. Accuracy of emergency physician assessment of left ventricular ejection fraction and central venous pressure
using echocardiography. Acad Emerg Med. Sep
2003;10(9):973-977. (Studio osservazionale; 115 pazienti)
Bendjelid K. Predicting fluid responsiveness: should
we adapt the scale to measure the central venous pressure swing? Intensive Care Med. Sep 2004;30(9):1847;
author reply 1848. (Commento)
Bendjelid K, Romand JA, Walder B, Suter PM,
Fournier G. Correlation between measured inferior
vena cava diameter and right atrial pressure depends
on the echocardiographic method used in patients
who are mechanically ventilated. J Am Soc Echocardiogr. Sep 2002;15(9):944-949. (Prospettico; 20 pazienti)
Moreno FL, Hagan AD, Holmen JR, Pryor TA, Strickland RD, Castle CH. Evaluation of size and dynamics
of the inferior vena cava as an index of right-sided car-
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
83.
Emerg Med. Jul 1994;12(4):425-428. (Prospettico, osservazionale; 84 pazienti)
De Jong MF, Beishuizen A, Spijkstra JJ, et al. Predicting a low cortisol response to ACTH in the critically ill:
a retrospective cohort study. Crit Care. May 24
2007;11(3):R61. (Retrospettivo; 405 pazienti)
Mohammad Z, Afessa B, Finkielman JD. The incidence of relative adrenal insufficiency in patients
with septic shock after the administration of etomidate. Crit Care. 2006;10(4):R105. (Retrospettivo; 152
pazienti)
Zhang Y, Luo A, An G, Huang Y. [Effect of propofol
and etomidate for anesthesia induction on plasma
total cortisol concentration]. Zhongguo Yi Xue Ke Xue
Yuan Xue Bao. Jun 2000;22(3):284-286. (Prospettico; 20
pazienti)
Adnet F. Ketamine Versus Etomidate During Rapid
Sequence Intubation: Consequences on Hospital Morbidity (KETASED study). 2007. (Studio in fase IV;
arruolamento dei pazienti)
Wood KE. The presence of shock defines the threshold
to initiate thrombolytic therapy in patients with pulmonary embolism. Intensive Care Med. Nov 2002;28
(11):1537-46. (Revisione)
Wood KE. Major pulmonary embolism: review of a
pathophysiologic approach to the golden hour of
hemodynamically significant pulmonary embolism.
Chest. Mar 2002;121(3):877-905. (Revisione)
Sharma VK, Dellinger RP. Recent developments in the
treatment of sepsis. Expert Opin Investig Drugs. Feb
2003;12(2):139-152. (Revisione)
Schwartz B, Vermeulen MJ, Idestrup C, Datta P. Clinical variables associated with mortality in out-of-hospital patients with hemodynamically significant bradycardia. Acad Emerg Med. Jun 2004;11(6):656-661. (Retrospettivo; 247 pazienti)
Kumar A, Roberts D, Wood KE, et al. Duration of
hypotension before initiation of effective antimicrobial
therapy is the critical determinant of survival in
human septic shock. Crit Care Med. Jun 2006;34
(6):1589-96. (Revisione retrospettiva delle Cartelle
cliniche; 2741 pazienti)
Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary
embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER).
Lancet. Apr 24 1999;353(9162):1386-89. (Esito prospettico; 2454 pazienti)
Ginde AA, Rhee SH, Katz ED. Predictors of outcome
in geriatric patients with urinary tract infections. J
Emerg Med. Aug 2004;27(2):101-108. (Retrospettivo;
284 pazienti)
Farooq MM, Freischlag JA, Seabrook GR, Moon MR,
Aprahamian C, Towne JB. Effect of the duration of
symptoms, transport time, and length of emergency
room stay on morbidity and mortality in patients with
ruptured abdominal aortic aneurysms. Surgery. Jan
1996;119(1):9-14. (Retrospettivo; 124 pazienti)
Chan L, Bartfield JM, Reilly KM. The significance of
out-of-hospital hypotension in blunt trauma patients.
Acad Emerg Med. Aug 1997;4(8):785-788. (Retrospettivo; 104 pazienti)
Castillo J, Leira R, Garcia MM, Serena J, Blanco M,
Davalos A. Blood pressure decrease during the acute
108.
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
109.
110.
111.
112.
113.
114.
115.
116.
117.
118.
119.
120.
diac function. Am J Cardiol. Feb 1 1984;53(4):579-585.
(Studio prospettico; 175 pazienti)
Nath J, Vacek JL, Heidenreich PA. A dilated inferior
vena cava is a marker of poor survival. Am Heart J. Mar
2006;151(3):730-735. (Retrospettivo; 4383 pazienti)
Barbier C, Loubieres Y, Schmit C, et al. Respiratory
changes in inferior vena cava diameter are helpful in
predicting fluid responsiveness in ventilated septic
patients. Intensive Care Med. Sep 2004;30(9):1740-46.
(Prospettico; 23 pazienti)
Gloviczki P, Pairolero PC, Mucha P, Jr., et al. Ruptured
abdominal aortic aneurysms: repair should not be
denied. J Vasc Surg. May 1992;15(5):851-857; discussion 857-859. (Retrospettivo; 231 pazienti)
Schuster ME, Fishman JE, Copeland JF, Hatabu H,
Boiselle PM. Pulmonary embolism in pregnant
patients: a survey of practices and policies for CT pulmonary angiography. AJR Am J Roentgenol. Dec
2003;181(6):1495-98. (Sondaggio; linea guida pratica)
Clinical policy: critical issues in the evaluation and
management of adult patients presenting with suspected pulmonary embolism. Ann Emerg Med. Feb
2003;41(2):257-270. (Linea di condotta clinica; linea
guida pratica)
Daniels LB, Krummen DE, Blanchard DG. Echocardiography in pulmonary vascular disease. Cardiol Clin.
Aug 2004;22(3):383-399, vi. (Revisione)
Pruszczyk P, Bochowicz A, Torbicki A, et al. Cardiac
troponin T monitoring identifies high-risk group of
normotensive patients with acute pulmonary
embolism. Chest. Jun 2003;123(6):1947-52. (Studio
comparativo; 60 pazienti)
Pruszczyk P, Torbicki A, Pacho R, et al. Noninvasive
diagnosis of suspected severe pulmonary embolism:
transesophageal echocardiography vs spiral CT. Chest.
Sep 1997;112(3):722-728. (Studio comparativo; 49 pazienti)
Randolph AG, Cook DJ, Gonzales CA, Pribble CG.
Ultrasound guidance for placement of central venous
catheters: a meta-analysis of the literature. Crit Care
Med. Dec 1996;24(12):2053-58. (Metanalisi)
Hilty WM, Hudson PA, Levitt MA, Hall JB. Real-time
ultrasoundguided femoral vein catheterization during
cardiopulmonary resuscitation. Ann Emerg Med. Mar
1997;29(3):331-336; discussion 337. (Studio prospettico, randomizzato, comparativo; 20 pazienti)
Cheitlin MD, Armstrong WF, Aurigemma GP, et al.
ACC/AHA/ASE 2003 guideline update for the clinical application of echocardiography: summary article:
a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to
Update the 1997 Guidelines for the Clinical Application of Echocardiography). Circulation. Sep 2 2003;108
(9):1146-62. (Linea guida pratica)
Vieillard-Baron A, Prin S, Chergui K, Dubourg O,
Jardin F. Hemodynamic instability in sepsis: bedside
assessment by Doppler echocardiography. Am J
Respir Crit Care Med. Dec 1 2003;168(11):1270-76.
(Revisione)
Kern JW, Shoemaker WC. Meta-analysis of hemodynamic optimization in high-risk patients. Crit Care
Med. Aug 2002;30(8):1686-92. (Metanalisi)
Emergency Medicine Practice
121. Boyd O, Hayes M. The oxygen trail: the goal. Br Med
Bull. 1999;55(1):125-139. (Metanalisi)
122. Connors AF, Jr., Speroff T, Dawson NV, et al. The
effectiveness of right heart catheterization in the initial
care of critically ill patients. SUPPORT Investigators.
Jama. Sep 18 1996;276(11):889-897. (Coorte prospettica;
5735 pazienti)
123. Shoemaker WC. Temporal physiologic patterns of
shock and circulatory dysfunction based on early
descriptions by invasive and noninvasive monitoring.
New Horiz. May 1996;4(2):300-318. (Revisione)
124. Shoemaker WC, Belzberg H, Wo CC, et al. Multicenter
study of noninvasive monitoring systems as alternatives to invasive monitoring of acutely ill emergency
patients. Chest. Dec 1998;114(6):1643-52. (Studio comparativo, prospettico; 680 pazienti)
125. Shoemaker WC, Wo CC, Bishop MH, Thangathurai D,
Patil RS. Noninvasive hemodynamic monitoring of
critical patients in the emergency department. Acad
Emerg Med. Jul 1996;3(7):675-681. (Studio comparativo, prospettico; 60 pazienti)
126. Shoemaker WC, Wo CC, Chan L, et al. Outcome prediction of emergency patients by noninvasive hemodynamic monitoring. Chest. Aug 2001;120(2):528-537.
(Studio prospettico, descrittivo; 151 pazienti)
127. Velmahos GC, Demetriades D, Shoemaker WC, et al.
Endpoints of resuscitation of critically injured
patients: normal or supranormal? A prospective randomized trial. Ann Surg. Sep 2000;232(3):409-418.
(Trial controllato, randomizzato; 75 pazienti)
128. Hopkins JA, Shoemaker WC, Chang PC, Schluchter M,
Greenfield S. Clinical trial of an emergency resuscitation algorithm. Crit Care Med. Aug 1983;11(8):621-629.
(Studio comparativo; 603 pazienti)
129. Shoemaker WC, Fleming AW. Resuscitation of the
trauma patient: restoration of hemodynamic functions
using clinical algorithms. Ann Emerg Med. Dec
1986;15(12):1437-44. (Studio comparativo, prospettico)
130. Scarpelini S, Rizoli S. Recombinant factor VIIa and the
surgical patient. Curr Opin Crit Care. Aug 2006;12
(4):351-356. (Revisione)
131. McMullin NR, Kauvar DS, Currier HM, Baskin TW,
Pusateri AE, Holcomb JB. The clinical and laboratory
response to recombinant factor VIIA in trauma and
surgical patients with acquired coagulopathy. Curr
Surg. Jul-Aug 2006;63(4):246-251. (Retrospettivo; 18
pazienti)
132. Tieu BH, Holcomb JB, Schreiber MA. Coagulopathy:
Its Pathophysiology and Treatment in the Injured
Patient. World J Surg. Mar 30 2007. (Revisione)
133. Howes DW, Stratford A, Stirling M, Ferri CC, Bardell
T. Administration of recombinant factor VIIa decreases blood loss after blunt trauma in noncoagulopathic
pigs. J Trauma. Feb 2007;62(2):311-315; discussion 314315. (Trial controllato, randomizzato; studio animale)
134. Thomas GO, Dutton RP, Hemlock B, et al. Thromboembolic complications associated with factor VIIa
administration. J Trauma. Mar 2007;62(3):564-569.
(Retrospettivo; 285 pazienti)
135. Lee BC, Ormsby EL, McGahan JP, Melendres GM,
Richards JR. The utility of sonography for the triage of
blunt abdominal trauma patients to exploratory
30
laparotomy. AJR Am J Roentgenol. Feb 2007;188(2):415421. (Retrospettivo; 4029 pazienti)
136. Heidenreich PA, Foster E, Cohen NH. Prediction of
outcome for critically ill patients with unexplained
hypotension. Crit Care Med. Nov 1996;24(11):1835-40.
(Coorte prospettica; 101 pazienti)
Definizione di Classi di Evidenza
Indeterminata
• Zona di continua ricerca
• Nessuna raccomandazione fino a quando non
siano disponibili ulteriori studi
Livello d’evidenza
• Evidenza non disponibile
• Studi più approfonditi in corso
• Risultati non fondati, contradditori
• Risultati non convincenti
Ogni azione nella sezione dell’Iter clinico di Emergency
Medicine Practice riceve un punteggio basato sulle
seguenti definizioni.
Classe I
• Sempre accettabile, sicuro
• Assolutamente utile
• Di comprovata efficacia ed efficienza
Livello d’evidenza
• Sono presenti uno o più ampi studi prospettici (con
rare eccezioni)
• Metanalisi di alta qualità
• I risultati degli studi sono consistentemente positivi
e convincenti
Significativamente modificato da: The Emergency
Cardiovascular Care Committees of the American
Heart Association e rappresentanti del consiglio di
rianimazione del ILCOR: How to Develop EvidenceBased Guidelines for Emergency Cardiac Care:
Quality of Evidence and Classes of Recommendations; inoltre: Anonimous. Guidelines for cardiopulmonary resuscitation and emergency cardiac care.
Emergency Cardiac Care Committees and Subcommittees, American Heart Association. Parte IX.
Ensuring effectiveness of community-wide emergency cardiac care. JAMA 1992; 268(16): 22892295.
Classe II
• Sicuro, accettabile
• Probabilmente utile
Livello d’evidenza
• Generalmente livello d’evidenza elevato
• Studi non randomizzati o retrospettivi: studi retrospettivi, di coorte o caso-controllo
• RCT meno forti
• I risultati sono positivi in modo costante
Classe III
• Può essere accettabile
31
Emergency Medicine Practice
MATERIALE PROTETTO DA COPYRIGHT. NON FOTOCOPIARE O DISTRIBUIRE ELETTRONICAMENTE SENZA L’AUTORIZZAZIONE SCRITTA DELL’EDITORE
• Possibilmente utile
• Considerare trattamenti alternativi o facoltativi
Livello d’evidenza
• Livelli di evidenza generalmente bassi o intermedi
• Serie di casi, studi su animali o consensi di esperti
• Talvolta risultati positivi

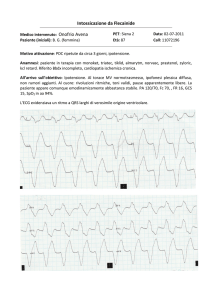

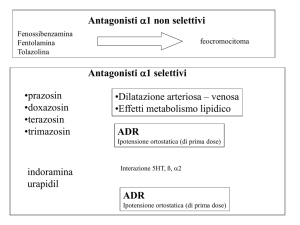


![Russo donazione organi e tessuti [modalità compatibilità]](http://s1.studylibit.com/store/data/005200047_1-6387be9468709a7d458463178816a744-300x300.png)





