Approfondimento 1.
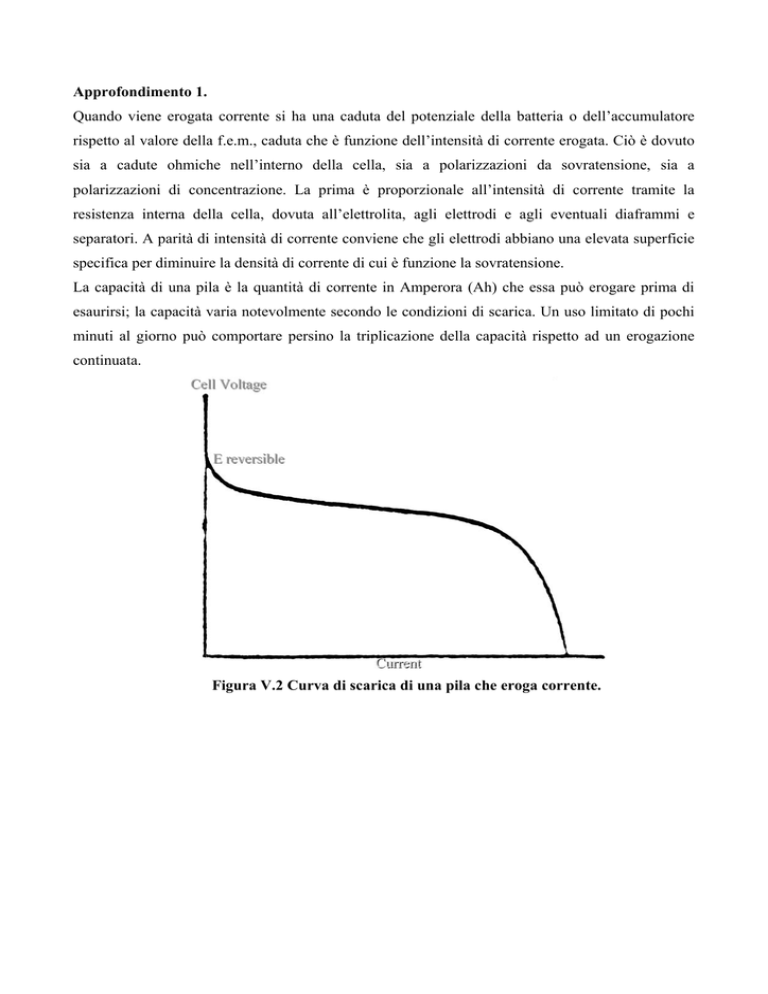
Quando viene erogata corrente si ha una caduta del potenziale della batteria o dell’accumulatore
rispetto al valore della f.e.m., caduta che è funzione dell’intensità di corrente erogata. Ciò è dovuto
sia a cadute ohmiche nell’interno della cella, sia a polarizzazioni da sovratensione, sia a
polarizzazioni di concentrazione. La prima è proporzionale all’intensità di corrente tramite la
resistenza interna della cella, dovuta all’elettrolita, agli elettrodi e agli eventuali diaframmi e
separatori. A parità di intensità di corrente conviene che gli elettrodi abbiano una elevata superficie
specifica per diminuire la densità di corrente di cui è funzione la sovratensione.
La capacità di una pila è la quantità di corrente in Amperora (Ah) che essa può erogare prima di
esaurirsi; la capacità varia notevolmente secondo le condizioni di scarica. Un uso limitato di pochi
minuti al giorno può comportare persino la triplicazione della capacità rispetto ad un erogazione
continuata.
Figura V.2 Curva di scarica di una pila che eroga corrente.
Approfondimento 2. Misura della Forza elettromotrice.
Gli ordinari sistemi voltmetrici assorbono una certa potenza per cui non sono adatti a misure precise
di f.e.m.. Con lo sviluppo dell’elettronica sono stati però messi a punto sistemi che applicano la
caduta di potenziale, che si ha ai capi di una resistenza elevata (1012 ohm), alla griglia di un triodo
speciale (tubo elettrometrico). In questo caso le correnti assorbite sono bassissime, inferiori a 10-11
Ampere e il sistema può essere considerato un elettrometro.
Un altro metodo di larghissimo impiego da molto tempo è il metodo potenziometrico, che utilizza
un circuito che in principio può essere considerato un voltmetro ad assorbimento nullo. Ci si limita
ad illustrarne il principio nel caso più comune, adatto a misure di f.e.m. dell’ordine di alcuni Volt.
Sfruttando il principio di opposizione di Poggendorf si contrappone una volta alla cella in esame e
una volta alla cella campione, una caduta di potenziale regolabile, che si può prelevare
accuratamente da un conduttore calibro inserito in un circuito ausiliario, in modo da bilanciarle: in
condizioni di equilibrio nel circuito della cella non circola corrente.
Figura V.3 Schemi di potenziometri.
Per la misura della f.e.m. occorrono quindi degli standard esattamente riproducibili e di cui si
conosca il comportamento con la temperatura. Da oltre sessant’anni si è affermata la pila Weston
che ha mostrato caratteristiche decisamente superiori a quelle di altre precedentemente usate che
non hanno trovato concorrenti in modelli più recenti. Se usate accortamente, in condizioni in cui
eroghi o sia attraversata da intensità di corrente molto basse, una pila Weston si conserva stabile per
diversi anni.
Approfondimento 3.
Gli elettrodi della pila Weston consistono di mercurio a contatto con una pasta di solfato mercuroso,
il positivo, e di un amalgama di cadmio, il negativo. L’elettrolita è una soluzione di solfato di
cadmio. Le semireazioni sono rispettivamente:
Cd + SO42− ⇔ CdSO4 + 2e −
Hg 2 SO4 + 2e − ⇔ 2 Hg + SO42−
Se si cortocircuita la pila, essa si scarica spontaneamente in modo che avvenga la reazione
complessiva:
Cd + Hg 2 SO4 → CdSO4 + 2 Hg
L’amalgama di cadmio ha una composizione (10÷12.5%) che le consente, nel campo d’uso abituale
della pila (-17°C÷+40°C), di rimanere semiliquida. In questo modo il potenziale dell’elettrodo
dipende solo dalla temperatura ed è praticamente indipendente dalla composizione dell’amalgama
stessa; per concentrazioni tali da rendere stabile solo la fase liquida o solo quella solida
dell’amalgama, il potenziale dipenderebbe strettamente dalla concentrazione del cadmio, con
difficoltà di riproducibilità. Nell’elettrolita è presente acido solforico per prevenire l’idrolisi del
solfato mercuroso.
Si usano due tipi di celle Weston: quella satura a tutte le temperature, con cristalli di CdSO4 in
contatto con ciascun elettrodo, e quella satura solo a 4°C. La prima è più stabile nel tempo e la
presenza dei cristalli di CdSO4 solido può prevenire alterazioni dovute al passaggio di piccole
intensità di corrente; d’altra parte ha un coefficiente di temperatura apprezzabile, dell’ordine di –
0,040 mV/°C, il che richiede un controllo della temperatura, nell’ambiente dove è posta la pila
standard, di ± 0.02°C per una riproducibilità di una parte per milione in E, quale si può
effettivamente pretendere. Inoltre variazioni di temperatura brusche comportano una certa isteresi,
per il riaggiustamento della solubilità. Per questi motivi la pila satura è usata come standard
primario e serve per tarare le pile “insature” usate più comunemente come riferimento nei
laboratori. Queste ultime, al di sopra dei 4°C. Esse presentano un coefficiente di temperatura
trascurabile fino a 40°C esse possono essere adoperate fino a 70°C, apportando la correzione per la
temperatura, mentre quelle sature non sono usabili in questo intervallo per le modificazioni
cristalline che subisce il CdSO4. Oggi si usano semimicropile Weston sature piuttosto robuste,
incorporate nei più svariati strumenti a transistors.
Figura V.4 Pila Weston standard.
Approfondimento 4.
Oggi si va affermando uno standard secondario di concezione completamente diversa. Si sfrutta un
normale circuito regolatore di tensione, in cui è inserito un diodo Zener che non è altro che una
variante del diodo a giunzione al silicio.
Un sistema del genere può fornire una tensione compresa tra 5 e 12 Volt circa, eccezionalmente
stabile nel tempo. Accoppiandolo in serie con altri diodi con coefficienti di temperatura opposta
possono costruirsi dei sistemi che forniscono una tensione indipendente dalla temperatura e che
varia anche meno di 3 p.p.m. nel giro di 3 anni. Il valore della tensione non è ben regolabile in base
a particolarità costruttive per cui vanno tarati; ma data la robustezza e le prestazioni e la possibilità
di miniaturizzazione trovano un uso sempre più ampio e rappresentano un concorrente severo per le
pile Weston insature.
Figura V.5 Stabilizzatore con diodo zener.