NOVITÀ DALLA RICERCA
Dal laboratorio al letto del malato
In questo articolo:
ricerca traslazionale
carcinoma del cavo orale
p53
La mutazione
che svela se la cura
funzionerà a dovere
Una proteina molto nota per le sue proprietà di protezione
della cellula diventa un indicatore prezioso per scegliere
la terapia giusta in un tumore, quello della bocca, in cui
la chirurgia resta il trattamento più efficace. Un bell’esempio
di rapido passaggio dal laboratorio alla clinica
a cura di DANIELA OVADIA
siste una proteina, chiamata p53, prodotta da un gene
che porta lo stesso nome e
che, da oltre trent’anni, è al
centro dell'attenzione della
ricerca oncologica. Ora un gruppo di
ricercatori dell’Istituto nazionale tumori di Milano, guidato da Lisa Licitra
e finanziato interamente da AIRC, ha
scoperto anche come sfruttarla per
identificare i pazienti che risponderanno alle cure farmacologiche nei tumori della bocca. Lo studio è stato pubblicato sulla rivista Journal of Clinical Oncology.
E
Prima della chirurgia
“È noto che il gene p53, che produce la relativa proteina, è un oncosoppressore, ovvero è capace di bloccare
la deriva di una cellula verso la trasformazione tumorale” spiega Lisa Licitra.
“Per questo ci è venuta l’idea di studiarne la struttura in alcuni pazienti
colpiti da un carcinoma a cellule squamose della bocca. In sostanza volevamo capire se il tipo di mutazione che
subisce p53 nelle diverse forme tumorali è in qualche modo in relazione
con la risposta del paziente alla chemioterapia”.
16 | FONDAMENTALE | GIUGNO 2010
Poiché la terapia chirurgica rimane
la principale cura in questo tipo di malattia, oggi gli oncologi tendono a utilizzare la chemioterapia neoadiuvante, cioè quella somministrata prima di
andare in sala operatoria, al fine di ridurre le dimensioni della massa tumorale e limitare i danni ai tessuti. È evidente quanto questa procedura possa
fare la differenza nel caso di un tumore che colpisce il cavo orale e richiede
quindi interventi anche demolitivi
sulla faccia e sulle strutture della
bocca.
“Non capivamo perché alcuni pazienti rispondevano bene alla chemioterapia mentre altri, invece, rispondevano poco o per nulla” continua Licitra.
In particolare, l’attenzione dei ricercatori milanesi si è concentrata sul
carcinoma a cellule squamose e sulle
caratteristiche di
p53 nelle sue cellule. “In quasi la
metà dei casi, p53
risulta mutata.
Non tutte le mutazioni, però, sono
uguali: alcune rendono p53 completamente inattiva, altre invece permettono alla proteina di mantenere, anche
se in forma ridotta, una certa attività”
Scoperta
spiega Licitra. “E se la mutazione è del
primo tipo (cioè se p53 non funziona
più) la terapia neoadiuvante ha davvero poche possibilità di successo”.
Non ci si ferma qui
Alla luce di questi risultati, utilizzare p53 per predire la risposta del tumore al farmaco potrebbe aiutare i medici
a scegliere la terapia più adatta evitando di sottoporre il malato a trattamenti
inutili. I ricercatori che tentano di portare le conquiste del laboratorio al letto
del paziente, nell’ottica di una terapia
personalizzata del tumore, hanno comunque ben chiaro che basarsi solo
sulle mutazioni di
p53 non è sufficiente. La proteina
collabora infatti
con un numero
molto elevato di altre molecole che in
alcuni casi riescono a sostituirsi a lei
almeno in parte e a portare a termine i
compiti che p53 non riesce più a svolgere a causa di una mutazione.
Ora è chiaro
perché alcuni
rispondono alle
cure e altri no
“”
L’IDENTIKIT
DI p53
di base subito utile
L’obiettivo finale è quindi conoscere meglio la fitta rete di relazioni
di p53 e gli effetti di queste collaborazioni molecolari sulla risposta
alla terapia, per scegliere i farmaci
giusti in grado di ridurre la necessità di intervenire in maniera molto
demolitiva.
Alla ricerca
dei complici
Se c’è chi ha già trovato applicazioni concrete alle sue scoperte su p53,
c’è chi invece ha aggiunto un tassello
importante proprio alla conoscenza
della “rete di complici” di questa proteina. È il caso di Giannino Del Sal, responsabile dell’Unità di oncologia molecolare dell’LNCIB e docente di biologia cellulare presso l’Università degli
studi di Trieste, che insieme al collega
olandese Reuven Agami ha scoperto
un’altra proteina, Brd7, che lavora in
stretta collaborazione con p53. Le due
proteine sono partner nell’attivare i
programmi genetici che bloccano la
proliferazione delle cellule evitando
che queste si moltiplichino senza
freno e diano origine al tumore. Grazie a Brd7, p53 diventa più potente
nella sua azione di “guardiano del genoma” e può lavorare al meglio per
proteggere la cellula. La scoperta, ottenuta anche grazie a finanziamenti di
AIRC, è stata pubblicata su Nature Cell
Biology. “Non conosciamo ancora tutti
i partner che collaborano con p53” afferma Del Sal. “Per questo motivo la
nostra scoperta aggiunge una tessera
al complesso mosaico rappresentato
dai circuiti di molecole che stanno attorno a questo fattore”. Tra l’altro gli
autori dello studio hanno osservato
che, nel tumore del seno in cui p53 è
normale, spesso l’altra proteina manca
o è presente a livelli molto bassi: una
conferma del suo ruolo nella genesi
della malattia. Conclude Del Sal: “In
futuro potremo agire su due fronti per
ottenere risultati simili: con farmaci
che riattivano Brd7 oppure con altri
che potenziano p53. E si sa che avere
più frecce al proprio arco è sempre un
vantaggio”.
La proteina oggi nota col nome di p53 è
stata identificata nel 1979 da Arnold
Levine dell’Università di Princeton, David
Lane dell’Imperial College di Londra e
Lloyd Old dello Sloan-Kettering Memorial
Hospital di New York. Il gene che la
produce (chiamato anch’esso p53 oppure
TP53) è stato invece clonato per la prima
volta nel 1983 da un biologo israeliano,
Moshe Oren, in forze all’Istituto Weizmann
di Rehovot. Solo nel 1989, però, grazie ai
lavori di Bert Vogelstein della Johns
Hopkins School of Medicine, si è capito
appieno il suo ruolo nei tumori.
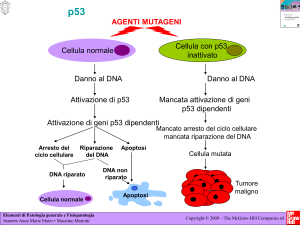
Infatti p53 interviene in molti meccanismi
antitumorali: se il DNA viene danneggiato,
attiva i meccanismi di riparazione; è in
grado di fermare il ciclo di duplicazione di
una cellula fino a quando non vengono
riparati eventuali errori nel materiale
genetico e, infine, può indurre l’apoptosi
(il suicidio programmato) nelle cellule che
non sono riparabili. È quindi un alleato
prezioso nei meccanismi di difesa
anticancro, poiché elimina i tumori
nascenti, prima che facciano danni. Il suo
ruolo è tanto importante che, nel 1993, la
rivista Science l’ha eletta “molecola
dell’anno”.