Nomenclatura e nomi comuni
Struttura e proprietà
Fonti
Reazioni
Derivati degli acidi carbossilici
Sono dei composti che hanno come gruppo funzionale il carbossile costituito da
un carbonile e un gruppo OH legato al carbonio del carbonile.
Il gruppo carbossile può essere scritto in uno dei seguenti
modi
─C
O
OH
R─ C
O
─ COOH
OH
─ CO2H
•I tre atomi del gruppo
carbossilico (ossigeno, carbonio,
ossigeno) hanno ibridazione sp2
e questo permette ai loro
elettroni p di essere
delocalizzati in tutto il sistema.
COOH
COOH
Acido linoleico
HCOOH
Le formiche rosse
producono acido
formico
CH3(CH2)3COOH
Le radici dell’eliotropo
Contengono acido valerico
O
Me
Acido benzoico
OH
Acido acetico
CH3(CH2)nCOOH
Le capre producono gli acidi capronico n= 4,
caprilico n= 6 e caprinico n= 8
• Trovare la catena più lunga di atomi di C, contenente il gruppo COOH.
• Sostituire la –e finale del nome dell’alcano con –oico, facendo precedere la
parola da acido.
• Assegnare un nome e numero ai sostituenti.
• Il carbonio 1 è quello del carbossile
Acidi Alifatici
Acidi Aromatici
Acido o-idrossi benzoico
Acido salicilico
acido 2-(acetilossi)benzoico
Acido acetil salicilico
Per gli acidi Bicarbossilici: la parola acido acido + il suffisso dioico
Acidi bicarbossilici Alifatici
Acido salicilico
Acidi bicarbossilici Aromatici
Alimenti naturalmente ricchi di acido salicilico
sono le albicocche (3 mg/100g), il ribes rosso
e nero (5 mg/100g), la
cicoria (1 mg/100g),le arance (2,4 mg/100g),
l'ananas (2 mg/100g) e i lamponi (5 mg/100g).
OH
HO
O
O
COOH
COOH
HOOC
COOH
CH3
Ac. etandioico
(Ac. Ossalico)
Ac. Butandioico
(Ac. Succinico)
Ac. Ciclopentanoico
Ac. 3-metilbenzencarbossilico
O
Br
H3C
COOH
O
COOH
H2C
COOH
COOH
H3C
Br
Ac. 2-bromopropanoico Ac. 3-oxopropanoico
Ac. Propenoico
Ac. 3-bromo-4-oxopentanoico
H
OH
HO
O
O
Il rabarbaro è fonte
di acido ossalico
Ac. trans-3-clorociclopentancarbossilico
COOH
Acido ciclopentancarbossilico
HOOC
HOOC
COOH
L’acido succinico è
presente nel vino
invecchiato deriva
dalla fermentazione
alcolica
H
C C
H
COOH
COOH
H OOC
COOH
Ac. fumarico
(Ac. trans-2-butendioico)
CH3
C C
H H
Ac. maleico
(Ac. cis-2-butendioico)
HO
Acidi carbossilici a catena alifatica
Acidi bicarbossilici a catena alifatica
• I primi termini della serie sono liquidi incolori con odori pungenti o sgradevoli.
Per esempio l’odore del nostro corpo è formato da una miscela di acidi
carbossilici a lunga catena. Ciascuno di noi ha la propria miscela ed è per questo
che i cani riescono a individuare una persona dopo averne annusato gli indumenti
• Composti polari e, come gli alcoli, formano legami idrogeno con se stessi o con
altre molecole.
• Di conseguenza: punti di ebollizione più elevati, degli alcoli di pari peso
molecolare.
[es. l'acido acetico e l'alcol propilico hanno lo stesso peso formula (60) e
bollono rispettivamente a 118 C e 97 C].
Ciò è dovuto al fatto che si possono formare forti
legami idrogeno che portano
alla formazione di dimeri.
Come dimeri sono solubili
anche nei solventi
relativamente non polari.
Acidi carbossilici
Proprietà chimiche del gruppo carbossilico
Possono essere dedotte dal profilo di distribuzione della carica
elettronica
accumulo di carica negativa
O relativamente basico
Carbonio non particolarmente
elettrofilo
•Il carbonile degli acidi carbossilici è
meno reattivo con i nucleofili rispetto
al carbonile di aldeidi e chetoni per
via della risonanza:
accumulo di carica positiva
H relativamente acido
Acido carbossilico
aldeide
Strutture risonanti della funzione carbossilica
Reazione sfavorita
Rezione favorita
Nu:
Strutture risonanti della funzione carbonilica
Acidi carbossilici
Proprietà chimiche del gruppo carbossilico
La maggiore acidità del gruppo OH del carbossile rispetto a quello alcolico è
dovuta al fatto che l’idrogeno che viene strappato in un acido permette la
delocalizzazione della carica negativa che si forma e non viene bloccata
sull’ossigeno (come in un alcol), ma è distribuita sui due ossigeni per risonanza.
Alcossido (carica negativa ferma)
carbossilato (carica negativa delocalizzata sui due ossigeni)
Infatti i due legami con
C─O, che hanno lunghezza
diversa (1.23 Å il legame
doppio e 1.36 Å il singolo),
diventano di uguale
lunghezza (1.27 Å)
nell’anione carbossilato.
+
Distribuzione della carica elettronica
nell’anione carbossilato
Gli acidi carbossilici si dissociano in acqua dando luogo ad un anione
carbossilato ed uno ione idronio:
Acidi carbossilici
Proprietà chimiche
Acidi carbossilici
Effetto induttivo della risonanza
Fra acidi carbossilici le acidità possono variare a seconda degli altri
gruppi presenti nella molecola.
- Es. tra l'acido acetico e gli acidi mono-, di- e tricloroacetico, l'acidità
aumenta di 10 000 volte, ciò è dovuto all'effetto induttivo dei gruppi
vicini al carbossile.
Il legame ClC diventa polare con il (C +) ed il (Cl -), rispetto a
quanto avveniva con CH3COOH non sostituito. Maggiore è il numero di
atomi di Cl, tanto maggiore è la delocalizzazione della carica e
maggiore la forza dell'acido.
Acidi carbossilici
Effetto induttivo dei sostituenti
L’effetto trasmette la carica lungo i legami, polarizzando gli elettroni di legame
in direzione degli atomi più elettronegativi.
Se il Cl (o un altro atomo molto
elettronegativo) è posizionato su
un carbonio più lontano dal
carbossile, l’effetto induttivo
è molto minore e si riduce
ulteriormente con l’aumentare
della distanza dal gruppo
carbossilato. Quindi l’acido
2-clorobutanoico è molto più
acido del 3-clorobutanoico.
Acidi carbossilici
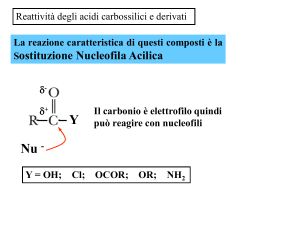
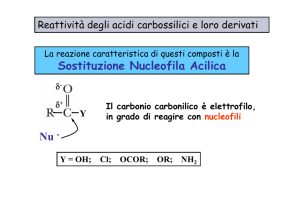
Reazioni degli acidi carbossilici
• La maggior parte delle reazioni degli acidi carbossilici produce derivati ottenuti
tramite un attacco nucleofilo sull'atomo di carbonio carbonilico.
•Tutti si ottengono sostituendo il gruppo -OH di un acido carbossilico con i gruppi
–OR (-SR), -Cl, -NH2, RCOON.B.Tutti i derivati degli acidi
Gruppo
Derivato
carbossilici possono essere
–OR (-SR)
Esteri (Tioesteri)
riconvertiti per idrolisi nell’acido
-Cl
Cloruri acilici
carbossilico
-NH2
Ammidi
RCOO-
Anidridi
Alfa-alogenazione
L’introduzione di un alogeno in posizione alfa rispetto al carbonile di un acido
carbossilico simile a quella vista per aldeidi e chetoni è più difficile (gli acidi
carbossilici presentano una forma
enolica in percentuale inferiore a
quanto avviene per aldeidi e chetoni),
vengono -brominati utilizzando
tricloruro di fosforo come
catalizzatore
reazione di Hell-Volhard-Zelinsky
Derivati degli Acidi carbossilici
Composti nei quali l'ossidrile carbossilico è
stato sostituito da altri gruppi.
Esteri e ammidi sono molto diffusi in
natura e per idrolisi danno corrispondenti
acidi carbossilici.
O
R─C─OR'
Estere
O
R─C─NH2
Ammide
Acidi carbossilici
Reazioni
1.Riduzione
Trattando gli acidi carbossilici con un riducente come l’idruro di litio e alluminio
(Li AlH4) in etere etilico anidro o l’idruro di sodio e boro (NaBH4) in soluzione
acquosa si ottiene il relativo alcol primario
RCOOH(l) + 4 [H]
Acido carbossilico
RCH2OH(l) + H2O(l)
Alcol
2.Reazione con cloruro di fosforo (V)
Quando un acido carbossilico reagisce col pentacloruro di fosforo, il gruppo
OH dell’acido viene sostituito da un atomo di cloro formando il cloruro acilico,
con formula generale RCOCl.
RCOOH
+
PCl5
Acido carbossilico
RCOCl
Cloruro acilico
+
HCl
acido cloridrico
I cloruri acilici sono più reattivi dei corrispondenti acidi carbossilici e nell’industria
sono preferiti per la maggiore velocità delle loro reazioni. Per reazione con
l’ammoniaca danno le ammidi primarie:
RCOCl
Cloruro acilico
+ NH3
ammoniaca
RCONH2 +
Ammide
HCl
acido Cloridrico
3.Esterificazione: reazione
di sostituzione nucleofila
acilica tra alcoli e acidi
carbossilici che, eseguita a
caldo e in ambiente acido per
acido solforico, porta alla
formazione degli esteri, i più
importanti derivati degli acidi
carbossilici.
Poiché
la
reazione
è
reversibile,
bisogna allontanare l’estere
via via che si forma.
Acidi carbossilici
Reazioni
Reazione di esterificazione
Reazione di idrolisi
Nella reazione di idrolisi la molecola di
acqua attacca il carbonio del carbonile
agendo da nucleofilo. La reazione deve
essere catalizzata da acidi per la scarsa
nucleofilicità della molecola dell’acqua
che rende la reazione molto lenta.
Industrialmente gli
esteri si preparano per
reazione dei cloruri
etanoato di 3-metil-1-butile
acilici con gli alcoli (o i
fenoli), dato che questa
L’acetato di isoamile ha un forte odore di banana e
reazione è completa.
viene utilizzato per aromatizzare gli alimenti. Prodotto
in natura dalla pianta di banane, viene sintetizzata a
partire da acido acetico e 3-metil-1-butanolo (alcol
isoamilico). Viene inoltre rilasciato dai pungiglioni delle
api come feromone per attirare altre api.
Quasi tutti gli aromi utilizzati
nell’industria alimentare non sono
esteri naturali ma di sintesi.
Acidi carbossilici
Salificazione
Gli acidi carbossilici reagiscono anche con le basi forti per formare
dei sali.
Esempi per la
nomenclatura
Acidi carbossilici
Salificazione
Proprietà dei Sali
Coda non polare
• Di solito sono solidi e non hanno odore.
• I sali carbossilati di Na+ , K+, Li+ e NH4+
sono solubili in acqua.
• I saponi sono i sali di sodio solubili di
acidi grassi a lunga catena.
Testa polare
controione
H2 O
Acidi carbossilici
Saponificazione
La saponificazione è una reazione acido–base o meglio l'idrolisi basica (di solito si
impiega soda caustica,NaOH) di un trigliceride, che può essere un estere o acido
grasso, per produrre il corrispettivo sale sodico (carbossilato di sodio).
E’ il processo attraverso il quale vengono prodotti i saponi a partire da grassi e
idrossidi di metalli alcalini. Assieme al sapone, i tradizionali processi di
saponificazione producono glicerolo.
Tutte le sostanze che per idrolisi basica possono produrre dei saponi sono dette
“saponificabili” .
Al sapone si possono poi aggiungere additivi per conferirgli caratteristiche
particolari (ad esempio sabbia e pomice per renderlo abrasivo), coloranti e
profumi per migliorarne l’aspetto e la gradevolezza.
Estere di un trigliceride
Sale alcalino
(sapone)
gliceriolo
A seconda del tipo di base utilizzata nella loro preparazione, i saponi acquistano
proprietà differenti. L'idrossido di sodio (NaOH) genera saponi solidi, l’idrossido di
potassio (KOH), dà luogo a saponi liquidi.
Applicazioni dei saponi
La conoscenza della saponificazione è attinente a molti campi delle tecnologie e della vita
di ogni giorno.
Saponi liquidi e solidi
A seconda del tipo di base utilizzata nella loro preparazione, i saponi acquistano
proprietà differenti. L'idrossido di sodio (NaOH) genera saponi solidi, mentre
se si impiega idrossido di potassio (KOH), si formano saponi liquidi.
Grasso al litio
I derivati del 12-idrossistearato e del litio e molti altri acidi carbossilici sono
importanti costituenti di grassi lubrificanti. Nello specifico, i carbossilati di
litio fungono da addensanti. Anche i “saponi complessi” sono piuttosto comuni,
essendo combinazioni di saponi metallici, come saponi di litio e calcio.
Estintori
Gli incendi di grassi di cottura e olii bruciano a temperature maggiori di
quelli causati da liquidi infiammabili, rendendo inefficace un normale
estintore di classe B. I liquidi infiammabili hanno un flash point inferiore a
50 °C. L'olio alimentare è un liquido combustibile, perché ha un punto di
infiammabilità superiore ai 50 gradi. Incendi del genere dovrebbero essere
spenti con un estintore chimico. I dispositivi di questo tipo sono progettati
per estinguere i grassi e gli oli di cottura attraverso la saponificazione.
L'agente estinguente converte rapidamente la sostanza che sta bruciando in
un sapone non-combustible. Questo processo è endotermico, cioè assorbe
l'energia termica dall'ambiente circostante inibendo ulteriormente il fuoco.
https://it.wikipedia.org/wiki/Saponificazione
STORIA DEL SAPONE https://it.wikipedia.org/wiki/Sapone
Meccanismo di azione dei saponi
Utilizzato come detergente, il sapone ha funzione di
tensioattivo. La molecola di sapone è costituita da una
parte idrocarburica (coda) idrofoba, ma solubile in
sostanze organiche poco polari e da un’estremità ionica
(testa) che è invece idrofila. Il potere pulente della
miscela acqua-sapone è attribuito all'azione delle micelle,
piccole sferette rivestite all'esterno di gruppi polari
idrofilici (la testa della molecola) e contenente all'interno
una tasca idrofobica costituita dalle code idrofobiche
che disciolgono le sostanze grasse.
Aggiungendo un sapone all’acqua contenente lo
sporco (in genere di natura grassa), la coda si
scioglie nelle particelle di sporco, mentre la testa
crea dei legami deboli con le molecole dell’acqua.
Agitando l’acqua, lo sporco viene completamente
circondato dal detergente, cioè “solubilizzato” e
rimosso.
Meccanismo di azione di un sapone
Palmitato di sodio
Possono essere preparati in diversi modi, alcuni dei quali sono:
1. Ossidazione di alcoli primari e di aldeidi
2. Ossidazione di catene laterali alchiliche di anelli aromatici
3. Idrolisi dei nitrili
1. Ossidazione di alcoli primari e di aldeidi
Ossidazione di catene laterali alchiliche di anelli aromatici
Gli anelli aromatici sono molto resistenti all’ossidazione anche in presenza di
forti agenti ossidanti quali il permanganato di potassio o il dicromato di sodio (si
ricordi che con il termine di ossidazione si intende l’aggiunta di ossigeno, la
diminuzione di idrogeno o la perdita di elettroni).
Se però un anello aromatico presenta un sostituente alchilico come il gruppo
metilico, etilico, ecc. tali composti possono essere facilmente ossidati:
Ossidazione di catene laterali alchiliche di anelli aromatici
Se non sono presenti legami C─ H di tipo benzilico, si ossida l’anello
aromatico, anche se sono necessarie condizioni più drastiche.
(CH3)3CCOOH
Industrialmente si utilizzano ossidanti diversi dal permanganato di potassio.
L’acido tereftalico, per esempio, uno dei
prodotti di partenza per preparare il
Dacron (polietilentereftalato-PET)
Si produce per ossidazione all’aria in
presenza di Sali di Co (III) come catalizzatori
Il dacron è
una fibra
che rimane
inalterata
all’umidità
L’acido ftalico, usato per preparare resine,coloranti e
plastificanti, si ottiene nelle stesse condizioni di
reazione, per ossidazione dell’orto-xilene
O2,Co(III)
CH3CO2H
acido 1,2-benzendicarbossilico
Braccialetti provenienti
dalla cina e sequestrati
perché contenenti acido
ftalico, aggiunto per
migliorarne la flessibilità
Idrolisi dei nitrili
Il triplo legame carbonio-azoto dei cianuri organici può essere idrolizzato
a carbossile, sia in ambiente acido che basico.
In ambiente acido l’azoto del cianuro si ritrova alla fine sotto forma di ione
Ammonio.
In ambiente basico si forma invece il sale dell’acido carbossilico e ammoniaca.
Per avere l’acido libero, bisogna neutralizzare in uno stadio successivo.
Acidi carbossilici: derivati
I derivati degli acidi carbossilici si ottengono per reazioni di
sostituzione nucleofila acilica del gruppo carbossilico.
Cloruri acilici
Anidridi
Esteri
Ammidi
Nomenclatura dei derivati degli acidi
carbossilici
1) Gli esteri
prendono il nome dall’acido, cambiando il suffisso da -ico
ad -ato, seguito dal nome del radicale alchilico R’presente
nel gruppo –OR’
RCOOR’
2) I cloruri acilici
con struttura:
RCOCl
3) Le ammidi
con struttura
RCONH2
prendono il nome dall’acido, cambiando il suffisso
-ico in –ile.
O
C
R
NH2
prendono
il nome
dall’acido,
cambiando
il suffisso
-oico in
–ammide.
prendono il nome dai
con struttura generale gruppi acilici che le
formano con suffisso
-oico
4) Le anidridi
RCOOCOR’
Anidride etanoica
5) I nitrili, con struttura generale R-C≡N, usano la desinenza –onitrile e la radice
della catena carboniosa più lunga contenente il gruppo ciano. In alternativa
vengono anche nominati come cianuri alchilici.
Etanonitrile
(Cianuro di metile)
CH3CN
Etanonitrile
(Acetonitrile)
(Cianuro di metile)
CH3CH2CN
propanonitrile
(Cianuro di etile)
N.B. I nitrili possono essere classificati come derivati degli acidi carbossilici
perché possono essere convertiti in acidi carbossilici tramite idrolisi.