Acidi carbossilici - Acidi grassi
Prof. Paolo Abis
Lic. Classico “D. A. Azuni”
SASSARI
Acidi carbossilici
Sono caratterizzati dal
gruppo carbossilico
O
C
OH
Hanno formula generale R—COOH
La nomenclatura IUPAC assegna agli
acidi carbossilici il suffisso -oico
Nomenclatura ACIDI
H–C=O
Acido metanoico (formico)
O-H
CH3 – C = O
Acido etanoico (acetico)
O-H
CH3 – CH2 - C = O
Acido propanoico o propionico
O-H
C=O
O-H
Acido benzoico
nome IUPAC
N. atomi C
ac. metanoico
ac. etanoico
ac. propanoico
ac. butanoico
ac. pentanoico
ac. esanoico
ac. ottanoico
ac. decanoico
1
2
3
4
5
6
8
10
nome corrente
ac. formico
ac. acetico
ac. propionico
ac. butirrico
ac. valerianico
ac. capronico
ac. caprilico
ac.caprinico
ossidazione e riduzione
R
CH2OH
alcool
riduzione
ossidazione
O
R
aldeide
C
H
riduzione
ossidazione
O
R
C
acido
OH
caratteristiche
Le caratteristiche del gruppo carbossilico
dipendono dalla presenza del gruppo
ossidrile –OH e del gruppo carbonilico C=O che interagiscono fra loro.
gruppo carbonilico
O
R
C
OH
gruppo ossidrilico
L’acidità del gruppo carbossilico è dovuta
all’effetto elettron attrattore esercitato
dal gruppo carbonilico sul gruppo ossidrilico
gruppo carbonilico
gruppo ossidrilico
Questo fatto determina la polarizzazione elettrostatica
della molecola
accumulo di carica negativa
Ossigeno relativamente basico
O
-
H+
C
O
accumulo di carica positiva
Idrogeno relativamente acido
Polarità del carbossile
d
..d
+
R C
O
..
..
O
..
-
d+
H
Proprietà del carbossile
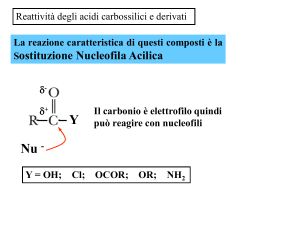
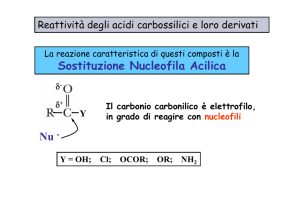
è elettrofilo
R C
In chimica, un elettrofilo è
una specie che prende
parte ad una reazione
accettando un doppietto
elettronico da un'altra
specie (il nucleofilo),
legandosi ad esso.
È pertanto un acido di
Lewis.
+
d
.. dO
..
.. d+
O
.. H
è acido
acidità
R C
O
+ H2O
OH
O
R C
+ H3O+
O
Nel gruppo carbossilico –COOH l’ossigeno legato al carbonio con
il doppio legame esercita una forte attrazione sugli elettroni ed
indebolisce il legame O-H.
Per questo motivo gli acidi carbossilici hanno un comportamento
acido: in presenza di una base si dissociano nell’anione
corrispondente ed in un idrogenione (H+)
Acidità degli acidi carbossilici
Nell’anione carbossilato il contributo delle due strutture di risonanza
all’ibrido è uguale: i legami C–O hanno la stessa lunghezza (tra un
doppio e singolo legame). Questa stabilizzazione porta ad un
considerevole aumento dell’acidità.
Acidità degli acidi carbossilici
—C
O
- H+
O
Proprietà fisiche
Gli
acidi
carbossilici
hanno
punti
di
ebollizione
eccezionalmente alti dovuti in gran parte alla capacità di
associarsi in dimeri che coinvolgono due legami H.
Inoltre la struttura planare favorisce la sovrapposizione dei
dimeri ottenendo una distribuzione ordinata.
il gruppo carbossilico può formare
legami H con l’acqua
Gli acidi carbossilici a corta catena sono solubili in acqua.
L’allungamento della catena li rende praticamente insolubili in
acqua ed aumenta la solubilità nei solventi organici apolari.
Acido metanoico (Formico)
L'acido formico (o acido metanoico) è il più semplice degli acidi
carbossilici. Ha formula chimica HCOOH
È un liquido incolore dall'odore pungente, è corrosivo e, se
tenuto a contatto con la pelle provoca ustioni, distruggendo
l'intero spessore del tessuto cutaneo.
È miscibile in glicerolo, acetato di etile, metanolo e acqua; è
molto solubile in acetone. È un forte agente riducente.
Deve il suo nome alle formiche, nel cui organismo viene
sintetizzato, che lo usano come veleno urticante.
L'uso principale dell'acido formico è come agente conservante
ed antibatterico nei mangimi per animali d'allevamento.
Acido etanoico (acetico)
A temperatura ambiente si presenta come un liquido incolore dal
pungente odore caratteristico. È completamente solubile in acqua ed
etanolo.
È un acido debole;
È un composto molto diffuso in natura, gli organismi superiori lo
impiegano ampiamente come intermedio di sintesi, è anche il prodotto
finale della fermentazione acetica in cui l'etanolo viene ossidato
dall'Acetobacter in presenza di aria.
La sua presenza determina la trasformazione del vino in aceto, in cui
è generalmente presente in quantità variabili comprese tra il 4% e l'8%.
L'acido acetico trova vasti impieghi industriali: è usato per la
produzione di rayon, materie plastiche, pellicole fotografiche, solventi
per vernici e farmaci.
Acidi Grassi
Si chiamano acidi grassi gli acidi carbossilici
alifatici a lunga catena carboniosa.
Si suddividono in:
saturi
insaturi
Solo legami
semplici
Contengono
doppi legami
nome IUPAC
N. atomi C
nome corrente
saturi
ac. tetradecanoico
ac. esadecanoico
ac. ottadecanoico
14
16
18
ac. miristico
ac. palmitico
ac. stearico
insaturi
ac. cis-9-ottadecenoico 18
ac. oleico
Strutture degli acidi grassi saturi ed insaturi
Ogni atomo di carbonio lega
il maggior numero possibile
di atomi di idrogeno
Contengono doppi legami che
influenzano la forma della molecola e
quindi della struttura di cui fa parte
I Lipidi
combinazione di acidi grassi e glicerolo. La maggior
parte dei lipidi neutri è rappresentata da trigliceridi.
Trigliceridi
I saponi
Si chiamano saponi i Sali sodici o potassici degli
acidi grassi a lunga catena carboniosa
Questi sali hanno un particolare comportamento in
acqua dovuto alla coesistenza nella stessa molecola
di regioni sia idrofile che idrofobe.
testa idrofilica o polare
coda idrofobica o apolare
Acidi grassi nell’acqua
Gli acidi grassi sono
praticamente insolubili e, per
la loro più bassa densità,
galleggiano sulla superficie
dell’acqua formando uno
stato monomolecolare in cui
i gruppi carbossilici polari
formano legami H
all’interfaccia con l’acqua
(mentre le catene alchiliche
si allineano tra loro
allontanandosi dall’acqua),
gruppi carbossilici
polari
catene alchiliche
apolari
I saponi formano micelle
i sali di sodio o di potassio degli
acidi grassi sono più solubili e
quando concentrati si assemblano
reversibilmente in aggregati chiamati
micelle.
I saponi formano micelle perché le
porzioni idrofobe si orientano l’una
accanto all’altra nel centro della
micella minimizzando la perdita di
legami H con l’acqua e permettendo
alle porzioni idrofile, gli ioni
carbossilato, di estendersi
nell’acqua circostante partecipando
ai legami H.
Azione detergente del sapone
Estremità idrofobica
micella
Meccanismo d'azione dei
tensioattivi
I tensioattivi attaccano lo sporco e lo
sciolgono mediante la loro catena
idrocarburica. L'acqua poi lo rimuove.
La reazione di saponificazione
I saponi sono sali degli acidi carbossilici a
lunga catena (da 10 a 20 atomi di C)
Si ottengono per idrolisi basica dei
trigliceridi.
O
NaOH
CH2O C R2
O
CH O C R1
CH2OH
O
KOH
+
3NaOH
CH OH
O
CH2O C R3
CH2OH
+ 3R C
O
[Na]