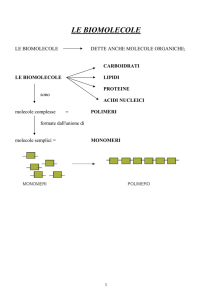
Macromolecole biologiche
E+
trsw**$nee
Tra le molecole organiche più diffuse vi sono le proreine:
anche più del5OVa (in peso secco) della maggior pame
dei sistemi viventi è composto da proteine; solo le piante, per il loro alto contenuto di cellulosa, hanno un contenuto proteico più modesro (meno della metà). Le pro_
utilizzando le letrere deli'alfabeto. Gli organismi, rutra_
via, síntetizzano solo una piccola parte delle proteine
teoricamenre possibili. Il batterio Escberichia colif), che
fa parte della flora batterica intestinale, per esempio,
contiene da 600 a 800 tipi diversi di proteine, mentre la
cellula di una piantao di un animale ne possiede sicura_
mente molti di più. Una cellula del vostro corpo conrie_
ne circa 100 milioni di molecole proreiche di circa
10000 tipi differenti, ciascuno con una funzione particolare e ciascuno, per l'unicità della sua natura chimica,
teine svolgono un'incredibile varietà dí funzioni nei sistemi viventi; per quanto úguarda la loro struttura, tut,
tavia, hanno tutte la stessa semplice impostazione: sono
tutte polimeri di molecole contenenti azoto, gli amminoacidi, disposte in sequenza. Nei sistemi viventi, per
formare le proteine vengono utilizzati fino a 20 tipi di
amminoacidi differenti.
ffi
Le proteine sono grosse molecole che contengono
di amminoacidi; il numero di
possibili combinazioni dei 20 amminoacidi è dar,,vero
enorme, il che rende possibile una grande varietà di pro-
Gli amminoacidi sono costituiti da carbonio, idrogeno e
ossigeno e contengono anche 7'azoto. Ogni amminoaci_
do, cioè il monomero che costituisce i polimeri proteici,
ha un atomo di carbonio cenÚale legato a un gruppo am-
spesso parecchie centinaia
teine, forse tante quante sono le frasí che potete scrivere
ffixxawg$wfuxxxas sem
adibito in modo specifico
a
quella funzione.
&H$ mxmcee#se##*$d$
minico
(-
NH2), a un gruppo carbossilico
(-
COOH)
*s&sffipxe d$ wpesffi#$m$*;*r
"emoglobina e una proteina sintetizH
En
7s13 e trasportata dai globuli rossi
del sangue. Le sue molecole hanno la
speciale proprietà di potersi combinare
debolmente con l'ossigeno, catturandolo
nei polmoni e liberandolo in altre partidel
corpo. La molecola dell'emoglobina ha
una struttura quaternaria formata da
quattro catene polipeptidiche, ognuna
delle quali è costituita da 'l5O amminoa-
cidi ed è ripiegata intorno a un gruppo
contenente ferro, detto eme.
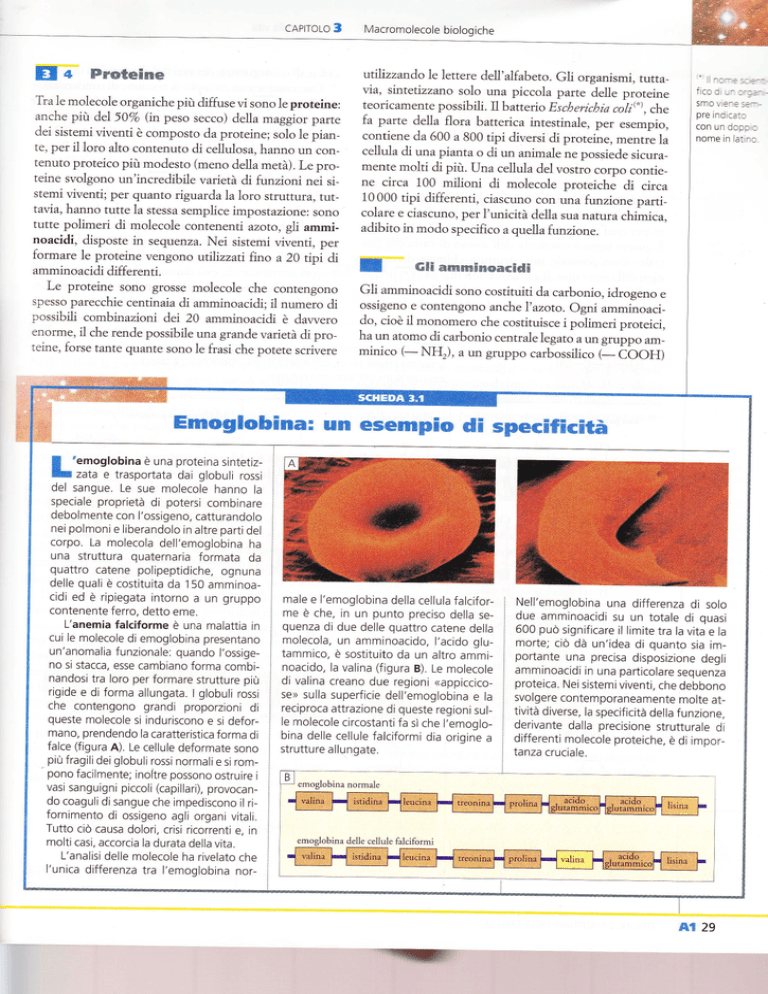
L'anemia falciforme e una maiattia in
cui le molecole di emoglobina presentano
un'anomalia funzionale: quando l'ossigeno si stacca, esse cambiano forma combinandosi tra loro per formare strutture più
rigide e di forma allungata. I globuli rossi
che contengono grandi proporzioni
di
queste molecole si induriscono e si deformano, prendendo la caratteristica forma di
falce (figura A). Le cellule deformate sono
più fragili dei globuli rossi normali e si rompono facilmente; inoltre possono ostruire i
vasi sanguigni piccoli (capillari), provocando coaguli di sangue che impediscono il rifornimento di ossrgeno agli organi vitali.
Tutto ciò causa dolori, crisi ricorrenti e, in
molti casi, accorcia la durata della vita.
L'analisi delle molecole ha rivelato che
male e l'emoglobina della cellula falcifor-
me è che, in un punto preciso della sequenza di due delle quattro catene della
molecola, un amminoacido, l'acido glutammico, è sostrtuito da un altro amminoacido, la valina (figura B). Le molecole
dr valina creano due regioni <appiccicose> sulla superficie dell'emoglobina e la
reciproca attrazione di queste regioni sulle molecole circostanti fa sì che l'emoglobina delle cellule falciformi dia origine a
strutture allungate.
F
Nell'emoglobina una differenza di solo
due amminoacidi su un totale di quasi
600 puo significare il limite tra la vita e la
morte; cio dà un'idea di quanto sia importante una precisa disposizione degli
amminoacidi in una particolare sequenza
proteica. Nei sistemiviventi, che debbono
svolgere contemporaneamente molte attività diverse, la specificità della funzione,
derivante dalla precisione strutturale di
differenti molecole proteiche, è di importanza cruciale.
emoglobina normale
lemoglobina delle cellule falciformi
l'unrca differenza tra l'emoglobina nor-
&ry 29
T|i'
UNITA DIDATTICA
'ffi
Chimica della vita
e a un atomo di idrogeno:
cidi e, di conseguenza, dei vari tipi di proteine.
Osservate ora un esempio di reazione di condensazione (figura Effi1, in cui l'estremità C, carbossilica, di un
amminoacido si collega all'estremità N, amminica, di un
altro con eliminazione di una molecola d'acqua. Il legame covalente che si forma è detto legame peptidico; la
molecola formata dall'associazione di molti amminoacidi è detta polipeptide (figura ffill.
gruppo carbossilico
RO
gruppo
amminico
I
ll
H-N-C-C-OH
ll
HH
Questa è la struttura base della molecola, uguale in tutti
gli amminoacidi. I vari amminoacidi differiscono tra 10ro per quel gruppo, indicato dalla lettera R, che occupa
il quarto legame covalente dell'atomo di carbonio centrale. Esso possiede una struttura chimica diversa in
ogni differente tipo di amminoacido (figura ffi); q""ste differenze sono molto importanti perché determinano le diverse proprietà biologiche dei singoli amminoa-
R
5
" |
HO
il
polri
t{,,,tt,
CH.
'I
HN-C_C-OH
ll
HO
alanina
(a1a)
t{urtt,
- lil
HO
I
H.NI-C-C-OH
I
H"N-C-C-OH
HO
leucina (leu)
'ttl
I
HN*C-C-OH
HO
SH
I
- |
HN-C-C-OH
lt
HO
I
't
I
H.N-C-C-OH
il
HO
treonina (thr)
cisteina (cys)
n
I
(
oo
r*"t
C
,ll
YCH.
HN-C-C-OH
- lil
HO
acido aspartico (asp)
acido glutammico (glu)
|
HO
1l
basici (con carica posit iva
HC-N ttcH
ll|,/
C-NH
I
I
t'
CH.
CH,
tirosina (tyr)
O
\,,C NH"
CH,
CH,
,NH
(>CH
J'
'til
I
H.N-C-C-OH
HO
asparagina (asn)
'til
t'
H.N-C-C-OH
HO
istidina (his)
NH"
I
C:NH
I
'l
t'
HrN-î-f-oH
*t-è-.-.r"
'I
ll
HO
HO
(tp)
metionina (met)
E STRUTTURA DELLE CELLULE
I
CH,
I
H.N-C-C-OH
l":
l
CH.
I
NH
CH,
1".
I
HN-C-C-OH
"
I
\/
3ì]G]NE
t'
CH,
a
pH 7)
t'
I\
/)/
prolina (pro)
30
'I
t"
I
OH
H,N-î-î-oH
HO
A1
t"
HN*C-C-OH
lt
HO
I
CH.
CH"
I
CH,
C
NH.
isoleucina (ile)
fenilalanina (phe)
ooH
\,/C
serina (ser)
H-C-OH
Y
triptofano
HN-C-C-OH
HO
glicina (gly)
()
l-\
" |il
I
pH 7)
ooH
I
CH,
CH.
H-C-CHI
CH,
a
OH
valina (val)
l
I
acidi (con carica negativa
7)
H
î",
CH"
CH
'til
polmi (ma neutri t pH
CH
I
mero di amminoacidi per ognuno dei 20 tipi. Dato che
gli animali sono capaci di sintetizzare solo alcuni dei
propri amminoacidi, essi devono procurarsi tutti gli altri, i cosiddetti amminoacidi essenziali, con la dieta, ingerendo vegetali o carne di animali erbivori.
3.f
I gruppi R possono essere non polari, come nell'alanina,
polari ma privi di carica, come nella serina, acidi o basici e quindi
ionizzalt al pH dell'ambiente cellulare.
I
HN-C-C*OH
non
Per potere assemblare gli amminoacidi in proteine,
una cellula deve avere a disposizione non solo una quantità sufficiente di amminoacidi, ma anche un elevaro nu-
il
HO
glutamina (gln)
I"
QHz
I
CH.
- t"
til
HN-C-C-OH
HO
arginina (arg)
CHr
1".
t'
CH.
t"
I'
HN-C-C-OH
CH.
-tll
HO
lisina (lyg
cAPlToLog
Macromolecolebiologiche
(A) Formazione del legame peptidico. (B) ln seguito all'udi più amminoacidi si forma un poli-
=Î6nione per condensazione
peptide, la cui catena principale è una sequenza di coppie di atomi di carbonio intervallate da un atomo di azoto.
RR
glicina
I
H
- NI- CI -
.ì-:i:aì1:.!.:;!iiliìt:i:;ltt:::
HHO']I
I
c
I- Ill-r,.o1*,:rlii::ltt::ill,.'
,r - HHO
N
C
c
ll
oH
-
H
î', C*:...N-C-Cii
lt l l
OHHO
I
amminoacido
amminoacido
RR
ll
H-N-C - C;,-rt+iN-C -C -OH
t t il l l ll
HHOHHO
tr
X
il
grupPo
mminico
terminale
ffi
dipeptide
*
tuEcÉ'e*là
dE **gmec#effie*ÉesÈ@
Fr#*e*#e
Nelle cellule le proteine sono assemblate in lunghe catene polipeptidiche in cui gli amminoacidi si susseguono
uno dopo I'altro. In queste molecole I'estremità C di un
amminoacido si lega all'esremità N di quello successivo,
come i vagoni che compongono un treno. La sequenza
lineare di amminoacidi in una particolare proteina, che
viene dettat a da77e ínformazioni ereditarie presenti nel
nucleo della cellula, è detta struttura primaria della proteina (figura ffi1. Ogni proteinaha una sua diversa
struttura primaria; essa determina le caratterisdche srutturali della molecola nel suo complesso e, quindi, la
sua funzione biologica. Anche una piccola variazione
della sequenza può alterare o distruggere la sua funzionalità e rendere la proteina inutllizzabile o, addirittura,
dannosa per l'organismo.
Una volta assemblata, lungo la caÍeflapolipeptidica incominciano ad avere luogo delle interazionitraivaú un'
minoacidi che la fanno in parte ripiegare su se stessa ín
una configurazione semplice detta struttura secondaria.
Una comune struttura secondaria è quella a spirale o, come viene detta più comunemente dai biochimici, a elica;
la forma di questa struttura è mantenuta da legamí idrogeno (figura ffi1. Poiché i legami idrogeno si spezzano
e si riformano facilmente,le proteine elicoidali (o, meglio,
le parti elicoidali delle proteine) sono elastiche. Esempi di
tali proteine sono la miosirca, che è uno dei principali
componenti del tessuto muscolare, ela cheratirca, la proteina presente nei capelli, Quando laviamo
e
asciughiamo
polipeptide
i capelli la piega eambia per effetto della rottura e della
formazione di nuovi legami idrogeno.
Altre proteine, come i fili di seta deibozzolie delle tele
dei ragni, sono costituite da lunghe catene polipeptidiche
allineate in file parallele e unite tra loro da legami idrogeno; le proteine che presentano questo tipo di struttura secarbonio
idrogeno
ossrgeno
TE-
Struttura secondarìa a elica; i legami idrogeno colÈgano un
gruppo NH della catena con un gruppo
O che si trova tre amminoacidi più avanti. I gruppi R sporgono verso l'esterno dell'elica.
C:
ffi
Struttura primaria di una proteina relativamente piccola,
l'ormone adrenocorticotropo.
Af 31
UNtTA DTDATT|CA
{
Chimica della vita
Wffi
sbonio
Funzioni biologiche delle proteine
Tipo di
proteine
Esempi
,
proteinestrutturali
collagene,seta, involucrivirali, microtubuli
di
proteine
regolazione
ormoni della crescrta
:
actina,miosina
t.
proteinecontrattili
proteine di trasporto
I
proteine di
riserva
difesa
proteine di
nel sangue
dei vertebrati
proleine
insulina, ormone adrenocorticotropo,
emoglobina, mioglobina
albume dell'uovo, proteine dei semi
anticorpi, complemento
recettori, proteine di trasporto, antigeni
di membrana
3.'19 Struttura secondaria
R
a foglio ripiegato. I gruppi
sporgono sopra e sotto il ptano di questa pagina.
condaria, detta afoglio ripiegato (figura
e soffici, ma non elastiche.
17
tossine
enzimi
ffi
) , sono lisce
collagene, un componente
fondamentale della cartilagine, delle ossa e dei tendini, ha
un altro tipo ancora di struttura secondaria; le molecole
di collagene sono prodotte da cellule specializzate chiamate fib rob la.r/i. Mentre vengono sintetizzate, le lunghe
catene polipeptidiche si awolgono a tre per volta l'una
sull'altra per formare una molecola simile a un cavo; queste molecole si raggruppano poi in lunghe e sottili fibrille.
Le proteine che per gîan parfe della loro lunghezza
hanno una struttura secondaria elícoidale, a foglio ripiegato o a forma di cavo sono dette proteine fibrose; esse
hanno diversi e importanti ruoli strutturali negli organismi (figura ffi1.
tossina botulinica, tossina difterica
saccarasi, pepsina
In altre proteine, dette proteine globulari, la struttura
secondaria si ripiega su se stessa per formale una comstruttutateniatial questa struttura si forma come
risultato di interazioni tra i gruppi R degli amminoacidi
plessa
che la compongono. Le interazioni comprendono sia
l'aftrazione o la repulsíone tra amminoacídi con gruppo
R polare sia la repulsione rra i gruppi R non polari e le
molecole d'acqua circosranti. lnoltre, i gruppi R contenenti zolfo dell'amminoacido cistein a (uedi figwaffi|)
possono formare legami covalenti ra loro; questí legami, detti ponti disolfuro, collegano in modo saldo alcune parti delle molecole proteiche.
Le proteine fibrose sono in genere molecole con una
limitata varietà di amminoacidi ripetuti molte volte
lungo la sequenza. Molte proteine
globulari, invece, hanno sequenze
di amminoacidi irregolari e moko
complesse, come irregolare e complessa è la sequenza di lettere, per
esempio, in una frase di questa pagina. Proprio come queste frasi
hanno senso
(se 1o
hanno) perché le
lettere sono quelle giuste e sono
poste nell'ordine giusto, le proteine hanno senso, in biologia, perché
gli amminoacidi sono quelli giusti e
nell'ordine giusto.
Gli organismi viventi sintetizzano una grande varietà di proteine
globulari; tra queste ci sono glíanticorpi, che sono importanri componenti del sistema immunitario; i re-
ff
La cheratina, una proteina fibrosa, è la principale componente di lana, unghie,
penne (A) e del corno del rinoceronte (B), formato da filamenti di cheratina strettamente ammassati.
A1
32
ORIG.NE E STRUTTURA DELLE CELLULE
cettori presenti sulla superficie delle membrane cellulari, che interagiscono con un certo numero di mole,
:
w
@
@
w
gruppo em€
@
e
catena
W
ffi
&
polipeptidica
stru(lura F*I
FH
e#
ffiffffi
$
struttufa
prlmana
secondaria M
T)ì*
L'emoglobina è una proteina a struttura
quaternaria formata da quattro subunità a due a
due uguali tra loro. (A) Sequenza lineare di amminoacidi della struttura primaria di una delle quattro
cole; e gli enzimi, che regolano le rcazioni chimiche che
awengono negli organismi. Gli enzimi sons catalizzatori proteici, cioè sostanze in grado di far ar,rzenire velocemente le reazioni chimiche che si svolgono nelle cellule;
senza enzimi la maggior parte di queste reazioni si svol-
gerebbe tanto lentamente da risultare non idonea ai
processi vitali.
Come vedremo nei capitoli successivi, le strutture tridimensionali di tutte queste proteine sono di fondamentale importanzanella determinazione delle funzioni biologiche di ciascuna (tabella
Molte proteine sono formate da più di una catena polipeptidica; queste catene sono tenute insieme da legami
ffi1.
idrogeno, ponti disolfuro, forze idrofobe e da attrazioni
eleftrostatiche tra cariche positive e negative. Questo livello di organizzazione delle proteine, che comporta
f interazione fra due o più polipeptidi, è chiamato smuttura quatern aúa (figura ffi1.
In una proteina, le strutture secondarie, terziarie e
quaternarie dipendono tutte dalla struttura primaria,
cioè dalla sequenza lineare degli ammínoacidi.
StfUttUIa ffi
tr*
terzlarra ffi
StrUttUIa
ffir
quaternaria ffi
subunità; (B) un tratto awolto a elica della struttura secondaria;
(C) struttura lerztaria con il gruppo eme; (D) quattro catene polipeptidiche, ciascuna con la propria struttura terziaria, formano la
struttura quaternaria.
ffi w
ffiwe$ewÉ$d6
e #ffiFd$ aeacs$e$e#
Llinformazione che, all'interno delle cellule dí tutri gli
organismi viventi, dirige la sintesi dell'enorme varietà di
molecole proteiche è codificata dalle molecole degli acidi nucleici. Proprio come le proteine, che sono costituite
da lunghe catene di amminoacidi, gli acidi nucleici sono
formati da lunghe catene di nucleotidi.
Come si vede nella figura ffit, un nucleotide è formato da tre parti: un gruppo fosfato, uno zucchero a cinque atomi di carbonio e una base azofafa (una molecola
che ha proprietà basiche e contiene azoto). Il gruppo fosfato (POi-) è uno ione dell'acido fosforico (HrPOo) ed
è la parte del nucleotide che possiede proprietà acide, da
cui il termine <<acido nucleico>>. Lo zucchero di un nucleotide può essere I ribosio (un monosaccaride a 5 afomi di carbonio) o il deossiribosio, che contiene un atomo
di ossigeno in meno rispetto al ribosio. Nei nucleotidi,
cioè nei <<mattoni>> degli acidi nucleici, si possono trovare cinque differenti tipi di basi azofafe; nel nucleotide
della figura ffi h base azotataè I'adenina.
NH,
t"
$&Kffi #$SS&mS * €Clg*€€YYX
l,
#TS
ffi
r;
Quoli gruppi chimici sono comuni o tutti
gli omminoocidi? Quole gruppo li differenzio?
Che coso s'intende per
strutturo
H.
r*''f,-t--l
-c-,*zc-H
base
aT.otafÀ
pimaio
di uno proteino?
ffi
Quoli sono le proteine fibrose? Fqi olcuni esempi. Quol è il loro livello strutturole?
m
Quol è lo fi:nzione dei ponti disoifuro?
ffi
Che coso s'intende per
ffi
strutturo terzioio
OH
OH
zucchero
di uno proteino?
Ctre coso sono
gli enzimi?
3.22 Un nucleotide è formato da tre parti: un gruppo fosfato,
uno zucchero a cinque atomi di carbonio e una base azotata.
es
33
UNITA D|DATTTCA
d&
Negli organismi viventi esisrono due tipi di acidi nuclei_
ci; nell'acido ribonucleico (RNA) lo zucchero del nucleotide è il ribosio, mentre nell'acido deossiribonuclei-
(DNA) è il deossiribosio. Come tutti i polimeri, anche
I'RNA e il DNA sono formari du monom.ri, i nucleotidi,
che si collegano I'uno all'alro in lunghe catene tramite
co
r
eazioni di condensazione (figura
ffi
I'RNA giocano in genere ruoli biologici differenti. Il DNA porta il messaggio genetico, cioè contiene
ie informazioni, organizzate in unità dette geni, che noi e
gli altri organismí ereditiamo dai genítori. 'È. grazie a
queste informazioni che ogni celluia dell,organismo può
assemblare correttamente tutte le sue proteirr. porr.ndo
gli amminoacidi nella giusta sequenzai a una specifica
sequenza di nucleotidi presente nel DNA corrisponde
una precisa sequenza di amminoacidi di una determina_
e
base
7Z
lorfrto
-r ,-..
. 1,. \l
."f'jl"
4-
Otata
j
base
azoiata
fosfato
Fosfato ll:li
ta proteina.
LRNA
è una copia del messaggio generic,_
portato da un pezzetto di DNA ch. permette la sintes,
proteica nel citoplasma della cellula.
La scoperra della srrumura e della funzione di ques,.
molecole è senza dubbio il più grande trionfo .onr.gu
to nel campo della biologia molecolare.
l.
Sebbene le loro strutrure chimiche siano molto simili,
iI DNA
Chimica della vita
ffi
+*YÉ+- e.e
d+*$*
b*6JÉ:
j"fi € -d{+,É1b
s-
+r*ÉEBÈff#
Oltre al loro ruolo di <<mattoni>> degli acidi nucleici, i nu_
cleoddi hanno una funzíone indipendente e fondamen_
tale negli organismi viventi. euando sono modificari
dall'aggiunta di altri due gruppi fosfaro, essi diventano i
trasportatori dell'energia necessaria alle numerose rea_
zioní chimíche che awengono all,interno della cellula.
Lenergia contenuta nei carboidrati di riserva, come 1,amido e il glicogeno, e nei lipidi è, in un certo senso, paragonabile al denaro che viene conservato in banca o in
Buoni del Tesoro, ossia non immediatamente disponíbi_
le. I- energia contenuta nel glucosio è accessibile ma
non
utilizzablleper ie piccole spese, come accade per
:.empre
il denaro sotto forma di assegni. L,energia presente in
quei particolari nucleotidi, invece, è come se fosse dena_
ro_contante, disponibile in quantítà sufficíente e spendibile subito.
Negli organísmi viventi il principale trasporrarore di
energia che partecipa alTa maggior parte dei processi è
una molecola conosciuta come adenosina trifosfato o
ATP. Nella figura ffi potere norare i tre gruppi fosfa_
to. I legami che tengono uniti questi tre gr,rppi, rappre_
sentati graficamente con una linea ondulata, sono relad_
vamente deboli e possono rompersi piuttosto facilmente
per idrolisi. I prodotdlglla reazione piu comune (quella
illustrata nella figura ffi ) .ono adenosina difosfato o
ADP, un gruppo fosfato ed energia. euando viene libe_
rata, questa energia può essere impiegata in altre rcazio,
ni chimiche.
LADP viene <<ricaricaro>> in ATp quando il glucosio è
ossidato in anidride carbonica e acqua, proprio come il
vostro portafoglio sí <<ricarica> quando cambiate un
as_
fosfato
adenina
baie
p6)p(\tp_--.r^..
s*ppiro,rrro (rs*r)
azotata
fosfatcr
I
E:-
adenosina trifosfato (ATp)
fosfato
-eqhènl.r
dì
rr rì
fÍ
t
$
$
CAPITOLO
P(\)P<\)P
3
Macromolecole biologiche
Hzo
P(\)P
adenosina trifosfaro (ATP)
enetsia
adenosina difosfato (ADP)
3.2s Schema dell'idrolisi dell'ATp: aggiungendo una molecola
d'acqua si forma ADP e si liberano un gruppo fosfato ed energia.
:
segno o prelevate denaro presso uno sportello automatico bancario. Per il momento è impofiante solo tenere a
ijl:i:; t:,|:tli:lt;
I
i
lt
p&ffi trgsss&&ffi $ g&w€ffiY*rè
mente che I'ATP è la molecola direttamente coínvolta
negii scambi energetici della cellula, srruttura di cui ci
occuperemo in dettaglio nei prossimi tre capitoli.
ffi
&"r#
ffi
w
Do quoli porti è costituito un nucleotide?
Quoli sono gli ocidi nucleici presenti negli orgonismi viventi?
ìn che coso differiscono tro loro?
Quoi è lo strutturc molecolore dell'ATp e dell,ADp7
&:* Quol è lo funzione di ATP e
ffi
Lu chimica degli organismi viventi è,
essenzial-
mente, la chimica dei composti organici, cioè dei com-
posti
con
ffir
Le molecole organiche vengono classificate in
gruppi funzianali in esse presenri e che confe-
-
tenenri carbonio,
base ai
riscono loro specifiche proprietà.
*
Wrr..
Nei sistemi viventi, i carboidrati, i lipidi, le proi più importanti tipi di
teine e gli acidi nucleici sono
molecole organiche,
ffiffi i carboidrati sono la risorsa primaria di energia
i sistemi viventi. I carboidrati più semplici sono i monosaccaridi. I monosaccaridi possono
chimica per
combinarsi e formare i disaccaridi e i polisaccaridi.
*
I disaccaridi e i polisaccaridi vengono prodotti
mediante reazioni di condensazione, in iui i monosaccaridi si uniscono tramite legami covalenti con eliminazione di una molecola d'acqua, e possono essere
scissi di nuovo per idrolisi con I'aggiunta di una molecola d'acqua.
ffi I lipidi sono molecole
organiche idrofobe che,
insieme ai carboidrati, hanno un ruolo importante
come componenti sffutturali e di riserva energetica. I
fosfolipidi e i glicolipidi sono i principali componenti
delle membrane cellulari.
ADp negli orgonismi viventi?
ffi L" proteine sono molecole molto grandi compo_
ste da lunghe catene di amminoacidi, dette catene
polipeptidich e. I 20 diversi amminoacidi che si trovano_nelle proteine differiscono tra loro per le proprietà
del
_gruppo R. Alcune proteine hanno un importante
ruolo $rutturaTe; altre, come gli enzimi e gli ormoni,
sono globulari e hanno funzioni specifichÉ. Vi sono
quattro principali livelli di organizzazione proteica.
*
L'esatta struttura di una molecola proteica è di
fon.damentale impofianza in relazione ailà sua capaci_
tà di svolgere una specifica funzione biologica.
ffi I <<matroni>
che compongono gii acidi nucleici
sono molecole complesse dette nucleotidi. Un nucleo_
tide è costituito da un gruppo fosfato, uno zucchero a
cinque atomi di carbonio e una base azotata.
*
L'acido deossiribonucleico (DNA) è la molecola
che contiene I'informazione genetica. L,acido ribonucleico (RNA), invece, è una copia di questa informazione e {unziona da traccia per la sintesidelle proteine.
.-* I nucleotidi parrecipano anche
agli scambi
ffir
ener_
getici che accompagnano le reazioni chimiche dei
sistemi viventi. Nella maggior parte dei processi il
principale trasportatore di energia è l'adenósina trifosfato (ATP).
&s
--'{F
35