bollettino d’informazione sui farmaci
ANNO XII N. 2
59
2005
Bifosfonati e placebo:
cronaca di una love story
Riassunto
Abstract
Background. L’osteoporosi è uno dei maggiori
problemi di salute pubblica che coinvolge oltre 75
milioni di persone in Europa, Stati Uniti e
Giappone con un rischio stimato del 15% di
andare incontro ad una frattura vertebrale, del
polso o dell’anca nell’arco della vita. Le donne in
menopausa rappresentano la popolazione a più
alto rischio di andare incontro ad osteoporosi.
I bifosfonati costituiscono una terapia di
provata efficacia nel trattamento dell’osteoporosi
post-menopausale.
Obiettivo. Il presente articolo offre un’analisi
critica e aggiornata degli studi clinici presentati alle
agenzie regolatorie, relativamente ai bifosfonati registrati per il trattamento dell’osteoporosi post-menopausale, con riferimento particolare agli endpoint e ai farmaci di confronto utilizzati nei trial.
Metodi. Valutazione degli studi presentati nei
dossier registrativi, consultazione delle banche
dati Medline e Cochrane Library (archivio delle
revisioni sistematiche e registro dei trial controllati) e delle linee-guida dell’EMEA e della FDA
relative agli studi sull’osteoporosi.
Risultati. Gli studi registrativi e post-registrativi
sino ad oggi condotti hanno mostrato che il trattamento con bifosfonati in donne osteoporotiche
in post-menopausa riduce il rischio di fratture vertebrali e non-vertebrali, incrementa la densità minerale ossea e diminuisce i marker del turn-over
osseo, rispetto a quelle trattate con placebo.
Conclusioni. I costi sanitari per la cura dell’osteoporosi crescono di pari passo con l’aumento
della popolazione anziana; si prospetta che il
numero di fratture da osteoporosi superi i sei
milioni nei prossimi 50 anni. Genera molte perplessità il lancio sul mercato di prodotti “me-too”,
senza che questi vengano prima confrontati con i
farmaci esistenti e senza averne valutati i maggiori
vantaggi, rispetto alle terapie disponibili, per i pazienti e per la salute pubblica. Per questo è necessario implementare dei programmi nazionali di
monitoraggio post-marketing per valutare il reale
valore aggiunto dei nuovi prodotti.
Background. Osteoporosis is a major public
health problem, affecting more than 75 millions
people in Europe, United States and Japan, with an
estimated lifetime risk for vertebral, hip and wrist
fractures of around 15%. Particularly postmenopausal women are at high risk to develop osteoporosis. Biphosphonates are potent inhibitors of bone
resorption and represent 70% of the worldwide
market for drugs used to treat osteoporosis.
Objectives. Aim of the article is to critically
evaluate the studies of biphosphonates which have
been licensed for the treatment of postmenopausal
osteoporosis in USA and in the European Union in the
past ten years.
Methods. We examined the characteristics and
bases for approval of biphosphonates and the FDA
and EMEA “Guidelines for preclinical and clinical
evaluation agents used in the prevention or treatment
of postmenopausal osteoporosis”. We searched
Medline, the Cochrane Library and the Cochrane Controlled trials registry from 1995-2004.
Results. Compared to placebo, biphosphonates
reduce the risk of clinical fractures, increase bone
mineral density and decrease biochemical markers of
bone remodelling in osteoporotic postmenopausal
women.
Conclusions. The health care costs related to
osteoporosis are growing in parallel with increases
in elderly population and it is expected that the
number of osteoporotic fractures will exceed six
millions over the next 50 years. According to the
EMEA and FDA Guidelines studies comparing new
drugs with placebo are enough to get a marketing
authorisation. However launching on the market
“me-too” drugs without having compared them with
existing therapies and without having assessed their
advantages for the patients and the public health
over the already existing therapies cast several
doubts. So we think there is an urgent need to
establish National post-marketing programs to
assess the added value of new drugs and a lasting
reimbursement should be granted only in the
presence of positive results of such studies.
AIFA - Ministero della Salute
60
AGGIORNAMENTI
Introduzione
Clinical Evidence (www.clinicalevidence.com)
indica i bifosfonati, potenti inibitori del riassorbimento osseo, quale terapia di provata efficacia nel
trattamento dell’osteoporosi post-menopausale e
considera alendornato e risedronato farmaci di
prima scelta. In Italia, alendronato, risedronato e raloxifene sono classificati in fascia A con nota 79, indicati per la profilassi secondaria di fratture osteoporotiche in donne in post-menopausa con
pregresse fratture vertebrali.
Obiettivo di questo lavoro è quello di ripercorrere lo sviluppo dei bifosfonati, registrati per il
trattamento dell’osteoporosi post-menopausale,
analizzando gli studi inseriti nei dossier registrativi
con particolare riferimento agli end-point e ai
farmaci di confronto utilizzati nei trial. I disegni
degli studi registrativi sono stati raffrontati con
quanto suggerito dalle linee-guida della European
Medicine Agency (EMEA, www.emea.eu.int) e
della U.S. Food and Drug Admnistration (FDA,
www.fda.gov) sull’osteoporosi.
L’osteoporosi è un disturbo caratterizzato da
una riduzione della massa ossea e da un’alterazione della microarchitettura del tessuto osseo,
con conseguente incremento della fragilità ed aumentato rischio di andare incontro a fratture1.
Operativamente l’Organizzazione Mondiale della
Sanità (OMS) ha definito osteoporosi una densità
minerale ossea (T score) inferiore di 2,5 deviazioni
standard (SD) rispetto al valore medio di picco rilevato in giovani adulti. Tale definizione è utile
quale criterio di inclusione/esclusione in studi
clinici o come strumento per valutare l’epidemiologia dell’osteoporosi, mentre presenta diversi
limiti nella normale pratica clinica2. Uno studio
condotto dall’OMS ha evidenziato che attualmente l’osteoporosi interessa oltre 75 milioni
di persone in Europa, Stati Uniti e Giappone con
un rischio stimato del 15% di andare incontro ad
una frattura vertebrale, del polso o dell’anca nell’arco della vita3. In Italia lo studio epidemiologico ESOPO, condotto in medicina generale nel
2001 e che ha visto il coinvolgimento di 83 centri
sparsi su tutto il territorio nazionale, ha rivelato
che il 23% delle donne oltre i 40 anni e il 14%
degli uomini con più di 60 sono affetti da osteoporosi. Le donne sono circa 4 volte più a rischio
degli uomini di sviluppare osteoporosi, una
donna su 2 e un uomo su 8 di età superiore ai 50
anni avrà una frattura nell’arco della propria vita
(www.epicentro.iss.it/focus/osteoporosi). L’età,
il sesso femminile, la presenza di patologie tiroidee o epatiche, il trattamento prolungato con
corticosteroidi, interventi di isterectomia o una
menopausa precoce, fratture pregresse legate a fragilità ossea o una storia individuale di cadute, il
fumo e un indice di massa corporea (BMI) < 19
costituiscono i maggiori fattori di rischio per l’osteoporosi3. In generale le donne con una ridotta
massa ossea (T score ≤ 2,5 DS), soprattutto se in
menopausa, quando il processo di perdita ossea è
ulteriormente accelerato, rappresentano la popolazione a più alto rischio di andare incontro ad
osteoporosi4. Le terapie attualmente disponibili
per il trattamento dell’osteoporosi post-menopausale sono costituite dai bifosfonati, dalla
terapia ormonale sostitutiva (TOS), dai modulatori dei recettori per gli estrogeni (raloxifene),
dai derivati della vitamina D e dai regolatori dell’ormone paratiroideo (teriparatide). Indipendentemente dalla terapia prescritta, viene sempre raccomandata l’associazione di calcio e vitamina D.
Materiali e metodi
Sono stati valutati gli studi registrativi inclusi
nei dossier di alendronato, risedronato ed ibandronato presentati alla FDA e all’EMEA. È stata
inoltre effettuata una ricerca bibliografica, consultando Medline e la Cochrane Library (archivio
delle revisioni sistematiche e registro dei trial controllati), per verificare l’eventuale pubblicazione
di tali studi e quella di altri trial condotti in fase
post-registrativa. Sono state infine analizzate le
linee-guida relative agli studi sull’osteoporosi realizzate rispettivamente da EMEA e FDA.
Risultati
Nel 1995 l’alendronato viene registrato negli
USA per il trattamento dell’osteoporosi post-menopausale, nello stesso anno il farmaco è
lanciato sul mercato europeo. Nel 2000, con la
stessa indicazione, viene approvato il risedronato sia in Europa che negli USA. Nel maggio
del 2003 la FDA registra il terzo bifosfonato per
l’osteoporosi post-menopausale: ibandronato.
Un anno dopo, lo stesso farmaco viene autorizzato all’immissione in commercio anche dall’EMEA. Nella tabella I sono riportate le caratteristiche essenziali degli studi registrativi pivotal
relativi ai tre bifosfonati.
AIFA - Ministero della Salute
61
bollettino d’informazione sui farmaci
ANNO XII N. 2
2005
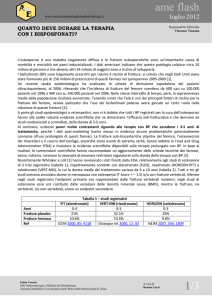
Tabella I – Caratteristiche degli studi registrativi pivotal relativi ai tre bifosfonati.
Farmaco
Alendronato
(FIT)
Risedronato
(VERT-NA)
Studio
pubblicato
Paese
Posologia
Durata
studio
No.
Pazienti
End-point
primari
%RRR
(IC 95%)
%RRA
NNT
Data
registrazione
Lancet 1996;
348: 1535-41.
USA
5-10 mg/die
3 anni
2027
Nuove
fratture vertebrali
47 (32-59)
7,0
14
FDA-1995
JAMA 1998;
280: 2077-82.
USA
5-10 mg/die
4 anni
4432
Fratture cliniche
Fratture vertebrali
36 (18-50)
44 (20-61)
6,5
1,7
15
58
JAMA 1999;
282: 1344-52.
Nord
America
5 mg/die
3 anni
2458
Nuove
fratture vertebrali
41 (18-57)
5,0
20
FDA-2000
Fratture
non-vertebrali
40 (6-61)
3,2
31
EMEA-2000
Risedronato
(VERT-MN)
Osteoporos
Int 2000;
11: 83-91.
Europa/
Australia
5 mg/die
3 anni
1226
Nuove
fratture vertebrali
49 (27-64)
10,9
9
Ibandronato
J Bone Miner
Res 2004;
19: 1241-9.
Europa/
Nord America
2.5 mg/die
20 mg*
3 anni
2946
Nuove
fratture vertebrali
62 (41-75)
50 (26-66)
4,9
4,7
20
21
FDA-2003
EMEA-2004
* 20 mg a giorni alterni per 12 giorni ogni 3 mesi.
RRR, riduzione relativa del rischio; RRA, riduzione assoluta del rischio; NNT, numero di pazienti che devono essere trattati per prevenire un evento.
Figura 1 – Alendronato:
flow-chart dello studio postregistrativo originario e delle
successive estensioni.
994 (804) pazienti sottoposti a randomizzazione
202 (164) assegnati
a 5 mg
di alendronato
196 assegnati
a 10 mg
di alendronato
397 (322) assegnati
a placebo
Studio di 3 anni
199 (160) assegnati
a 20 mg
di alendronato
per 1-2 anni e
5 mg per 3 anni
1° estensione, 4-5 anni
143 (114) assegnati
a 5 mg
di alendronato
145 (112) assegnati
a 5 mg
di alendronato
151 (120) assegnati
a 10 mg
di alendronato
288 (232) assegnati
a 10 mg
di alendronato
2° estensione, 6-7 anni
115 (97) assegnati
a placebo
113 (92) assegnati
a 5 mg
di alendronato
122 (105) assegnati
a 10 mg
di alendronato
ineleggibili
per un ulteriore
studio
3° estensione, 8-10 anni
83 (51,9% di 160)
assegnati a placebo
78 (47,6% di 164)
assegnati a 5 mg
di alendronato
86 (54,4% di 158)
assegnati a 10 mg
di alendronato
Per un’analisi completa della “storia” dei bifosfonati è interessante valutare il quadro relativo
agli studi realizzati sui tre farmaci in fase post-registrativa.
La figura 1 ripercorre dieci anni di studi
condotti su alendronato5. Nel primo trial, durato
3 anni, le pazienti trattate con 10 mg/die del
farmaco hanno riportato una RRR pari al 48% (IC
95% 5-72), ed una RRA del 3%, nel numero di
fratture vertebrali rispetto a coloro che avevano ricevuto placebo6. Le donne che avevano terminato
lo studio erano state incluse in 3 estensioni successive, durate complessivamente 7 anni, dove
l’efficacia dell’alendronato è stata valutata in
termini di densità minerale ossea e di marker bioumorali, mentre le fratture venivano considerate
come semplici misure di safety. In tabella II sono
sintetizzati i risultati in termini di incremento
AIFA - Ministero della Salute
62
AGGIORNAMENTI
Tabella II – Incremento medio in 10 anni della densità minerale ossea a seguito della somministrazione di aledronato 10
mg/die.
Siti ossei
No. Pazienti
% Variazione (IC 95%)
Tratto lombare della colonna
70-80
13,7 (12,0-15,5)
Collo femorale
70-77
5,4 (3,5-7,4)
Troncatere
69-76
10,3 (8,1-12,4)
Anca
44-49
6,7 (4,4-9,1)
Total body
52-56
2,9 (1,9-3,9)
medio della densità minerale ossea dopo 10 anni5.
L’efficacia di alendronato nell’osteoporosi postmenopausale rispetto al placebo è stata confermata in numerosi altri studi. In particolare una
metanalisi relativa a 11 RCT, per un totale di
12.855 donne, ha evidenziato che dosi > 5 mg/die
del farmaco hanno ridotto il RR di fratture vertebrali del 48% (IC 95% 35-57) e dosi comprese tra
10-40 mg/die hanno determinato una RRR per le
fratture non vertebrali del 49% (IC 95% 31-62)7.
Anche per risendronato si ritrovano in letteratura numerosi studi eseguiti dopo la sua commercializzazione. Una metanalisi di 8 RCT vs
placebo, con 14.832 donne coinvolte, ha riportato
una RRR delle fratture vertebrali del 36% (IC 95%,
23-46) e di quelle non-vertebrali del 27% (IC 95%,
13-39) in donne osteoporotiche in post-menopausa
trattate con dosi > 2,5 mg/die di risedronato8.
Nel caso di ibandronato, l’“ultimo nato”, un’analisi delle linee di ricerca sviluppate dalle industrie farmaceutiche9 evidenzia un orientamento
a condurre trial in cui viene testata l’efficacia del
farmaco per via e.v. oppure, come già avvenuto
per alendronato e risendronato, di formulazioni
somministrabili settimanalmente o mensilmente.
condotti studi che abbiano confrontato i bifosfonati con altre terapie, per le quali è stata dimostrata un’efficacia paragonabile, né tantomeno
risedronato ed ibandronato sono stati confrontati
con alendronato, il capostipite del gruppo.
FDA ed EMEA non sembrano porre particolare
attenzione alla “questione placebo”, quasi indifferenti al dibattito che questa ha suscitato a
partire dall’ultima revisione della Dichiarazione
di Helsinki10 che ha rafforzato i dubbi sull’uso appropriato del placebo. Infatti viene affermato con
forza che: “Qualsiasi studio volto a documentare
l’efficacia di un trattamento deve comunque garantire ai partecipanti la migliore terapia disponibile. Unicamente in caso di mancanza di un efficace trattamento si potrà ricorrere al confronto
col placebo” (vedi anche pp.84-88).
Per altro vale la pena sottolineare che tutti gli
studi presentati alle autorità regolatorie sono reperibili nella letteratura scientifica, in alcuni casi
avendo ottenuto l’attenzione di riviste prestigiose
(range Impact Factor: 2,5-28,6). Analogamente
non sembra aver posto alcun particolare problema
agli editori la pubblicazione di una pletora di studi
di confronto con placebo, non solo nel caso di
alendronato, ma neppure per risedronato.
Pare che esista poi, o forse prima di tutti gli
altri, un altro attore che potrebbe contribuire a
trovare la risposta a due domande che sembrano
fondamentali:
• i Comitati Etici che hanno valutato molti
degli studi che ritroviamo nei dossier registrativi e pubblicati in letteratura, secondo
quali criteri hanno ritenuto che le pazienti
trattate con placebo ricevessero effettivamente la migliore terapia disponibile?
• È pensabile che la Dichiarazione di Helsinki
non sia richiesta dai Comitati Etici come
semplice allegato da aggiungere al protocollo di ricerca, bensì quale documen-
Discussione
Tutti gli studi condotti sino ad oggi hanno dimostrato la superiorità dei tre bifosfonati rispetto
al placebo, in termini di riduzione di fratture vertebrali e non-vertebrali, come anche di incremento della densità minerale ossea e di riduzione dei marker del turn-over osseo.
I bifosfonati, dall’alendronato al più recente
ibandronato, sono stati sviluppati seguendo una
linea comune in accordo con le linee-guida indicate da EMEA e FDA (tabella III). Tuttavia
neppure in fase post-registrativa sono mai stati
AIFA - Ministero della Salute
bollettino d’informazione sui farmaci
ANNO XII N. 2
63
2005
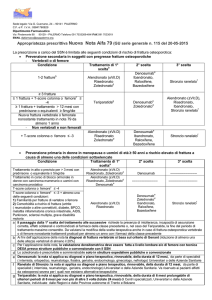
Tabella III – Linee-guida per la conduzione di studi per il trattamento dell’osteoporosi.
EMEA
FDA
Disegno dello studio
Studi di superiorità
randomizzati e controllati
Studi di superiorità
randomizzati e controllati
Comparatore
Placebo e/o farmaco attivo
Placebo e/o farmaco attivo
Criteri di inclusione
Donne con densità minerale ossea
a livello della colonna e dell’anca
con T score inferiore a -2.5
deviazioni standard (S.D.),
con o senza storia di fratture
Donne in post-menopausa da almeno 5 anni,
con una o più fratture vertebrali e/o con una
densità minerale ossea a livello delle vertebre
lombari ≥ 2,0 deviazioni standard (S.D.)
Misure di efficacia
End-point primari: fratture
(vertebrali, anca, altre).
End-point secondari:
densità minerale ossea,
variabili biochimiche,
indicatori del turn-over osseo
End-point: fratture
Durata degli studi
3 anni
3 anni
tazione che si ponga a garanzia dei reali interessi dei soggetti coinvolti nelle sperimentazioni?
• Inoltre, quale vantaggio rappresenta per la
collettività lo sviluppo di molecole “me-too”
prive di un qualsivoglia confronto con le
terapie esistenti?
L’osteoporosi è uno dei maggiori problemi di salute pubblica che coinvolge milioni di persone. I
costi legati a tale patologia crescono parallelamente
all’invecchiamento della popolazione e si calcola
che nei prossimi 50 anni il numero delle sole fratture dell’anca supererà i sei milioni. Si ricorda che in
Italia la spesa relativa ai soli bifosfonati nei primi 9
mesi del 2004 è risultata di 103 milioni di euro
(www.ministerosalute.it/medicinali/osmed),
pari all’1% della spesa farmaceutica complessiva.
Sulla base di queste considerazioni e tenuto
conto della posizione assunta dalle principali
agenzie regolatorie internazionali circa l’uso del
placebo negli studi registrativi, si potrebbe ipotizzare che, una volta ottenuta la rimborsabilità
del nuovo farmaco, il suo successivo mantenimento sia vincolato alla presentazione, a livello
nazionale, di studi di confronto vs comparatori
attivi?
Bibliografia
1. Royal College of Physicians. Osteoporosis. Clinical guidelines for prevention and treatment. Uptodate on pharmacological interventions and an algorithm for management. London 2001.
2. Eastell R. Treatment of postmenopausal osteoporosis. N
Engl J Med 1998; 338: 736-46.
3. Chan KM, Anderson M, Lau EM. Exercise interventions:
defusing the world’s osteoporosis time bomb. Bull World
Health Organ 2003; 81: 827-30.
4. Scottish Intercollegiate Guidelines Network (SIGN).
Management of osteoporosis. Report no. 71. June 2003.
5. Bone HG, Hosking D, Devogelaer JP, et al. Alendronate
Phase III Osteoporosis Treatment Study Group. Ten years’
experience with alendronate for osteoporosis in postmenopausal women. N Engl J Med 2004; 350: 1189-99.
6. Liberman UA, Weiss SR, Broll J, et al. Effect of oral alendronate on bone mineral density and the incidence of
fractures in postmenopausal osteoporosis. The
Alendronate Phase III Osteoporosis Treatment Study
Group. N Engl J Med 1995; 333: 1437-43.
7. Cranney A, Wells G, Willan A, et al. Osteoporosis
Methodology Group and The Osteoporosis Research
Advisory Group. Meta-analyses of therapies for postmenopausal osteoporosis. II. Meta-analysis of alendronate for
the treatment of postmenopausal women. Endocr Rev
2002; 23: 508-16.
8. Cranney A, Tugwell P, Adachi J, et al. Osteoporosis
Methodology Group and The Osteoporosis Research
Advisory Group. Meta-analyses of therapies for postmenopausal osteoporosis. III. Meta-analysis of risedronate for
the treatment of postmenopausal osteoporosis. Endocr
Rev 2002; 23: 517-23.
9. R&D Insight. ADIS International (Last update March
2005).
10. La nuova versione della Dichiarazione di Helsinki.
Bollettino d’Informazione sui Farmaci 2001; 4-5: 152.
AIFA - Ministero della Salute