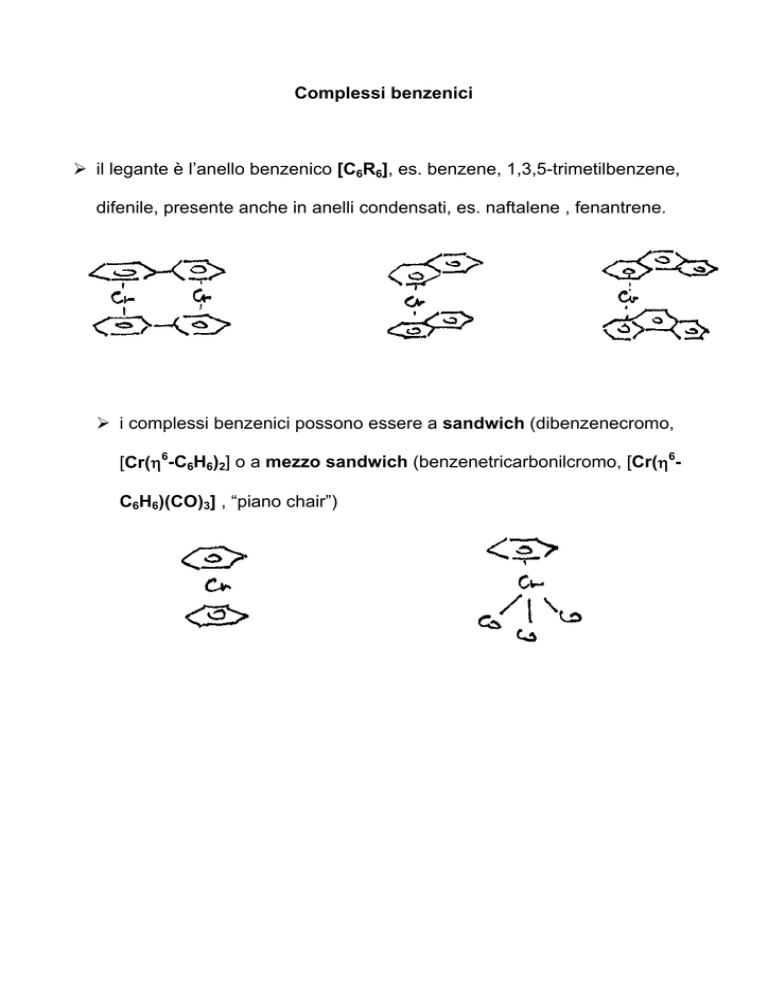
Complessi benzenici
¾ il legante è l’anello benzenico [C6R6], es. benzene, 1,3,5-trimetilbenzene,
difenile, presente anche in anelli condensati, es. naftalene , fenantrene.
¾ i complessi benzenici possono essere a sandwich (dibenzenecromo,
[Cr(η6-C6H6)2] o a mezzo sandwich (benzenetricarbonilcromo, [Cr(η6C6H6)(CO)3] , “piano chair”)
¾ il legante benzenico, C6R6, può essere coordinato:
¾ η6 (donatore di 6e-); l’anello è planare (dC-C = 1,42 Å , più lunghe di
quelle nel benzene libero, 1,40 Å); può essere esclusa la coordinazione
localizzata η2, η2, η2 (cicloesatriene), che darebbe due set diversi di
distanze di legame C-C.
¾ η4 (donatore di 4e-); l’anello è piegato; la distanza(1-2) non coivolta nel
legame è più corta delle altre due (3-4, 5-6).
¾ sono noti complessi con leganti benzenici a coordinazioni miste, η6 e η4
[Ru(η6-C6R6)2]2+ + 2e- → [Ru(η6-C6R6)(η4-C6R6)]
(R=CH3)
(controllo stereochimico del numero di elettroni di valenza)
¾ η2 (donatore di 2e-); tale coordinazione è rara nei monomeri, es.
[Os(NH3)5(η2-C6H6)]2+, ma è presente quando l’anello è a ponte tra vari
centri metallici,
es. [Os3(CO)9(μ3-η2,η2,η2-C6H6)]; in questo caso vi è un’alternanza nella
lunghezza delle distanze di legame C-C.
es. [Ru3(CO)9(μ3-η2,η2,η2-C60)]
Schema dell’interazione di legame nei complessi benzenici
Metodi di sintesi dei complessi benzenici
¾ reazione tra un alogenuro metallico ed un Grignard arilico (Hein):
CrIIICl3 +
3 C6H5MgBr → [CrIII(η1-C6H5)3] + 3 MgClBr
2 [CrIII(η1-C6H5)3] + 4 H+ → [CrI(η6-C6H6)2]+ + 2 C6H6 + Cr3+ + C12H10
[CrI(η6-C6H6)2]+ + ½ S2O42- + 2 OH- → [Cr0(η6-C6H6)2] + SO32- + H2O
¾ reazione tra alogenuro metallico, arene, Al (riducente) e AlCl3 (accettore di
alogenuri) (Fischer-Hafner):
3 CrIIICl3 + 2 Al + AlCl3 + 6 C6H6 → 3 [CrI(η6-C6H6)2]+
+ [AlCl4]-
¾ reazione di sostituzione di leganti su un complesso carbonilico:
[MnCl(CO)5] + C6H6 + AlCl3 → [Mn(η6-C6H6)(CO)3]+ + [AlCl4]- + 2 CO
Reattività generale dei complessi benzenici
¾ il benzene coordinato, impoverito di elettroni nel sistema π-aromatico, è
soggetto ad attacco nucleofilo più facilmente del benzene libero,
¾ la nucleofilicità dell’anello è esaltata, nei complessi a mezzo sandwich,
dagli altri leganti presenti, quando sono buoni π-accettori (es. CO),
¾ le due facce dell’arene coordinato non sono equivalenti (enantiotopiche);
quindi è possibile sintetizzare due enantiomeri:
¾ i complessi a sandwich o a mezzo sandwich sono molecole prochirali
¾ la reattività sul legante arenico può essere sfruttata per la sintesi di nuovi
composti organici che possono essere de-coordinati tramite ossidazione
del centro metallico (CeIV , I2 ).
Complessi ciclopropenilici
¾ il legante è il radicale neutro ciclopropenile [C3R3]• oppure il catione
ciclopropenilio [C3R3]+
¾ il legante ciclopropenilico, C3R3, può essere coordinato in vari modi :
¾ η3 (3e- covalente, 2e- ionico ), η3 (metallatetraedrano, [C3R3]3- , 3ecovalente, 6e- ionico ) , η1 (1e- covalente, 2e- ionico )
¾ Il legante ciclopropene, C3R4 , può essere coordinato η2 (2e- covalente).
Metodi di sintesi dei complessi ciclopropenilici
¾ reazione tra alogeno-ciclopropenili con complessi metallo- carbonilici:
2 Ph3C3Br + 2 [Ni(CO)4] → [Ni(μ-Br)(η3-C3Ph3)(CO)]2 + 6 CO
¾ reazione di sostituzione di leganti su un complesso:
[Ph3C3]+ + [Mo(CO)3(NCCH3)3] → [Mo(η3-C3Ph3)(CO)3(NCCH3)2]+ + NCCH3
Complessi ciclobutadienilici
¾ il legante è il ciclobutadiene neutro [C4R4] oppure l’anione ciclobutadienuro
[C4R4]2-
¾ il ciclobutadiene libero è una specie instabile (antiaromatico) (struttura
rettangolare),
¾ un poliene ciclico è non aromatico quando possiede 4n elettroni π, ossia
4 ,8,12 e- π e diventa antiaromatico quando è instabile.
¾ Il ciclobutadiene può essere stabilizzato mediante la coordinazione ad un
metallo, diventando ciclobutadienuro (aromatico) (struttura quadrata) .
Metodi di sintesi dei complessi ciclobutadienici
¾ reazione di sostituzione di leganti su un complesso:
[Mn(NO)(CO)4] + 2 PhC≡CPh → [Mn(η4-C4Ph4)(NO)(CO)2] + 2 CO
¾ reazione di dealogenazione di dialociclobuteni vicinali:
Complessi cicloeptatrienilici
¾ il legante è il radicale neutro cicloeptatrienile [C7R7]• oppure il catione
cicloeptatrienilio (tropilio) [C7R7]+
¾ il legante cicloeptatrienilio, C7R7, può essere coordinato in vari modi :
¾ η7 (7e- covalente, 6e- ionico ), η5 (5e- covalente, 4e- ionico ), η3 (3ecovalente, 2e- ionico ), η1 (1e- covalente, 0e- ionico )
¾ il catione tropilio può essere isolato come sale, es. [C7H7]+[BF4]- ed è un
debole ossidante monoelettronico (E°’ = - 0,25 V in CH3CN vs SCE):
2 [C7H7]+ + 2e- → C14H14
¾ Il legante cicloeptatriene, C7H8 , può essere coordinato η4 (4e- covalente) o
η6 (6e- covalente).
¾ esistono complessi a mezzo sandwich o a sandwich misto , es:
[V(η5-C5H5)(η7-C7H7)], isomero di [V(η6-C6H6)2].
Metodi di sintesi dei complessi cicloeptatrienilici
¾ estrazione di uno ione idruro, H- , da un cicloeptatriene coordinato:
Complessi cicloottatetraenilici
¾ il legante è il cicloottatetraene neutro [C8H8] (8e- covalente) oppure
l’anione cicloottatetraenuro [C8H8]2- (10e- ionico).
¾ l’anione cicloottatetraenuro può essere isolato come sale, es. Li2[C8H8] ed
è un buon riducente bielettronico:
[C8H8]2- → C8H8
+
2e-
¾ esistono complessi a sandwich con attinidi, [M(η8-C8H8)2] (M=U, Th)
(uranocene, toriocene), e con lantanidi, [Ce(η8-C8H8)2]- (ceriocene), mentre
con gli altri metalli sono noti complessi a mezzo sandwich o a sandwich
misto, [Ti(η8-C8H8)(η2,η2-C8H8)].
Metodi di sintesi dei complessi cicloottatetraenilici
¾ reazione tra cicloottatetraenuri alcalini con alogenuri metallici:
2 Na2(C8H8) + UCl4 → [U(η8-C8H8)2] + 4 NaCl
2 Na2(C8H8) + CeCl3 → Na[Ce(η8-C8H8)2] + 3 NaCl