Complessi ciclopentadienilici
il primo composto di questo tipo è stato il ferrocene, ossia il
bis(ciclopentadienil)ferro(0) [Fe(5-C5H5)2]
il legante è il radicale neutro ciclopentadienile [C5R5] oppure l’anione
ciclopentadienuro [C5R5]-
i composti contenenti il ciclopentadienile possono essere classificati in tre
categorie secondo il tipo di legame:
1) composti ionici con metalli alcalini pesanti (Na, K, Rb, Cs) o
alcalino-terrosi pesanti (Ca, Sr, Ba) e con lantanidi
(sono molto sensibili all’aria e all’umidità, reagiscono con i solventi
protici, non sono sublimabili)
2) complessi covalenti con metalli di transizione
(sono più stabili e sono sublimabili)
3) complessi covalenti (con legame a elevato carattere ionico) con
metalli di post-transizione (Zn, Cd, Hg, In, Tl, Sn, Pb) e con metalli
alcalini leggeri (Li) o alcalino-terrosi leggeri (Be, Mg).
il legante ciclopentadienilico, C5R5, può essere coordinato:
5 (donatore di 5e- covalente, 6e- ionico),
3 (donatore di 3e- covalente, 4e- ionico),
1 (donatore di 1e- covalente, 2e- ionico),
il legante ciclopentadienilico, C5R4, può essere coordinato:
a ponte tra due centri metallici 2-1+ 5 (donatore di 1e- + 5ecovalente, 2e- + 6e- ionico),
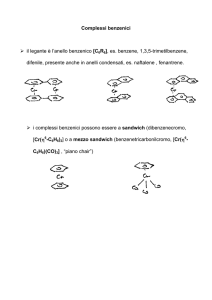
due leganti ciclopentadienilici, in assenza di altri leganti e di doppietti di
non legame, sono coordinati in modo parallelo tra loro (complessi a
sandwich); il complesso può presentarsi in due forme isomeriche
(sfalsata, D5d e eclissata, D5h).
due leganti ciclopentadienilici, in presenza di altri leganti, non sono
coordinati in modo parallelo tra loro (complessi a bent sandwich).
quando è presente un solo legante ciclopentadienilico, si hanno
complessi a mezzo sandwich.
l’anello ciclopentadienilico può essere a ponte doppio nei complessi a
sandwich multiplo.
nei complessi con più di due anelli ciclopentadienilici sono possibili anche
coordinazioni miste:
es. [Ti(1-C5H5)2(5-C5H5)2 ]
es. [Zr(1-C5H5)2(5-C5H5)3]
es. [U(5-C5H5)4 ]
Schema dell’interazione di legame M-5 ciclopentadienile
Metodi di sintesi dei complessi ciclopentadienilici
reazione tra ciclopentadienuro di Na con alogenuri metallici:
C10H12
C5H6 + Na
2 C5H6
Na[C5H5] + ½ H2
2 Na[C5H5] + FeCl2 [Fe(5-C5H5)2] + 2 NaCl
3 Na[C5H5] + CrIIICl3 [CrII(5-C5H5)2] + 3 NaCl + ½ [C5H5]2
reazione tra ciclopentadiene con alogenuri metallici, in presenza di basi:
2 C5H6 + FeCl2 + 2 NEt2H [Fe(5-C5H5)2] + 2 [NEt2H2]+ + 2 Cl-
reazione tra alogeno-ciclopentadienili con un complesso anionico:
-
[Fe(5-C5H5)(CO)2] + C5H5Br
-
[Fe(5-C5H5)2] + 2 CO + Br
reazione di sostituzione di leganti su un complesso:
W(CO)6 + Na[C5H5] [W(5-C5H5)(CO)3]- + Na+ + 3 CO
Reattività dei complessi ciclopentadienilici
i complessi bis-ciclopentadienilici danno reazioni redox:
es. lo ione ferrocenio è un buon ossidante monoelettronico che si riduce
facilmente a ferrocene (E°’ = + 0,40 V in CH3CN vs SCE)
[Fe(5-C5H5)2]+ (17e-) + e- [Fe(5-C5H5)2] (18e-)
il cobaltocene è un buon riducente monoelettronico che si ossida
facilmente a ione cobaltocenio (E°’ = - 1,50 V in CH3CN vs SCE)
[Co(5-C5H5)2] (19e-) [Co(5-C5H5)2]+ (18e-) +
e-
il ferrocene può essere sottoposto a reazioni di sostituzione elettrofila
sull’anello ciclopentadienilico:
[Fe(5-C5H5)2] + CH3CO+ [Fe(5-C5H5) (5-C5H4OCCH3)] + H+
il legante pentametilciclopentadienilico [C5R5] (R = CH3) (abbreviato Cp*)
in genere stabilizza il complesso più che il legante ciclopentadienilico.
Strutture dei complessi ciclopentadienilici (detti metalloceni)
allo stato solido, nel ferrocene tutte le distanze C-C sono uguali tra loro,
come pure tutte le distanze Fe-C, e l’isomero sfalsato è più stabile.
in soluzione, nel ferrocene c’è libera rotazione degli anelli intorno all’asse
di legame, poiché l’energia rotazionale per l’interconversione tra le due
forme isomeriche è piccola (4 KJ/mole).
allo stato solido, nel ruteno cene l’isomero eclissato è più stabile.
il manganocene , allo stato solido, presenta una struttura polimerica che
diventa monomerica sopra i 160 °C.
Complessi con leganti aromatici
gli anelli aromatici possono coordinarsi al metallo tramite tutto o parte del
sistema delocalizzato di elettroni , oppure con il sistema localizzato di
elettroni
un poliene ciclico è aromatico quando possiede (4n+2) elettroni , ossia 2
, 6 , 10 , 14 , 18 elettroni (regola di Huckel)
i più comuni leganti aromatici sono gli anelli ciclopentadienilici, [C5R5]-, e
gli anelli arenici, [C6R6] con 6 elettroni .
i leganti possono essere anelli di sistemi policiclici oppure anelli di sistemi
eterociclici:
indenile o anione indenuro
anione pirrolato
Leganti anelli aromatici
C3H4
C3H4
C4H4
+
C4H4
C5H6
C5H6
2e-
[C3H3]+
+
[C3H3]
+
H-
(2e- , modello ionico)
H
[C4H4]2-
(3e- , modello covalente)
(6e- , modello ionico)
(4e- , modello covalente)
[C5H5]-
[C5H5]
+
+
H+
H
(6e- , modello ionico)
(5e- , modello covalente)
C6H6 (6e- , modello covalente)
C7H8
[C7H7]
C7H8
C8H8
[C7H7]+
+
2e-
H-
+
+
H
[C8H8]2-
(6e- , modello ionico)
(7e- , modello covalente)
(10e- , modello ionico)
C8H8 (8e- , modello covalente)
per il conteggio elettronico:
se considerati come radicali neutri, i cicli donano al metallo n
elettroni (pari all’apticità coinvolta nel legame) (metodo covalente)
se considerati come ioni donano al metallo (n c) elettroni (c :
carica dell’anello) (metodo ionico)
es. nel ferrocene, [Fe(5-C5H5)2]
metodo covalente: Fe0 (8e-) + 2 (5-C5H5) (2 x 5e-) = 18e metodo ionico: Fe2+ (6e-) + 2 (5-C5H5)- (2 x 6e-) = 18e-
es. nel cromobenzene, [Cr(6-C6H6)2]
metodo covalente: Cr0 (6e-) + 2 (6-C6H6) (2 x 6e-) = 18e metodo ionico: -------------
es. nel composto, [Ti(1-C5H5)2(5-C5H5)2 ]
metodo covalente: Ti0 (4e-) + 2(1-C5H5) (2x1e-) + 2(5-C5H5)
(2x5e-) = 16e metodo ionico: Ti4+ (0e-) + 2(1-C5H5) (2x2e-) + 2(5-C5H5) (2x5e-) =
16e-