Terzo principio della termodinamica
la variazione di entropia in una trasformazione reversibile tende ad annullarsi
al tendere a zero della temperatura termodinamica assoluta
lim ∆S =
0
T →0
come conseguenza del terzo principio i calori specifici e il coefficiente di
dilatazione termica devono tendere ad annullarsi al tendere a zero
della temperatura assoluta
infine il terzo principio comporta l’impossibilita’ di raggiungere lo zero assoluto
in quanto al tendere a zero di T tende a zero anche ∆S e quindi tende a zero
il prodotto T ∆S ossia tende a zero il calore scambiato durante la trasformazione
il che significa che al tendere a zero della temperatura diventa sempre piu’ difficile
sottrarre calore ad un corpo e quindi abbassarne ulteriormente la temperatura
da notare che
∆S → 0 non implica che anche S → 0
Potenziali termodinamici
la disuguaglianza di Clausius in forma differenziale diviene
dQ
dS ≥
T
per cui
dQ
= dU + dL
dL = pdV
TdS ≥ dQ
dQ ≤ TdS
primo principio della termodinamica
espressione del lavoro in trasformazioni quasi-statiche
combinando queste relazioni si ottiene
ovvero
dU + pdV ≤ TdS
dU + pdV − TdS ≤ 0
usando questa relazione e’ possibile definire una serie di funzioni di stato
dette potenziali termodinamici utili per determinare le condizioni di equilibrio
di un sistema in particolari trasformazioni termodinamiche
Potenziale di Gibbs
Potenziale di Helmholtz
se si opera in modo isotermo ed isobaro
se si opera in modo isotermo ed isocoro
G =U + pV − TS
F= U − TS
G e’ detto potenziale di Gibbs
o entalpia libera
F e’ detto potenziale di Helmholtz
o energia libera
dG = d (U + pV − TS )
dF = d (U − TS )
se T e p rimangono costanti
se T e V rimangono costanti
dG = dU + pdV − TdS
dF = dU − TdS
ma
dU + pdV − TdS ≤ 0
dG ≤ 0
lo stato di
equilibrio di un sistema in condizioni
isoterme ed isobare e’ quello in cui
il potenziale di Gibbs e’ minimo
ma
dU − TdS ≤ 0
dF ≤ 0
lo stato di
equilibrio di un sistema in condizioni
isoterme ed isocore e’ quello in cui
il potenziale di Helmholtz e’ minimo
Entalpia
se si opera in modo isobaro ed isoentropico
H= U + pV
H e’ detta: entalpia
dH = d (U + pV )
se
p
e
S
rimangono costanti
dH
= dU + pdV
ma
dU + pdV ≤ 0
dH ≤ 0
lo stato di equilibrio
di un sistema in condizioni
isobare ed isoentropiche
e’ quello in cui l’entalpia e’ minima
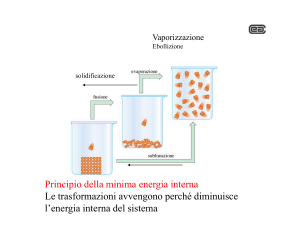
Nota Bene
durante una trasformazione isobara
la variazione di entalpia fornisce
il calore scambiato
nel corso della trasformazione
differenziando
dH =dU + pdV + dpV
e se
p e’
costante
dH
= dU + pdV = dQ
l’entalpia e’ utile nello studio delle
reazioni chimiche che si sviluppano
in contenitori aperti e durante
i cambiamenti di fase
Legge di Hess
la variazione di entalpia in una reazione chimica non dipende da come avviene
la reazione chimica, in un unico passaggio o in step intermedi, e questo
perche’ l’entalpia e’ una funzione di stato
Backup slides