Biochimica Applicata
Programma delle lezioni del Corso di Laurea in Infermieristica
Introduzione alle metodiche e tecniche di analisi del
laboratorio clinico. Controllo di qualità, statistica, modalità di
campionamento, fattori preanalitici. Elettroforesi delle
proteine. Profilo glicemico, glicemia, curva da carico, HbA1c.
Profilo lipidico: lipoproteine, colesterolo, trigliceridi Marcatori di danno miocardico: CK, CK-MB, troponine I/T,
mioglobina. Significato dei dosaggi degli enzimi AST e ALT.
Significato del dosaggio di alcuni metaboliti e altre molecole
non proteiche di interesse clinico: acido lattico, acido urico,
azoto ureico, creatinina, creatina.
Biochimica Applicata
Definizioni e applicazioni
• Studio delle metodologie di preparazione e analisi di
campioni biologici con applicazioni nel campo della ricerca
e della diagnostica medica di laboratorio.
• In campo medico riguarda principalmente lo studio delle
alterazioni biochimiche di natura patologica tramite
l’ausilio di tecniche analitiche chimico-strumentali ed
immunochimiche.
• Si applica principalmente a studi su sangue e urine per la
facilità di reperimento dei campioni.
Biochimica Applicata
Definizioni e applicazioni
• I risultati degli esami biochimici sono utili alla
formulazione della prognosi di una malattia una volta che
ne sia stata effettuata la diagnosi così come sono utili nel
monitoraggio di una terapia.
• Ogni ospedale è attrezzato con apparecchiature per
effettuare esami di tipo biochimico per determinare
parametri al fine di controllare lo stato di salute dei
pazienti (es. determinazione della glicemia, del
colesterolo…ecc.).
Biochimica Applicata
Definizioni e applicazioni
• Esistono anche esami di tipo specialistico che vengono
effettuati solo da alcuni laboratori a causa del costo di
apparecchiature e reagenti e della relativa limitata
richiesta per queste analisi (es. dosaggio di ormoni…ecc.).
• Tutti i laboratori ospedalieri che effettuano analisi di tipo
biochimico sono disponibili anche fuori orario per esami
urgenti in situazioni di emergenza in cui la tempestività
delle indagini è fondamentale per il paziente (es. diagnosi
di infarto del miocardio…ecc.).
Biochimica Applicata
Definizioni e applicazioni
• Ad oggi, molti laboratori sono attrezzati di macchine
computerizzate per l’esecuzione di esami effettuati
abitualmente, ne sono un esempio i contatori elettronici,
che consentono l’analisi di un campione in pochi secondi e
forniscono anche numerosi parametri utili per stabilire se
vi sono anomalie a carico delle cellule del sangue. Vi sono
poi kit di analisi per effettuare indagini meno frequenti.
• Il laboratorio di biochimica rappresenta soltanto uno dei
processi di accertamento e gestione del paziente e possono
essere effettuati anche altri tipi di indagini per accertare
una determinata patologia.
Campionamento e analisi
Fase preanalitica
Il campione è influenzato da diversi fattori e processi prima
di essere analizzato in laboratorio, tra questi vi sono:
l’informazione da parte del clinico;
la preparazione del paziente;
il prelievo, il trattamento, la conservazione e il trasporto
del campione.
Campionamento e analisi
Fase preanalitica
Esempi:
¾ La raccolta del campione deve avvenire in modo tale da evitare
contaminazioni esterne, garantendone l’integrità e la corrispondenza
al reale stato di salute presentato dal paziente (es. ingresso di
microorganismi nel contenitore del campione).
¾ Durante un prelievo di sangue può avvenire emolisi del campione cioè
il passaggio delle componenti intracellulari dei globuli rossi nel
plasma per la distruzione della loro membrana cellulare.
Ciò può avvenire perché il laccio emostatico sul braccio del paziente è
allacciato troppo stretto ed è causa di una prolungata stasi venosa, ma
anche perché l’ago utilizzato ha un diametro troppo piccolo.
Campionamento e analisi
Fase preanalitica
Esempi:
¾ L’emolisi può anche essere causata da un eccessivo scuotimento delle
provette dopo il prelievo e dalla ritardata separazione delle cellule dal
siero o plasma (più di 3 ore dal prelievo).
¾ Un campione di sangue conservato ad una temperatura eccessiva per
tutta la notte prima di essere spedito in laboratorio, avrà valori
erroneamente elevati di potassio, fosfato ed enzimi del globulo rosso
come la lattico-deidrogenasi a causa del loro rilascio nel plasma dovuto
ad una emolisi di natura termica.
Campionamento e analisi
Fase preanalitica
Quindi un emolizzato è caratterizzato da una alterata composizione di
costituenti chimici nel siero o nel plasma. Presenta una colorazione rossa
dovuta all'emoglobina fuoriuscita dai globuli rossi che interferisce con le
misurazioni fotometriche e tra l’altro le reazioni chimiche durante le
analisi possono essere influenzate dalle sostanze cellulari disperse con
l'emolisi.
In conclusione, la causa di molti errori durante la fase preanalitica
può avere effetto sul risultato finale dell'analisi e in alcune
circostanze può condurre ad una falsa diagnosi.
Campionamento e analisi
Fase analitica
La maggior parte delle analisi biochimiche è di tipo quantitativo.
Si determina il quantitativo di una certa molecola in un piccolo volume di
plasma, siero, urine o altri fluidi e i risultati sono espressi come
concentrazioni, (mmoli o μmoli per litro, mg/dl…ecc.).
Gli enzimi non sono espressi normalmente in moli, ma come attività
enzimatica in “Unità” che è un valore direttamente proporzionale alla
quantità di enzima presente. Si definisce unità di enzima quella quantità
di enzima che ad una temperatura prefissata (standardizzata) elabora 1
μmole di substrato in un minuto. Rappresenta una misura della propria
funzione catalitica.
Campionamento e analisi
Fase analitica
In molti tipi di analisi si ricercano nel campione specifici marcatori
(markers) che sono molecole spesso di natura proteica contenute
esclusivamente o quasi in un determinato tessuto perché caratteristiche di
un dato tipo di cellule differenziate.
Per essere utilizzato come indice di malattia un marker dovrebbe essere
osservabile solo quando questa si manifesti. Generalmente è necessario
però comparare più dati e seguirne l’andamento nel tempo poiché pochi
markers sono veramente specifici.
Campionamento e analisi
Fase analitica
Il valore dei risultati delle misure analitiche è influenzato dalle modalità
con cui si esegue una certa metodica e dai cambiamenti che possono
avvenire nei fluidi biologici del paziente in un certo periodo di tempo.
La discriminazione tra risultati normali o patologici è influenzata da
fattori biologici che devono essere presi in considerazione durante
l’interpretazione di un qualunque risultato quali sesso, età, dieta, orario
dell’esame, uso di farmaci…ecc. Ciò permette di comprendere come in
casi particolari un risultato anomalo non sempre indica una malattia e un
risultato nella norma non la esclude necessariamente.
Campionamento e analisi
Fase analitica
I risultati di un campionamento sono caratterizzati da:
1) Precisione e accuratezza
2) Sensibilità e specificità
3) Controllo di qualità
4) Intervalli di riferimento
Campionamento e analisi
Fase analitica
1) La precisione è la riproducibilità di un metodo analitico rappresentata
dal grado di convergenza di dati individualmente rilevati su un valore
medio della serie cui appartengono. L’accuratezza indica quanto il valore
misurato si avvicina al valore medio preso come miglior stima del valore
reale.
Impreciso
Preciso ma non accurato
Preciso e accurato
Campionamento e analisi
Fase analitica
2) La sensibilità analitica di un esame è la misura della più piccola
quantità di analita che il metodo può rilevare. La specificità analitica
riguarda quanto un esame riesce a discriminare tra l’analisi richiesta e le
sostanze che potenzialmente possono interferire.
3) Controllo di qualità è costituito dalle prove che vengono eseguite dallo
staff del laboratorio per accertarsi che l’esecuzione del saggio sul
campione del paziente sia corretta. Nei campioni di controllo che vengono
analizzati regolarmente si conoscono i risultati.
Campionamento e analisi
Fase analitica
4) Intervalli di riferimento sono forniti con il risultato degli esami per un
confronto con valori trovati in soggetti sani e sono diversi a seconda dei
fattori biologici del paziente quali sesso, età…ecc.
Il clinico deve comunque interpretare i risultati a seconda della storia del
paziente e in base al risultato di altri tipi di indagini.
Se il risultato non è in accordo con quello atteso per il paziente può essere
prescritta la ripetizione degli esami.
Campionamento e analisi
Il sangue
E’ un vero e proprio tessuto con sostanza intercellulare liquida, costituito
dagli elementi figurati quali i globuli rossi, i globuli bianchi e le piastrine e
da una parte liquida, il plasma sanguigno.
Campionamento e analisi
Il sangue: la coagulazione
Poichè il sistema circolatorio deve essere “autosigillante”, l'arresto di un
eventuale sanguinamento sia arterioso che venoso avviene tramite il
meccanismo della coagulazione che consiste nella trasformazione di una
parte del sangue in una massa solida. Ciò avviene tutte le volte che il
sangue entra in contatto con una superficie bagnabile diversa
dall’endotelio vasale. La coagulazione avviene tramite una serie di fattori
che agiscono “in cascata” nel senso che ciascuno di essi funge da attivatore
di quello seguente fino alla trasformazione della protrombina (enzima
inattivo presente nel plasma) in trombina che agendo proteoliticamente
sulla proteina plasmatica solubile fibrinogeno induce la formazione della
fibrina, una proteina monomerica filamentosa che tende a legarsi agli altri
monomeri formando un reticolo che imbriglia gli elementi figurati dando
inizio alla formazione del coagulo.
Campionamento e analisi
Il sangue: la coagulazione
Autore Peter Forster
Campionamento e analisi
Il sangue
Nel laboratorio clinico, se si raccoglie il sangue in una comune provetta,
dopo la formazione del coagulo si ottiene un campione di siero mediante
centrifugazione e si può procedere su questo per parecchie analisi
biochimiche.
In altri casi, quando ad esempio il campione deve essere congelato, il
sangue viene raccolto in una provetta contenente un anticoagulante che è
un composto capace di rallentare o interrompere il processo di
coagulazione del sangue.
L'impiego di sostanze anticoagulanti è indispensabile per l'esecuzione di
tutte le analisi che devono essere effettuate su "sangue intero", come
l'esame emocromocitometrico, l'allestimento di strisci ematici su vetrino
per eseguire la formula eritrocitaria o l'esame morfologico di eritrociti e
leucociti.
Campionamento e analisi
Il sangue
In commercio sono disponibili provette che contengono diversi tipi di
anticoagulante, la cui scelta nella diagnostica di laboratorio è molto
importante al fine di evitare interferenze nell'esecuzione degli esami
richiesti o per conservare al meglio la morfologia degli elementi cellulari
per le indagini ematologiche.
www.donatoricapranica.org
Campionamento e analisi
Il sangue
Tra gli anticoagulanti più diffusi vi sono:
EPARINA
E’ un glicosamminoglicano presente a bassi livelli nel sangue e nei tessuti
ed è prodotta da granulociti basofili. Inibisce alcuni fattori della
coagulazione impedendo una crescita incontrollata del coagulo. L’impiego
di questo anticoagulante permette di effettuare praticamente ogni tipo di
analisi biochimica. Non può essere utilizzato per la determinazione
dell’emocromo perché causa la formazione di aggregati di leucociti e
soprattutto di piastrine.
EDTA
L'acido etilendiamminotetracetico di sodio o di potassio esplica la sua
azione formando un composto insolubile con lo ione calcio (meccanismo
comune ad altri anticoagulanti) che è fondamentale per il processo di
coagulazione. Viene utilizzato per eseguire l'esame emocromocitometrico
e raramente è d’uso per altri esami.
Campionamento e analisi
Il sangue
CITRATO
Sottoforma di sale sodico, agisce legandosi al calcio per dare un composto
insolubile tale da impedire la coagulazione. Non ha effetti tossici e quindi è
utilizzato per il sangue destinato alle trasfusioni. E’ impiegato per la
misura della velocità di eritrosedimentazione (VES) e per lo studio dei
principali fattori della coagulazione.
FLUORURO DI SODIO
Agisce analogamente legandosi allo ione calcio. E’ un inibitore della
glicolisi per cui stabilizza la concentrazione del glucosio ematico nel
tempo.
È quindi l'anticoagulante da preferirsi per i campioni di sangue sui quali
si debba determinare la glicemia.
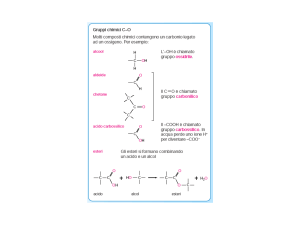
Elettroforesi delle proteine
L’elettroforesi è un metodo mediante il quale, in soluzione, molecole
elettricamente cariche (proteine o acidi nucleici) vengono separate tramite
migrazione per applicazione di un campo elettrico.
Nel caso della separazione di proteine generalmente si utilizza il metodo
della elettroforesi su gel di poliacrilammide (SDS-PAGE) che si basa sulla
polimerizzazione del monomero solubile acrilammide (in presenza di un
catalizzatore) all’interno di una vaschetta di materiale plastico.
Il gel così ottenuto presenta maglie porose, le cui dimensioni possono essere
modificate variando le componenti delle matrice acrilammidica o degli
agenti polimerizzanti.
Elettroforesi delle proteine
Le proteine che si vogliono separare elettroforicamente vengono
parzialmente denaturate con un detergente anionico, il sodio
dodecilsolfato (SDS) che ne causa la denaturazione conferendo al
polipeptide una netta carica negativa proporzionale alla sua lunghezza.
Sono anche trattate con un agente riducente che scinde i legami disolfuro
(mercaptoetanolo) agevolando la linearizzazione della proteina. Le
proteine così rese solubili vengono immesse in piccoli pozzetti (polo
negativo) ricavati nel gel precedentemente immerso in una soluzione
tampone che mantiene costante il pH.
Elettroforesi delle proteine
A questo punto una volta completato l’apparato, si collega agli elettrodi di
un alimentatore di corrente e le proteine migreranno nel campo elettrico
in base al loro peso molecolare essendo più o meno trattenute nelle maglie
del gel che funziona da setaccio molecolare.
La corsa elettroforetica del campione viene associata a polipeptidi che
fungono da standard di peso molecolare che per confronto diretto
permettono di stimare il peso molecolare con buona approssimazione.
Elettroforesi delle proteine
Terminata la corsa elettroforetica si procede alla colorazione del gel per
identificare le singole bande di proteine. E’ possibile “tradurre” la corsa
elettroforetica in un segnale digitalizzato mediante uno strumento chiamato
densitometro che sfrutta il passaggio di un raggio luminoso a velocità
costante lungo il percorso della separazione elettroforetica e registra così la
densità ottica delle varie bande. Questo consente di determinare l’esatta
posizione delle varie bande (peso molecolare) rispetto ad uno standard noto,
e di valutare con buona approssimazione la concentrazione di proteina nelle
singole bande.
Elettroforesi delle proteine
Colorazione Blu-Coomassie
Bande visualizzate con
Silver-stain kit
94
94
67
67
43
30
20
43
30
20
Gel elettroforetici con marcatori di peso molecolare
Elettroforesi delle proteine
Concentrazioni
proteiche
+
-
Tracciato elettroforetico delle sieroproteine
del sangue umano
Si utilizza per lo studio di alcune anomalie
nelle proteine del siero.
La glicemia
Il glucosio proveniente dalla dieta viene
trasportato dalle cellule epiteliali dell’intestino
tenue al flusso sanguigno. Una parte è
destinata alle cellule cerebrali, mentre buona
parte del rimanente viene convertita nei tessuti
del fegato e dei muscoli nel polisaccaride
glicogeno che funge da riserva di energia che
viene utilizzata dall’organismo solo quando è
necessario.
Tra le funzioni più importanti del fegato vi è il mantenimento a valori
costanti della concentrazione di glucosio nel sangue (glicemia).
In questo organo avviene in misura rilevante la sintesi di glicogeno e
viceversa anche il processo di glicogenolisi che libera glucosio
destinato al circolo sanguigno.
I due processi di sintesi e di scissione del glicogeno agiscono in
equilibrio e sono finemente regolati in modo da mantenere il più
possibile costante la glicemia, garantendo l’apporto di glucosio a tutti
i tessuti dell’organismo.
La glicemia
La regolazione della glicemia (valori normali 80-100 mg/dl) avviene
ad opera della parte endocrina del pancreas (isole di Langerhans)
costituita da gruppi di cellule disseminati nella parte esocrina
(preposta alla produzione di enzimi digestivi) di questa ghiandola.
Quando la concentrazione di glucosio nel sangue tende a diminuire il
fegato rilascia nel flusso sanguigno tale zucchero. Questo processo
viene mediato dall’ormone peptidico glucagone prodotto dalle cellule
α del pancreas endocrino. Viceversa se il livello ematico di glucosio
nel sangue aumenta viene liberato in circolo l’ormone peptidico
insulina prodotto dalle cellule β del pancreas endocrino.
La glicemia
L’insulina che è secreta in risposta a elevati livelli ematici di glucosio agisce
legandosi ad un recettore esterno della membrana cellulare per favorire
l’ingresso del glucosio nelle cellule del fegato, del muscolo e del tessuto
adiposo stimolando la sintesi di glicogeno e grassi e inibendone la
demolizione.
Insulina
Glucosio
Recettore
per l’insulina
Trasportatore
del Glucosio
Glicogeno
Fosforilasi attiva
Glicogeno
Fosforilasi inattiva
P
Fosfatasi
+
Pi
La glicemia
Il glucagone che è secreto in risposta a bassi livelli ematici di glucosio agisce
legandosi ad un recettore esterno della membrana cellulare stimolando il
fegato a rilasciare il glucosio attraverso la glicogenolisi e la gluconeogenesi e
stimolando il tessuto adiposo a rilasciare acidi grassi.
Glucagone
Recettore
per il glucagone
Trasportatore
del Glucosio
Glucosio
Glicogeno
Fosforilasi attiva
Glicogeno
Fosforilasi inattiva
+
P
ADP
Cinasi
+
ATP
La glicemia
Il diabete mellito
E’ una patologia caratterizzata da iperglicemia (valori di
concentrazione di glucosio ematico anche maggiori di 200 - 250 mg/dl)
e da conseguente glicosuria cioè da perdita di glucosio con le urine.
Ne è causa l’insufficiente secrezione di insulina oppure la scarsa
stimolazione delle cellule bersaglio. Come conseguenza il livello di
glucosio nel sangue molto alto ne permette un cospicuo passaggio
attraverso il filtro glomerulare e anche a causa di un insufficiente
riassorbimento nei tubuli dei nefroni si ritrova nelle urine. L’elevata
quantità di glucosio nelle urine fornisce un utile test diagnostico della
malattia.
Il principale problema di questa patologia è che le cellule non possono
assumere una quantità adeguata di glucosio.
Esistono due forme di questa malattia:
La glicemia
Il diabete mellito
1) Il diabete insulina-dipendente o giovanile colpisce circa il 15% dei
pazienti diabetici. In questa patologia l’insulina è assente o quasi
perché il pancreas ha cellule β difettose o ne è privo come
conseguenza di un attacco autoimmunitario. Gli individui che ne
sono affetti hanno bisogno di iniezioni giornaliere di insulina per
sopravvivere e possono presentare in età giovanile disfunzioni
renali, danni neurologici e malattie cardiovascolari, se non
controllati adeguatamente.
2) Il diabete non insulina-dipendente o dell’età adulta colpisce circa l’
85% dei pazienti diabetici. Di solito si sviluppa progressivamente
dopo i 40 anni di età. I malati hanno livelli di insulina normali o
anche superiori alla media, ma i loro sintomi possono derivare
dalla scarsità di recettori per l’insulina sulla superficie delle loro
cellule.
La glicemia
Diagnosi del diabete
La concentrazione del glucosio viene determinata di routine in
campioni di sangue raccolti in provette contenenti fluoruro
(anticoagulante inibitore della glicolisi).
Quando si ottiene un valore della glicemia a digiuno maggiore o uguale
a 110 mg/dl si è al limite per avere un ragionevole dubbio che vi sia una
alterazione, anche se iniziale, della regolazione del metabolismo del
glucosio.
Nel caso in cui il paziente presenti una glicemia basale compresa tra
115 mg/dl e 140 mg/dl, si deve ricorrere ad ulteriori accertamenti come
al test curva da carico orale di glucosio.
La glicemia
Diagnosi del diabete: curva da carico orale di glucosio
E’ un test mediante il quale viene diagnosticato il diabete in soggetti in
cui si è osservata una glicemia superiore ai valori nella norma.
L’esame si svolge tramite alcuni prelievi ematici su cui si determina la
glicemia. Il primo è a digiuno e gli altri quattro avvengono a distanza di
30 minuti l’uno dall’altro per le due ore successive dopo l’ingestione di
75 grammi di glucosio sciolti in acqua.
Se i valori, dopo 2 ore dall’assunzione del carico di glucosio sono
maggiori o uguali a 200 mg/dl si è in presenza di un soggetto diabetico.
Se sempre dopo 2 ore, sono compresi tra 140 e 200 mg/dl si parla di
alterata o ridotta tolleranza al glucosio.
La glicemia
Diagnosi del diabete: curva da carico orale di glucosio
L’attendibilità dei risultati del test che deve essere svolto al mattino
dipende dalle condizioni di preparazione del paziente che:
¾non deve avere assunto farmaci in grado di modificare i livelli
di glicemia;
¾deve mantenersi a digiuno da almeno dieci ore;
¾non si deve essere impegnato in attività lavorative o sportive
troppo intense;
¾non deve avere ingerito, nei tre giorni precedenti il test,
quantità troppo scarse o eccessive di carboidrati;
¾non deve avere manifestato stati febbrili.
Monitoraggio del Diabete Mellito
Profilo glicemico
Spesso è necessario ottenere risultati immediati della glicemia.
E’ ormai diffusa la pratica dell’automonitoraggio nei pazienti
diabetici con frequenza stabilita dal medico.
Il glucosio ematico viene valutato al di fuori del laboratorio tramite
un misuratore elettronico della glicemia. Questo tipo di esame
prevede il prelievo di una piccola quantità di sangue da un dito del
paziente variando il momento dell’autoesame, allo scopo di ottenere
un quadro complessivo del proprio controllo glicemico.
Monitoraggio del Diabete Mellito
Profilo glicemico
Consiste nella determinazione della glicemia più volte durante la giornata:
a digiuno, prima e 2 ore dopo il pasto ed eventualmente alla sera prima di
coricarsi.
Si impiega:
•nel monitoraggio di un diabete ancora non ben compensato per
individuare i necessari aggiustamenti della terapia;
•se si deve cambiare la terapia farmacologica;
•routinariamente, in tutti i casi in cui è necessario uno stretto controllo
metabolico.
Monitoraggio del Diabete Mellito
Emoglobina glicata
Il glucosio presente nel sangue ad alte concentrazioni (iperglicemia), come
avviene in caso di diabete, può legarsi irreversibilmente con un
meccanismo non enzimatico ai gruppi amminici N-terminali delle catene β
dell'emoglobina, trasformandola in una forma glicata (HbA1c).
L’emoglobina in questo stato alterato non è più in grado di legare
l'ossigeno con la stessa efficacia dell'emoglobina fisiologica, provocando
così una minore ossigenazione dei tessuti. Ne conseguono danni agli organi
che si possono osservare in soggetti diabetici.
Monitoraggio del Diabete Mellito
Emoglobina glicata
L’entità di HbA1c aumenta proporzionalmente ai valori di glicemia,
pertanto i livelli di emoglobina glicata sono un indice del livello medio di
glucosio ematico.
Il legame delle molecole di glucosio all'emoglobina avviene lentamente
tanto da impiegare anche diverse settimane, pertanto la concentrazione di
emoglobina glicata fornisce una stima retrospettiva della glicemia per un
periodo di circa 120 giorni (tempo di vita medio dei globuli rossi).
Monitoraggio del Diabete Mellito
Emoglobina glicata
Considerando che i danni dovuti all'iperglicemia si hanno solo a seguito di
un certo prolungamento di questo stato si può comprendere l'importanza
del dosaggio dell’emoglobina glicata che deve essere mantenuta il più
possibile in bassa concentrazione.
Non si conosce però una concentrazione soglia di emoglobina glicata al di
sotto della quale sicuramente non si avranno complicazioni ma, in linea
generale livelli al di sotto di 7,7 % di emoglobina glicata rispetto a quella
fisiologica sono ritenuti accettabili, livelli inferiori a 5,5 % sono considerati
normali.
Monitoraggio del Diabete Mellito
Emoglobina glicata
Normalmente il dosaggio dell’emoglobina glicata viene richiesto dal medico
da due a quattro volte all’anno.
Per poter valutare al meglio il controllo della glicemia di un paziente, il
medico spesso prende in considerazione sia i risultati dell’automonitoraggio
sia i valori di emoglobina glicata.
In conclusione si può affermare che per valutare lo stato glicemico del
paziente diabetico è molto utile associare alla glicemia anche la
determinazione dell'emoglobina glicata che fornisce informazioni sulla
media glicemica degli ultimi 120 giorni.
Monitoraggio del Diabete Mellito
Emoglobina glicata
Queste considerazioni consentono di affermare che una glicemia nella
norma ma con un alto livello di emoglobina glicata in quel dato momento,
non corrisponde al grado di compenso metabolico del soggetto che, durante
la giornata, potrebbe avere picchi glicemici senza rendersene conto.
Pertanto, la sola glicemia, risulta insufficiente per un efficace controllo del
soggetto diabetico perché non fornisce alcuna indicazione sullo stato di
compenso glico-metabolico che è responsabile delle numerose complicanze
del diabete.
La glicosuria
Molte sostanze presenti nel plasma sanguigno si ritrovano nell’urina
solo quando la loro concentrazione plasmatica supera un determinato
valore detto soglia di escrezione. Per tali sostanze esiste quindi un
valore massimo di filtrato che può essere totalmente riassorbito nei
tubuli renali ed oltre il quale la sostanza compare nell’urina.
www.atlanteanatcomp.unito.it
La glicosuria
Esiste una ben definita soglia renale di escrezione che è caratteristica
di quei componenti del filtrato preziosi per l’organismo come il
glucosio e gli amminoacidi che non devono essere perduti con l’urina.
La loro concentrazione plasmatica è infatti di regola inferiore alla
loro soglia di escrezione.
Una conseguenza di tale fenomeno è che si può ritrovare glucosio nelle
urine di soggetti anche in condizioni fisiologiche, ad esempio dopo un
abbondante pasto a base di carboidrati.
Se però è presente glucosio nelle urine anche quando il glucosio
ematico presenta valori normali, in genere ciò può riflettere
l’incapacità dei tubuli renali di riassorbire glucosio, a causa di
specifiche lesioni tubulari.
Molecole non proteiche di interesse clinico
Azotemia
E’ la misura dell'azoto totale non proteico presente nel sangue derivante
cioè da urea, amminoacidi, acido urico, creatina e creatinina.
In condizioni fisiologiche ha valori tra 8 e 24 mg/dl.
Questa misura indica però principalmente la concentrazione di urea nel
sangue che è presente in maggiore quantità rispetto ad altre molecole
azotate (circa il 90%).
Alcune di queste molecole eliminate a livello renale con le urine sono
prodotti di rifiuto che derivano dalla degradazione delle proteine.
Danni all'apparato renale possono provocare accumulo di sostanze di
rifiuto nel sangue, ne consegue che la presenza di una azotemia elevata
può essere indice di problemi renali.
Molecole non proteiche di interesse clinico
Azotemia
I valori che si riscontrano in un soggetto sono influenzati dall'attività
metabolica del fegato e dalla capacità di escrezione del rene.
Un aumento dei valori dell'azotemia (iperazotemia) si riscontra
principalmente in patologie renali croniche.
Inoltre, è presente iperazotemia anche in patologie acute come
l’insufficienza renale acuta ed in casi di ostruzione del tratto urinario.
Una diminuzione dei valori, invece, può indicare un’insufficienza
epatica.
Molecole non proteiche di interesse clinico
Azotemia
Fra le cause non patologiche di elevati valori di azotemia vi sono:
•
Una dieta eccessivamente ricca di proteine.
•
Un'attività sportiva o lavorativa intensa che causa un notevole
catabolismo muscolare: l'organismo usa le proteine come scorta
energetica.
•
Molti farmaci che aumentano il catabolismo (per esempio i
cortisonici) e in particolare: l'aspirina, le cefalosporine e alcuni
agenti chemioterapici.
•
la gravidanza (per la elevata richiesta di proteine).
Molecole non proteiche di interesse clinico
Urea
E’ il prodotto finale del catabolismo delle proteine e si produce
nel fegato per deamminazione degli amminoacidi. E’ presente
nel sangue ad una concentrazione da 8 a 20 mg/dl (uremia) ed è
anche il composto che si ritrova nell’urina in maggiore quantità
con una eliminazione giornaliera di 20-30 gr. che varia però in
funzione del tipo di alimentazione (aumenta con una dieta
iperproteica e diminuisce con una dieta a base di vegetali).
Valori elevati possono essere indice di:
•Insufficienza renale acuta o cronica
•Insufficienza cardiaca acuta o cronica
•Diabete
•Altre patologie
Valori al di sotto della norma possono essere indice di:
•Malnutrizione
Molecole non proteiche di interesse clinico
Acido urico E’ uno dei prodotti finali del catabolismo degli acidi
nucleici derivando dalle basi azotate puriniche adenina
e guanina. La quantità eliminata con l’urina dipende
quindi dall’entità del catabolismo ed aumenta quando
l’alimentazione è ricca di composti purinici.
Normalmente essa ammonta a circa 0,6 gr. nelle 24 ore.
L’acido urico è poco solubile in acqua e nell’urina
tende a cristallizzare, formando un sedimento.
Tipica manifestazione patologica di un suo eccesso nei
fluidi corporei è la gotta. Si manifesta con una
infiammazione articolare dolorosa determinata dalla
deposizione di cristalli quasi insolubili di urato di sodio.
L’acido urico può anche precipitare nei reni e negli
ureteri sotto forma di calcoli potendo provocare anche
l’ostruzione delle vie urinarie. Ciò accade se la sua
presenza nel sangue supera la soglia di 7 mg/dl
instaurandosi uno stato di iperuricemia.
Molecole non proteiche di interesse clinico
Bilirubina
E’ un pigmento biliare, intermedio della degradazione
dell’eme. Viene trasportata nel sangue sotto forma di
complesso con l’albumina.
Quando il sangue ne contiene quantità eccessive si ha la
deposizione di questa sostanza che colora di giallo la
pelle e le sclere (ittero). Ciò è indice di una anormale
velocità di distruzione dei globuli rossi, una disfunzione
epatica, o l’ostruzione del dotto biliare.
Eliminazione giornaliera con le urine di 2 mgr.
Molecole non proteiche di interesse clinico
Creatina
Rappresenta una riserva ad alta anergia per la
formazione di ATP. E’ abbondante nei muscoli per la
contrazione muscolare e nelle cellule nervose che
hanno un notevole fabbisogno energetico. Nei
vertebrati è presente in forma fosforilata tramite una
reazione reversibile ad opera dell’ATP catalizzata dalla
creatina chinasi:
ATP + creatina
fosfocreatina + ADP
La fosfocreatina funziona come un tampone per l’ATP
nelle cellule sopperendo alla richiesta energetica.
Molecole non proteiche di interesse clinico
Creatinina
Dopo l’urea, è la più abbondante delle molecole azotate
presenti nell’urina. Deriva dalla defosforilazione e
catabolismo della fosfocreatina presente nel tessuto
muscolare in qualità di donatore di gruppi fosforici ad
alto contenuto energetico, nella catena di reazioni che
accompagnano la contrazione muscolare. La quantità
di creatinina escreta varia leggermente a seconda dello
sviluppo e dell’attività delle masse muscolari e
ammonta a circa 2 gr. nelle 24 ore.
Viene dosata nelle urine e nel sangue (creatininemia)
come indice della funzionalità renale.
Molecole non proteiche di interesse clinico
Clearance della creatinina
In generale per clearance renale si indica il volume di plasma sanguigno
che viene completamante “ripulito” dai reni nell’unità di tempo
(solitamente un minuto) per una determinata sostanza.
Nel caso della creatinina è la quantità di sangue che può essere
efficacemente depurata da essa nell'unità di tempo.
Per calcolarla devono essere noti contemporaneamente i valori di
creatininemia, di creatinina ed il volume di urina emesso per minuto.
Poiché la creatinina passa nel filtrato glomerulare in concentrazione
uguale a quella che ha nel sangue e poiché non viene né eliminata, né
riassorbita dai tubuli renali, il calcolo della clearance della creatinina
permette di valutare, con buona approssimazione, la quantità di filtrato
glomerulare che si forma in un minuto. E', dunque, un indice della
funzionalità renale.
Molecole non proteiche di interesse clinico
Clearance della creatinina
Per determinare la clearance della creatinina è necessario eseguire una
raccolta delle urine nelle 24 ore, valutando poi la creatininuria e la
creatininemia sempre nello stesso periodo di tempo.
I dati raccolti vanno poi inseriti nella formula che è comunque di uso
generale es. EDTA…ecc.):
C= (U x V)/P
C = clearance (volume del plasma)
U = concentrazione urinaria della creatinina
V = volume di urine raccolto nelle 24 ore
UxV=quantità di creatinina escreta nell’urina
P = concentrazione plasmatica della creatinina (creatininemia)
Molecole lipidiche di interesse clinico
Trigliceridi
Sono esteri del glicerolo, importante riserva
energetica dell’organismo che costituiscono
circa il 90% dei lipidi assunti con
l’alimentazione.
Una volta sintetizzati nel fegato sono
impacchettati in lipoproteine a densità molto
bassa (VLDL) e rilasciati direttamente nel
circolo sanguigno. Questo permette di
mantenerli in soluzione acquosa e di
trasportarli nei distretti di consumo o
accumulo.
Mediamente un valore ematico normale è
compreso tra i 70 e i 140 mg/dl.
Molecole lipidiche di interesse clinico
Trigliceridi
La concentrazione ematica di trigliceridi aumenta per cause esogene, da
introduzione eccessiva di alcolici, glucidi e lipidi portando a
ipertrigliceridemia. Si può avere anche dislipidemia.
Alti livelli di trigliceridi nel sangue aumentano il rischio di malattie
coronariche (come l'infarto) e la possibilità di sviluppare l'aterosclerosi.
L’ ipertrigliceridemia, associata ad assunzione di alcol, è il risultato di un
aumento plasmatico delle VLDL.
In una malattia genetica a carattere autosomico la concentrazione di
trigliceridi è aumentata per deficit familiare di lipasi lipoproteica,
portando ad un aumento delle VLDL.
Molecole lipidiche di interesse clinico
Colesterolo
E’ lo sterolo più abbondante negli animali ed è uno
dei principali componenti delle membrane
plasmatiche delle cellule. Possiede un gruppo
ossidrilico responsabile del debole carattere
anfipatico di questa molecola. Essendo un
composto ad anelli condensati genera una rigidità
della molecola superiore a quella degli altri lipidi
della membrana. E’ abbondante anche nelle
lipoproteine del plasma sanguigno dove circa il
70% del colesterolo totale è esterificato ad acidi
grassi a lunga catena.
Altra funzione importante è quella di precursore
degli ormoni steroidei e degli acidi biliari.
Mediamente un valore ematico normale è
compreso tra i 150 e i 200 mg/dl.
Molecole lipidiche di interesse clinico
Colesterolo
Molecole lipidiche di interesse clinico
Colesterolo
Esistono due vie di approvigionamento del colesterolo, la sintesi nel fegato
a partire dall’Acetil-Coa e l’assunzione con gli alimenti.
Può essere convertito in acidi biliari utilizzati nei processi digestivi o in
alternativa può essere esterificato e immesso nel sangue come parte dei
complessi lipoproteici chiamati lipoproteine a bassa densità (LDL).
I tessuti periferici normalmente ricavano la maggior parte del loro
colesterolo esogeno dalle LDL mediante endocitosi mediata da recettore.
Molecole lipidiche di interesse clinico
Colesterolo
Questa molecola viene trasportata tra il fegato e i tessuti periferici e
viceversa. Mentre le LDL trasportano il colesterolo dal fegato, il
colesterolo è ritrasportato al fegato dalle lipoproteine ad alta densità
(HDL). Il colesterolo in eccesso viene eliminato dal fegato come acidi
biliari, proteggendo quindi il corpo da un eccessivo accumulo di questa
molecola insolubile in acqua.
Anche se questo composto è essenziale per la vita la sua deposizione nelle
arterie è stato associata a malattie cardiache e aterosclerosi che
costituiscono principali cause di morte dell’uomo.
In un organismo sano è efficiente un intricato equilibrio tra biosintesi,
utilizzazione e trasporto del colesterolo, che tende a mantenere al minimo
la sua pericolosa deposizione.
Molecole lipidiche di interesse clinico
Lipoproteine
Sono complessi molecolari costituiti da proteine e lipidi non associati
covalentemente.
Questo sistema costituito da diversi tipi di lipoproteine si è evoluto per
risolvere il problema rappresentato dal trasporto di molecole idrofobiche
nell’organismo in un mezzo acquoso quale il plasma sanguigno.
Una lipoproteina è una complessa struttura sferica con un core idrofobico
avvolto da un rivestimento idrofilico.
Nel core sono contenuti trigliceridi ed esteri del colesterolo, mentre la
superficie contiene fosfolipidi, colesterolo libero ed apolipoproteine, che
permettono il riconoscimento di specifici recettori sulla superficie delle
cellule bersaglio, permettendo così l’internalizzazione delle lipoproteina.
E’ d’uso classificare le lipoproteine in base alla loro densità poichè vengono
principalmente isolate mediante ultracentrifugazione.
Molecole lipidiche di interesse clinico
Lipoproteine
Apolipoproteina
Colesterolo
libero
Fosfolipidi
Trigliceridi e
esteri del colesterolo
www.iss.it
Molecole lipidiche di interesse clinico
Tipi di lipoproteine
Sono le più grandi.
¾ Chilomicroni
Sono prodotte dalla mucosa
intestinale.
Non presenti nel
sanguigno a digiuno.
plasma
Trasportatori dei trigliceridi e
del colesterolo esogeni.
¾ Lipoproteine a densità molto
bassa (VLDL)
Sintetizzate
nel
fegato.
Principali trasportatori dei
trigliceridi sintetizzati per via
endogena.
Molecole lipidiche di interesse clinico
Tipi di lipoproteine
¾ Lipoproteine a bassa densità
(LDL)
Generate dalle VLDL in
circolo (lipasi lipoproteica).
Principali trasportatori del
colesterolo nel sangue.
¾ Lipoproteine ad alta densità
(HDL)
Sono le più piccole ed hanno
funzione protettiva.
Trasportano il colesterolo dai
tessuti extraepatici al fegato a
scopo di escrezione.
Molecole lipidiche di interesse clinico
Lipoproteine: aterosclerosi
Le HDL hanno essenzialmente funzione opposta alle LDL, cioè permettono
la rimozione del colesterolo dai tessuti. L’incidenza delle malattie
cardiovascolari è correlata agli alti livelli di LDL e ai bassi livelli di HDL.
L’aterosclerosi, la forma più comune di arteriosclerosi (indurimento delle
arterie), è caratterizzata dalla presenza di ateromi cioè ispessimenti delle
arterie che dopo dissezione mostrano un deposito di colore giallo a
consistenza pastosa e sono costituiti quasi esclusivamente di esteri del
colesterolo.
Molecole lipidiche di interesse clinico
Lipoproteine: aterosclerosi
L’aterosclerosi è una malattia progressiva che inizia con accumuli
intracellulari di lipidi nelle cellule del muscolo liscio collocate nella parte
interna delle arterie. Lo sviluppo di questa patologia è fortemente correlato
ai livelli del colesterolo plasmatico.
Può proseguire con la comparsa di placche fibrose che possono calcificare,
rallentando o anche bloccando il flusso sanguigno nelle arterie.
Le superfici discontinue e rugose che si formano all’interno dei vasi
promuovono la formazione di coaguli che a loro volta possono essere causa
di occlusione dei vasi sanguigni.
Altra causa dell’aterosclerosi può essere una deficienza di recettori per le
LDL.
Molecole lipidiche di interesse clinico
Profilo lipidico
I livelli plasmatici delle molecole lipidiche variano significativamente in
popolazioni diverse essendo in rapporto a fattori genetici oltre che
all’alimentazione. È quindi relativo definire dei valori "normali“ di
riferimento.
In generale valori di colesterolo totale inferiori a 200 mg/dl e di colesterolo
LDL inferiori a 130 mg/dl si possono considerare accettabili.
Sono considerati valori "limite" per il colesterolo totale quelli compresi tra
200 e 239 mg/dl e per il colesterolo LDL tra 130 e 159 mg/dl.
In genere si considerano nella norma valori di colesterolo HDL compresi tra
40 e 50 mg/dl nell’uomo e 50 e 60 mg/dl nella donna.
Enzimi in biochimica clinica
Quando nel siero sanguigno si trovano enzimi che sono normalmente
intracellulari si è in presenza di danni tessutali e spesso il tipo di enzima
può essere messo in relazione al tessuto danneggiato.
Alcuni enzimi esistono in forme multiple (isoenzimi) e sono espressi in
cellule di tessuti diversi.
Isoenzimi = catalizzano la stessa reazione, ma hanno sequenza aa.
differente.
Esempi: la lattico deidrogenasi (LDH), l’alanina amminotransferasi
(ALT o GPT), l’aspartato amminotransaminasi (AST o GOT) e la
creatina chinasi (CK) sono tra gli enzimi più utili per fare diagnosi di
danno tessutale specifico (epatico o muscolare).
Marcatori di danno miocardico
Malattie cardiovascolari
L’infarto del miocardio e l’ictus sono caratterizzati dall’interruzione del
flusso sanguigno a una porzione di cuore o di cervello. Sono tra le principali
cause di morte nei paesi industrializzati.
Le cellule di questi organi muoiono a seguito della persistente carenza di O2
(accettore finale di elettroni nella catena di trasporto mitocondriale) dovuta
all’alterato flusso sanguigno. Ciò si può mettere anche in relazione al fatto
che una cellula dipendente soltanto dalla glicolisi per la produzione di ATP,
consuma rapidamente le sue scorte di fosfocreatina e di glicogeno non
avendo disponibilità di ossigeno da utilizzare per la respirazione.
Marcatori di danno miocardico
Malattie cardiovascolari
Quando nelle cellule la velocità di produzione dell’ATP si abbassa al di
sotto del livello richiesto per il funzionamento delle pompe ioniche di
membrana non può più essere mantenuta la corretta concentrazione
intracellulare dei vari ioni. Il bilancio osmotico del sistema si altera e la
cellula tende a gonfiarsi.
La membrana sotto tensione diventa permeabile e lascia uscire all’esterno
il materiale intracellulare. Entrano così nel circolo sanguigno molecole e
ioni che normalmente sono contenuti all’interno di queste cellule.
Marcatori di danno miocardico
Infarto del miocardio
La patologia che né è alla base è l’aterosclerosi.
Se il restringimento del lume delle arterie provoca la riduzione del flusso
coronarico si può avere dolore al torace (angina pectoris).
Se una placca ateromatosa instabile si frammenta, il contenuto rilasciato può
favorire la formazione di coaguli. Questo processo conosciuto come
trombosi, può dare luogo a un’improvvisa e completa occlusione dell’arteria
interessata e all’infarto dell’area del miocardio da essa irrorata.
Tra gli esami necessari per la diagnosi vi è la ricerca dei marcatori
biochimici entrati in circolo dopo i danni cellulari.
Marcatori di danno miocardico
Infarto del miocardio
Le cellule miocardiche perdendo la loro integrità rilasciano alcuni enzimi
quali AST, LDH e CK che entrano nel circolo sanguigno. Si innalza così il
loro livello sierico in misura significativa.
Rispetto agli altri enzimi diagnostici la LDH compare più tardivamente in
circolo in quanto l’aumento ematico dell’enzima si manifesta dopo circa
dodici ore dall’inizio della manifestazione dell’infarto; esso raggiunge il
massimo livello dopo circa 72 ore mantenendosi sopra i valori normali fino
alla settima o decima giornata di malattia. Perciò la determinazione dei
valori plasmatici di questo enzima ha particolare valore nei casi di infarto o
di sospetto infarto del miocardio di cui si effettua l’indagine a qualche
giorno di distanza dalla manifestazione clinica.
Marcatori di danno miocardico
Creatina chinasi (CK)
E’ il primo enzima ad aumentare nel siero dopo danno
muscolare o infarto del miocardio (> 100 mU/ml).
-Presente nel cuore e nei muscoli.
3 forme isoenzimatiche:
MM: muscolare
MB: cardiaco
BB: cerebrale
Comincia ad aumentare 4-6 ore dall’inizio della
sintomatologia dolorosa per raggiungere il massimo
dopo 18-36 ore e ritornare ai valori normali dopo 3-4
giorni.
Marcatori di danno miocardico
Isoenzima CK-MB
E’ un dimero formato da due diversi monomeri (M e B) presente nel
miocardio . L’interesse clinico della sua determinazione nel siero deriva dal
fatto che esso aumenta quasi esclusivamente nell’infarto del miocardio e
può essere considerato un enzima “infarto miocardico specifico”.
Nei casi di infarto del miocardio l’aumento dell’isoenzima MB è precoce;
comincia ad aumentare nelle prime 4-6 ore, raggiunge il massimo
rapidamente (16-20 ore) e più rapidamente della CK totale, torna nei limiti
della norma.
Marcatori di danno miocardico
Troponina
E’ una proteina formata da tre subunità (TnC, TnT e TnI) che regola
insieme ad altri complessi proteici la contrazione muscolare. Due isoforme
di queste proteine, T e I, sono specifiche per il miocardio.
Le cellule cardiache sono caratterizzate dalla presenza nel citoplasma di
strutture organizzate in filamenti, che consentono l’attività contrattile del
miocardio.
Le fibrille sono costituite da filamenti spessi, composti prevalentemente da
miosina, e filamenti sottili, composti da actina, tropomiosina e troponina.
La dismissione nel circolo sanguigno inizia 3-6 ore dopo l’insorgenza
dei sintomi dell’infarto e raggiungendo la massima concentrazione
dopo 12-24 ore.
Permane in circolo fino a 10 giorni e più dall’insorgenza dell’infarto
del miocardio.
Marcatori di danno miocardico
Troponina
www.portalesmedicos.com
J. I. A. Soler Díaz, M. Garrido Fernández, R.
Navarro Castelló, J. Díaz Torres.
Mentre le troponine T e I sono costitute da isoforme distinguibili
immunologicamente in cardiache e scheletriche, la TnC è costituita da
forme che presentano identica composizione amminoacidica, quindi
indistinguibili.
Marcatori di danno miocardico
Mioglobina
E’ la prima molecola ad essere immessa nel circolo sanguigno a seguito di
infarto. Non è però specifica per il muscolo cardiaco e risulta essere
fortemente elevata anche in altre condizioni. Infatti le caratteristiche
molecolari della mioglobina dei muscoli scheletrici e di quella cardiaca
sono identiche: pertanto non risulta possibile attribuire a questa molecola
proprietà tessuto specifiche.
L’incremento delle sua concentrazione ematica è osservabile mediamente
1-4 ore dopo l’insorgenza del dolore al torace per ritornare alla normalità
dopo 24-36 ore.
Comunque la mancata presenza in circolo di questa proteina può essere
utile per escludere l’infarto.
Marcatori di danno tessutale
Lattico deidrogenasi (LDH)
E’ un enzima presente in tutte le cellule con particolare riguardo al cuore,
fegato, muscoli, reni ed eritrociti, per cui il suo aumento nel siero è una
indicazione aspecifica di danno tessutale. Anche in questo caso maggiori
informazioni però si ottengono dall’analisi del tipo di isoenzima presente
che deriva dall’associazione di quattro subunità di due tipi differenti:
M4: muscoli e fegato
H4: cuore
H2M2: polmone, linfociti
H3M1: eritrociti
Valori elevati in:
¾Infarto del miocardio
¾Anemie
¾Patologie muscolari
¾Danni epatici
Dosaggi degli enzimi AST e ALT
Le transaminasi sono enzimi ubiquitari, sono comunque particolarmente
abbondanti in fegato e muscolo striato. Catalizzano reazioni di
trasferimento di un gruppo amminico da un amminoacido donatore ad
una molecola di α-chetoglutarato accettore, secondo la seguente reazione:
amminoacido 1 + α-chetoglutarato → chetoacido + glutammato
Per poi proseguire con la reazione catalizzata dalla glutammico
deidrogenasi:
glutammato + NAD + Pi→ α-chetoglutarato + NADH + NH4+
Questi enzimi sono considerati in clinica come indice, sebbene non
specifico di danno acuto degli epatociti, a prescindere dalle cause che ne
hanno provocato l’immissione in circolo anche se aumentano nel caso di
danni al tessuto muscolare scheletrico o cardiaco.
Dosaggi degli enzimi AST e ALT
Aspartato amminotransferasi (AST)
Spesso è indicata con la sigla GOT (4-37 U/l)
9E’contenuta in diverse cellule ma risulta particolarmente elevata in
cellule epatiche, miocardio e nel tessuto muscolare scheletrico.
9E’ localizzata nei mitocondri
–rilascio più lento nel sangue
–danno più grave
9Vi possono essere falsi positivi in caso di emolisi
9AST aumenta nell’infarto del miocardio, nelle epatiti, nella cirrosi
alcolica ( ↑ AST/ALT)
Catalizza la reazione reversibile:
L-aspartato+ α-chetoglutarato
L-glutammato + ossalacetato
Dosaggi degli enzimi AST e ALT
Alanina amminotransferasi (ALT)
Spesso è indicata con la sigla GPT (4-40 U/l)
9Localizzata principalmente nelle cellule epatiche fuoriesce per danni
a carico della membrana cellulare.
9Vi sono farmaci che ne causano l’innalzamento ematico.
9E’ più specifica per danno epatico, aumenta in epatite e cirrosi
catalizza la reazione reversibile:
L-alanina+ α-chetoglutarato
L-glutammato + piruvato
Biochimica Applicata
Corso di Laurea in Infermieristica
Dott. Maurizio Zecchini
E-mail: [email protected]
Azienda Sanitaria Locale 3 “Genovese”
Testo consigliato: Gaw A., Murphy M. J.,
“Biochimica clinica”
Editore Elsevier Masson