CHIMICA DI COORDINAZIONE I
LA SERIE SPETTROCHIMICA DEL COIII
INTRODUZIONE
Lo ione cobalto forma complessi in differenti stati ossidazione i più comuni tra i quali sono il Co II
ed il CoIII. I complessi in cui il cobalto si trova nello stato di ossidazione II risultano più stabili
rispetto a quello III, tuttavia i composti a basso spin del Co III sono numerosi. La loro stabilità
dipende grandemente dalla forza esercitata dai
leganti e risultano essere tanto più stabili quanto
più forte è il campo da essi esercitato. Il cobalto
(III) mostra una particolare affinità per i donatori
azotati. I genere questi complessi vengono
sintetizzati
per
reazione
dell’acquaione
[Co(H2O)6]2+
con i leganti e successiva
ossidazione con ossigeno molecolare (spesso in
presenza di carbone attivo come catalizzatore) o
con perossido di idrogeno.
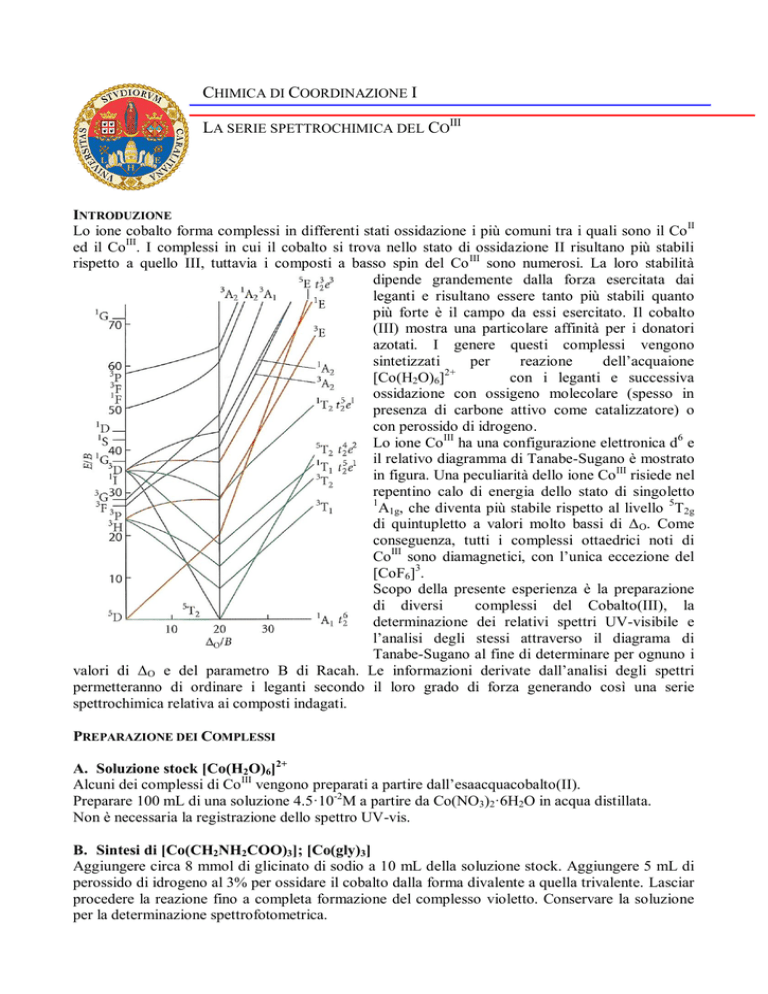
Lo ione CoIII ha una configurazione elettronica d6 e
il relativo diagramma di Tanabe-Sugano è mostrato
in figura. Una peculiarità dello ione Co III risiede nel
repentino calo di energia dello stato di singoletto
1
A1g, che diventa più stabile rispetto al livello 5T2g
di quintupletto a valori molto bassi di ΔO. Come
conseguenza, tutti i complessi ottaedrici noti di
CoIII sono diamagnetici, con l’unica eccezione del
[CoF6]3.
Scopo della presente esperienza è la preparazione
di diversi
complessi del Cobalto(III), la
determinazione dei relativi spettri UV-visibile e
l’analisi degli stessi attraverso il diagrama di
Tanabe-Sugano al fine di determinare per ognuno i
valori di ΔO e del parametro B di Racah. Le informazioni derivate dall’analisi degli spettri
permetteranno di ordinare i leganti secondo il loro grado di forza generando così una serie
spettrochimica relativa ai composti indagati.
PREPARAZIONE DEI COMPLESSI
A. Soluzione stock [Co(H2O)6]2+
Alcuni dei complessi di Co III vengono preparati a partire dall’esaacquacobalto(II).
Preparare 100 mL di una soluzione 4.5·10-2M a partire da Co(NO3)2·6H2O in acqua distillata.
Non è necessaria la registrazione dello spettro UV-vis.
B. Sintesi di [Co(CH2NH2COO)3]; [Co(gly)3]
Aggiungere circa 8 mmol di glicinato di sodio a 10 mL della soluzione stock. Aggiungere 5 mL di
perossido di idrogeno al 3% per ossidare il cobalto dalla forma divalente a quella trivalente. Lasciar
procedere la reazione fino a completa formazione del complesso violetto. Conservare la soluzione
per la determinazione spettrofotometrica.
C. Sintesi di [Co(C2O4)3]3-; [Co(ox)3]3Aggiungere circa 8.5 mmol di ossalato di potassio a 10 mL della soluzione stock. Aggiungere 5 mL
di perossido di idrogeno al 3% e scaldare blandamente sotto agitazione fino alla formazione di un
complesso verde smeraldo. Conservare la soluzione per la determinazione spettrofotometrica.
D. Sintesi di [Co(CO3)3]3a) Preparare una soluzione solubilizzando 2 mmol di Co(NO3)2·6H2O in 10 mL d’acqua e 0.1
mL di perossido di idrogeno al 30%.
b) Preparare in un becher capiente una soluzione contenente 54 mmol di NaHCO 3 solubilizzati
in 10 mL d’acqua e 0.1 mL di perossido di idrogeno al 30%.
Unire la soluzione di nitrato di cobalto (a) alla soluzione di bicarbonato di potassio (b):
ATTENZIONE la reazione sviluppa gas, accertarsi pertanto che il becher scelto per la preparazione
sia sufficientemente grande da contenere l’eventuale sviluppo di schiuma. La soluzione presenta un
colore verde.
Conservare una parte della soluzione per la registrazione dello spettro UV-visibile. Diluire sul
momento la soluzione (circa 1:25) prima della registrazione dello spettro UV.
La rimanente soluzione viene utilizzata per la preparazione della soluzione di esaacquo cobalto
(III).
E. Sintesi di [Co(H2O)6]3+
ATTENZIONE: L’esa-acquo complesso di Co III è particolarmente instabile: potrebbe risultare
necessario ripreparare la soluzione immediatamente prima della sua determinazione
spettrofotometrica.
Aggiungere cautamente 16 mL di acido nitrico 4M a 4 mL della soluzione di tri-carbonato-cobaltato
(III). La reazione sviluppa gas e porta all’ottenimento di una soluzione di colore blu. Evitare
l’utilizzo di HCl per evitare la successiva riduzione del Co III.
F. Sintesi di [Co(phen)3]3+
Utilizzare 10 mL della soluzione di [Co(H2O)6]3+ preparata al punto precedente ed aggiungere 0.7
mmol di 1,10-fenantrolina. Controllare la soluzione ottenuta: se quest’ultima si presenta rossobordeaux aggiungere 10 mL di H2O2 al 3% e tenere sotto agitazione finché la soluzione diventa
di colore giallo (circa 5 minuti). Conservare la soluzione per la determinazione spettrofotometrica.
G. Sintesi di [Co(NO2)6]3Procurarsi una beuta con relativo tappo.
a) Solubilizzare 0.7 mmol di nitrato di cobalto (II) in 2 mL d’acqua.
b) Solubilizzare 22 mmol di nitrito di sodio in 5 mL d’acqua (utilizzare la beuta).
c) Unire le due soluzioni e aggiungere 0.8 mL di acido acetico glaciale.
ATTENZIONE: lavorare sotto cappa perché la reazione avviene con sviluppo di gas.
Diluire la soluzione così ottenuta fino a raggiungere un volume finale di 25 mL, tappare la beuta e
lasciare sotto vigorosa agitazione per 3-5 minuti. Conservare la soluzione ottenuta (arancio) e
diluirla prima dell’analisi spettrofotometrica UV-Vis (circa 1:50 colorazione gialla).
H. Sintesi di [Co(NH3)6]3+
Utilizzare un provettone per la reazione.
Dissolvere 3.3 mmol di Co(NO3)2·6H2O e 10 mmol di NH4Cl in 5 mL di H2O, aggiungendo 1.7 mL
di NH3(aq) concentrata e 13 mg di carbone attivo. Far gorgogliare aria all’interno della soluzione
per circa 3 ore al fine di ossidare il cobalto dalla forma divalente a quella trivalente.
Filtrare il solido sotto vuoto utilizzando un filtro tipo Buchner munito di un disco di carta da filtro.
Trattare il solido ottenuto in 25 mL di HCl 0.24 M sotto blando riscaldamento (40-50°C) per 10
minuti. Rimuovere il carbone attivo filtrando su celite.
Conservare la soluzione arancione così ottenute per la determinazione spettrofotometrica. Prima di
registrare lo spettro UV-Vis è necessario diluire la soluzione 1:10.
I. Sintesi di [Co(en)3]3+
In una piccola beuta aggiungere goccia a goccia 1.7 mL di etilendiammina ad 1 mL di HCl 6M.
Aggiungere quindi 2.5 mmol Co(NO3)2·6H2O e solubilizzare in 5 mL d’acqua.
Far gorgogliare aria all’interno della soluzione per circa 3 ore al fine di ossidare il cobalto dalla
forma divalente a quella trivalente. Al termine dell’ossidazione filtrare la miscela di reazione e
lavare il solido arancione ottenuto con etanolo. Asciugare in stufa il solido ottenuto.
Preparare la soluzione per la determinazione spettrofotometrica solubilizzando 20 mg del prodotto
in 10 mL di H2O.
ANALISI SPETTROFOTOMETRICA
Registrare gli spettri UV-visibile dei complessi preparati e ricavare i valori dei massimi di
assorbimento relativi ad ognuno dei composti di coordinazione. Utilizzando il diagramma di
Tanabe-Sugano relativo alla configurazione d6 calcolare per ogni composto il valore del ΔO, del
parametro B di Racah e calcolare il valore β.
RELAZIONE
a) Per ognuna delle sintesi effettuate riportare la procedura sperimentale eseguita, scrivere le
reazioni ed indicare eventuali problemi o difficoltà riscontrati.
b) Commentare i dati spettroscopici ottenuti e utilizzarli per costruire la serie spettrochimica e
la serie nefelauxetica relative ai leganti studiati.