The European Agency for the Evaluation of Medicinal Products
ALLEGATO I
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
7 Westferry Circus, Canary Wharf, London E14 4HB, UK
Tel: (+44-171) 418 84 00 Fax: (+44-171) 418 84 16
E_Mail: [email protected] http://www.eudra.org/emea.html
1.
DENOMINAZIONE DEL MEDICINALE
BEROMUN 1 mg polvere e solvente per soluzione per infusione.
2.
COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Un flaconcino contiene 1 mg di tasonermina (Fattore di Necrosi Tumorale alfa-1a; TNFα-1a) con
attività compresa tra 3,0 e 6,0 x 107 UI. Dopo ricostituzione la concentrazione è di 0,2 mg/ml.
Per gli eccipienti, vedere 6.1.
3.
FORMA FARMACEUTICA
Polvere e solvente per soluzione per infusione (per perfusione locoregionale dell'arto; ILP) contenente
una quantità di 1 mg di tasonermina.
La soluzione ricostituita può essere utilizzata solo per uso singolo in terapie perfusive locoregionali
degli arti (ILP).
4.
INFORMAZIONI CLINICHE
4.1
Indicazioni terapeutiche
Terapia aggiuntiva alla terapia chirurgica finalizzata alla rimozione del tumore, al fine di prevenire o
ritardare l'amputazione dell'arto, o come terapia palliativa in presenza di sarcomi inoperabili dei
tessuti molli degli arti, somministrata in associazione al melfalan per perfusione locoregionale
ipertermica moderata dell'arto (ILP).
4.2
Posologia e modo di somministrazione
BEROMUN:
Arti superiori: dose totale 3 mg per perfusione locoregionale.
Arti inferiori: dose totale 4 mg per perfusione locoregionale.
Melfalan:
La dose di melfalan deve essere calcolata in accordo al metodo litro-volume di Wieberdink1) fino ad
una dose massima di 150 mg.
13 mg/l per volume perfuso dell'arto superiore.
10 mg/l per volume perfuso dell'arto inferiore.
Questo trattamento deve essere eseguito in centri specialistici, ad opera di gruppi di chirurghi
specializzati nel trattamento dei sarcomi dei tessuti molli degli arti e nelle tecniche di perfusione
locoregionale degli arti con un' unità di terapia intensiva sempre a disposizione e con
attrezzature per monitorare in modo continuo l'immissione del medicinale a livello sistemico
per una perdita dalla perfusione locoregionale.
BEROMUN deve essere somministrato per perfusione locoregionale ipertermica moderata dell'arto. Il
circuito di perfusione (pompa a cilindro, ossigenatore con serbatoio, scambiatore termico, tubi di
collegamento) deve essere preparato prima dell'intervento chirurgico e caricato con da 700 a 800 ml di
perfusato, con ematocrito da 0,25 a 0,30.
Occorre scegliere un adeguato livello di perfusione per comprendere completamente il tessuto affetto
(le possibili vie sono le seguenti: iliaca esterna, femorale comune, poplitea-femorale, poplitea,
1
ascellare e brachiale) e introdurre i cateteri. La dispersione di calore a livello dell'arto deve essere
prevenuta applicando coperte termiche e si deve monitorare continuamente la temperatura dell'arto
con sonde termistore inserite nel tessuto sottocutaneo e nel muscolo. Mano e piede, se non interessati,
devono essere protetti da bendaggi Esmarch (espulsione). Deve essere applicato un tourniquet all'arto
prossimale.
Dopo la connessione dell'arto al circuito di perfusione locoregionale, si deve regolare la velocità di
flusso a 35 - 40 ml/l di volume dell'arto / minuto e controllare la perdita di liquidi (leakage) dall'arto
alla circolazione sistemica utilizzando la tecnica tracciante radioattiva (vedere paragrafo 4.4). Possono
essere necessari aggiustamenti della velocità del flusso e un tourniquet per garantire che la perdita di
liquidi (leakage) dal circuito di perfusione alla circolazione sistemica sia stabile (il livello sistemico di
radioattività ha raggiunto il plateau) e non sia superiore al 10%. BEROMUN deve essere
somministrato solo se la perdita è inferiore al 10%.
Una volta che la temperatura nel tessuto distale subcutaneo dell'arto ha raggiunto un valore > 38°C
(ma non deve superare i 39°C) e il pH del perfusato è compreso tra 7,2 e 7,35, BEROMUN deve
essere somministrato come bolo nella linea arteriosa del circuito. Dopo 30 minuti di perfusione del
solo BEROMUN, si deve aggiungere melfalan come bolo nel serbatoio del circuito, o aggiungerlo
lentamente nella linea arteriosa del circuito. La temperatura deve quindi essere aumentata a > 39°C
(ma non deve superare i 40°C) in due diversi punti di misura nell'area tumorale. La durata della
perfusione per la somministrazione di melfalan deve essere di 60 minuti. In questo modo, la durata
totale della perfusione sarà di 90 minuti.
Al termine della perfusione, il perfusato deve essere raccolto nel serbatoio mentre il fluido di lavaggio
è aggiunto contemporaneamente al circuito e deve circolare alla stessa velocità di flusso di 35 - 40
ml/l di volume dell'arto / minuto. Il lavaggio deve continuare fino a quando il colore del perfusato è
chiaro (rosa, trasparente; vedere paragrafo 4.4).
Non si hanno dati sulla tollerabilità ed efficacia in bambini ed adolescenti di età inferiore ai 16 anni.
Quando è possibile si deve procedere alla rimozione chirurgica del tumore residuo. Se necessario, può
essere effettuata una seconda perfusione locoregionale dell'arto 6 - 8 settimane dopo il primo
trattamento.
4.3
Controindicazioni
Le controindicazioni all'impiego di BEROMUN per perfusione locoregionale dell'arto (ILP),
suddivise per componenti della procedura, sono:
Controindicazioni a BEROMUN:
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti.
Gravi malattie cardiovascolari come scompenso cardiaco (New York Heart Association, Classe II, III,
o IV), angina pectoris grave, aritmie cardiache, infarto miocardico verificatosi nei 3 mesi precedenti il
trattamento, trombosi venosa, arteriopatie periferiche occlusive, embolia polmonare recente.
Forme gravi di patologia polmonare.
Storia recente di ulcera peptica o ulcera peptica in fase attiva.
Forme gravi di ascite.
Alterazioni ematologiche clinicamente significative: es. leucociti < 2,5 x 109/l, emoglobina < 9 g/dl,
piastrine < 60 x 109/l, diatesi emorragica o sanguinamenti.
Alterazioni della funzionalità renale clinicamente significative: es. sindrome nefrotica, creatinina
sierica > 150 moli/l o clearance della creatinina < 50 ml/minuto.
2
Alterazioni della funzionalità epatica clinicamente significative: es. livelli di aspartatoaminotransferasi, di alanina-aminotransferasi o di fosfatasi alcalina superiori di 2 volte al limite
superiore di normalità; o livelli di bilirubina superiori di 1,25 volte al limite superiore di normalità.
Ipercalcemia > 12 mg/dl (2,99 mmoli/l).
Pazienti per i quali sia controindicato l'uso di farmaci vasopressori.
Pazienti per i quali sia controindicato l'uso di anticoagulanti.
Trattamento contemporaneo con sostanze cardiotossiche (es. antracicline).
Uso durante la gravidanza e l'allattamento. (Vedere paragrafo 4.6).
Controindicazioni a melfalan:
Per cortesia prendere come riferimento il riassunto delle caratteristiche del prodotto di melfalan.
Controindicazioni alla procedura ILP:
Gravi forme di ascite.
Grave forma di linfoedema dell'arto.
Pazienti per i quali sia controindicato l'uso di agenti vasopressori.
Pazienti per i quali sia controindicato l'uso di anticoagulanti.
Pazienti per i quali sia controindicato il monitoraggio con tracciante radioattivo.
Pazienti per i quali sia controindicata l'ipertermia dell'arto.
Pazienti in cui si sospetti che l'irrorazione di distretti dell'arto distali rispetto al tumore sia altamente
dipendente dai vasi sanguigni che irrorano il tumore. Questa possibilità può essere verificata con un
arteriogramma.
Uso in gravidanza e allattamento.
4.4
Avvertenze speciali e opportune precauzioni d'impiego
La perfusione locoregionale dell'arto deve essere effettuata in centri specialistici, ad opera di gruppi di
chirurghi specializzati nelle tecniche di trattamento dei sarcomi dell'arto e della perfusione
locoregionale, con un'unità di terapia intensiva sempre a disposizione ed inoltre devono essere
disponibili attrezzature ed organizzazioni tali che permettano di monitorare in modo continuo la
perdita del medicinale nella circolazione sistemica. BEROMUN non deve essere somministrato
sistemicamente.
Per cortesia fare riferimento al riassunto delle caratteristiche del prodotto di melfalan prima di iniziare
la procedura di perfusione locoregionale.
E' necessario indurre l'anestesia generale e conseguentemente instaurare una ventilazione meccanica
in accordo ai metodi standard. E' importante mantenere un livello costante di anestesia in modo da
prevenire grandi fluttuazioni nella pressione sanguigna sistemica, che può influenzare la perdita tra la
circolazione sistemica e il circuito di perfusione.
Durante la procedura di perfusione locoregionale dell'arto, si deve monitorare la pressione venosa e
arteriosa centrale. Inoltre, è opportuno monitorare costantemente nelle prime 24 - 48 ore, ed anche più
a lungo se necessario, la pressione sanguigna, la diuresi giornaliera e la funzionalità cardiaca
attraverso l'elettrocardiogramma. Per il monitoraggio della pressione arteriosa polmonare e per la
3
pressione occludente, durante la procedura di perfusione locoregionale dell'arto e nel periodo postoperatorio, può essere usato un catetere di Swan-Ganz.
Per la prevenzione ed il trattamento di febbre, brividi ed altri sintomi di tipo influenzali associati alla
somministrazione di BEROMUN, si può utilizzare del paracetamolo (per via orale o rettale) o un altro
farmaco analgesico/antipiretico, da somministrare prima della procedura di perfusione locoregionale
dell'arto.
Per la profilassi dello shock, i pazienti devono sempre ricevere una adeguata idratazione
immediatamente prima, durante e dopo la procedura di perfusione. In tal modo sono assicurate
condizioni emodinamiche ottimali ed una elevata diuresi giornaliera, specialmente dopo la perfusione,
per permettere una eliminazione rapida da qualsiasi residuo di BEROMUN. Ulteriori liquidi di
rianimazione (cristalloidi e soluzioni di colloidi) devono essere disponibili per determinare
un'espansione di volume in caso di grave caduta della pressione sanguigna. Fluidi a base di colloidi e
etilidrossiamido sono preferibili, poichè è meno probabile che possano infiltrarsi nel sistema
vascolare. Inoltre, se ritenuto clinicamente necessario, sia durante la procedura di perfusione
locoregionale dell'arto sia nel periodo post-operatorio, si può somministrare un agente vasopressore,
ad esempio dopamina. Nel caso in cui si verifichi uno shock grave prima che sia terminato il
trattamento, si deve interrompere la perfusione locoregionale dell'arto e si deve ricorrere ad una
appropriata terapia.
Per ridurre al minimo il rischio di un passaggio del perfusato nella circolazione sistemica, la velocità
del flusso di perfusione non deve superare i 40 ml/l di volume dell'arto / minuto. Il potenziale
passaggio deve essere misurato con albumina o eritrociti marcati iniettati nel circuito di perfusione,
con appropriate misure per il monitoraggio continuo del passaggio del marcato nella circolazione
sistemica2,3,4. Possono essere necessari aggiustamenti della velocità di flusso e un tourniquet per
assicurare che la perdita di liquidi (leakage) dal circuito di perfusione alla circolazione sistemica sia
stabile (il livello sistemico di radioattività ha raggiunto il plateau) e non sia superiore al 10%. La
perfusione deve essere interrotta se la quantità totale di leakage è superiore al 10%. In questo caso,
deve essere eseguita una procedura standard di lavaggio, usando almeno 2 litri di dextran 70 infusione
intravenosa o di un fluido simile.
Dopo la procedura di perfusione locoregionale dell'arto, deve essere sempre eseguita una procedura
standard di lavaggio, usando dextran 70 infusione intravenosa o un fluido simile. Dopo una perfusione
dell'arto inferiore, devono essere usati 3-6 litri e dopo una perfusione dell'arto superiore 1-2 litri. In
casi di perfusione poplitea o brachiale, può essere necessario non più di un litro. Il lavaggio deve
continuare fino ad ottenere un flusso venoso pulito (rosa, trasparente).
E' necessario controllare che i periodi di mancanza di ossigenazione all'arto siano i più brevi possibili
(20 minuti al massimo).
Se è necessaria una seconda procedura di perfusione loregionale dell'arto, il medico deve tenere in
considerazione la velocità di leakage della precedente procedura di perfusione.
La dose massima tollerata (MTD) di BEROMUN per perfusione locoregionle dell'arto (ILP) è 4 mg,
che è 10 volte la dose massima sistemica tollerata. Quindi, ogni volta che c'è una perdita sistemica
significativa di BEROMUN, ci si deve attendere degli eventi indesiderati gravi. Dosi superiori a 6 mg
di altre preparazioni di TNFα sono state somministrate con procedura di perfusione, ma questa dose è
risultata inaccettabile in termini di tossicità locoregionale.
Se appaiono segni di tossicità, per esempio febbre, aritmie cardiache, shock/ipotensione, sindrome da
distress respiratorio dell'adulto (ARDS), si devono utilizzare misure di supporto generali e si deve
trasferire immediatamente il paziente in un'unità di terapia intensiva per il controllo. Si consigliano
espansori di volume e vasopressori. Nel caso si sviluppi sindrome da distress respiratorio dell'adulto
(ARDS) può essere richiesto il supporto di respirazione artificiale. Si devono controllare attentamente
la funzione epatica e renale. Si potrebbero verificare alterazioni ematologiche, in particolare
leucopenia, trombocitopenia e disfunzioni della coagulazione.
4.5
Interazioni con altri medicinali ed altre forme d’interazione
4
Non sono stati condotti studi formali sulla possibile interazione di BEROMUN con altri farmaci.
BEROMUN non deve essere somministrato in concomitanza con altri farmaci se non con quanto
previsto dalla terapia standard, cioè con melfalan.
BEROMUN è stato somministrato con gamma interferone nella procedura di perfusione locoregionale
dell'arto, ma non è stato dimostrato valore aggiunto. L'aggiunta di interferone gamma al perfusato di
tasonermina sembra non essere associata ad un significativo aumento nella produzione endogena di
tasonermina o di altre citochine infiammatorie, come dimostrato in pazienti con trauma grave.
Comunque dati clinici indicano che l'incidenza degli eventi avversi aumenta globalmente se i pazienti
sono esposti contemporaneamente a tasonermina e interferone gamma.
Le combinazioni con sostanze cardiotossiche (es. antracicline) devono essere evitate perchè è
possibile che la tasonermina possa aumentarne la cardiotossicità, come osservato in uno studio
preclinico tossicologico di 13 settimane.
Durante la procedura di perfusione locoregionale dell'arto e nell'immediato periodo postoperatorio
sono comunemente usate diverse misure terapeutiche. Queste includono farmaci anestetici, analgesici,
antipiretici, fluidi per somministrazione endovenosa, agenti anticoagulanti e vasopressori. Nessuno di
questi farmaci antagonizza gli effetti farmacodinamici della tasonermina. Sebbene sino ad oggi non
siano state osservate interazioni significative, si raccomanda comunque la massima cautela. Non è
raccomandata la somministrazione di farmaci che possano indurre una significativa ipotensione.
Si rimanda alla consultazione del riassunto delle caratteristiche del prodotto di melfalan per conoscere
le interazioni di melfalan con altri farmaci.
4.6
Gravidanza ed allattamento
Non sono disponibili dati sull'uso di BEROMUN nell'uomo e nell'animale durante la gravidanza.
BEROMUN non deve essere somministrato alle donne in stato interessante o a donne non in
menopausa che non usino adeguati metodi contraccettivi.
Non è noto se BEROMUN venga secreto nel latte materno. Non avendo dati sui potenziali rischi per il
neonato, l'allattamento è controindicato nei 7 giorni successivi al trattamento con BEROMUN.
4.7
Effetti sulla capacità di guidare veicoli e sull'uso di macchine
Non pertinente.
4.8
Effetti indesiderati
Gli effetti indesiderati possono essere collegati a BEROMUN, a melfalan, o alla procedura di
perfusione e alle misure associate.
Eventi indesiderati sistemici:
La maggior parte dei pazienti accusa febbre, normalmente lieve o moderata. Altri eventi indesiderati
sistemici comunemente verificatisi (superiori al 10%) sono nausea e/o vomito, aritmie cardiache,
stanchezza, brividi, epatotossicità e infezioni.
Eventi indesiderati sistemici meno comuni (inferiori al 10%) riportati sono alterazioni della
funzionalità cardiaca, stipsi, trombocitopenia, sudorazione notturna, neurotossicità periferica,
proteinuria, shock/ipotensione, mialgia, alterazioni dello stato di coscienza, cefalea, diarrea, sindrome
da distress respiratorio nell'adulto, leucopenia, insufficienza renale acuta.
5
Gravi eventi indesiderati sistemici riportati (stadio III e IV della World Health Organization; tutti con
incidenza inferiore al 10%) sono epatotossicità, trombocitopenia, febbre, alterazioni della funzionalità
cardiaca, leucopenia, shock, infezioni, sindrome da distress respiratorio nell'adulto, aritmie cardiache
e insufficienza renale acuta.
Eventi indesiderati a livello locale:
Eventi indesiderati locali comunemente verificatesi (superiori al 10%) comprendono reazioni cutanee,
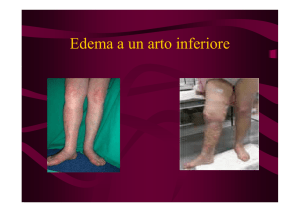
edema, dolore all'arto perfuso, lesioni neurologiche e infezione della ferita. Eventi indesiderati locali
meno comuni (inferiori al 10%) sono trombosi arteriosa e venosa, perdita delle unghie e danni
tissutali tali da comportarne l'amputazione.
Sono state raramente osservate nei pazienti a cui è stato somministrato BEROMUN reazioni gravi di
ipersensibilità acuta.
4.9
Sovradosaggio
Poichè il trattamento con BEROMUN avviene sempre in pazienti ospedalizzati sotto il controllo di
gruppi di esperti chirurghi è estremamente improbabile che una dose eccessiva di farmaco venga
somministrata accidentalmente. Nell'eventualità che si verifichi comunque un sovradosaggio, si deve
immediatamente sospendere la perfusione e si deve lavare l'arto usando almeno 2 litri di dextran 70
infusione intravenosa o di soluzioni equivalenti (vedere paragrafo 4.4).
Se si rendessero evidenti segni di tossicità sistemica, per esempio se comparissero febbre, aritmie
cardiaca, shock/ipotensione, sindrome da distress respiratorio dell'adulto (ARDS) allora si dovrebbero
utilizzare le consuete misure e trattamenti di supporto trasferendo il paziente in una unità di terapia
intensiva. Si consiglia l'uso di espansori del volume plasmatico e la somministrazione di farmaci
vasopressori. Nel caso si sviluppasse la sindrome da distress respiratorio dell'adulto, può essere
necessario ricorrere ad un respiratore artificiale. Le funzionalità renale ed epatica devono essere
monitorate strettamente. Si possono verificare alterazioni ematologiche come leucopenia,
trombocitopenia e alterazioni della coagulazione.
Attualmente non è disponibile un antidoto specifico per BEROMUN. Si sconsiglia il trattamento con
anticorpi anti-TNFα.
Per cortesia prendere come riferimento il riassunto delle caratteristiche del prodotto di melfalan per
informazioni circa il sovradosaggio con melfalan.
5.
PROPRIETÀ FARMACOLOGICHE
5.1
Proprietà farmacodinamiche
Categoria farmacoterapeutica: Citochine, codice ATC: LO3A A
6
Meccanismo d'azione:
In vivo L'attività antitumorale è basata probabilmente sia su effetti diretti che indiretti:
-
Inibizione diretta della proliferazione delle cellule tumorali
In vitro la tasonermina si è dimostrata citotossica e citostatica rispetto a parecchie linee cellulari
tumorali di varia istogenesi.
-
Effetti diretti sul sistema vascolare del tumore
La tasonermina agisce sulla morfologia e riduce la proliferazione delle cellule endoteliali e modifica
l'espressione di proteine specifiche della superficie cellulare nonchè l'espressione di proteine di tipo
secretorio (come le molecole responsabili dei processi di adesione, le proteine che modulano la
coagulazione, le interleuchine e i fattori di crescita ematopoietici). A loro volta tali modificazioni
portano ad uno stato procoagulativo che comporta delle trombosi microvascolari. Inoltre, vengono
aumentate le capacità di adesione e di fuoriuscita dai vasi dei leucociti, favorendo l'infiltrazione della
massa tumorale da parte di linfociti, monociti e granulociti. Per ora non è nota la causa della maggiore
sensibilità alla tasonermina del sistema vascolare del tumore, che ha una alta sensibilità, rispetto al
normale sistema vascolare, caratterizzato invece da una bassa sensibilità.
-
Modulazione immunologica diretta ed indiretta
La tasonermina ha effetti di notevole entità sui componenti cellulari del sistema immunologico.
Vengono aumentate la proliferazione dei linfociti attivati di tipo B e T, lo sviluppo delle cellule
citotossiche di tipo T, lo sviluppo delle cellule che producono immunoglobuline. I monociti e i
macrofagi vengono attivati per sopprimere le cellule tumorali, i granulociti vengono attivati per
esercitare una maggiore attività fagocitaria, un aumento del burst respiratorio e della degranulazione,
e una maggiore capacità di adesione all'endotelio. Inoltre, in aggiunta agli effetti diretti, la
tasonermina modula le risposte immunitarie inducendo sia la produzione di citochine che di mediatori
a basso peso molecolare (prostaglandine, fattori di attivazione delle piastrine). Molte evidenze
sperimentali suggeriscono che queste attività immunomodulatrici sono rilevanti per gli effetti
antitumorali; ad esempio, le attività antitumorali della tasonermina sono molto meno pronunciate in
animali immunodeficienti. Inoltre, gli animali che, a seguito di un trattamento con tasonermina,
rigettano i tumori sperimentali possono sviluppare una immunità specifica contro questo tipo di
cellule tumorali.
Effetti farmacodinamici:
La tasonermina è risultata attiva nel classico saggio del fattore di necrosi del tumore, producendo, a
seguito di somministrazione sistemica o locale, una necrosi emorragica dei noduli tumorali nei tumori
singenici del topo e in quelli xenogenici dell'uomo.
La somministrazione sistemica di tasonermina viene limitata a causa dei suoi effetti tossici, poichè la
dose efficace individuata negli studi preclinici è sostanzialmente più alta della dose massima tollerata
dall'uomo.
Il trattamento locoregionale con BEROMUN insieme a melfalan, si è dimostrato altamente efficace
contro il sarcoma del tessuto molle degli arti. Comunque, il trattamento è specificamente un
trattamento locoregionale e non è dimostrato che influisca sulla sopravvivenza.
Con un'analisi statistica per dati appaiati sulla sopravvivenza di pazienti trattati con BEROMUN e
melfalan mediante ILP rispetto a dati storici di confronto non è stato possibile dimostrare nessuna
differenza sulla sopravvivenza (p=0,5).
7
5.2
Proprietà farmacocinetiche
Farmacocinetica sistemica:
Le informazioni sulla farmacocinetica sistemica della tasonermina sono scarse. E' stata osservata una
dose-dipendenza, come evidente dalla diminuzione della clearance e dall'aumento della emivita
all'aumentare delle dosi. L'emivita terminale alla massima dose tollerata per via intravenosa (150
μg/m2) è di 15-30 minuti.
Farmacocinetica nella perfusione locoregionale dell' arto:
La perfusione locoregionale dell'arto permette di somministrare, nell'arto, concentrazioni di
tasonermina alte e piuttosto stabili. I dati ottenuti da 51 pazienti sottoposti a ILP hanno dimostrato che
le concentrazioni massime di tasonermina nel circuito di perfusione vengono raggiunte in 30 minuti
dall'inizio della procedura ILP e sono comprese tra 3000 e 4000 ng/ ml. In condizioni di perdita
sistemica inferiore al 2% (osservate in 38 pazienti su 51), le concentrazioni massime di tasonermina
nella circolazione sistemica sono raggiunte in 5 minuti dall'inizio della procedura ILP e sono
approssimativamente 200 volte inferiori rispetto al circuito di perfusione. In condizioni di perdita
sistemica superiore al 2% (osservate in 13 pazienti su 51) le concentrazioni massime di tasonermina
nella circolazione sistemica sono ancora almeno 10 volte più basse rispetto al circuito di perfusione.
5.3
Dati preclinici di sicurezza
Il profilo tossicologico della tasonermina è stato valutato in studi preclinici usando topi, ratti, conigli,
cani e scimmie. Variazioni ematologiche e circolatorie, diminuzione del benessere e dell'aumento di
peso così come modifiche delle funzionalità epatica e renale sono stati i principali effetti collaterali
osservati per somministrazioni ripetute di tasonermina. Le variazioni ematologiche comprendono
anemia, aumento dell'ematocrito e aumento o diminuzione di leucociti e piastrine a seconda delle
specie e della durata del trattamento. Le variazioni circolatorie comprendono diminuzione della
pressione sanguigna e, in alcuni studi, aumento della frequenza cardiaca e diminuzione della
contrattilità. Le capacità di sintesi del fegato vengono diminuite come dimostrato dall'aumento degli
enzimi epatici. Le alterazioni della funzionalità renale comprendono aumento dell'escrezione di acqua
e di sodio e aumento di urea e creatinina. Negli studi preclinici, con l'eccezione di uno studio durato 7
giorni nelle scimmie cui erano stati somministrati 0,1 μg/kg di tasonermina, non è stato possibile
stabilire il livello esente da effetti tossici (No Observed Toxic Effect Level; NOTEL). Le alterazioni,
osservate alla dose più bassa negli studi di 13 settimane, possono essere classificate come minime e
completamente reversibili.
La tasonermina non attraversa in quantità significativa la barriera ematoencefalica intatta nel topo.
Nelle scimmie Rhesus, la radiografia dell'intero corpo effettuata dopo la somministrazione di
tasonermina marcata non ha indicato una modalità particolare di distribuzione. La tasonermina non
attraversa la placenta nè passa in zone necrotiche del tumore. Nelle scimmie Rhesus, gli studi di
farmacocinetica a seguito di iniezione i.v. di tasonermina hanno indicato una escrezione non-specifica
e non-saturabile attraverso la filtrazione glomerulare renale. Sembra probabile poi un secondo
meccanismo di escrezione, specifico e saturabile, che coinvolge i recettori della tasonermina.
In vivo e in vitro non è stato segnalato alcun effetto mutageno. Non sono stati condotti studi di
tossicità sulla riproduzione o di cancerogenesi, poichè tali studi sono stati ritenuti inappropriati visto
che l'uso clinico di BEROMUN è quello della perfusione locoregionale dell' arto per il trattamento di
sarcomi dei tessuti molli.
Allo scopo di ottenere dati significativi per il previsto uso clinico di BEROMUN, sono state condotte
sperimentazioni di perfusione locoregionale negli arti posteriori di ratti sani usando varie dosi nella
stessa concentrazione di tasonermina della situazione clinica. Ad eccezione di lievi aggravamenti
degli effetti ischemici alle dosi più alte, gli esami istologici standard della pelle, del muscolo, delle
ossa, dei nervi e dei vasi non hanno rivelato alcuna differenza tra i risultati ottenuti sugli animali
trattati con tasonermina e i risultati ottenuti sui controlli. Non si sono osservati effetti dannosi a
distanza del trattamento con tasonermina.
8
6.
INFORMAZIONI FARMACEUTICHE
6.1
Elenco degli eccipienti
BEROMUN contiene i seguenti eccipienti: sodio diidrogeno fosfato diidrato, disodio idrogeno fosfato
dodecaidrato, cloruro di sodio e albumina di siero umano. La soluzione solvente è costituita da cloruro
di sodio e acqua per preparazioni iniettabili.
6.2
Incompatibilità
La tecnica di perfusione locoregionale dell'arto non ha messo in luce particolari incompatibilità di
BEROMUN con gli altri componenti del perfusato, con la situazione di ipertermia, con la membrana
dell'ossigenatore o con le cannule e i tubi in silicone. L'analisi di molteplici campioni di perfusato,
prelevati durante diversi trattamenti di perfusione locoregionale dell'arto, ha dimostrato che i livelli di
plateau di tasonermina (misurati con metodo ELISA) si mantengono per un periodo superiore ai 100
minuti dall'inizio della perfusione, senza che si verifichi un abbassamento della concentrazione
attribuibile alla degradazione di tasonermina.
Per cortesia fare riferimento al riassunto delle caratteristiche del prodotto di melfalan per
informazioni realtive alle incompatibilità con melfalan.
6.3
le
Periodo di validità
Periodo di validità del farmaco confezionato per la vendita:
3 anni.
Soluzione ricostituita:
La stabilità chimica e fisica in corso d'uso è stata dimostrata fino a 48 ore a temperatura ambiente.
Da un punto di vista microbiologico, il farmaco deve essere utilizzato immediatamente. Se non
utilizzato immediatamente, le condizioni e il tempi di conservazione prima dell'utilizzo sono sotto la
responsabilità dell'utilizzatore e dovrebbero normalmente essere non più lunghi di 24 ore a
temperatura di 2°C - 8°C, a meno che la ricostituzione sia avvenuta in condizioni asettiche controllate
e validate.
6.4
Speciali precauzioni per la conservazione
Conservare a temperature comprese tra 2°C e 8°C.
6.5
Natura e contenuto della confezione
Flaconcini sterili, di vetro, da 9 ml, dotati di tappo sterile di gomma idoneo per la liofilizzazione e
chiusi ermeticamente con un ghiera in alluminio o coperchio flip-off.
Fiale di vetro da 5 ml.
4 flaconcini e 4 fiale per confezione.
9
6.6
Istruzioni per l'impiego e la manipolazione e per lo smaltimento
Si raccomanda l'uso dei guanti durante la preparazione e la somministrazione di BEROMUN. Se la
polvere secca o la soluzione ricostituita di BEROMUN dovesse venire a contatto con la pelle o le
mucose, lavare a fondo con acqua.
Il sovrariempimento rende necessario l'impiego di 5,3 ml di soluzione sterile di sodio cloruro allo
0,9% (che è fornita in fiale contenenti soluzione di cloruro di sodio allo 0,9% per iniezioni) per
consentire di prelevare 5 ml di soluzione alla concentrazione di 0,2 mg/ml di tasonermina. Agitando
leggermente si otterrà una soluzione omogenea.
Si consiglia di sottoporre sempre ad ispezione visiva il flaconcino dopo ricostituzione per accertarsi
che non sia presente particolato in sospensione prima della somministrazione. La soluzione può essere
incolore o tendere a un giallo pallido.
La formulazione non contiene conservanti ed è solamente per uso singolo. Una volta aperto il
flaconcino, normalmente il contenuto deve essere utilizzato immediatamente (vedere paragrafo 6.3). Il
prodotto non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità ai
requisiti di legge locali.
7.
TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO
Boehringer Ingelheim International GmbH
Binger Strasse 173
55216 Ingelheim am Rhein
Germania
8.
NUMERO DI ISCRIZIONE NEL REGISTRO COMUNITARIO DEI MEDICINALI
9.
DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL'AUTORIZZAZIONE
10.
DATA DI REVISIONE DEL TESTO
10
1)
Wieberdink J, Benckhuysen C, Braat RP, van Slooten EA, Olthius GAA. Dosimetry in isolation perfusion of the
limbs by assessments of perfused tissue volume and grading of toxic tissue reactions. Eur J Cancer Clin Oncol 1982;
18: 905-910.
2)
Hoekstra HJ, Naujocks T, Schraffordt Koops H, Beekhuis H, van Groningen a Stuling R, ter Veen H, et. al..
Continuous leakage monitoring during hyperthermic isolated regional perfusion of the lower limb: techniques and
results. Reg Cancer Treat 1992; 4: 301-304.
3)
Klaase JM, Kroon BBR, Van Geel AN, Eggermont AMM, Franklin HR. Systemic leakage during isolated limb
perfusion for melanoma. Br J Surg 1993; 80: 1124-1126.
4)
Sprenger HJ, Markwardt J, Schlag PM. Quantitative Leckkontrolle mit Radionukliden bei der isolierten
Extremitätenperfusion. Nuklearmedizin 1994; 33: 248-253.
11
ALLEGATO II
A.
TITOLARE DELL'AUTORIZZAZIONE ALLA
PRODUZIONE RESPONSABILE DEL RILASCIO DEI
LOTTI E PRODUTTORE DEL PRINCIPIO ATTIVO
BIOLOGICO
B.
CONDIZIONI DI FORNITURA E UTILIZZAZIONE
12
A.
TITOLARE DELL'AUTORIZZAZIONE ALLA PRODUZIONE RESPONSABILE DEL
RILASCIO DEI LOTTI E PRODUTTORE DEL PRINCIPIO ATTIVO BIOLOGICO
Nome e indirizzo del produttore del principio attivo biologico
Bender and Co. GesmbH, Dr. Boehringer Gasse 5-11, 1121 Vienna, Austria.
Autorizzazione alla produzione, o equivalente, rilasciata il 4 agosto 1995 dal Bundesministerium für
Gesundheit und Konsumentenschutz, Radetzkystrasse 2, 1031 Vienna, Austria.
Nome e indirizzo del produttore responsabile del rilascio dei lotti
Bender and Co. GesmbH, Dr. Boehringer Gasse 5-11, 1121 Vienna, Austria.
Autorizzazione alla produzione rilasciata il 4 agosto 1995 dal Bundesministerium für Gesundheit und
Konsumentenschutz, Radetzkystrasse 2, 1031 Vienna, Austria.
B.
CONDIZIONI DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO
•
CONDIZIONI O LIMITAZIONI DI FORNITURA E UTILIZZAZIONE IMPOSTE AL
TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
Medicinale soggetto a prescrizione medica limitativa (Vedere Allegato I: Riassunto delle
caratteristiche del prodotto, 4.2).
13
ALLEGATO III
ETICHETTATURA E FOGLIO ILLUSTRATIVO
14
A. ETICHETTATURA
15
INFORMAZIONI DA APPORRE SULL'IMBALLAGGIO ESTERNO O, IN SUA ASSENZA,
SUL CONDIZIONAMENTO PRIMARIO
1.
DENOMINAZIONE DEL MEDICINALE
BEROMUN 1 mg polvere e solvente per soluzione per infusione.
tasonermina
2.
INDICAZIONE DEL (DEI) PRINCIPIO(I) ATTIVO(I)
1 mg
BEROMUN è formulato per contenere 1,07 mg di tasonermina per flaconcino con un
sovrariempimento del 7%.
Ricostituendo con 5,3 ml di solvente, si ottengono 0,2 mg di tasonermina per ml.
Composizione: un flaconcino di polvere per soluzione contiene: tasonermina 1 mg.
Una fiala di solvente contiene: 5,4 ml di soluzione di cloruro di sodio allo 0,9% (ogni flaconcino di
BEROMUN deve essere ricostituito con 5,3 ml di solvente).
3.
ELENCO DEGLI ECCIPIENTI
Eccipienti: sodio diidrogeno fosfato diidrato, disodio idrogeno fosfato dodecaidrato, sodio cloruro e
albumina di siero umano.
4.
FORMA FARMACEUTICA E CONTENUTO
Polvere e solvente per soluzione per infusione (perfusione locoregionale dell'arto; ILP).
4 flaconcini di polvere per soluzione per infusione
4 fiale di solvente per uso parenterale
5.
MODO E, OVE NECESSARIO, VIA(E) DI SOMMINISTRAZIONE
Da somministrarsi in ILP (uso endoarterioso) dopo ricostituzione con 5,3 ml di solvente.
6
AVVERTENZA SPECIALE CHE PRESCRIVA DI TENERE IL MEDICINALE FUORI
DALLA PORTATA E DALLA VISTA DEI BAMBINI
Tenere fuori della portata e della vista dei bambini
7.
ALTRA(E) AVVERTENZA(E) SPECIALE(I), OVE NECESSARIO
8.
DATA DI SCADENZA
Scad.:
9.
PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE
16
Conservare a temperature comprese tra 2°C e 8°C (in frigorifero)
10.
OVE NECESSARIO, PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO DEL
MEDICINALE NON UTILIZZATO O DEI RIFIUTI DERIVATI DA TALE
MEDICINALE
Gettare il flaconcino e la soluzione non utilizzati nell'apposito contenitore.
11.
NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE
ALL’IMMISSIONE IN COMMERCIO
Boehringer Ingelheim International GmbH
Binger Strasse 173
55216 Ingelheim am Rhein
Germania
12.
NUMERO(I) DI ISCRIZIONE NEL REGISTRO COMUNITARIO DEI MEDICINALI
EU/0/00/000/000
13.
NUMERO DI LOTTO
Lotto :
Lotto solvente :
14.
CONDIZIONE GENERALE DI FORNITURA
Medicinale soggetto a prescrizione medica.
15.
ISTRUZIONI PER L’USO
Per singolo uso. Dopo la ricostituzione, il medicinale deve essere usato immediatamente
17
INFORMAZIONI MINIME DA APPORRE SUI CONDIZIONAMENTI PRIMARI DI
PICCOLE DIMENSIONI
ETICHETTA INTERNA DEL FLACONCINO DI BEROMUN
1.
DENOMINAZIONE DEL MEDICINALE E, SE NECESSARIO, DOSAGGIO E/O
VIA(E) DI SOMMINISTRAZIONE
BEROMUN
tasonermina
Polvere per infusione
2.
MODO DI SOMMINISTRAZIONE
(ILP)
3.
DATA DI SCADENZA
EXP
4.
NUMERO DI LOTTO
Batch
5.
CONTENUTO IN PESO, VOLUME O UNITÀ
1 mg
18
ETICHETTA INTERNA PER LA FIALA DI SOLVENTE
1.
DENOMINAZIONE DEL MEDICINALE E, SE NECESSARIO, DOSAGGIO E/O
VIA(E) DI SOMMINISTRAZIONE
Solvente per BEROMUN 1 mg
Solvente per uso parenterale
2.
MODO DI SOMMINISTRAZIONE
3.
DATA DI SCADENZA
EXP
4.
NUMERO DI LOTTO
Batch
5.
CONTENUTO IN PESO, VOLUME O UNITÀ
5,4 ml di soluzione sterile di cloruro di sodio allo 0,9%
19
B. FOGLIETTO ILLUSTRATIVO
20
FOGLIO ILLUSTRATIVO
Legga attentamente questo foglietto prima di iniziare a prendere il medicinale.
Conservi questo foglietto. Potrebbe aver bisogno di leggerlo di nuovo.
Se ha dei dubbi, si rivolga al suo medico o al suo farmacista.
Contenuto di questo foglio:
1.
Che cos'è BEROMUN e a che cosa serve
2.
Informazioni prima di prendere BEROMUN
3.
Come viene somministrato BEROMUN?
4.
Possibili effetti collaterali
5.
Come conservare BEROMUN
[denominazione del medicinale]
BEROMUN polvere 1 mg e solvente per soluzione per infusione.
Tasonermina
[Indicazione completa del(i) principio(i) attivo(i) e degli eccipienti]
- Il principio attivo è tasonermina (Fattore alfa-1a di necrosi tumorale; TNFα-1a)
- Gli eccipienti sono sodio diidrogeno fosfato diidrato, disodio idrogeno fosfato dodecaidrato,
cloruro di sodio, albumina di siero umano
[Nome e indirizzo del titolare dell'autorizzazione all'immissione in commercio e del titolare
dell’autorizzazione alla produzione responsabile del rilascio dei lotti, se diversi]
BEROMUN è commercializzato da:
Boehringer Ingelheim International GmbH
Binger Strasse 173
55216 Ingelheim am Rhein
Germania
BEROMUN è prodotto da:
Bender & Co. GmbH
Dr. Boehringer Gasse 5-11
1121 Vienna
Austria
1.
CHE COS'È BEROMUN E A CHE COSA SERVE
[Forma farmaceutica e contenuto, categoria farmacoterapeutica]
La tasonermina appartiene ad una classe di sostanze note per la loro azione immunostimolante e si è
dimostrata attiva come antitumorale. BEROMUN è fornito in astucci contenenti 4 flaconcini di vetro,
ogni flaconcino contiene 1 mg (3,0-6,0 x 107 UI) del principio attivo tasonermina, sodio diidrogeno
fosfato diidrato, disodio idrogeno fosfato dodecaidrato, cloruro di sodio e albumina di siero umano,
insieme a 4 fiale di vetro contenenti soluzione sterile di cloruro di sodio (fisiologica salina) per
disciogliere i contenuti dei flaconcini in vetro.
Indicazioni terapeutiche]
BEROMUN viene prescritto e viene somministrato dal medico in associazione con il farmaco
antitumorale melfalan per la cura di sarcomi inoperabili dei tessuti molli della gamba e del braccio. Il
trattamento con BEROMUN e melfalan è indicato per diminuire le dimensioni del tumore, che è stato
giudicato non operabile oppure operabile ma con grave invalidità. Riducendo la dimensione del
tumore sarà più facile operare e asportare il tumore, evitando gravi danni ai tessuti sani, ai nervi ed ai
vasi sanguigni vicini, e ritarderà o se possibile eviterà, l'amputazione del braccio o della gamba.
21
2.
INFORMAZIONI PRIMA DI PRENDERE BEROMUN
[Elenco delle informazioni necessarie prima dell'assunzione del medicinale]
[Controindicazioni]
Quando non si deve usare BEROMUN?
BEROMUN non deve essere prescritto e somministrato dal medico:
- in caso di ipersensibilità (allergia) alla tasonermina o ad uno degli eccipienti di BEROMUN
- se lei soffre di scompenso cardiaco, grave angina pectoris, aritmie cardiache, o se ha subito un
infarto miocardico nei 3 mesi precedenti il trattamento con BEROMUN. Se soffre di altre malattie
circolatorie, il medico potrebbe non prescrivere BEROMUN;
- se lei soffre di gravi malattie polmonari;
- se lei ha o ha avuto recentemente un'ulcera peptica;
- se nel suo caso la conta dei globuli rossi o di quelli bianchi o degli altri componenti del sangue è
troppo bassa;
- se lei soffre di gravi malattie epatiche o renali;
- se lei non può assumere farmaci vasopressori (medicinali che vengono usati per aumentare una
bassa pressione sanguigna);
- se lei non può assumere farmaci anticoagulanti (medicinali utilizzati per prevenire la coagulazione
del sangue);
- se lei non può assumere tracciante radioattivo (medicinali radiomarcati utilizzati per analizzare la
perdita del farmaco nel circolo sistemico; vedere "Informazioni importanti di BEROMUN" di
seguito);
- se lei è sottoposto contemporaneamente a trattamento con medicinali cardiotossici (es.
antracicline);
- se lei ha alti livelli di calcio nel sangue;
- se lei ha infezioni che non rispondono alla terapia antibiotica;
- se lei la gamba o il braccio malato sono gonfi a causa di un edema locale;
- se lei ha un grave edema a livello addominale;
- se lei è affetto da ampie o gravi ferite, ulcere o piaghe sul braccio o sulla gamba coinvolte;
se è in stato interessante o se è stata pianificata una gravidanza. Non deve allattare al seno per
almeno 7 giorni dopo il trattamento con BEROMUN.
[Opportune precauzioni di impiego; avvertenze speciali]
Informazioni importanti di BEROMUN:
BEROMUN sarà somministrato utilizzando la tecnica della perfusione locoregionale dell'arto che
assicura che BEROMUN rimanga nell'arto ammalato e non raggiunga le altri parti del corpo. Se
BEROMUN raggiunge il corpo, si parla di perdita sistemica. E' importante capire che tale perdita
sistemica può essere pericolosa, poichè BEROMUN può avere degli effetti collaterali sui principali
organi del corpo.
Quindi BEROMUN verrà somministrato da un medico esperto nella tecnica della perfusione
locoregionale dell'arto. Il medico avrà a sua disposizione tutte le apparecchiature ed i dispositivi
necessari per garantire che BEROMUN, una volta somministrato, rimanga nell'arto malato e non
raggiunga invece la restante parte del corpo. Il medico avrà comunque a sua disposizione tutti gli
apparecchi e dispositivi necessari a curarla nel caso BEROMUN raggiunga involontariamente la
restante parte del corpo.
Durante la perfusione locoregionale dell'arto e anche dopo, per qualche tempo, verranno attentamente
controllate la pressione sanguigna e i parametri circolatori. Poichè la somministrazione di
BEROMUN richiede una procedura di tipo chirurgico che viene effettuata in anestesia generale ed è
associata a degli effetti collaterali (vedere il paragrafo "POSSIBILI EFFETTI COLLATERALI"),
potrebbe essere necessario portarla per un breve periodo di tempo in una unità di terapia intensiva
subito dopo la perfusione locoregionale dell'arto.
22
Inoltre, a causa della natura della tecnica di perfusione locoregionale dell'arto, in ogni caso le sarà
richiesto di rimanere in ospedale per circa 7-10 giorni dopo la somministrazione di BEROMUN; in
questo periodo verrà attentamente controllato per accertare la comparsa di eventuali effetti collaterali
di BEROMUN.
[Uso in gravidanza e allattamento]
Gravidanza
Se lei è incinta deve informare il suo medico che, allora, non le prescriverà BEROMUN.
Allattamento
Se lei sta allattando, non deve allattare il bambino per almeno 7 giorni dopo essere stata sottoposta al
trattamento con BEROMUN.
Informazioni importanti su alcuni eccipienti di BEROMUN:
Se lei ha avuto una reazione allergica all'albumina di siero umano deve informare il suo medico che
allora non le prescriverà BEROMUN.
[Interazioni con altri medicinali]
Assunzione di altri medicinali:
Informi il suo medico o il suo farmacista se sta assumendo altri medicinali, anche non prescritti.
BEROMUN sarà somministrato usando la tecnica della perfusione locoregionale dell'arto che richiede
la somministrazione anche di molti altri farmaci da parte del suo medico. Questi farmaci
comprendono l'agente antitumorale melfalan, anestetici, antidolorifici, antipiretici, agenti vasopressosi
ed anticoagulanti, al fine di consentire il corretto funzionamento della tecnica di perfusione. Il suo
medico conosce i medicinali che sono necessari ed è responsabile della loro somministrazione.
3. COME VIENE SOMMINISTRATO BEROMUN?
[Istruzioni per una corretta utilizzazione]
Al momento dell' uso il medico scioglie BEROMUN nella soluzione di cloruro di sodio (salina)
appositamente fornita e la soluzione così ottenuta viene iniettata nell'arteria della gamba o del braccio
malato utilizzando la tecnica della perfusione locoregionale dell'arto in associazione al farmaco
antitumorale melfalan. Tutto ciò si verificherà durante l'anestesia mentre il paziente non è cosciente.
[Posologia - Durata del trattamento]
BEROMUN le verrà somministrato dal medico con la tecnica di perfusione locoregionale dell'arto.
Prima viene somministrata una dose di 3 mg (se l'arto malato è il braccio) o di 4 mg (se l'arto malato è
la gamba) di BEROMUN per perfusione locoregionale dell'arto per un periodo di tempo di 30 minuti.
Poi si aggiunge al circuito di perfusione locoregionale dell'arto una dose di melfalan non superiore ai
150 mg, e la procedura di perfusione locoregionale continua per altri 60 minuti. In questo modo l' arto
malato viene esposto all'azione di BEROMUN per un totale di 90 minuti.
[Modo e/o via(e) di somministrazione - Durata del trattamento]
BEROMUN insieme con melfalan viene somministrato nell'arto malato con un catetere nella arteria
principale, mentre il sangue viene portato via con un altro catetere dalla vena principale. Il sangue
viene rifornito di ossigeno con una macchina cuore-polmone e poi pompato ancora nell'arto malato. In
questo modo tutte le cellule tumorali dell'arto possono essere esposte ad una dose molto alta dei
medicinali per un'ora e mezza, dando il migliore effetto antitumorale possibile. Per bloccare il sangue
che contiene una dose molto alta di BEROMUN e melfalan ed impedire che fluisca nel resto del
corpo, il flusso di sangue all'arto e dall'arto malato viene interrotto usando un tourniquet durante
l'operazione.
23
Alla fine della procedura di perfusione locoregionale, l'arto viene lavato con un opportuno liquido per
rimuovere completamente BEROMUN e melfalan dall'arto stesso. Questo assicura ulteriormente che,
solo tracce di farmaco possano eventualmente raggiungere la circolazione sistemica.
[Frequenza della somministrazione]
Di solito non riceverà una seconda perfusione con BEROMUN, e nel caso dovesse essere ripetersi
allora non sarà prima che siano trascorse almeno 6 settimane dalla prima perfusione.
[Sintomi e modalità d'intervento in caso di dose eccessiva]
Cosa accadrà se lei riceve un sovradosaggio o soffre di passaggio sistemico?
Poiché BEROMUN viene sempre somministrato in ospedale da chirurghi specializzati, è molto
difficile che possa verificarsi un sovradosaggio accidentale. Comunque, in questo caso, il medico
laverà immediatamente l'arto malato per rimuovere BEROMUN usando una soluzione appropriata e
la procedura di perfusione verrà interrotta.
Durante la procedura di perfusione locoregionale, il medico osserverà e controllerà attentamente la
quantità di BEROMUN che raggiunge la restante parte del corpo. Se più del 10% di BEROMUN
raggiunge la restante parte del corpo (questo è noto come passaggio sistemico o leakage) il medico
interviene in modo simile a quanto previsto per il sovradosaggio.
Nel caso improbabile in cui il medico supponga che lei abbia sofferto o possa soffrire per effetti
collaterali pericolosi dovuti o al sovradosaggio o al passaggio sistemico, verrà trasferito
immediatamente all'unità di terapia intensiva dell'ospedale dove il medico può monitorare più
accuratamente i parametri e prescrivere l'opportuno trattamento ritenuto necessario a curare eventuali
effetti collaterali pericolosi riscontrati.
4.
POSSIBILI EFFETTI COLLATERALI
[Descrizione degli effetti collaterali]
E' necessario sapere che la somministrazione di BEROMUN con melfalan per perfusione
locoregionale dell'arto provocherà effetti collaterali. Alcuni effetti collaterali sono causati da
BEROMUN, altri da melfalan, altri dalla tecnica di perfusione. Alcuni sono causati dalla
combinazione di queste tre cose. In casi rari, alcuni di questi effetti collaterali potrebbero essere gravi,
in particolare se BEROMUN raggiunge la restante parte del corpo (passaggio sistemica; vedere dopo).
Il medico discuterà tutte queste possibilità, spiegando i rischi ed i benefici del trattamento con
BEROMUN.
Immediatamente dopo la somministrazione di BEROMUN e melfalan, al risveglio dall'anestesia al
termine della perfusione locoregionale, si potrebbero verificare i seguenti effetti a livello della gamba
o del braccio:
-
dolore e gonfiore, o infezioni, al braccio o alla gamba coinvolta;
danno ai nervi del braccio o della gamba coinvolta;
vesciche sulla pelle, qualche volta in seguito a una ferita locale infetta;
trombi rossi nell' arteria o vena del braccio o gamba coinvolta;
edema nel braccio o gamba coinvolta;
perdita delle unghie nell'arto coinvolto.
Nel 2% circa dei casi, BEROMUN può causare danni cosi' gravi ai tessuti dell'arto malato da
richiedere l'amputazione.
Subito dopo la somministrazione di BEROMUN, al risveglio dall'anestesia dopo la perfusione
locoregionale si potrebbero verificare i seguenti effetti sistemici, dovuti a un passaggio di lieve entità
di BEROMUN nella restante parte dell'organismo (passaggio sistemica o leakage):
-
febbre;
disturbi del ritmo e delle funzioni del cuore e pressione bassa (shock);
nausea, perdita di appetito ed eventualmente vomito;
brividi, mal di testa e altri sintomi di tipo influenzale;
24
-
temporanee alterazioni della funzionalità renale come presenza di proteine nell'urina;
stanchezza e affaticamento;
temporanee alterazioni della funzionalità epatica;
aumento della probabilità di contrarre infezioni batteriche;
difficoltà respiratorie;
costipazione o eventualmente diarrea;
diminuzione dei livelli di alcuni componenti del sangue;
danni neurologici.
Inoltre, è importante rendersi conto che il trattamento con BEROMUN e melfalan può portare ad un
aggravarsi degli effetti collaterali sistemici elencati sopra. Ciò è più probabile nel caso si verificasse
un più alto grado di passaggio sistemico di BEROMUN e melfalan (superiore al 10% della dose
somministrata).
Nel caso il medico ritenga che lei soffra o possa soffrire per uno degli effetti collaterali gravi sopra
descritti, verrà trasferito immediatamente all'unità di terapia intensiva dell'ospedale dove il medico
può monitorare più accuratamente i parametri e prescrivere l'opportuno trattamento ritenuto
necessario a curare eventuali effetti collaterali pericolosi riscontrati.
Se accusa in modo grave uno degli effetti collaterali sopra menzionati, e che non sia stato notato dal
medico, lo informi immediatamente.
Se nota la comparsa di qualche effetto collaterale non menzionato in questo foglio, ne informi il
medico o il farmacista.
5.
COME CONSERVARE BEROMUN
[Condizioni di conservazione e data di scadenza]
BEROMUN va conservato ad una temperatura compresa tra i 2°C e gli 8°C (in firgorifero) senza
aprire il flaconcino nè ricostituire la soluzione. In queste condizioni, il periodo di validità del farmaco
è di 3 anni.
E' stato raccomandato al medico di usare BEROMUN appena possibile dopo la ricostituzione con la
soluzione di cloruro di sodio fornita (soluzione salina).
Il medico guarderà la data di scadenza del farmaco riportata sulla confezione. BEROMUN non deve
essere usato dopo questa data. BEROMUN è solamente per uso singolo e la soluzione non utilizzata
sarà attentamente smaltita dal suo medico.
Questo foglio è stato approvato l'ultima volta il {data}
25
Altre informazioni
Per ulteriori informazioni sul prodotto, si prega di contattare il rappresentate locale del
titolare dell'autorizzazione all’immissione in commercio.
België /Belgique/Belgien
n.v. Boehringer Ingelheim s.a.
Avenue Ariane, Arianelaan 16
B-1200 Bruxelles/Brussel/Brüssel
Tél:. +32 2 773 33 11
Luxembourg/Luxemburg
n.v. Boehringer Ingelheim s.a.
Avenue Ariane, Arianelaan 16
B - 1200 Bruxelles/Brussel/Brüssel
Tél: +32 2 773 33 11
Danmark
Boehringer Ingelheim Danmark A/S
Strødamvej 52
DK-2100 København Ø
Tlf: +45 39 15 88 88
Nederland
Boehringer Ingelheim b.v.
Berenkoog 28
NL-1822 BJ Alkmaar
Tel: +31 72 5 66 24 24
Deutschland
Boehringer Ingelheim Pharma KG
Binger Straße 173
D-55216 Ingelheim
Tel: +49 6132 77-0
Österreich
Bender & Co Ges mbH
Dr. Boehringer-Gasse 5-11
A-1121 Wien
Tel: +43 1 80 105-0
Eλλάδα
Boehringer Ingelheim Ellas A.E.
Eλληνικού 2
GR – 167 77 Eλληνικό -Aθήνα
Tηλ: +30 1 89 06 300
Portugal
Boehringer Ingelheim Lda.
Av. António A. de Aguiar 104 - 1.°
P-1063 Lisboa Codex
Tel: +351 1 313 53 00
España
Boehringer Ingelheim S.A.
Pablo Alcover, 33
E-08017 - Barcelona
Tel: +34 93 404-51-00
Suomi/Finland
Panfarma Oy/Boehringer Ingelheim
Harmaaparrankuja 1
FIN-02200 Espoo / Esbo
Puh/Tfn: +358 9 429 98
France
Boehringer Ingelheim France S.A.R.L.
37-39, Rue Boissière
F-75116 Paris
Tél: +33 1 44 34 65 65
Sverige
Boehringer Ingelheim AB
Box 44
S-127 21 Skärholmen
Tfn: +46 8 721 21 00
Ireland
Boehringer Ingelheim Ltd.
31 Sandyford Office Park
Blackthorn Road
Sandyford
IRL-Dublin 18
Tel: +353 1 295 9620
United Kingdom
Boehringer Ingelheim Ltd.,
Ellesfield Avenue,
Bracknell, Berkshire,
RG12 8YS-UK
Tel: +44 1344 424 600
Italia
Boehringer Ingelheim Italia S.p.A.
Via Lorenzini, 8
I-20 139 Milano
Tel: +39 02 535 51
26