TEMA GRUPPO B
Concetti fondamentali
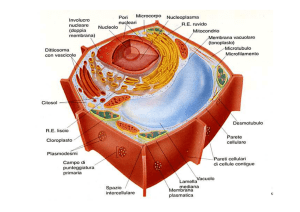
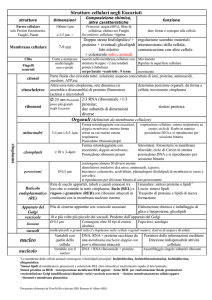
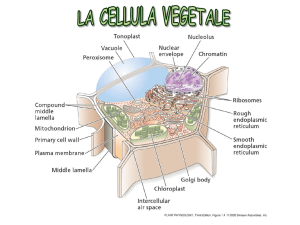
Struttura e ruolo dei FOSFOLIPIDI DELLE MEMBRANE [DI TUTTE LE MEMBRANE, non
solo la membrana plasmatica].
Sono i principali componenti delle membrane cellulari in quanto possono formare doppi
stratii che separano ambienti acquosi con composizione diversa.
Sono composti anfipatici (anfifilici) che contengono componenti idrofiliche e componenti
idrofobiche.
La maggior parte è derivata dal glicerolo e contiene due acidi grassi di lunghezza e
grado di insaturazione variabile legati (esterificati) a due dei tre gruppi –OH del
glicerolo. Il terzo gruppo –OH del glicerolo è legato ad un gruppo fosfato che a sua
volta è legato a piccole molecole polari (es. colina, serina, etanolamina, inositolo).
Le cosidette “code” che costituiscono la componente apolare è data dalle catene di
acidi grassi che si stabilizzano tra di loro mediante legami di van der Waals e interazioni
idrofobiche. Di solito uno degli acidi grassi è saturo e quindi forma una catena lineare.
L’altro acido grasso ha uno o più insaturazioni che provocano un ripiegamento della
catena. Quanto maggiore è il numero di legami insaturi tanto più difficile è, a
temperatura ambiente, compattare le code in strutture ordinate e quindi predomina uno
stato semi-liquido, ossia fluido.
Nel doppio foglietto le code sono rivolte verso l’interno. Possono interagire e
stabilizzare, sempre mediante legami di van der Waals e interazioni idrofobiche, i
domini transmembrana delle proteine di membrana [Volendo si può ricordare che i
domini di aminoacidi rivolti verso le code dei fosfolipidi sono anche essi apolari].
La fluidità, che dipende anche dallla lunghezza della catena, dalla concentrazione di
altro tipo di lipide, il colesterolo, e dalla temperatura, è fondamentale per permettere la
flessibilità della membrana, e i movimenti delle proteine transmembrana (cambiamenti
conformazionali nei processi di trasporto o di recezione di segnali; migrazione laterale).
Le “teste polari” (fosfato + gruppi polari) mediano le interazioni dei fosfolipidi delle
membrane con l’ambiente esterno e interno.
Nelle membrane i fosfolipidi sono distribuiti in modo asimmetrico: alcuni dei lipidi come
la fosfatidilcolina sono più concentrati nell’ambiente rivolti verso l’esterno della cellula
(caso della membrana plasmatica) mentre altri quali la fosfatidilserina, che ha una
carica netta negativa, sono rivolti verso il citosol. Questa assimmetrica contribuisce a
creare una distribuzione di cariche elettriche diverse a ridosso della membrana e quindi
a creare un potenziale elettrico [ricordatevi che i lipidi sono impermeabile agli ioni che,
si devono attraversare la emembrana devono farlo tramite canali ionici] . Le cariche
negative della serina possono inoltre stabilizzare (mediante legami ionici) residui carichi
positivamente di aminoacidi delle proteine integrali o periferiche.
Un altro caso di fosfolipidi della membrana plasmatica è la sfingomielina, l’unico lipidi
derivato della sfingosina non legato a catene oligosaccaridiche bensì alla fosforilcolina
(stessa testa della fosfatidilcolina derivata dal glicerolo).
• Funzione e tipi di RIBOSOMI.
Sono macchine molecolari di grandi dimensioni e complessità, specializzate per la
traduzione (processo di conversione del messaggio convogliato dal RNA messaggero
(mRNA) in termini di triplette di nucleotidi in una sequenza di aminoacidi di una
proteina).
Negli eucarioti sono composti da quattro tipi di RNA ribosomiale ( tre rRNA nei
procarioti) e da decine di proteine.
1
Gli rRNA svolgono ruoli non solo strettamente strutturali [volendo si può ricordare che
hanno forme complesse basate su diversi appaiamenti mediante legami di idrogeno di
basi (A-U; G-C) all’interno della stessa catena nucleotidica] ma anche catalitici ribozimi
in quanto catalizzano la formazione del legame peptidico fra due aminoacidi.
I ribosomi formano due subunità di composizione e diversa che si riuniscono soltanto
quando un mRNA deve essere tradotto.
La subunità piccola legga il mRNA e lo orienta in modo a che la sua sequenza di
nucleotidi possa essere “letta” dai vari tRNA.
.Nella subunità grande, che si collegherà alla piccola dopo il legame di questa con il
mRNA, sono presenti anfratti e canali che permettono l’ingresso dei vari tRNA carichi
degli aminoacidi specifici, il posizionamento del tRNA che trasporterà la catena
peptidica in crescita, e la loro uscita dal ribosoma una volta completata la sintesi
proteica, nonchè per il rilascio del peptide formato.
Il messaggio del mRNA verrà letto dal ribosoma in senso 5’-3’.
Il primo tRNA a fermarsi avrà un anticodone complementare al codone di inizio (AUG) e
trasporta l’aminoacido metionina (entra nel sito P). Il secondo tRNA entra nel sito
adiacente (sito A), e si ferma se avrà un anticodone complementare al secondo codone
del mRNA.Il ribosoma catalizza la formazione di un legame peptidico tra i due
aminoacidi che rimarrano legati al secondo tRNA che si sposta nella posizione P
mentre il primo scarico escee il ribosoma si sposta in avanti. Un terzo tRNA entra a sua
volta nella posizione A, collega il suo aminoacido alla catena precedente, si sposta in P,
mentre il secondo tRNA esce. La situazione si ripete finchè non compare un codone di
stop per il quale non c’è un tRNA equivalente. Invece si lega una proteina, detta fattore
di rilascio che provoca la separazione dei polipeptide completo dal tRNA (che esce dal
sito E). Il peptide viene rilasciato..
Lo stesso mRNA può essere letto in sequenza da diversi ribosomi (poliribosoma).
I ribosomi possono funzionare liberi nel citosol, se all’inzio della traduzione non
compare la sequenza segnale che indirizza il ribosoma al reticolo endoplasmatico
(ribosomi legati)
Le proteine tradotte nei ribosomi liberi sono le proteine solubili nel citosol, le proteine
del citoscheletro, le proteine nucleari, le proteine dei mitocondri, perossisomi o
cloroplasti, o le proteine periferiche di membrana.
Il segnale che indirizza i ribosomi al RE è presente in tutte le proteine di secrezione, dei
lisosomi, della membrana plasmatica, oppure che funzioneranno nel reticolo stesso o
nel Golgi.
• Ruoli svolti dall’APPARATO DI GOLGI
Prosegue l’elaborazione di proteine sintetizzate su ribosomi legati al RER..
Comprende diverse strutture simili a cisterne appiattite rivestite da una singola membrana. Il
numero di cisterne è variabile. Le cisterne più vicine al reticolo endoplasmatico sono chiamate
“cisterne cis”, quelle rivolte vero la membrana plasmatica “cisterne trans” e quelle in mezzo
cisterne mediane. Oltre alle cisterne vi è una miriade di vescicole di trasporto.
Fra il RE e il Golgi vi è una struttura intermedia ramificata “ERGIC” a cui approdano vescicole
contenenenti proteine di membrana o solubili derivate dal RE. Le vescicole si fondono con la
membrana della rete cis del Golgi: le proteine inserite nella membrana delle vescicole sono
inserite nella membrana della rete cis mentre le proteine in soluzione nel lume della vescicola
sono rilasciate nel lume della rete cis. Se queste proteine contengono sequenze di aminoacidi
2
specifiche per il reticolo (ad es KDEL) sono riconosciute da recettori specifici che le raccolgono e
le inseriscono in nuove vescole che sono rispedite in dietro al RE. Le altre vanno avanti e
saranno elaborate progressivamente nelle varie cisterne del Golgi.
Le glicoproteine che hanno subito la fase iniziale di N-glicosilazione nel RER subiranno nel Golgi
processamenti vari mediati da enzimi che aggiungono (glicosil trasferasi) o rimuovono
(glicosidasi) determinati zuccheri fino a raggiongere le complesse composizioni ramificate
tipiche delle glicoproteine della membrana plasmatica o delle proteine di secrezione.
Le glicoproteine O-glicosilate riceveranno progressivamente i vari zuccheri già nel Golgi.
Anche le proteine assiali dei proteoglicani ricevono le catene lineari di zuccheri
(glicosaminoglicani) nel Golgi
Le proteine destinate ai lisosomi riceveranno un gruppo mannosio-6-fosfato che funziona come
segnale specifico di enzima lisosomiale.
Oltre alla fosforilazione del mannosio ci possono essere diverse altre modificazioni chimiche
degli zuccheri o degli aminoacidi.
I lipidi derivati dalla sfingosina, molti dei quali saranno glicosilati (glicolipidi) sono sintetizzati
nelle cisterne del Golgi.
Oltre le cisterne trans vi è una struttura ramificata da dove verranno smistate e indirizzate, in
modo altamente specifico basato su recettori specifici, le proteine destinate alla membrana
plasmatica, quelle destinate alla secrezione, e quelle destinate ai lisosomi.
Non esiste accordo fra le scienziati sulla modalità di trasporto delle sostanze elaborate (modelli
della maturazione delle vescicole o della maturazione delle cisterne.
Una delle teorie (maturazione delle vescicole) presume che le cisterne siano statiche e
contengano una dotazione specifica di enzimi e che le sostanze progressivamente elaborate
vengano spedite tramite vescicole alla cisterna successiva. L’altra teoria presume che le
cisterne si spostino in avanti con il loro contenuto progressivamente modificato e che gli enzimi
che non servono più siano rispediti in dietro alla vescicole precedenti.
Il traffico di vescicole richiede la collaborazione di diverse proteine transmembrana (recettori
vari), proteine di rivestimento nel citoplasma che provocano l’incurvamento delle emembrana
contenente recettori occupati, e la fusione dei due lembi di membrana per chiudere la
vescicola e proteine di collegamento alla cisterna successiva. Il processo di rivestimento
esterno delle vescicole è alatemente dinamico e GTP-dipendente. [N.B. Le vescicole si
muovono lungo rotaie fatte da microtubuli --- da ricordare se la domanda venisse fatta
nell’esame finale].
3