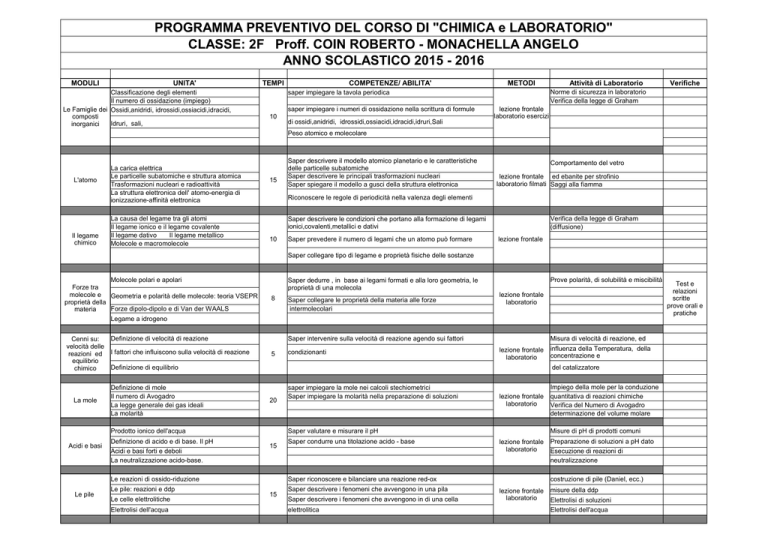
PROGRAMMA PREVENTIVO DEL CORSO DI "CHIMICA e LABORATORIO"
CLASSE: 2F Proff. COIN ROBERTO - MONACHELLA ANGELO
ANNO SCOLASTICO 2015 - 2016
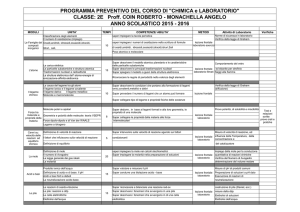
MODULI
UNITA'
Classificazione degli elementi
Il numero di ossidazione (impiego)
Le Famiglie dei Ossidi,anidridi, idrossidi,ossiacidi,idracidi,
composti
Idruri, sali,
inorganici
TEMPI
COMPETENZE/ ABILITA'
METODI
saper impiegare i numeri di ossidazione nella scrittura di formule
10
di ossidi,anidridi, idrossidi,ossiacidi,idracidi,idruri,Sali
Attività di Laboratorio
Verifiche
Norme di sicurezza in laboratorio
Verifica della legge di Graham
saper impiegare la tavola periodica
lezione frontale
laboratorio esercizi
Peso atomico e molecolare
L'atomo
Il legame
chimico
La carica elettrica
Le particelle subatomiche e struttura atomica
Trasformazioni nucleari e radioattività
La struttura elettronica dell' atomo-energia di
ionizzazione-affinità elettronica
La causa del legame tra gli atomi
Il legame ionico e il legame covalente
Il legame dativo
Il legame metallico
Molecole e macromolecole
15
Saper descrivere il modello atomico planetario e le caratteristiche
delle particelle subatomiche
Saper descrivere le principali trasformazioni nucleari
Saper spiegare il modello a gusci della struttura elettronica
Comportamento del vetro
lezione frontale ed ebanite per strofinio
laboratorio filmati Saggi alla fiamma
Riconoscere le regole di periodicità nella valenza degli elementi
Verifica della legge di Graham
(diffusione)
Saper descrivere le condizioni che portano alla formazione di legami
ionici,covalenti,metallici e dativi
10
Saper prevedere il numero di legami che un atomo può formare
lezione frontale
Saper collegare tipo di legame e proprietà fisiche delle sostanze
Molecole polari e apolari
Forze tra
molecole e Geometria e polarità delle molecole: teoria VSEPR
proprietà della
Forze dipolo-dipolo e di Van der WAALS
materia
Legame a idrogeno
Definizione di velocità di reazione
Cenni su:
velocità delle
reazioni ed I fattori che influiscono sulla velocità di reazione
equilibrio
Definizione di equilibrio
chimico
La mole
Acidi e basi
Le pile
Definizione di mole
Il numero di Avogadro
La legge generale dei gas ideali
La molarità
Saper dedurre , in base ai legami formati e alla loro geometria, le
proprietà di una molecola
8
Saper collegare le proprietà della materia alle forze
intermolecolari
Saper intervenire sulla velocità di reazione agendo sui fattori
5
condizionanti
20
saper impiegare la mole nei calcoli stechiometrici
Saper impiegare la molarità nella preparazione di soluzioni
Saper valutare e misurare il pH
Definizione di acido e di base. Il pH
Acidi e basi forti e deboli
La neutralizzazione acido-base.
Saper condurre una titolazione acido - base
15
Le reazioni di ossido-riduzione
Saper riconoscere e bilanciare una reazione red-ox
Le pile: reazioni e ddp
Saper descrivere i fenomeni che avvengono in una pila
Elettrolisi dell'acqua
lezione frontale
laboratorio
Misura di velocità di reazione, ed
lezione frontale influenza della Temperatura, della
concentrazione e
laboratorio
del catalizzatore
Prodotto ionico dell'acqua
Le celle elettrolitiche
Prove polarità, di solubilità e miscibilità
15
Saper descrivere i fenomeni che avvengono in di una cella
elettrolitica
Impiego della mole per la conduzione
lezione frontale quantitativa di reazioni chimiche
laboratorio
Verifica del Numero di Avogadro
determinazione del volume molare
Misure di pH di prodotti comuni
lezione frontale Preparazione di soluzioni a pH dato
laboratorio
Esecuzione di reazioni di
neutralizzazione
costruzione di pile (Daniel, ecc.)
lezione frontale misure della ddp
laboratorio
Elettrolisi di soluzioni
Elettrolisi dell'acqua
Test e
relazioni
scritte
prove orali e
pratiche