Esercizi di Nomenclatura Chimica
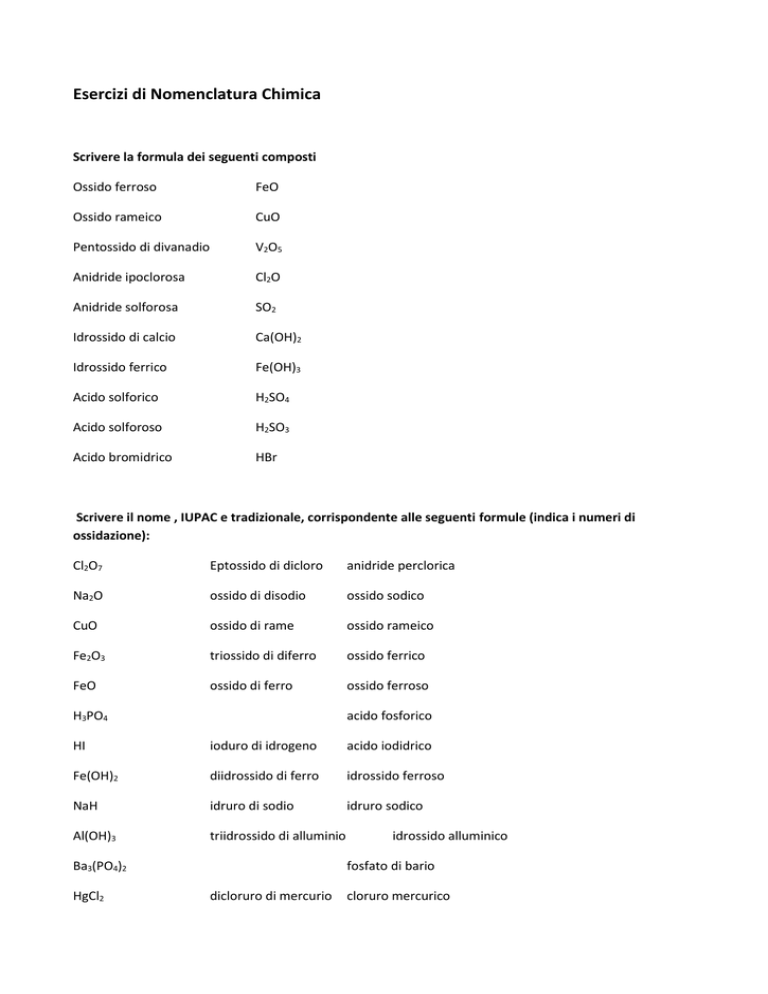
Scrivere la formula dei seguenti composti
Ossido ferroso
FeO
Ossido rameico
CuO
Pentossido di divanadio
V2O5
Anidride ipoclorosa
Cl2O
Anidride solforosa
SO2
Idrossido di calcio
Ca(OH)2
Idrossido ferrico
Fe(OH)3
Acido solforico
H2SO4
Acido solforoso
H2SO3
Acido bromidrico
HBr
Scrivere il nome , IUPAC e tradizionale, corrispondente alle seguenti formule (indica i numeri di
ossidazione):
Cl2O7
Eptossido di dicloro
anidride perclorica
Na2O
ossido di disodio
ossido sodico
CuO
ossido di rame
ossido rameico
Fe2O3
triossido di diferro
ossido ferrico
FeO
ossido di ferro
ossido ferroso
H3PO4
acido fosforico
HI
ioduro di idrogeno
acido iodidrico
Fe(OH)2
diidrossido di ferro
idrossido ferroso
NaH
idruro di sodio
idruro sodico
Al(OH)3
triidrossido di alluminio
Ba3(PO4)2
HgCl2
idrossido alluminico
fosfato di bario
dicloruro di mercurio
cloruro mercurico
Esercizi sulla mole
1) Calcolare quante moli sono contenute in 30.0 g di acqua. [1,66 mol]
(moli = grammi / massa molare)
M (H2O)= 2 + 16 = 18 g/mol
n = m/M= 30/18= 1.66 mol
2) Calcolare quanto pesano 2.30 moli di sodio. [52,9 g]
(grammi = numero di moli x massa molare)
M (Na)= 23 g/mol
m= Mxn = 23 x 2.30 = 52,9 g
3) Calcolare quanti atomi di piombo sono contenuti in 2.70 g del metallo. [7.84 x 1021 atomi]
( 1 mole contiene 6.02 x 1023 particelle)
M Pb = 207,2 g/mol
N= 2.70/ 207,2= 0.013 mol
Atomi= 0.013 x 6.02 x 1023 = 7.84 x 1021 atomi
4)Con riferimento alla seguente reazione (da bilanciare):
Mg + 2 HCl → H2 + MgCl2
calcolare i grammi di H2 che si ottengono facendo reagire completamente 20 g di magnesio.
[1,65 g]
M (H2) = 2 g/mol
M(Mg) = 24,3 g/mol
n= 20/24,3= 0,823 mol
1 : 1= 0,832 X
N (H2)= 0.832 mol
M = 0.0832 x 2 = 1.65 g
5)Il carbonato di potassio reagisce con il cloruro di alluminio secondo la reazione (da bilanciare):
3 K2CO3 + 2 AlCl3 →6 KCl + Al2(CO3)3
Determinare i g di KCl che si ottengono per reazione di 14 g di carbonato di potassio [15,1 g]
M (K2CO3)= 39,1 x2+12+16x3= 138 g/mol
n = 14/138 = 0.101 mol
3 : 6 = 0.101 = X
n(KCl) = 0.101x 6/3= 0.20 mol
M (KCl) = 39,1 + 35,45 = 74.55 g/mol
m (KCl) = 0.202 x 74.55 = 15,1 g












