IL LEGAME METALLICO
1
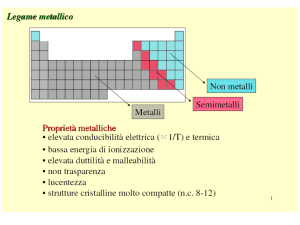
Non metalli
Metalli
Metalloidi
Proprietà dei metalli
Elevata conducibilità elettrica;
Elevata conducibilità termica;
Effetto fotoelettrico;
Elevata duttilità e malleabilità;
Lucentezza;
Elettropositività;
Strutture cristalline molto compatte (n.c. 8-12)
2
Proprietà dei metalli
Conducibilità elettrica: è dovuta alla presenza di e- liberi di muoversi sotto la
sollecitazione di un campo elettrico. All’aumentare di T, la conducibilità elettrica
diminuisce perché il moto degli e- viene ostacolato dal progressivo aumento di
oscillazioni degli atomi.
Effetto fotoelettrico: facilità di estrazione di e- per irraggiamento con luce
apropriata.
Effetto termoionico: facilità di estrazione di e- per riscaldamento.
Conducibilità termica: trasporto di energia termica dovuto alla mobilità degli e-.
Duttilità e malleabilità: i piani reticolari possono slittare con una certa facilità gli
uni sugli altri senza alterare le interazioni di legame.
Elettropositività: facilità di estrazione degli e-.
Non trasparenza e Lucentezza: i metalli assorbono tutte le radiazioni visibili
incidenti e le riemettono in tutte le direzioni. Gli e- possono essere eccitati a livelli
energetici superiori assorbendo quantità qualsiasi di energia, variabili praticamente
3
con continuità.
Modello semplificato di un reticolo metallico
“Mare” di elettroni di valenza,
molto mobili e delocalizzati
Cationi disposti secondo
un reticolo ordinato
4
Legame metallico - La teoria delle bande
Un cristallo metallico è caratterizzato da un’estesa sovrapposizione
degli orbitali di valenza dei singoli atomi in modo da formare orbitali
molecolari delocalizzati, estesi su tutto il reticolo cristallino (orbitali
di Bloch).
Costruzione di un reticolo metallico
In un cristallo formato da
molti atomi, i livelli
energetici degli orbitali
molecolari sono talmente
ravvicinati da formare
una banda continua
TEORIA DELLE BANDE
5
Cristallo metallico di Na
Gli e- sono delocalizzati
sull’intero cristallo
La separazione fra le diverse bande è tanto minore quanto minore è la
differenza di energia tra gli orbitali atomici dei singoli atomi e quanto
6
minore è la distanza fra atomi adiacenti nel cristallo
Mobilità degli elettroni nei conduttori
E
(+)
e-
(-)
Conducibilità diminuisce
all’aumentare di T
7
CONDUTTORI
a) banda di valenza solo parzialmente riempita (Li)
b) banda di valenza satura ma sovrapposta con bande vuote (Be)
c) banda di valenza parzialmente riempita ma sovrapposta con bande vuote
E
Banda
vuota
Banda vuota
sovrapposta
a quella di
valenza
Banda di
valenza
non satura
Banda di
valenza
satura
Bande
interne
sature
Bande
interne
sature
a)
Banda vuota
sovrapposta
a quella di
valenza
Banda di
valenza
non satura
Bande
interne
sature
b)
c)
8
La teoria delle bande si può applicare anche ai composti covalenti a struttura
infinita (es. diamante, silice) o ai composti ionici (es. AgBr).
Isolante: banda di valenza satura e separata dalla banda di conduzione
da un dislivello (GAP) energetico molto elevato.
C: 1s22s22p2 → 1s22(sp3)4
E
2(sp3)4
4N OM
DIAMANTE
1s2
N OM
∆E = 6 eV
9
Semiconduttori: banda di valenza satura e separata dalla banda di
conduzione da un dislivello (GAP) energetico piccolo.
GERMANIO
SILICIO
Si: [Ne]3s23p2 → [Ne]3(sp3)4
E
Ge: [Ar]3d104s24p2 → [Ar]3d104(sp3)4
E
3(sp3)4
4N OM
∆E = 1.1 eV
4(sp3)4
4N OM
∆E = 0.7 eV
10
Semiconduttori
Conducibilità aumenta
all’aumentare di T
Meccanismo di conduzione elettrica nei
semiconduttori puri (INTRINSECI)
(+)
Conduzione di
tipo n (elettroni)
(-)
-
-
Gap ∆E
1.1 eV Si, 0.7 eV Ge
∆E
+ + +
Conduzione di
tipo p (lacune)
Irraggiamento (FOTOCONDUZIONE)
Eccitazione termica (TERMOCONDUZIONE)
11
Proprietà magnetiche degli atomi
Figura 5-30 apparecchiatura
(bilancia magnetica)
utilizzata per misurare il paramagnetismo
di una sostanza.
Le sostanze che contengono elettroni spaiati sono leggermente attratte da un
campo magnetico e per questo sono dette paramagnetiche.
Viceversa le sostanze con tutti gli elettroni accoppiati sono debolmente respinte
da un campo magnetico e chiamate quindi diamagnetiche.
Ferro, cobalto e nichel sono le uniche sostanze che presentano proprietà
ferromagnetiche. Questa forma di interazione magnetica è molto forte rispetto al
paramagnetismo; questo permette ad una sostanza di essere magnetizzata in
12
modo permanente, dopo essere stata immersa in un campo magnetico.
Distribuzione statistica della carica elettronica
ATOMI ISOLATI
La carica elettronica si
sposta verso la zona
intermedia tra i 2 nuclei;
alcuni elettroni risentono
dell’attrazione di
entrambi i nuclei.
Legame covalente
Trasferimento di elettroni
da un atomo all’altro in
modo da formare uno ione
positivo ed uno ione
negativo, tra i quali nasce
un’attrazione elettrostatica.
Legame ionico
Parte della carica
elettronica è distribuita
uniformemente in tutto lo
spazio attorno ai nuclei e
risente dell’attrazione di
molti di essi (nella figura ne
sono mostrati solo due).
Legame metallico
13