L’atomo polielettronico
Abbiamo
parlato
dell’idrogeno,
finora
prendiamo
in
considerazione ora un atomo
con due elettroni, l’elio.
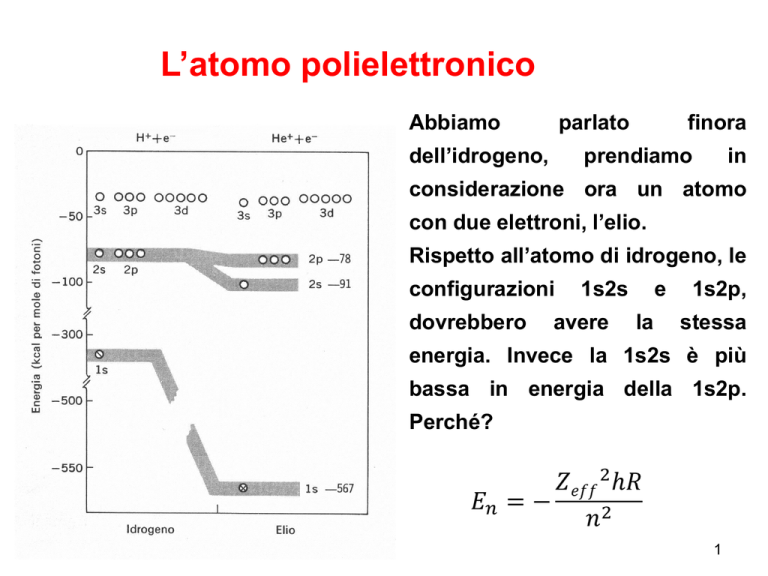
Rispetto all’atomo di idrogeno, le
configurazioni
dovrebbero
1s2s
avere
e
la
1s2p,
stessa
energia. Invece la 1s2s è più
bassa in energia della 1s2p.
Perché?
1
2
Effetto della carica nucleare
3
Nel caso dell’atomo di idrogeno, l’energia dei livelli dipende solo da n!
Nel caso di atomi a più elettroni l’energia dei livelli dipende sia da n che dal l!
L’equazione quantomeccanica va corretta per i termini repulsivi degli elettroni,
ed il tutto diventa più complicato.
1s
2s
4
Principio di esclusione di Pauli
Un orbitale non può essere
occupato da più di 2 elettroni e
quando 2 elettroni occupano lo
stesso orbitale i loro spin devono
essere appaiati
5
Riempimento degli orbitali
1 e- = H
2s
1s
2p
6
Riempimento degli orbitali
2 e- = He
2s
1s
2p
7
Riempimento degli orbitali
3 e- = Li
2s
1s
2p
8
Riempimento degli orbitali
4 e- = Be
2s
1s
2p
9
Riempimento degli orbitali
5 e- = B
2s
1s
2p
10
Riempimento degli orbitali
6 e- = C
2s
1s
2p
11
Riempimento degli orbitali
7 e- = N
2s
1s
2p
12
Riempimento degli orbitali
8 e- = O
2s
1s
2p
13
Riempimento degli orbitali
9 e- = F
2s
1s
2p
14
Riempimento degli orbitali
10 e- = Ne
2s
1s
2p
15
16
17
"The law of periodicity first allowed us to perceive undiscovered elements at
a distance which formerly was inaccessible to chemical vision."
from Dimitri Ivanovich Mendeleev's Faraday lecture before the Chemical
Society in London, twenty years after his discovery of periodic law (1889)
Nel 1870 il chimico russo Mendeleev ordina gli elementi in funzione del peso
atomico crescente dimostrando che le loro proprietà chimiche sono funzioni
periodiche del peso atomico. Nasce così la TAVOLA PERIODICA.
La rappresentazione risultante era così suddivisa in periodi orizzontali ed in
gruppi verticali.
Guidato dal principio della periodicità lasciò dei posti vuoti nella tavola,
intuendo con sicurezza che dovevano ancora essere scoperti alcuni
elementi (es. Tra Ca e Ti).
Inoltre riuscì a prevedere le proprietà di alcuni elementi ancora sconosciuti,
come gli elementi al di sotto Al e Si, che chiamò eka-alluminio ed eka-silicio.
Tali elementi successivamente scoperti erano il Gallio ed il Germanio.
Mendeleev incontrò alcune difficoltà per i metalli di transizione.
gruppi e periodi
elementi transizione (B)
IUPAC
IUPAC vecchia
CAS
nome
Gruppo 1
IA
IA
metalli alcalini
Gruppo 2
IIA
IIA
metalli alcalino terrosi
Gruppo 3
IIIA
IIIB
gruppo dello scandio
Gruppo 4
IVA
IVB
gruppo del titanio
Gruppo 5
VA
VB
gruppo del vanadio
Gruppo 6
VIA
VIB
gruppo del cromo
Gruppo 7
VIIA
VIIB
gruppo del manganese
Gruppo 8
VIIIA
VIIIB
gruppo del ferro
Gruppo 9
VIIIA
VIIIB
gruppo del cobalto
Gruppo 10
VIIIA
VIIIB
gruppo del nichel
Gruppo 11
IB
IB
gruppo del rame, anche detti
metalli nobili
Gruppo 12
IIB
IIB
gruppo dello zinco
Gruppo 13
IIIB
IIIA
gruppo del boro, anche detti
terrosi
Gruppo 14
IVB
IVA
gruppo del carbonio
Gruppo 15
VB
VA
gruppo dell'azoto
Gruppo 16
VIB
VIA
calcogeni
Gruppo 17
VIIB
VIIA
alogeni
Gruppo 18
VIIIB o 0
VIIIA
gas nobili
Gli elementi di uno stesso gruppo hanno configurazione elettronica
esterna dello stesso tipo
Poiché sono gli elettroni esterni che entrano in gioco nei fenomeni chimici, le
proprietà degli elementi appartenenti allo stesso gruppo presentano analogie.
Da notare che queste analogie sono assai marcate fra gli elementi successivi
al secondo, mentre i primi due elementi presentano proprietà che possono
essere notevolmente differenti.
Nel V gruppo le proprietà chimico-fisiche di As, Sb e Bi sono simili, ma hanno
ben poco in comune con N e P.
Poiché aumenta la distanza degli elettroni dal nucleo (raggio atomico),
diminuisce l’energia con la quale sono legati gli elettroni esterni
Proprietà periodiche
•
•
•
•
•
•
•
•
numero di elettroni esterni
carattere metallico
energia di ionizzazione
affinità elettronica
elettronegatività
raggio atomico
raggio ionico
numero di legami
Regole
• le proprietà periodiche variano con
continuità da sinistra a destra e
dall’alto al basso
• si ripetono simili ogni 8 elementi in
successione di numero atomico
crescente
• in ogni periodo, ciascun elemento
mostra valori intermedi tra quello che
lo precede e quello che lo segue
• si ripetono con valori simili all’interno
dei gruppi
Una prima grossa divisione degli elementi della tavola periodica
consiste nel loro carattere metallico o non metallico
Il carattere metallico aumenta:
- da destra a sinistra lungo un periodo
- dall’alto al basso lungo un gruppo
Il raggio atomico
Le nuvole elettroniche non hanno dimensioni definite,
tuttavia si definisce raggio atomico la metà della
distanza che separa i centri di due atomi contigui
quando questi formano molecole o si impacchettano in
solidi.
r
Misure date in
picometri (pm)
10-12 m
Le dimensioni atomiche
Le dimensioni
atomiche
diminuiscono
muovendosi
lungo un periodo
aumentano
scendendo lungo
un gruppo
Energie di Ionizzazione
Energia di ionizzazione: Eion o energia di prima ionizzazione si definisce
come la quantità di energia necessaria per allontanare a distanza
infinita da un atomo allo stato gassoso, l’elettrone più esterno (meno
fortemente legato), formando così uno ione positivo X+
X(gassoso) + Eion X+(gassoso) + e-
L’energia di ionizzazione si esprime normalmente in elettron-Volt (eV)
relativamente ad un singolo elettrone, ovvero in Kcal-1 mol-1 riferendosi
ad una mole di elettroni.
E’ possibile “strappare” altri elettroni, quindi si possono definire le
energie di seconda, terza, etc., ionizzazione.
E’ chiaro che l’energia di seconda ionizzazione è sempre più alta di
quella di prima ionizzazione.
E = h
Energie di I e II ionizzazione in funzione del
numero atomico
Notare a quali elementi corrisponde il massimo di I ionizzazione
M → M+ + eM+ → M++ + e-
pot. di prima ionizzazione
pot. di seconda ionizzazione
Na → Na+ + eNa+ → Na++ + eNa++ → Na+++ + e-
PI1 = 5.12 eV
PI2 = 47.05 eV
PI3 = 70.70 eV
Li → Li+ + eLi+ → Li++ + eLi++ → Li+++ + e-
PI1 = 5.39 eV
PI2 = 50.0 eV
PI3 = 122.4 eV
Gli atomi tendono alla configurazione elettronica più
stabile (ns2p6, strato completamente pieno), cioè a
quella del gas nobile più vicino.
·Eion diminuisce scendendo nel gruppo perché gli
elettroni sono meno attratti dal nucleo.
·Eion aumenta passando dal 1° al 2° gruppo, (X+ ha qui
una configurazione ns2, parzialmente stabile)
diminuisce al 3° e aumenta nel resto del periodo.
Affinità elettronica
L’affinità elettronica è l’energia che viene liberata (per convenzione di
segno negativo) da un atomo neutro gassoso isolato, nel suo stato
fondamentale, quando acquista un elettrone per dare luogo alla
formazione di uno ione negativo isolato
Elemento(gassoso) + e-
Elemento (gassoso) –
Raggio ionico
L’allontanamento di elettroni da un
nucleo atomico comporta una
diminuzione delle dimensioni
atomiche (minor repulsione fra
elettroni). Al contrario, l’inserimento
di elettroni comporta un aumento
delle dimensioni (maggior repulsione
interelettronica)
Dimensioni degli ioni
L’elettronegatività
Elettronegatività è la tendenza con la quale un
atomo tende ad attrarre gli elettroni di legame.
Non è quindi un valore “assoluto” come l’affinità
elettronica
Mulliken cercò di darne una spiegazione più generale
definendola come la media tra il potenziale di ionizzazione
(E.I.) e l’affinità elettronica (E.A.).
((E.I. – E.A.)/2).
Elettronegatività degli elementi
Esercizi
Grammi 0,235 di un ossido di stagno SnxOy, riscaldati in una corrente di
idrogeno lasciano un residuo di 0,185 g di Sn metallico. Si scriva la formula
empirica dell’ossido.
Scrivere la configurazione elettronica ed il diagramma degli orbitali per
ciascuno ione e determinare se è diamagnetico o paramagnetico.
Al3+; S2-; Fe3+; Co2+; N3-; Ca2+