09/03/2012
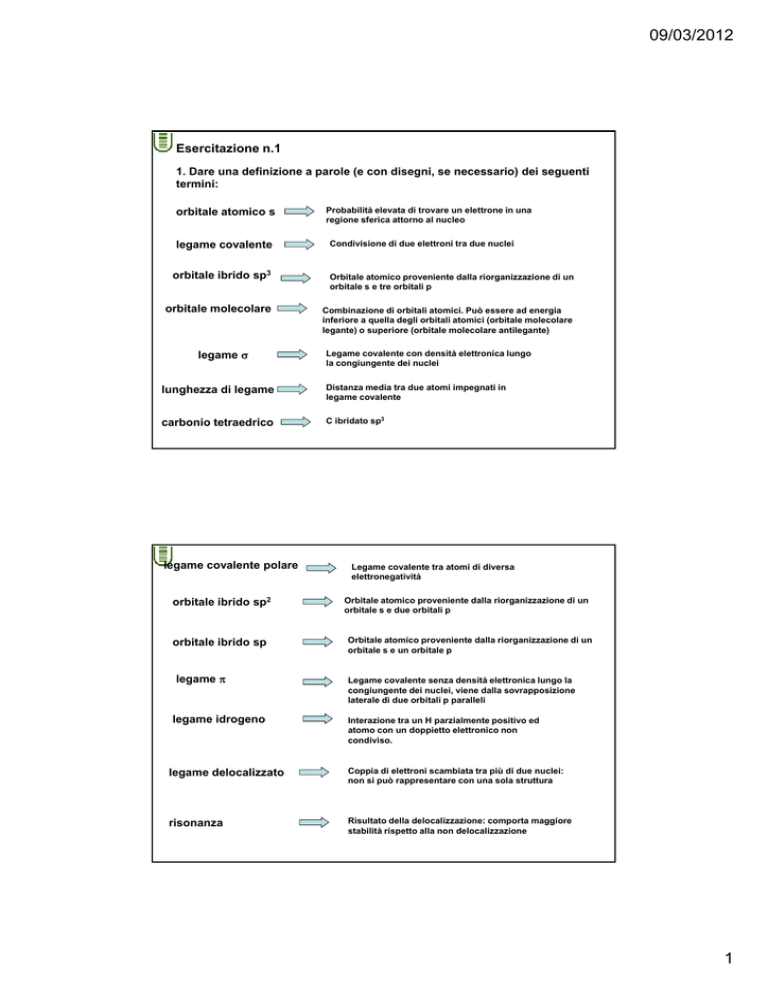
Esercitazione n.1
1. Dare una definizione a parole (e con disegni, se necessario) dei seguenti
termini:
orbitale atomico s
legame covalente
Probabilità elevata di trovare un elettrone in una
regione sferica attorno al nucleo
Condivisione di due elettroni tra due nuclei
orbitale ibrido sp3
Orbitale atomico proveniente dalla riorganizzazione di un
orbitale s e tre orbitali p
orbitale molecolare
Combinazione di orbitali atomici. Può essere ad energia
inferiore a quella degli orbitali atomici (orbitale molecolare
legante) o superiore (orbitale molecolare antilegante)
legame σ
Legame covalente con densità elettronica lungo
la congiungente dei nuclei
lunghezza di legame
Distanza media tra due atomi impegnati in
legame covalente
carbonio tetraedrico
C ibridato sp3
legame covalente polare
orbitale ibrido sp2
orbitale ibrido sp
legame π
legame idrogeno
Legame covalente tra atomi di diversa
elettronegatività
Orbitale atomico proveniente dalla riorganizzazione di un
orbitale s e due orbitali p
Orbitale atomico proveniente dalla riorganizzazione di un
orbitale s e un orbitale p
Legame covalente senza densità elettronica lungo la
congiungente dei nuclei, viene dalla sovrapposizione
laterale di due orbitali p paralleli
Interazione tra un H parzialmente positivo ed
atomo con un doppietto elettronico non
condiviso.
legame delocalizzato
Coppia di elettroni scambiata tra più di due nuclei:
non si può rappresentare con una sola struttura
risonanza
Risultato della delocalizzazione: comporta maggiore
stabilità rispetto alla non delocalizzazione
1
09/03/2012
2. a) Individuare gli otto elettroni leganti associati all'atomo di carbonio in
ciascuna delle seguenti strutture:
:O:
..
..
:O::C::O:
..
..
:O :: C :: O :
H:C:::N:
H:C:::N:
::
H:C:H
:O:
..
..
H:C:H
b) Nelle strutture precedenti assegnare gli elettroni associati a ciascun atomo
di H e gli otto elettroni associati a ciascun atomo di ossigeno e di azoto.
..
..
:O::C::O:
H:C:::N:
:O:
::
H:C:H
3. Scrivere le strutture dei seguenti composti, usando un trattino per ogni
coppia di elettroni costituenti un legame e due puntini per ogni coppia di
elettroni non impegnata in legame: HBr; HF; acido solfidrico (H2S); acqua;
ammoniaca; fosfina (PH3); cloroformio (CHCl3).
HBr
..
H-Br:
..
HF
..
H-F:
..
..
H-S-H
..
H 2S
H 2O
..
H-O-H
..
NH3
PH3
..
H N H
H
..
: Cl:
..
H P H
H
CHCl3
..
:
H C Cl
..
: Cl :
..
2
09/03/2012
5. Ciascuna delle seguenti strutture contiene un doppio o un triplo legame.
Scrivere le formule di Lewis e di Kekulé (a legame di valenza) corrispondenti:
HCN, Cl2CO, C2Cl4, C2H2, C2H4, CH2O
H:C:::N:
N:
H C
..
..
:Cl:
:Cl:
..
:Cl:C::C:Cl:
C
..
:Cl:
:
:
Cl
..
..
H..
..H
..C::C..
H
H
..
:Cl :
..
:Cl:
. . ..
C::O:
..
:Cl:
..
C
:Cl
.. :
H:C:::C:H
H
H
C
H
..
: Cl :
H C
H..
..
..C::O..
H
C
H
..
O..
C
: Cl
:
..
C H
H
C
..
O..
H
7. Scrivere le formule a legame di valenza (di Kekulé) per ciascuna delle
seguenti formule di Lewis:
H H
H .. ..
H
H
.. ..
.. ..
..
; H:C:N:H
H:C:::C:H ; H:C:O:C:H
.. .. ; H:C::C:H
.. .. ..
H
H H
H:C:::C:H
H C
C H
H .. ..
H
..
H:C:O:C:H
.. .. ..
H H
H
.. ..
H:C:N:H
.. ..
H
H .. H
H C O
.. C H
H
H
H ..
H C N
.. H
H
H
.. H
..
H:C::C:H
H
H
C C
H
H
3
09/03/2012
9. Scrivere le formule di Lewis per ciascuna delle seguenti strutture di Kekulé
e condensate:
H H H H
H
H ..H ..H
.. ..
H:C:C:C:C:H
.. .. .. ..
H HHH
H C C C C H
H H H H
H
H
..
H:C:H
H
.. .. H
..
H:C
:H
.. : C : C
..
H .. H
H:C:H
..
H
H H C HH
C
C H
H C
HH C H H
H
H2C
H
.. H
..
H:C::C:H
CH2
CH3CHClCH(CH3)2
H
..
H:C:H
H
H
..
.. ..
H:C
.. : C
.. :
.. : C
H :Cl: H
..
H
..
C
.. :H
H
10. Scrivere le formule di Lewis e le corrispondenti formule di Kekulé (a
legame di valenza) dei seguenti composti organici, scritti con le formule
condensate:
H
CH3CH2-
H C
H
H
CH3CH2.
C:
CH3CH2+
H
H C C+
H
H
H
H
H
H C C.
H
H
H
H
CH3CH=CH2
H
C
H
H
C
H
C
H
H H
..
H C O
.. C C H
H
H H
H
CH3OCH2CH3
H
..
H C O
.. C H
H
H
H
CH3OCH3
4
09/03/2012
H
H
..
H C O
.. H
H
CH3OH
.. :
H C O
..
H
CH3OH
.. +
H C O H
CH3OH2+
H H
Br
H
CH2=CHBr
H
CH3NH2
C
C
H
..
H C N H
H
H
H
H
..
H C N C H
H
CH3NHCH3
H
H
H
..
H C N C H
H
H
H C H
H
H
(CH3)3N
H
H C H
(CH3)4N+
H
H C
H
H
+
N C
H
H C H
H
H
18. L'angolo di legame O-C-O nella anidride carbonica (CO2) è 180°. Scrivere
la struttura di Lewis e dire quale è l'ibridazione dell'atomo di carbonio.
180°
..
..O
..
C O
..
sp
21. Quale elemento è il più elettronegativo in ciascuna delle seguenti serie?
a)
C, H, O
b) C, H, N
c) C, Cl, O
d) C, H, F
5
09/03/2012
22. Tra i seguenti composti, quali hanno un legame ionico e quali solo legami
covalenti?
CH CO Na, CH I, LiOH, CH ONa, CH OH, H S, Mg(OH)Br, CHCl
3
2
3
3
3
Hanno un legame ionico: CH3CO2Na, LiOH,
CH3CO2-+Na
Li+-OH
2
3
CH3ONa,
HOMgBr
CH3O-+Na
HO-+Mg+-Br
Che cosa potete dire sul punto di fusione dei composti con un legame ionico
rispetto a quelli con solo legami covalenti?
Il p.f. è più alto, perché bisogna allontanare ioni di carica opposta
24. Indicare le estremità positive e negative del dipolo dei seguenti legami:
C-Mg; C-Br; C-O; C-Cl; C-H; C-B.
C Mg
δ- δ+
C
Br
C
δ+ δ-
O
δ+ δ-
C Cl
δ+ δ-
C
H
C B
δ- δ+
26. Sistemare i seguenti composti in ordine di carattere ionico crescente:
CH4, HBr, LiCl.
CH4 < HBr < LiCl
38. Calcolare l’energia associata alle seguenti frequenze, lunghezze
d’onda o numeri d’onda:
a) ν = 2 x 108 Hz
E = hν
s-1
h = 6.6626 x 10-34 J s
E = 6.626 x 10-34 J s x 2 x 108 s-1 = 1.99 x 10-25 J
b) λ = 254 nm (2.54 x 10-9 m)
E = hν
3 x 108 m s-1
E =hν =
c = λν
ν = c/λ
x 6.626 x 10-34 J s = 7.83 x 10-19 J
2.54 x 10-9 m
6
09/03/2012
c) λ = 1.0 cm
c = λν
E = hν
3 x 108 m s-1
E =hν =
x 6.626 x 10-34 J s = 1.99 x 10-23 J
1 x 10-2 m
d) ν = 2600 cm-1
ν = 1/λ
ν = c/λ = c x ν
E = hν
Ricordarsi di esprimere λ in m e c in m s-1!!!
E = 5.17 x 10-20 J
e) ν = 4.1 x 1014 Hz
f) ν = 2 x 108 m-1
E = hν
E = 2.72 x 10-19 J
E = 3.99 x 10-17 J
7












