Caso 1: DIAGNOSI, TERAPIA E DISCUSSIONE
Le aritmie ventricolari sono disturbi del ritmo cardiaco ad origine dalle camere ventricolari. Possono essere
classificate in complessi prematuri ventricolari singoli, coppie ventricolari, triplette ventricolari o
tachicardie ventricolari (quando 4 o più complessi prematuri ventricolari si susseguono con frequenza di
scarica > 180 bpm).
Le aritmie ventricolari possono avere un’origine cardiaca o conseguire a patologie extra-cardiache. Nel
cane, tra le aritmie ad origine cardiaca troviamo le rare forme primarie (idiopatiche) e le più comuni forme
secondarie a patologie cardio-strutturali, quali la cardiomiopatia dilatativa, la cardiomiopatia aritmogena
del ventricolo destro, l’insufficienza mitralica grave, le stenosi sub-aortica e polmonare gravi, le miocarditi,
le neoplasie cardiache. Tra le patologie extra-cardiache troviamo: dilatazione-torsione gastrica, patologie
spleniche, processi infiammatori (pancreatite, piometra, prostatite, peritonite), sepsi, neoplasie primarie o
metastatiche varie, uremia, squilibri elettrolitici ed acido-base.
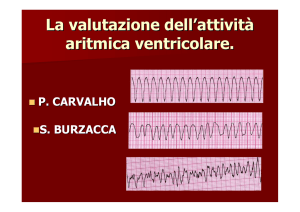
Nel caso clinico in questione l’ECG e l’esame Holter hanno mostrato numerosi complessi prematuri
ventricolari singoli ma in prevalenza organizzati in coppie, triplette e lembi di tachicardia ventricolare
monomorfa a carattere iterativo. Con il termine iterativo si intende una forma aritmica in cui brevi lembi di
tachicardia si ripetono alternandosi a battiti sinusali. La morfologia prevalente dei complessi ventricolari è
risultata tipo blocco di branca destro. Questo quadro aritmico in un cucciolo di pastore tedesco, in assenza
di patologie cardio-strutturali sottostanti, porta a porre come prima diagnosi differenziale una forma di
aritmie ventricolari ereditarie del pastore tedesco. Dato il rialzo della troponina I sierica una miocardite non
può del tutto essere esclusa, soprattutto una forma cronica. Tuttavia i valori di troponina che si registrano
in corso di miocarditi sono generalmente molto più elevati ed è probabile che il lieve rialzo in questo caso
clinico sia secondario al grave quadro aritmico.
Le aritmie ventricolari ereditarie del pastore tedesco sono una patologia aritmica conseguente ad un
difetto di innervazione simpatica del ventricolo sinistro. La modalità di trasmissione genetica non è ancora
stata del tutto chiarita. Il difetto di innervazione porta all’insorgenza di aritmie ventricolari, comunemente
rappresentate da tachicardie ventricolari polimorfe ad elevata frequenza di scarica. In un numero ridotto di
cani, la patologia si presenta invece con tachicardie ventricolari monomorfe, come nel caso qui presentato.
La aritmie ventricolari si concentrano solitamente nei periodi di bradicardia, motivo per cui la morte
improvvisa, che rappresenta purtroppo un frequente esito della patologia, avviene maggiormente nel
sonno o nelle fasi post-esercizio fisico. La morte improvvisa consegue ad una degenerazione delle aritmie
ventricolari in fibrillazione ventricolare. La patologia colpisce i cuccioli di pastore tedesco con un’età
compresa tra i 4 ed i 18 mesi, con un picco di gravità intorno ai 5-7 mesi. Dopo i 18 mesi invece le aritmie
tendono a scomparire o ridursi in numero e organizzazione. La terapia che normalmente si utilizza è
l’associazione di due farmaci antiaritmici, quali mexiletina (8 mg/kg PO TID) e sotalolo (2.5 mg/kg PO BID).
Anche nel caso qui presentato si è iniziata tale terapia ed il controllo Holter dopo 15 giorni ha mostrato una
marcata riduzione del numero e dell’organizzazione delle aritmie ventricolari. Tuttavia numerosi lembi di
tachicardia ventricolare continuavano a persistere. Dopo un mese dalla diagnosi, all’età di 6 mesi, il cane ha
avuto morte improvvisa dopo il risveglio dal riposo notturno.
La conoscenza di questa patologia aritmica ereditaria del pastore tedesco è importante sia per la gestione
clinica sia per la gestione riproduttiva di questa razza. E’ importante un’accurata auscultazione cardiaca ed
uno screening elettrocardiografico in tutti i pastori tedeschi di giovane età, in particolar modo in quei
soggetti che devono essere sottoposti a sedazione o anestesia per procedure diagnostiche (es. radiografie
ortopediche) o chirurgiche. Infatti qualunque farmaco bradicardizzante può determinare l’innesco delle
aritmie ventricolari o esacerbare un quadro aritmico già presente. Infine sarebbe opportuno considerare
l’esclusione dalla riproduzione dei soggetti affetti ed eseguire un monitoraggio Holter dei familiari.
BIBLIOGRAFIA – Diagnosi, terapia e discussione
•
Moise NS, Meyers-Wallen V, Flahive WJ, et al. Inherited ventricular arrhythmias and sudden death
in German shepherd dogs. J Am Coll Cardiol. 1994;24:233-243.
•
Moise NS, Gilmour RF Jr, Riccio ML, et al. Diagnosis of inherited ventricular tachycardia in German
shepherd dogs. J Am Vet Med Assoc. 1997;210:403-410.
•
Gelzer AR, Kraus MS, Rishniw M, et al. Combination therapy with mexiletine and sotalol suppresses
inherited ventricular arrhythmias in German shepherd dogs better than mexiletine or sotalol
monotherapy: a randomized cross-over study. J Vet Cardiol. 2010;12:93-106.
•
Church WM, Sisson DD, Oyama MA, et al. Third degree atrioventricular block and sudden death
secondary to acute myocarditis in a dog. J Vet Cardiol 2007;9:53-57.
Caso 2: DIAGNOSI, TERAPIA E DISCUSSIONE
I complessi ventricolari sono depolarizzazioni ectopiche, ad origine dai ventricoli. Essi si dividono in due
grosse categorie: 1) complessi “prematuri” ventricolari e 2) complessi “di scappamento” ventricolare. I
complessi prematuri ventricolari, anche definiti “extrasistoli ventricolari”, sono depolarizzazioni ectopiche
che originano prematuramente rispetto alla frequenza di scarica del nodo del seno. Invece i complessi di
scappamento ventricolare, o battiti di fuga ventricolare, sono depolarizzazioni ectopiche ad origine dai
pacemaker sussidiari ventricolari (fibre del Purkinje) che insorgono dopo una pausa. La pausa può
conseguire ad un ritardo di scarica del pacemaker dominante (nodo del seno), ad un suo malfunzionamento
o ad un blocco atrioventricolare.
I complessi prematuri ventricolari possono presentarsi singoli, in coppie, in triplette ventricolari od
organizzarsi in una serie di 4 o più battiti. Nel cane, se la serie di 4 o più complessi ventricolari ha una
frequenza di scarica maggiore di 180 bpm si parla di tachicardia ventricolare. Se invece la frequenza
cardiaca è compresa tra 70 e 180 bpm si parla di ritmo idioventricolare accelerato (RIVA). I ritmi ventricolari
con frequenza minore di 70 bpm sono invece denominati ritmi di scappamento ventricolare.
Le tachicardie ventricolari sono generalmente secondarie a cardiopatie sottostanti e tendono quindi ad
avere caratteri di malignità. Invece i RIVA conseguono generalmente a patologie extra-cardiache e tendono
ad avere un carattere più benigno. Nella seguente discussione ci concentreremo sui RIVA dato l’argomento
del caso clinico.
Le cause più comuni di ritmo idioventricolare accelerato sono patologie che portano ad ischemia/ipossia
miocardica. Le più comuni condizioni patologiche associate sono: 1) sindrome da dilatazione/torsione
gastrica 2) varie condizioni di shock, con la forma ipovolemica più rappresentata. In questi casi le aritmie
comunemente insorgono da aree di sofferenza miocardica, per ischemia primaria o per danni da
riperfusione. Altre patologie frequentemente causa di RIVA sono patologie infiammatorie/infettive
addominali (pancreatite, prostatite, piometra, peritonite), patologie spleniche (emangiosarcoma, torsione
splenica), patologie tossiche (uremia), patologie neoplastiche varie (metastatiche in prevalenza), traumi
miocardici (trauma toracico), patologie neurologiche, grave anemia. In questi casi il meccanismo
aritmogenico risiede in un insulto miocardico dovuto a: citochine infiammatorie o tumorali, tossine
endogene o batteriche, stress ossidativo, trombo-embolismo neoplastico, rilascio di fattore pancreatico
depressante miocardico. Cause più rare di RIVA sono patologie primariamente cardiache quali: pericarditi,
miocarditi, infarto miocardico, cardiomiopatie o insufficienza mitralica grave. Più è focale il danno
miocardico e più frequente sarà la presentazione monomorfa del RIVA. Più diffuso è il danno miocardico
più polimorfo sarà il RIVA. La forma monomorfa tende ad essere più benigna della polimorfa.
Comunemente il RIVA tende ad assumere un carattere intermittente e si alterna a complessi sinusali o
periodi di ritmo sinusale; in alcuni casi invece si presenta sostenuto (durata > 30 secondi) e non si
registrano complessi sinusali.
Nel caso clinico in questione la diagnosi clinica è di rottura di massa splenica, con conseguente emoaddome
e shock ipovolemico (emorragico). L’ipotensione e l’anemia riscontrate sono le cause più probabili di
ischemia e ipossia miocardica alla base delle aritmie ventricolari dell’animale.
La decisione di trattare o meno con antiaritmici un RIVA dipende molto dall’impatto emodinamico che esso
ha sul paziente. Tuttavia la maggioranza dei RIVA non necessita di trattamento. Primo, perché la frequenza
cardiaca non elevata (70-180 bpm) generalmente non comporta un significativo impatto emodinamico.
Secondo, perché il RIVA tende a risolversi in 24-72 h se si tratta la patologia sottostante (ipotensione,
infiammazione, infezione, tossicosi, ecc…). Nel caso in cui invece il RIVA abbia una frequenza di scarica
elevata (>160 bpm) alternandosi a lembi di tachicardia ventricolare o abbia caratteri di malignità (es.
polimorfismo) è consigliabile valutare un trattamento antiaritmico. Comunemente la prima scelta
terapeutica in corso di RIVA è la lidocaina, somministrata in bolo endovenoso seguito da infusione continua
endovenosa. Il comune utilizzo della lidocaina nasce da una buona efficacia terapeutica associata a: effetto
analgesico, effetto anti-infiammatorio e scarso effetto ipotensivo. Nei casi non responsivi alla lidocaina, in
cui il trattamento antiaritmico sia estremamente necessario, si può ricorrere ad altri tipi di antiaritmici
come amiodarone o sotalolo.
Nel caso clinico in questione si è proceduto alla stabilizzazione del paziente in regime di terapia intensiva
per poi procedere con la splenectomia d’urgenza. Data la moderata anemia e lo stato ipotensivo si è
proceduto con una emotrasfusione pre-chirurgica. Si è anche eseguito una radiografia toracica che non ha
mostrato alterazioni significative. Si è deciso di non trattare l’aritmia per la bassa frequenza di scarica e per
il suo carattere intermittente. Si è eseguito monitoraggio elettrocardiografico post-operatorio che ha
mostrato la persistenza di periodi di RIVA con frequenza di scarica media 140 bpm. Dopo 12 ore
dall’intervento si è registrato unicamente ritmo sinusale all’ECG. L’esame istologico della massa splenica
asportata ha indicato emangiosarcoma di milza. Ecocardiografia ed TC total-body non hanno messo in
evidenza fenomeni metastatici visibili né patologie significative concomitanti. Il cane è stato quindi
sottoposto a chemioterapia.
BIBLIOGRAFIA – Diagnosi, terapia e discussione
•
Bruchim Y, Itay S, Shira BH, et al. Evaluation of lidocaine treatment on frequency of cardiac
arrhythmias, acute kidney injury, and hospitalization time in dogs with gastric dilatation volvulus. J
Vet Emerg Crit Care (San Antonio). 2012;22:419-427.
•
Chandler JC, Monnet E, Staatz AJ. Comparison of acute hemodynamic effects of lidocaine and
procainamide for postoperative ventricular arrhythmias in dogs. J Am Anim Hosp Assoc.
2006;42:262-268.
•
Guglielmini C, Diana A, Civitella C, et al. Accelerated Idioventricular Rhythm in 9 Dogs. Veterinary
Research Communications 2006;30:305-307.
•
Langhorn R, Willesen JL. Cardiac Troponins in Dogs and Cats. J Vet Intern Med. 2016;30:36-56.
•
Marino DJ, Matthiesen DT, Fox PR, et al. Ventricular arrhythmias in dogs undergoing splenectomy:
a prospective study. Vet Surg. 1994;23:101-106.
•
Naito M, David D, Michelson EL, et al. The hemodynamic consequences of cardiac arrhythmias:
evaluation of the relative roles of abnormal atrioventricular sequencing, irregularity of ventricular
rhythm and atrial fibrillation in a canine model. Am Heart J. 1983;106:284-291.
•
Silverstein D, Hopper K. Small animal critical care medicine. 2nd Ed, 2014. Elsevier.
Caso 3: DIAGNOSI, TERAPIA E DISCUSSIONE
I complessi prematuri atriali, anche definiti extrasistoli atriali, sono depolarizzazioni ectopiche, ad origine
dagli atri, che insorgono prematuramente rispetto alla frequenza di scarica del nodo del seno. I complessi
prematuri atriali possono presentarsi singoli, in coppie, in triplette od organizzarsi in una serie di 4 o più
battiti. Nel cane, se la serie di 4 o più complessi prematuri atriali ha una frequenza di scarica maggiore di
180 bpm si parla di tachicardia atriale. Inoltre i complessi prematuri atriali e le tachicardie atriali posso
avere origine “focale”, quando è presente solo un focus aritmogeno, o “multifocale”, quando più focus
atriali concorrono all’aritmia.
Le cause più comuni di complessi prematuri atriali sono patologie cardiache che portano ad un
ingrandimento atriale, con conseguente stiramento parietale, morte cellulare e sostituzione fibrosa del
miocardio atriale. Le patologie cardio-strutturali più frequentemente associate a complessi prematuri atriali
sono forme gravi di insufficienza mitralica, cardiomiopatie, ipertensione polmonare, cardiopatie congenite
o miocarditi. I complessi prematuri atriali possono anche conseguire a patologie neoplastiche che infiltrano
il miocardio atriale; tra le più comuni l’emangiosarcoma, i chemodectomi, i paragangliomi ed i linfomi.
Meno comunemente, i complessi prematuri atriali possono conseguire a patologie extra-cardiache di
natura ischemica (shock), di natura infiammatoria/infettiva (pancreatite, prostatite, piometra, peritonite) o
tossica (uremia).
Nel caso clinico in questione la diagnosi clinica è di insufficienza mitralica grave, complicata da moderata
ipertensione polmonare post-capillare e complessi prematuri atriali singoli. Secondo la classificazione
ACVIM della valvulopatia mitralica cronica, il paziente è in classe C in quanto anche se non in edema
polmonare al momento ha già presentato un episodio di scompenso cardiaco in passato. I complessi
prematuri atriali conseguono in prima ipotesi a fenomeni di sofferenza miocardica e sostituzione fibrosa a
carico dell’atrio sinistro fortemente ingrandito.
Complessi prematuri atriali singoli hanno scarso impatto emodinamico, ma in caso di loro riscontro all’ECG
di superficie è sempre importante eseguire un esame Holter per escludere la possibile presenza nell’arco
delle 24 ore di fenomeni aritmici più complessi quali le tachicardie atriali. Nel presente caso clinico si è
deciso di potenziare la terapia cardiologica con l’aggiunta dello spironolattone: antagonista del recettore
per l’aldosterone, quindi ulteriore molecola per il blocco del sistema renina-angiotensina-aldosterone, ma
avente anche potere anti-fibrotico miocardico. Inoltre si è proceduto all’esecuzione di un esame Holter per
appunto approfondire il quadro aritmico riscontrato. L’esame Holter ha messo in evidenza un ritmo di base
sinusale con presenza di numerosi complessi prematuri atriali (8820), prevalentemente singoli e rare coppie
atriali; assenza di aritmie ventricolari. Dato il basso grado di organizzazione delle aritmie atriali non si è
intrapresa terapia antiaritmica. Generalmente si procede col trattamento delle aritmie atriali quando
queste hanno un elevato grado di organizzazione ed hanno un significativo impatto emodinamico: es.
tachicardie atriali molto frequenti e/o sostenute (durata maggiore di 30 secondi). In questi casi si procede
solitamente trattando i pazienti con antiaritmici (β-bloccanti, calcio-antagonisti, sotalolo o amiodarone) sia
per migliorare l’emodinamica del paziente, sia per prevenire la degenerazione delle tachicardie atriali in
flutter atriale o fibrillazione atriale. Nel caso in questione si è solo consigliato di ripetere controllo clinico,
ECG ed eventuale Holter a distanza di un mese per monitorare l’eventuale evoluzione delle aritmie atriali.
BIBLIOGRAFIA – Diagnosi, terapia e discussione
•
Atkins C, Bonagura J, Ettinger S, et al. Guidelines for the diagnosis and treatment of canine chronic
valvular heart disease. J Vet Intern Med. 2009;23:1142-1150.
•
Bernay F, Bland JM, Häggström J, et al. Efficacy of spironolactone on survival in dogs with naturally
occurring mitral regurgitation caused by myxomatous mitral valve disease. J Vet Intern Med.
2010;24:331-341.
•
Burashnikov A, Di Diego JM, Sicouri S, et al. A temporal window of vulnerability for development of
atrial fibrillation with advancing heart failure. Eur J Heart Fail. 2014;16:271-280.
•
Fox PR. Pathology of myxomatous mitral valve disease in the dog. J Vet Cardiol. 2012;14:103-126.
•
Janus I, Noszczyk-Nowak A, Nowak M, et al. A comparison of the histopathologic pattern of the left
atrium in canine dilated cardiomyopathy and chronic mitral valve disease. BMC Vet Res. 2016;12:3.
•
Lavall D, Selzer C, Schuster P, et al. The mineralocorticoid receptor promotes fibrotic remodeling in
atrial fibrillation. J Biol Chem. 2014;289:6656-6668.
•
Naito M, David D, Michelson EL, et al. The hemodynamic consequences of cardiac arrhythmias:
evaluation of the relative roles of abnormal atrioventricular sequencing, irregularity of ventricular
rhythm and atrial fibrillation in a canine model. Am Heart J. 1983;106:284-291.
•
Page RL, Joglar JA, Caldwell MA, et al. 2015 ACC/AHA/HRS Guideline for the Management of Adult
Patients With Supraventricular Tachycardia. J Am Coll Cardiol. 2015; [Epub ahead of print].
Caso 4: DIAGNOSI, TERAPIA E DISCUSSIONE
La fibrillazione atriale è una delle più comuni aritmie cardiache che si riscontrano sia in medicina umana che
veterinaria. Nel cane rappresenta il 14% di tutte le aritmie documentate e frequentemente è associata a
prognosi sfavorevole.
La fibrillazione atriale è un un’aritmia caratterizzata da un’attivazione atriale rapida e disorganizzata, in cui
il ritmo cardiaco non è più sotto il controllo del nodo del seno ma è guidato da una caotica attività elettrica
atriale secondaria a numerosi circuiti di microrientro. Frequenza e ritmo cardiaco conseguono
all’interazione tra la frequenza atriale e la funzione di filtro del nodo atrio-ventricolare; quest’ultimo agisce
da “portinaio”, permettendo il passaggio ai ventricoli solo alle depolarizzazioni atriali aventi adeguata
intensità, tempistica e orientazione. Data l’irregolarità delle depolarizzazioni atriali che raggiungono il nodo
atrioventricolare, gli impulsi passano ai ventricoli ad intervalli irregolarmente irregolari, da qui il ritmo
caotico percepibile all’auscultazione che prende storicamente il nome latino di «delirium cordis» («delirio
del cuore»). L’assenza di depolarizzazione atriale organizzata porta ad un’inefficiente contrazione atriale,
con perdita di un 20% di gittata sistolica e ad un aumento delle pressioni di riempimento ventricolare.
Questi due aspetti sommati alla frequenza cardiaca generalmente elevata portano ad un notevole impatto
emodinamico dell’aritmia.
La fibrillazione atriale può essere la conseguenza di patologie cardio-strutturali (forma secondaria) o può
presentarsi in assenza di alterazioni cardiache sottostanti (forma primaria). Nel cane, la forma secondaria
generalmente consegue a patologie che portano ad ingrandimento atriale, quali endocardiosi mitralica,
cardiomiopatia dilatativa o cardiopatie congenite. La forma primaria si presenta invece in assenza di
patologie cardio-strutturali ed è tipica delle razze giganti, tra cui Alano, Terranova, Dogue de Bordeaux,
Mastiff, Levriero irlandese.
Nel caso clinico in questione, dopo la stabilizzazione del paziente con terapia diuretica in infusione continua
(furosemide), si è proceduto con l’esecuzione di uno studio radiografico del torace in doppia proiezione che
ha confermato un quadro di edema polmonare cardiogeno. L’esame ecocardiografico completo ha
evidenziato un insufficienza mitralica grave con marcato ingrandimento atrio-ventricolare sinistro (classe
ACVIM C). In questo soggetto la fibrillazione atriale conseguiva in prima ipotesi all’ingrandimento atriale
sinistro. E’ inoltre probabile che l’insorgenza di fibrillazione atriale possa esser stato il fattore precipitante
in un paziente con patologia cardiaca compensata. L’alta frequenza cardiaca nel cane in questione era
determinata dalla fibrillazione atriale in associazione all’ipertono simpatico conseguente allo scompenso
cardiaco. Infatti con il trattamento dell’edema polmonare la frequenza cardiaca è scesa fino a 180 bpm. Il
paziente è stato dimesso dopo 36 ore con assenza di edema polmonare alla radiografia toracica, presenza
di rare linee B all’ecografia toracica di controllo e con parametri emato-biochimici nella norma. Si è
prescritta terapia cardiologica orale a base di furosemide 2 mg/kg BID, pimobendan 0.25 mg/kg BID,
benazepril 0.25 mg/kg BID, spironolattone 2 mg/kg SID e digossina 0.003 mg/kg BID. Dopo 8 giorni il
paziente si presentava in buone condizioni cliniche ma la frequenza cardiaca a riposo risultava ancora alta:
170 bpm. Si procede a prelievo ematico per dosaggio della digossinemia (nella norma) e controllo della
funzionalità renale con elettroliti (nella norma). Si aggiunge quindi alla terapia un calcio-antagonista con
l’obiettivo di ridurre ulteriormente la frequenza cardiaca: diltiazem a rilascio prolungato 1 mg/kg BID. Dopo
7 giorni il paziente presenta ancora fibrillazione atriale ma con 150 bpm a riposo. Si applica quindi un
monitoraggio Holter che mette in evidenza una frequenza cardiaca media giornaliera pari a 128 bpm e rari
complessi prematuri ventricolari monomorfi. Poiché si considera adeguatamente controllata una
fibrillazione atriale con una frequenza cardiaca media giornaliera inferiore a 140 bpm, nel caso in questione
si decide di proseguire con la terapia in corso e di eseguire controllo cardiologico dopo 1 mese.
BIBLIOGRAFIA – Diagnosi, terapia e discussione
•
Atkins C, Bonagura J, Ettinger S, et al. Guidelines for the diagnosis and treatment of canine chronic
valvular heart disease. J Vet Intern Med. 2009;23:1142-1150.
•
Bonagura JD, Ware WA. Atrial fibrillation in the dog: clinical findings in 81 cases. J Am Anim Hosp
Assoc 1986;22:111-20.
•
Calvert CA, Pickus CW, Jacobs GJ, et al. Signalment, survival, and prognostic factors in Doberman
pinschers with end-stage cardiomyopathy. J Vet Intern Med. 1997;11:323-326.
•
Gelzer AR, Kraus MS, Rishniw M, et al. Combination therapy with digoxin and diltiazem controls
ventricular rate in chronic atrial fibrillation in dogs better than digoxin or diltiazem monotherapy: a
randomized crossover study in 18 dogs. J Vet Intern Med. 2009;23:499-508.
•
Gelzer AR, Kraus MS, Rishniw M. Evaluation of in-hospital electrocardiography versus 24-hour
Holter for rate control in dogs with atrial fibrillation. J Small Anim Pract. 2015;56:456-462.
•
January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS guideline for the management of patients
with atrial fibrillation. J Am Coll Cardiol. 2014;64:e1-76.
•
Jung SW, Sun W, Griffiths LG, Kittleson MD, et al. Atrial Fibrillation as a Prognostic Indicator in
Medium to Large-Sized Dogs with Myxomatous Mitral Valvular Degeneration and Congestive Heart
Failure. J Vet Intern Med. 2016;30:51-57.
•
Lévy S, Camm AJ, Saksena S, et al. International consensus on nomenclature and classification of
atrial fibrillation. J Cardiovasc Electrophysiol. 2003;14:443-445.
Caso 5: DIAGNOSI, TERAPIA E DISCUSSIONE
La fibrillazione atriale è una delle più comuni aritmie cardiache che si riscontrano sia in medicina umana che
veterinaria. La fibrillazione atriale è un un’aritmia caratterizzata da un’attivazione atriale rapida e
disorganizzata, in cui il ritmo cardiaco non è più sotto il controllo del nodo del seno ma è guidato da una
caotica attività elettrica atriale secondaria a numerosi circuiti di microrientro.
La fibrillazione atriale nel cane può essere classificata in base a:
-
Durata
o
parossistica: durata inferiore a 7 giorni o più frequentemente minore di 24 ore;
o
persistente: durata maggiore di 7 giorni o che risponde alla cardioversione elettrica o
farmacologica;
o
permanente: durata prolungata (>1 anno) in pazienti in cui non è indicata la cardioversione
elettrica o in cui non ha avuto successo.
-
-
Eziologia
o
Primaria: assenza di alterazioni cardiache sottostanti;
o
Secondaria: presenza di patologie cardio-strutturali.
Frequenza cardiaca
o
Bassa penetranza ventricolare: frequenza cardiaca < 160 bpm all’ECG di superficie;
o
Alta penetranza ventricolare: frequenza cardiaca > 160 bpm all’ECG di superficie.
Nel cane, le forme più comuni sono le fibrillazioni atriali persistenti o permanenti secondarie a malattie
cardiache primarie, tra cui endocardiosi mitralica, cardiomiopatia dilatativa o cardiopatie congenite. Tali
forme secondarie si presentano solitamente ad elevata penetranza ventricolare e possono essere causa di
scompenso cardiaco.
La fibrillazione atriale primaria è tipica delle razze giganti, tra cui Alano, Terranova, Dogue de Bordeaux,
Mastiff, Levriero irlandese. Questa forma si sviluppa in cani con cardio-struttura conservata e spesso è
caratterizzata da un bassa penetranza ventricolare. La frequenza cardiaca è frequentemente nella norma e
quindi l’impatto emodinamico del problema non è significativo. I cani con fibrillazione atriale primaria sono
frequentemente asintomatici o, più raramente, presentare intolleranza all’esercizio fisico.
Nel caso clinico in questione la fibrillazione atriale è stata un reperto occasionale in seguito ad ECG preanestesiologico. Si è posticipata quindi la valutazione ortopedica e si è proposto un esame ecocardiografico,
che non ha mostrato alterazioni significate. Ci troviamo quindi di fronte ad una forma primaria. Si è
proposto a questo punto un esame Holter per valutare l’andamento della frequenza cardiaca nelle 24 ore e
l’eventuale presenza di ulteriori aritmie non visibili all’ECG di superficie. Tale esame ha messo in evidenza
una fibrillazione atriale per l’intera registrazione ed una normale frequenza cardiaca media giornaliera (93
bpm), che conferma la bassa penetranza ventricolare. Tale frequenza cardiaca non ha un impatto
emodinamico significativo e quindi non si è proceduto con un trattamento anti-aritmico.
In corso di fibrillazione atriale può essere valutato il trattamento con cardioversione elettrica, ovvero
rilascio di shock elettrico mediante defibrillatore, con l’obiettivo di ripristinare il ritmo sinusale. Tale
opzione è fortemente indicata nelle forme primarie in quanto, a differenza delle forme secondarie, la
probabilità di recidiva è molto più bassa. I proprietari hanno accettato tale proposta. Si è quindi pretrattato il cane per 5 giorni con amiodarone 10 mg/kg BID e poi si è eseguita la cardioversione elettrica in
anestesia, che ha ripristinato il ritmo sinusale. Lo stesso giorno si è eseguita valutazione ortopedica in
anestesia, che ha evidenziato un segno del cassetto e test di compressione tibiale positivi a carico del
ginocchio destro. Lo studio radiografico ha mostrato una sublussazione craniale marcata della tibia con
segni di infiammazione articolare ed artrosi. Il ginocchio sinistro non presenta invece nessuna alterazione,
mentre le anche presentano una moderata displasia.
Dopo la cardioversione elettrica il cane ha continuato a ricevere terapia a base di amiodarone e si è
programmata la chirurgia ortopedica di TPLO per la rottura del legamento crociato anteriore dopo 10 giorni
dalla cardioversione.
Dopo 1 mese di terapia a base di amiodarone, si è scalato gradatamente il farmaco fino a completa
sospensione dopo 2 mesi. A distanza di 6 mesi della cardioversione il cane presenta ancora ritmo sinusale e
la zoppia si è completamente risolta.
BIBLIOGRAFIA – Diagnosi, terapia e discussione
•
Bonagura JD, Ware WA. Atrial fibrillation in the dog: clinical findings in 81 cases. J Am Anim Hosp
Assoc 1986;22:111-20.
•
Bright JM, Martin JM, Mama K. A retrospective evaluation of transthoracic biphasic electrical
cardioversion for atrial fibrillation in dogs. J Vet Cardiol. 2005;7:85-96.
•
Bright JM, Martin JM. Cardioversion. In: Bonagura & Twedt. Kirk's Current Veterinary Therapy XV.
2014. Web chapter 60.
•
Gelzer AR, Kraus MS, Rishniw M. Evaluation of in-hospital electrocardiography versus 24-hour
Holter for rate control in dogs with atrial fibrillation. J Small Anim Pract. 2015;56:456-462.
•
January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS guideline for the management of patients
with atrial fibrillation. J Am Coll Cardiol. 2014;64:e1-76.
Caso 6: DIAGNOSI, TERAPIA E DISCUSSIONE
Il ritmo seno-ventricolare è un’aritmia caratterizzata da assenza di onde P con linea isoelettrica piatta e
complessi QRS di morfologia normale e durata spesso aumentata. La frequenza cardiaca varia a seconda
dell’automatismo sinusale.
Tale alterazione è associata a tutte le condizioni che causano un aumento dei livelli sierici di potassio quali:
eccessiva supplementazione di potassio, alterata escrezione di potassio (es. insufficienza renale acuta,
ipoadrenocorticismo) e traslocazione del potassio dal compartimento intracellulare a quello extracellulare
(es. danni da riperfusione).
Nel caso appena descritto, l’iperkaliemia è causata da insufficienza renale acuta per intossicazione d’uva. Il
meccanismo mediante il quale l’uva può portare ad insufficienza renale acuta non è stato ancora ad oggi
ben compreso. Le ipotesi sono la presenza in tale frutto di sostanze nefrotossiche o l’insorgenza di reazioni
idiosincrasiche che determinano shock ipovolemico e ischemia renale.
L’iperkaliemia che si riscontra in corso d’insufficienza renale acuta può portare a gravi alterazioni del ritmo
cardiaco in quanto presenta un’azione bifasica sulla conduzione e sull’eccitazione cardiaca. Infatti
l’aumento del potassio inizialmente aumenta la velocità di ripolarizzazione del miocardio, in quanto il
potenziale di riposo diventa meno negativo, avvicinandosi al potenziale soglia. Successivamente la
conduzione e l’eccitabilità si riducono poiché il potenziale di riposo si avvicina al potenziale soglia fino al
punto di raggiungerlo e le cellule rimangono in uno stato costante di depolarizzazione, perdendo la
capacità di eccitarsi. Inoltre una percentuale di canali rapidi del sodio si inattiva. Per questo le cellule del
miocardio sono più sensibili ad un aumento del potassio, in quanto l’insorgenza del potenziale d’azione
dipende dai canali del sodio. I canali lenti del calcio del nodo del seno e delle fibre di conduzione atriale e
ventricolare, rimangono invece funzionanti, e questo permette la conduzione dell’impulso.
Nel caso in questione l’assenza della depolarizzazione atriale (assenza di onde P) è associata ad un ritmo
irregolare. Tale riscontro è probabilmente dovuto all’influenza del sistema nervoso autonomo sul nodo del
seno. Infatti, in corso d’iperkaliemia, l’impulso origina a livello di nodo del seno e si propaga normalmente
ai miocardiociti atriali, i quali però non possono depolarizzarsi, e al nodo atrio-ventricolare attraverso le vie
internodali.
Tuttavia in caso di gravi aumenti sierici di potassio anche l’automatismo del nodo del seno si può deprimere
ed in questi casi il ritmo cardiaco è governato da ritmi di scappamento giunzionali e ventricolari.
In genere, i segni elettrocardiografici precoci che si possono riscontrare in caso d’iperkaliemia è un’onda T
che assume un aspetto definito “a tenda”, con branche simmetriche e con aumento di durata e ampiezza,
seguito da un aumento della durata dei complessi QRS ed una scomparsa progressiva dell’onda P. In corso
di grave iperkaliemia si può assistere a fibrillazione ventricolare ed arresto cardiaco. Sfortunatamente esiste
solo un’approssimativa correlazione tra valori sierici di potassio e le alterazioni elettrocardiografie, in
quanto, molto spesso si tratta di pazienti con altri squilibri elettrolitici e alterazioni acido-base associate, le
quali a loro volta possono alterare il ritmo cardiaco.
La terapia dell’iperkaliemia è spesso multimodale e dipende dalla concentrazione di potassio, dalla causa
sottostante e dalla presenza di alterazioni elettrocardiografiche. Nel nostro caso l’aumento del potassio era
dovuto ad un quadro d’insufficienza renale acuta secondaria ad intossicazione d’uva. Si è iniziata quindi una
fluidoterapia spinta e, date le alterazioni elettrocardiografiche riscontrate, si è somministrato un bolo di
calcio gluconato al 20%. La terapia con calcio serve per aumentare il valore del potenziale soglia, in modo
da ristabilire la differenza tra quest’ultimo e il potenziale di riposo. Successivamente alla somministrazione
di calcio, l’elettrocardiogramma di Peggy è tornato nella norma. Tuttavia il calcio ha azione cardioprotettiva
della durata di circa 30 minuti e non determina una riduzione della concentrazione sierica di potassio. A tale
scopo, è consigliata la somministrazione di insulina e glucosio al 50% per stimolare i canali del potassio ATPdipendenti e determinare così la traslocazione del potassio dallo spazio extracellulare al compartimento
intracellulare. Per cercare inoltre di ridurre il valore della pressione sistemica è stata introdotta
l’amlodipina. Tuttavia, in seguito al rifiuto dei proprietari di iniziare una emodialisi ed in seguito al mancato
miglioramento del paziente, si è giunti, dopo circa 24 ore, all’eutanasia.
BIBLIOGRAFIA – Diagnosi, terapia e discussione
•
Cortinovis C, Caloni F. Household Food Items Toxic to Dogs and Cats. Front Vet Sci. 2016 Mar
22;3:26.
•
Jung S, Jandrey KE. Hyperkalemia secondary to renal hypoperfusion in a dog with third-degree
atrioventricular block. J Vet Emerg Crit Care (San Antonio). 2012 Aug;22(4):483-7.
•
Johns SM, Stern JA, Nelson OL. ECG of the month. Hyperkalemia. J Am Vet Med Assoc. 2011 Apr
15;238(8):982-4.
•
Schaer M. Therapeutic approach to electrolyte emergencies. Vet Clin North Am Small Anim Pract.
2008 May;38(3):513-33.J
Caso 7: DIAGNOSI, TERAPIA E DISCUSSIONE
Il blocco atrio-ventricolare è un disturbo del sistema di conduzione che si verifica a livello di tessuto atrioventricolare. Esistono tre tipi di blocco atrio-ventricolare:
- Blocco atrio-ventricolare di I grado: ritardo della conduzione atrio-ventricolare, caratterizzato da un
prolungamento dell’intervallo PQ;
- Blocco atrio-ventricolare di II grado, a sua volta suddiviso in 4 tipi:
o
tipo Wenckebach: progressivo rallentamento della conduzione atrio-ventricolare fino al
completo blocco di un impulso. Corrisponde nell’ECG al progressivo prolungamento
dell’intervallo PQ fino alla comparsa di un’onda P bloccata (cioè non seguita dal complesso
QRS);
o
tipo Mobitz: blocco improvviso di un impulso, senza allungamento dell’intervallo PQ
o
tipo 2:1 conduzione di un impulso ai ventricoli ogni 2 (2 onde P per un complesso QRS)
o
tipo avanzato: presenza di più di 2 onde P non condotte (≥ 3 onde P per un complesso QRS)
- Blocco atrio-ventricolare di III grado: nessun impulso atriale è in grado di depolarizzare i ventricoli,
quindi si rileva una completa dissociazione atrio-ventricolare, come nel nostro caso clinico. Nessun
impulso atriale riesce a raggiungere il ventricolo, che viene depolarizzato attraverso un segnapasso
sussidiario, che di solito ha una frequenza di scarica inferiore rispetto a quella atriale.
Il blocco atrio-ventricolare di III grado è spesso associato a degenerazioni fibro-adipose del nodo atrioventricolare, ma è stato descritto anche in corso di miocarditi, infestazioni parassitarie, endocarditi
batteriche, patologie immunomediate, neoplasie e trauma toracico.
Nel caso appeno descritto, gli esami del sangue completi e le analisi strumentali eseguite (studio
radiografico del torace, ecocardiografia ed ecografia dell’addome), non hanno rilevato alcuna anormalità o
causa potenziale di blocco atrio-ventricolare, per cui la diagnosi più probabile è stata quella di una
degenerazione del sistema di conduzione cardiaco.
Tale aritmia è spesso causa di sincopi, debolezza e astenia, per una riduzione della portata cardiaca e per
un’alterata relazione temporale tra contrazione atriale e contrazione ventricolare. Nel nostro caso, il
paziente oltre ad avere debolezza e astenia, presentava anche diarrea, sintomo anch’esso probabilmente
secondario alla riduzione della portata cardiaca. Si assiste infatti ad un’ipossigenazione dei villi intestinali
con conseguente necrosi ischemica e disintegrazione della punta o talvolta, dell’intero villo, con
conseguente diarrea.
In corso di blocco atrio-ventricolare di III grado, la terapia salvavita è l’impianto del pacemaker.
Un pacemaker impiantabile è un disposi^vo che invia uno s^molo ele_rico controllato al muscolo cardiaco
al fine di mantenere un efficace ritmo cardiaco per un lungo periodo di tempo, garantendo una prestazione
emodinamica efficace. Si possono individuare tre elementi funzionali principali di un pacemaker
impiantabile: il generatore di impulsi, la ba_eria e il sistema ele_rocatetere più ele_rodo. Il generatore di
impulsi è il vero e proprio pace-maker e fornisce il segnale di uscita, che viene inviato alla muscolatura
cardiaca. La connessione ele_rica tra il cuore e il generatore di impulsi è fornita dall’ele_rocatetere, che ha
in punta l’elettrodo fissato al muscolo cardiaco (di solito ventricolo destro). Al fine di iden^ficare in modo
universale il ^po e la modalità di funzionamento del pacemaker è stato definito un codice universale
composto da almeno 3 lettere (da 3 a 5). La prima posizione indica la camera stimolata, la seconda indica la
camera rilevata, infine la terza identifica il comportamento del pacemaker al rilevamento dell’a`vità
ele_rica. Il pacemaker può rispondere in due modi: inibizione (Inhibited) o innesco (Triggered). Nel nostro
caso è stato impiantato un pacemaker con modalità di funzionamento VVI. Ciò significa che la camera
stimolata è il Ventricolo, la camera rilevata è anch’essa il Ventricolo e la modalità di risposta del pacemaker
all’attività rilevata è l’Inibizione, cioè non stimola la camera sentita.
L’impianto del pacemaker endocardico viene eseguito mediante chirurgia mininvasiva, facendo passare
l’elettrocatere attraverso la vena giugulare di destra, fino a raggiungere il ventricolo destro. La batteria di
solito viene posizionata a livello sottocutaneo della regione del collo.
Le complicazioni di tale intervento si possono suddividere in complicazioni maggiori (quelle che possono
causare la morte del paziente) e complicazioni minori (formazione di sieroma nel sito d’impianto, aritmie
minori e lievi emorragie). In uno studio del 2006 le complicazioni per l’impianto di pacemaker su 105 cani
sono state per il 13% complicazioni maggiori (dislocazioni dell’elettrodo, problemi di “sensing” dell’attività
cardiaca intrinseca, gravi emorragie e fibrillazione ventricolare durante l’impianto) e per l’11%
complicazioni minori. In questo studio nessun paziente è morto nelle 48 ore successive all’impianto.
Nel nostro paziente abbiamo assistito alla formazione di un sieroma nel sito d’accesso chirurgico una
settimana dopo l’impianto, che poi si è riassorbito nei giorni successivi. I controlli eseguiti successivamente
sono stati radiografia del torace, ecocardiografia, ECG ed interrogazione dell’attività del pacemaker, che
sono sempre stati nella norma. Blanko è ancora vivo ed in buona salute dopo 4 anni dall’impianto.
BIBLIOGRAFIA – Diagnosi, terapia e discussione
•
Santilli RA, Porteiro Vàzquez DM, Vezzosi T, Perego M. Long-term Intrinsic Rhythm Evaluation in
Dogs with Atrioventricular Block. J Vet Intern Med. 2016 Jan-Feb;30(1):58-62.
•
Schrope DP, Kelch WJ. Signalment, clinical signs, and prognostic indicators associated with highgrade second- or third-degree atrioventricular block in dogs: 124 cases (January 1, 1997-December
31, 1997). J Am Vet Med Assoc. 2006 Jun 1;228(11):1710-7.
•
Wess G, Thomas WP, Berger DM, Kittleson MD. Applications, complications, and outcomes of
transvenous pacemaker implantation in 105 dogs (1997-2002). J Vet Intern Med. 2006 JulAug;20(4):877-84.
Caso 8: DIAGNOSI, TERAPIA E DISCUSSIONE
La cardiomiopatia aritmogena del ventricolo destro è una patologia del miocardio ventricolare
caratterizzata dalla perdita della normale struttura e funzione del miocardio, in seguito ad una sostituzione
adiposa o fibro-adiposa dei miocardiociti, con conseguente insorgenza di aritmie ventricolari e disfunzione
sistolica del ventricolo destro. Nell’uomo il 50% dei pazienti affetti presenta una mutazione dei geni che
codificano per i desmosomi, particolari giunzioni cellulari. Nel cane, tale mutazione non è stata riscontrata,
tuttavia è stata identificata una riduzione dell’espressione dei recettori cardiaci della rianodina e una
riduzione della calstabina2. Tali proteine sono necessarie per la corretta regolazione dell’omeostasi del
calcio intracellulare, il quale svolge un ruolo critico per il mantenimento della normale contrattilità e ritmo
cardiaco. In aggiunta nei Boxer è stato riscontrato un deficit delle proteine delle gap-junction e dei dischi
intercalari, nonchè la mutazione della striatina, una proteina localizzata a livello di dischi intercalari.
L’ipotesi eziopatogenetica più accreditata è che l’alterazione di tali strutture porti ad un’alterata adesione
cellula-cellula, morte dei miocardiociti e successiva sostituzione fibro-adiposa del tessuto.
Ne consegue un’anomala depolarizzazione e ripolarizzazione dei miocardiociti, che promuove l’insorgenza
di aritmie ventricolari e, meno comunemente, aritmie sopraventricolari. Il meccanismo fisio-patologico di
tali alterazioni elettrocardiografiche sono di solito la formazione di circuiti anatomici di rientro e aree di
esaltato automatismo anormale.
Le ectopie ventricolari che si rilevano durante tale patologia sono spesso caratterizzate da complessi
prematuri ventricolari ad alto grado di organizzazione, con lembi di tachicardia ventricolare sostenuta e non
e di solito a carattere iterativo.
Inoltre la morfologia di tali complessi è di solito di tipo blocco di branca sinistra, in quanto i cambiamenti
istologici sono predominanti nel ventricolo di destra. Tuttavia studi istopatologici nell’uomo, nel cane e nel
gatto, hanno evidenziato un coinvolgimento anche del ventricolo di sinistra. Per questo motivo, se vi è
anche un coinvolgimento del setto interventricolare e di parti del ventricolo di sinistra, l’aritmia può avere
diversi foci d’origine e presentarsi quindi come complessi ventricolari prematuri polimorfi. Nel nostro caso,
l’esame Holter ha rilevato ectopie ventricolari monomorfe, ad elevato grado di organizzazione. Tale reperto
ci ha fatto sospettare il coinvolgimento del solo miocardio di destra, anche se la diagnosi definitiva è solo
possibile con l’esame istopatologico post-mortem.
L’esame Holter è il metodo d’elezione e meno invasivo per la diagnosi di tale patologia, soprattutto se non
sono ancora presenti alterazioni morfo-funzionali del ventricolo destro all’esame ecocardiografico e se le
aritmie presenti hanno carattere intermittente. Infatti si parla di cardiomiopatia aritmogena del ventricolo
destro qualora, in assenza di patologie extra-cardiache causanti complessi ventricolari prematuri, sia
presente uno di questi criteri all’esame Holter:
•
presenza di più di 300 complessi ventricolari prematuri nell’arco di 24 ore;
•
presenza di 51-300 complessi ventricolari prematuri con criteri di malignità (lembi di tachicardia
ventricolare, coppie o triplette nell’arco delle 24 ore).
Qualora siano presenti meno di 50 complessi ventricolari prematuri nelle 24 ore, il paziente si considera
esente dalla patologia e l’esame Holter deve essere ripetuto annualmente, mentre se i complessi
ventricolari prematuri fossero di numero tra 51 e 300 nelle 24 ore, l’Holter dovrà essere ripetuto dopo 6
mesi, in quanto il paziente viene considerato borderline per la patologia.
Nel nostro caso, l’ECG di superficie, ha rilevato la presenza di bigeminismo ventricolare, mentre l’esame
Holter ha evidenziato la presenza di circa 35000 complessi ventricolari prematuri ad alto grado di
organizzazione con la presenza di circa 2000 lembi di tachicardia ventricolare monomorfa e spesso
sostenuta.
Inoltre tale mezzo diagnostico non solo serve per una corretta diagnosi, ma viene anche utilizzato per
valutare l’efficacia del trattamento antiaritmico che spesso si instaura, e la progressione della patologia.
In Gennaro la terapia che si è instaurata ha previsto una terapia cardiologica per lo scompenso cardiaco
destro, rappresentata da furosemide 2 mg/kg BID, benazepril 0.25 mg/kg BID, spironolattone 2 mg/kg SID e
pimobendan 0.25 mg/kg BID, associata ad una terapia antiaritmica con sotalolo 1mg/kg BID.
Nell’uomo la terapia medica è il trattamento di prima scelta per le tachicardia ventricolari, in particolare
farmaci anti-aritmici di classe III, quali amiodarone e sotalolo. Nei Boxer l’utilizzo del sotalolo in
monoterapia o in combinazione con mexiletina o atenololo, è stato descritto essere un trattamento efficace
per la gestione di tale patologia. Tuttavia non c’è evidenza che l’utilizzo di farmaci anti-aritmici possa
ridurre il rischio di morte improvvisa e a volte, l’utilizzo di tali farmaci, potrebbe avere effetti pro-aritmici.
Per questo, i rischi e i benefici di un trattamento anti-aritmico dovrebbero essere attentamente considerati
e discussi con il proprietario, prima di iniziare la terapia. Nel nostro paziente, 10 giorni dopo l’inizio del
trattamento anti-aritmico, è stato eseguito un controllo Holter, che ha rilevato la marcata riduzione delle
ectopie ventricolari e la scomparsa dei lembi di tachicardia ventricolare. La proprietaria inoltre non ha più
riportato episodi di debolezza. Nei mesi successivi la terapia cardiologica è stata modificata e intensificata
di pari passo alla progressione della patologia. Gennaro è morto circa 7 mesi dopo, di morte improvvisa e
l’autopsia eseguita ha confermato la diagnosi di cardiomiopatia aritmogena del ventricolo destro.
BIBLIOGRAFIA – Diagnosi, terapia e discussione
•
Meurs KM, Spier AW, Wright NA et al. Comparison of the effects of four antiarrhythmic treatments
for familial ventricular arrhythmias in Boxers. J Am Vet Med Assoc. 2002 Aug 15;221(4):522-7.
•
Romito G, Baron Toaldo M, Diana A, Cipone M. ECG of the Month. Arrhythmogenic right ventricular
cardiomyopathy. J Am Vet Med Assoc. 2015 Sep 1;247(5):484-6.
•
Santilli RA, Ramera L, Baron Toaldo M et al. La cardiomiopatoa aritmogena del ventricolo destro nel
Bulldog Inglese: una patologia emergente. Veterinaria. 2014 Giugno 3: 7-15.
•
Spier AW1, Meurs KM. Evaluation of spontaneous variability in the frequency of ventricular
arrhythmias in Boxers with arrhythmogenic right ventricular cardiomyopathy. J Am Vet Med Assoc.
2004 Feb 15;224(4):538-41.
Caso 9: DIAGNOSI, TERAPIA E DISCUSSIONE
Il blocco di branca sinistro è un disturbo della conduzione intraventricolare caratterizzato
elettrocardiograficamente da complessi QRS con MEA nella norma e durata marcatamente aumentata (>80
msec) con assenza o meno di onde Q in DI (onda negativa che precede l’onda R).
Anatomicamente il sistema di conduzione intraventricolare è formato dal fascio atrio-ventricolare distale, il
quale è una continuazione del nodo atrio-ventricolare. Da esso nascono due branche: la branca destra e
quella sinistra. Quest’ultima, a sua volta, è formata da due fascicoli: quello antero-superiore e quello
caudo-inferiore. Si parla di blocco di branca quando l’impulso si arresta in una o più ramificazioni. In base
alla localizzazione del blocco nelle branche, si possono riconoscere:
•
•
•
blocco di branca destro: complesso QRS con MEA deviato a destra fino a -80° e durata aumentata o
meno in base alla sede del blocco (blocco completo o incompleto rispettivamente);
blocco del fascicolo antero-superiore sinistro: complesso QRS con MEA deviato a sinistra, tra -30° e
-60°, e durata normale o lievemente aumentata (tra 70 e 80 msec);
blocco del fascicolo caudo-inferiore sinistro: non sempre diagnosticabile con l’elettrocardiogramma
di superficie, il complesso QRS presenta MEA deviato a destra tra 100° e 120°.
Questi tipi di blocchi vengono definiti MONOFASCICOLARI, in quanto il blocco coinvolge una sola
ramificazione (la branca destra o uno dei due fascicoli della branca sinistra).
Questi devono essere differenziati dai blocchi BIFASCICOLARI e dai blocchi TRIFASCICOLARI.
Dei primi fanno parte:
•
•
•
blocco di branca sinistro: si veda il testo per la spiegazione;
blocco di branca destro associato al blocco del fascicolo anteriore sinistro: in questo caso la
depolarizzazione viene bloccata sia nella branca destra, sia nella divisione anteriore della branca
sinistra. L’elettrocardiogramma sarà caratterizzato da un complesso QRS con durata superiore a 80
msec e MEA deviato a sinistra tra -60° e -90°;
blocco di branca destro associato al blocco del fascicolo posteriore sinistro: come nel blocco del
fascicolo posteriore, tale alterazione si può solo sospettare dal tracciato elettrocardiografico se si è
in presenza di alterazioni compatibili con blocco di branca destro completo e MEA del complesso
QRS deviato inferiormente e verso destra, assenza di onde Q in DI e aVL e presenza delle stesse in
DII, DIII e aVF.
Un’ulteriore classificazione del blocco di branca sinistro può essere eseguita in base al sito del blocco a
livello di branca sinistra. Questo si definisce tronculare quando il blocco coinvolge la porzione predivisionale della branca sinistra; si definisce divisionale se il blocco coinvolge entrambi i fascicoli della
branca sinistra; infine si definisce parietale, quando la sede del blocco è a livello di ramificazioni distali delle
fibre del Purkinje. Sull’ECG di superficie i sottotipi tronculare e divisionale sono caratterizzati solitamente
dall’assenza dell’onda Q in DI, in quanto manca la depolarizzazione del setto interventricolare, che è
normalmente mediata dalla prima ramificazione della branca di sinistra. Tuttavia nel cane l’onda Q può
essere presente anche nei blocchi divisionali o tronculari, poiché si può assistere a una depolarizzazione
precoce del setto interventricolare che origina dalla parete ventricolare di destra. Nel tracciato
elettrocardiografico di Alice, data la presenza dell’onda Q in DI, non è stato possibile identificare con
esattezza l’origine del blocco.
Dal punto di vista eziologico i blocchi di branca si possono distinguere in:
•
•
•
anatomico: per lesioni del sistema di conduzione;
funzionale: quando un complesso sopraventricolare prematuro raggiunge il normale sistema di
conduzione intraventricolare e trova una branca in stato refrattario;
frequenza-dipendente: avviene dopo una variazione improvvisa della frequenza cardiaca e
possono essere bradicardia-dipendente o tachicardia-dipendente.
Nel nostro caso, l’assenza di complessi sopraventricolari prematuri o di variazioni della frequenza cardiaca,
ha indicato un blocco di tipo anatomico.
Tale alterazione è spesso associata a quadri di cardiomiopatie ipocinetiche-dilatative con insufficienza
cardiaca congestizia. Tuttavia altre cause di blocco includono: ipertrofia cardiaca, trauma, neoplasia, stenosi
sub-aortica e malattie infiammatorie o degenerative del tessuto di conduzione.
Le aritmie cardiache sono considerate rare complicazioni in corso di piometra (circa l’1%). Esse possono
presentarsi in seguito all’insorgenza di un danno miocardico secondario a batteriemia, setticemia,
endotossiemia o SIRS i quali, a loro volta, possono essere indotti dall’infezione uterina. Inizialmente, nel
nostro caso, non si poteva escludere che il blocco di branca sinistro fosse indotto da uno stato
infiammatorio sistemico, che avesse coinvolto secondariamente anche il sistema di conduzione cardiaco.
Tuttavia dopo terapia chirurgica (ovarioisterectomia) e antibiotica (amoxicillina + acido clavulanico 20
mg/kg BID per 10 giorni post-chirurgia) con risoluzione dello stato infiammatorio, il disturbo di conduzione
intraventricolare è continuato a persistere nei controlli elettrocardiografici successivi (fino a 6 mesi dopo).
Inoltre, per queste ragioni, associate all’assenza di alterazioni ecocardiografiche, si è sospettato, come
causa del blocco, un processo degenerativo a livello di sistema di conduzione.
BIBLIOGRAFIA – Diagnosi, terapia e discussione
•
Jitpean S, Ström-Holst B, Emanuelson Uet al. Outcome of pyometra in female dogs and predictors
of peritonitis and prolonged postoperative hospitalization in surgically treated cases. BMC Vet Res.
2014 Jan 7;10:6.
•
Santilli RA, Perego M. Elettrocardiografia del cane e del gatto. Elsevier. 2009.
Caso 10: DIAGNOSI, TERAPIA E DISCUSSIONE
Le onde QRS e T rappresentano la depolarizzazione e la ripolarizzazione ventricolare, quindi l’intervallo QT
rappresenta la totale durata della depolarizzazione e della ripolarizzazione ventricolare dell’intero ciclo
cardiaco. In circostanze normali, l’intervallo QT è primariamente determinato dall’influenza del sistema
nervoso autonomo e varia in maniera inversamente proporzionale alla frequenza cardiaca. Molti metodi
sono stati valutati per il corretto calcolo dell’intervallo QT, basandosi sulla frequenza cardiaca; tuttavia tali
misurazioni sono state effettuate per l’uomo e per il cane, mentre nel gatto non sono state testate formule
per correggere l’intervallo QT. La sua durata deve essere quindi compresa tra 70 e 200 msec.
Un intervallo QT, il cui valore è superiore ai limiti della norma, come nel nostro paziente, può essere
primario (sindrome del QT lungo congenita) o secondario (sindrome del QT lungo acquisita). La sindrome
del QT lungo congenita è causata dalla variazione di diversi geni che causano mutazioni dei canali ionici
cardiaci e negli animali è stata descritta in topi transgenici ed in una famiglia di English Springer Spaniel. Nel
gatto tale sindrome non è mai stata descritta. La forma acquisita invece può essere secondaria alla
somministrazione di alcuni farmaci (es. chinidina, procainamide, sotalolo), ritardo della conduzione
intraventricolare, ipotermia, patologie del sistema nervoso o squilibri elettrolitici (ipocalcemia, ipokaliemia,
ipomagnesemia).
Nel nostro caso, il prolungamento del QT, è stato imputato alla grave ipocalcemia ionica evidenziata
dall’emogasanalisi in ingresso. Tale ipotesi è stata anche supportata dal fatto che tale intervallo è tornato
entro i range di riferimento dopo l’aumento del calcio ionico, in seguito all’infusione di calcio gluconato.
Il calcio ha un ruolo fondamentale nella corretta funzionalità cardiaca in quanto svolge 2 funzioni
fondamentali: l’accoppiamento eccitazione-contrazione dei miocardiociti e la normale formazione del
potenziale d’azione.
Si definisce potenziale d’azione una rapida variazione del potenziale di membrana dei miocardiociti che
passa dal valore negativo di riposo (circa -90 mV) ad un valore positivo (fino a +40 mV), per poi tornare al
valore iniziale. Esso è composto da 5 fasi, associate a variazioni della conduttanza della membrane cellulare
per alcuni ioni, in particolare il sodio, il potassio ed il calcio.
La prima fase del potenziale d’azione viene definita fase 0 ed è caratterizzata da una rapida
depolarizzazione della membrana in seguito all’ingresso di ioni sodio nella cellula, con il raggiungimento di
un potenziale positivo fino a +40 mV. La successiva è la fase 1 ed è caratterizzata da una breve
ripolarizzazione che rispecchia in parte l’effetto dell’inattivazione dei canali rapidi del sodio, ma soprattutto
l’apertura dei canali del potassio, che permettono a questi ioni di uscire dalla cellula, riportando il
potenziale ad un valore più negativo. In seguito si ha la fase che viene definita “di plateau”, ossia la fase 2.
In questa fase gli ioni calcio entrano nella cellula e gli ioni potassio fuoriescono secondo gradiente di
concentrazione. In questo modo il valore del potenziale di membrana rimane costante durante questa fase,
in quanto vi è un bilanciamento tra cariche positive che escono dalla cellula (potassio) e cariche positive che
vi entrano (calcio). Successivamente, si passa alla fase 3, in cui si riduce la conduttanza degli ioni calcio ed
aumenta l’uscita degli ioni potassio. Questo meccanismo rende negativo l’interno della cellula rispetto
all’esterno. Questa fase è definita di “ripolarizzazione”. Infine durante la fase 4 il potenziale di riposo verrà
mantenuto e regolato da tre pompe ioniche (Na+/K+-ATPasi, Na+/Ca2+-ATPasi e Ca2+-ATPasi) e dalla corrente
in uscita di ioni potassio.
Il calcio quindi ha un’azione fondamentale durante la fase 2 o fase di plateau del potenziale d’azione.
L’ipocalcemia infatti può indurre un prolungamento di tale fase con conseguente prolungamento del QT.
Le complicazioni che ne possono conseguire dal punto di vista aritmologico sono di artimie ventricolari,
quali tachicardia ventricolare e torsioni di punta, la quale può degenerare in fibrillazione ventricolare e
morte. Nel nostro paziente tali complicazioni non sono state riscontrate.
Le cause di ipocalemia nel gatto sono molteplici quali insufficienza renale acuta, chetoacidosi diabetica,
intossicazione da glicole etilenico, eclampsia, sepsi, trauma, ostruzione uretrale, pancreatite e tumor lysis
syndrome. Nel nostro caso la causa dell’ipocalcemia è stata imputata al quadro di pancreatite evidenziato.
Infatti tale reperto è presente nel 43-61% dei gatti con pancreatite acuta e rappresenta un fattore
prognostico negativo. I meccanismi proposti per tale alterazione elettrolitica in corso di pancreatite acuta
sono l’aumento degli acidi grassi liberi, i quali chelano il calcio e il sequestro del calcio nei tessuti molli o nel
grasso peripancreatico, come risultato della saponificazione.
Nel nostro paziente dopo la stabilizzazione attraverso fluidoterapia endovenosa e bolo di calcio gluconato
endovenoso, è stata successivamente impostata, una terapia sintomatica a base di pantoprazolo (1 mg/hk
EV BID), buprenorfina (15 mcg/kg ogni 4 ore) e maropitant (1 mg/kg SC SID). Dopo circa 12 ore è stata
inoltre eseguita una trasfusione di plasma in seguito alla progressiva riduzione delle albumine e
all’insorgenza di dispnea. Lo studio radiografico del torace eseguito per l’insorgenza di questo nuovo
sintomo ha messo in evidenza un pattern polmonare alveolare diffuso compatibile in prima ipotesi con
ARDS (acute respiratory distress syndrome). E’ stata tuttavia eseguita anche un’ecocardioscopia per
escludere che tale sintomo fosse legato ad uno scompenso cardiaco. Tale indagine è risultata essere
negativa. Ivy è morta circa il giorno seguente.
BIBLIOGRAFIA – Diagnosi, terapia e discussione
•
Chatterjee K, Anderson M, Heistad et al. Cardiology An Illustrated Textbook. Jaypee Brothers
Medical Publishers. 2013.
•
Holowaychuk MK. Hypocalcemia of Critical Illness in Dogs and Cats. Vet Clin Small Anim 43
(2013) 1299–1317.
•
Santilli RA, Perego M. Elettrocardiografia del cane e del gatto. Elsevier. 2009.