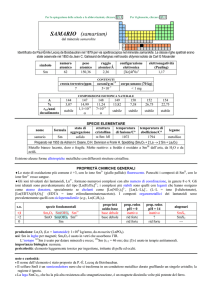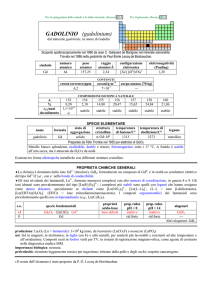
NOMENCLATURA SALI TERNARI
Prima di chiarire il tema della nomenclatura dei Sali ternari occorre ricordare come si formano gli ossiacidi
e le basi o idrossidi
Fai attenzione a tutti gli argomenti che ora esporrò
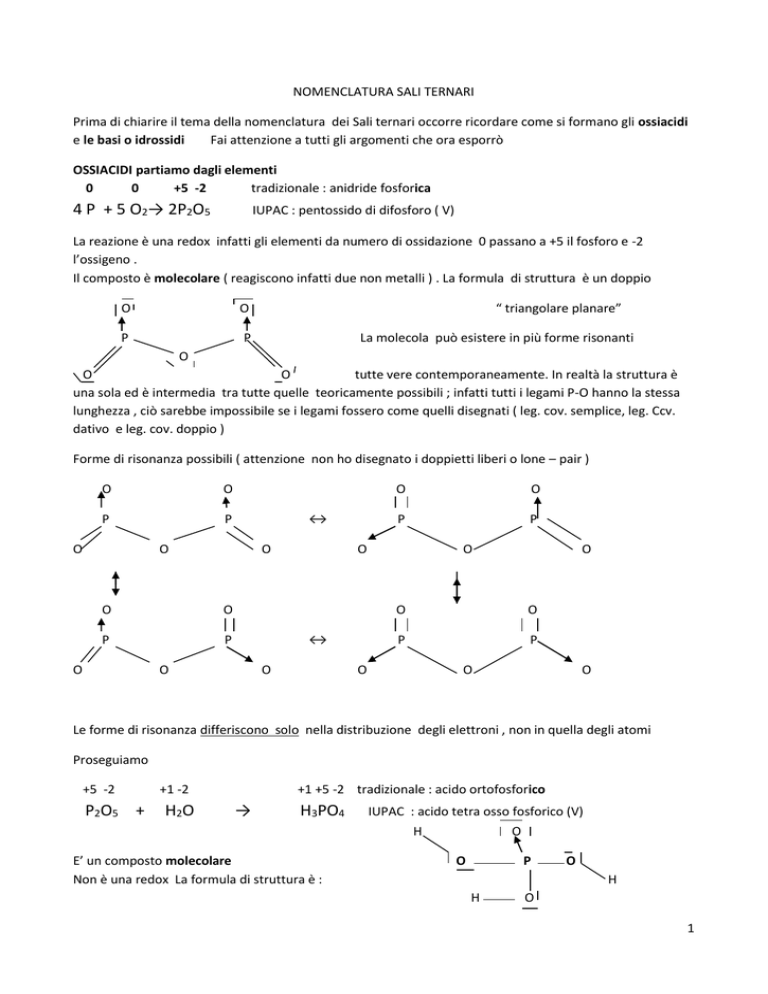
OSSIACIDI partiamo dagli elementi
0
0
+5 -2
tradizionale : anidride fosforica
4 P + 5 O2→ 2P2O5
IUPAC : pentossido di difosforo ( V)
La reazione è una redox infatti gli elementi da numero di ossidazione 0 passano a +5 il fosforo e -2
l’ossigeno .
Il composto è molecolare ( reagiscono infatti due non metalli ) . La formula di struttura è un doppio
O
O
P
P
“ triangolare planare”
La molecola può esistere in più forme risonanti
O
O
O
tutte vere contemporaneamente. In realtà la struttura è
una sola ed è intermedia tra tutte quelle teoricamente possibili ; infatti tutti i legami P-O hanno la stessa
lunghezza , ciò sarebbe impossibile se i legami fossero come quelli disegnati ( leg. cov. semplice, leg. Ccv.
dativo e leg. cov. doppio )
Forme di risonanza possibili ( attenzione non ho disegnato i doppietti liberi o lone – pair )
O
O
P
P
O
↔
O
O
O
O
P
P
O
O
P
P
O
↔
O
O
O
O
O
O
O
P
P
O
O
O
Le forme di risonanza differiscono solo nella distribuzione degli elettroni , non in quella degli atomi
Proseguiamo
+5 -2
P2O5 +
+1 -2
H2O
+1 +5 -2 tradizionale : acido ortofosforico
→
H3PO4
IUPAC : acido tetra osso fosforico (V)
H
E’ un composto molecolare
Non è una redox La formula di struttura è :
O
O
P
O
H
H
O
1
IDROSSIDI O BASI : partiamo dagli elementi
0
2 Ca
0
+
+2 -2 tradizionale : ossido di calcio
O2
→
2 Ca O
IUPAC : ossido di calcio
Ca+2 O-2 Ca+2 O-2
O-2 Ca+2 O-2 Ca+2
O-2 Ca+2 O-2
Il composto è ionico
È una redox
La formula di struttura è
2CaO + H2O → Ca ( OH )2
reticolo cristallino
tradizionale : idrossido di calcio
( II )
UIPAC : di idrossido di calcio
OH- Ca+2 OH- Ca+2 OHOH- Ca+2 OH- Ca+2 OHOH- Ca+2 OHOHOH-
Il composto è ionico
non è una redox
La formula di struttura è
reticolo cristallino
VEDIAMO COSA ACCADE SE METTIAMO GLI OSSIACIDI E LE BASI IN ACQUA
è un acido debole
H3PO4 + H2O
H2PO4- + H3O+ daremo successivamente il nome a questo ione
che è ancora un acido ; anche se è ancora più
H2PO4-
HPO4-2
+ H2O
+
+ H3O
debole di H3PO4
è ancora un acido ; anche se è ancora più
HPO4-2
PO43-
+ H2O
+
+ H3O
debole di
H2PO4-
non è un acido
Struttura dell’ossiacido e degli ioni senza doppietti liberi
O
O
H
H3o+ H3PO4
H2O
HPO42-
PO43-
O
P
O
H
H
H
O
H2PO4-
H
O
H
_
H
O
P
O
+
O
H
H
H
O
2
ed ancora
H
O
O
P
2-
+
O
O
H
H
H
O
O
H
3O
P
O
+
O
H
H
O
base in acqua
Fe ( OH ) 2 + H2O
Fe+2 + 2 OH- + H2O
Anche le basi possono essere forti o deboli ms ne riparleremo più
avanti
OH- Fe+2
H2O
Diamo ora il nome agli anioni che si formano dalla dissociazione in acqua degli
ossiacidi
Esempi
1 - HNO3 : acido nitrico(trad. ) ; acido triossonitrico( V ) si dissocia in NO3- ed H3O+
NO3-
: ione nitrato (trad. ) ; ione triossonitrato ( V )
2 – HNO2 : acido nitroso ; acido diossonitrico( III ) si dissocia in NO2- ed H3O+
NO2- : ione nitrito (trad. ) ; ione triossonitrato ( V )
3
Per dare il nome tradizionale allo ione occorre :
1) togliere la parola acido e sostituirla con ione
2 ) sostituire alla desinenza ico la desinenza ato oppure
sostituire alla desinenza oso la desinenza ito oppure
3 ) se rimangono idrogeni nello ione si aggiunge il numero di idrogeni presenti
Per dare il nome IUPAC allo ione occorre :
1) togliere la parola acido e sostituirla con ione
2 ) sostituire alla desinenza ico la desinenza ato ; ciò vale per qualsiasi anione senza alcuna
differenza di numero di ossidazione
3 ) se rimangono idrogeni nello ione si aggiunge il numero di idrogeni presenti
Facciamo altri esempi
Acido / ione
H3PO4
H2PO4HPO42PO43Acido / ione
H3PO3
H2PO3HPO32PO33-
Nom. tradizionale
Acido ortofosforico
Ione diidrogenofosfato
oppure ione fosfato diacido
Ione idrogeno fosfato
oppure ione fosfato acido
Ione fosfato
Nom. IUPAC
Acido tetraossofosforico (V)
Ione tetraossodiidrogenofosfato(V)
Nom. tradizionale
Acido ortofosforoso
Ione diidrogenofosfito
oppure ione fosfito diacido
Ione idrogeno fosfito
oppure ione fosfito acido
Ione fosfito
Nom. IUPAC
Acido triossofosforico (III)
Ione triossodiidrogenofosfato(III)
Ione tetraossoidrogenofosfato (V)
Ione tetraossofosfato(V)
Ione triossoidrogenofosfato (III)
Ione triossofosfato(III)
*Per i due acidi che seguono e per tutti gli acidi diprotici una vecchia nomenclatura ancora in uso
prevede che lo ione che si forma per la perdita di un solo protone , prenda il prefisso bi- ; da cui
bisolfito, bisolfato , bicarbonato ai seguenti ioni HSO3-, HSO4-, HCO3-,
Acido / ione
H2SO4
HSO4-
SO42-
Nom. tradizionale
Acido solforico
Ione idrogeno solfato
oppure ione solfato acido
oppure ione bisolfato *
Ione solfato
Nom. IUPAC
Acido tetraossosolforico (VI)
Ione tetraossoidrogenosolfato (VI)
Ione tetraossosolfato(VI)
4
Acido / ione
H2SO3
HSO3-
SO32-
Nom. tradizionale
Acido solforoso
Ione idrogenosolfito
oppure ione solfito acido
oppure ione bisolfito *
Ione solfito
oppure ione fosfito acido
Nom. IUPAC
Acido triossosolforico (IV)
Ione triossoidrogenosolfato(IV)
Ione triossosolfato (IV)
NOME DEI SALI TERNARI
Un sale deriva da una reazione di neutralizzazione . In realtà possono derivare da diversi tipi di
reazioni ma noi ora analizzeremo quella di neutralizzazione
Ossiacido + idrossido ( base )
sale + acqua
Un acido è una specie chimica che in acqua libera ioni H+
Una base è una specie chimica che in acqua libera ioni ossidrile ( OH- ) ed è capace di catturare H+
Esempio
Acido perclorico
acido tetraossoclorico( VII )
HClO4
idrossido di sodio
perclorato di sodio
idrossido di sodio tetraossoclorato (VII) di sodio (I)
+
(aq)
NaOH (aq)
Na+
Cosa si pensa accada ?
O
O
Cl
NaClO4 + H2O
OH_
O
O
H
O
O
Cl
H
O
-
O
Na +
+ H2O +
O
ClO4- = ione perclorato (trad.)
ione tetraossoclorato(VII)
Il sale si chiamerà quindi : tetraossoclorato (VII) di sodio (I)
Per dare il nome ad un sale si deve quindi :
1) dare il nome all’anione
2) togliere il termine ione
3) si aggiunge come complemento di specificazione il nome del metallo ( ° ).
5
° nel nome tradizionale il metallo , se ha più di un numero di ossidazione, prenderà i suffissi –oso, ico. Nel nome IUPAC il metallo si esprimerà attraverso il complemento di specificazione
accompagnato dal numero di ossidazione dell’elemento in numero romano tra
parentesi
Ora prova tu a scrivere la formula del sale con accanto la reazione di
neutralizzazione che lo produce esempio
+2
nitrato rameico: Cu (NO3)2 ; HNO3 + Cu(OH)2
Cu (NO3)2 + H2O
Nitrito di sodio
Carbonato ferrico
Solfato ferrico
Orto fosfito di alluminio
tetraossodiidrogenofosfato(V)calcio (II)
Introduciamo due ioni importanti nei laboratori anche se i loro rispettivi acidi non
sono famosi né utilizzati ma ne troviamo i Sali:
MnO4- : ione permanganato
CrO42-: ione cromato
Sali :
permanganato di potassio
cromato di sodio
6