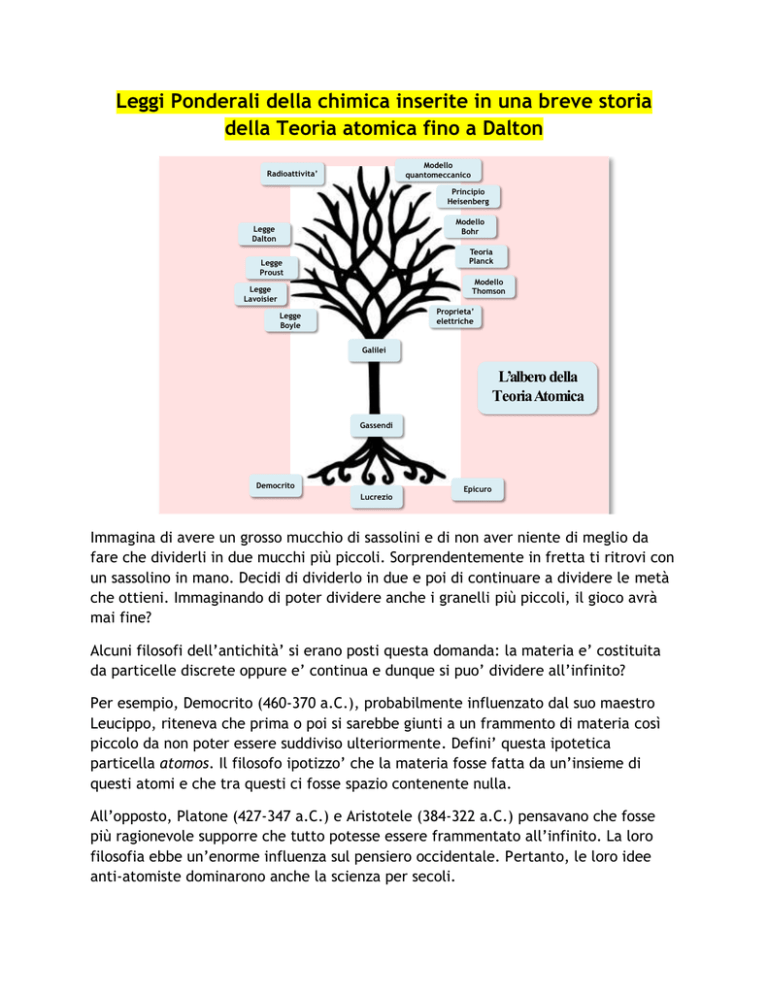
Leggi Ponderali della chimica inserite in una breve storia
della Teoria atomica fino a Dalton
Modello
quantomeccanico
Radioattivita’
Principio
Heisenberg
Modello
Bohr
Legge
Dalton
Teoria
Planck
Legge
Proust
Modello
Thomson
Legge
Lavoisier
Proprieta’
elettriche
Legge
Boyle
Galilei
L’albero della
TeoriaAtomica
Gassendi
Democrito
Lucrezio
Epicuro
Immagina di avere un grosso mucchio di sassolini e di non aver niente di meglio da
fare che dividerli in due mucchi più piccoli. Sorprendentemente in fretta ti ritrovi con
un sassolino in mano. Decidi di dividerlo in due e poi di continuare a dividere le metà
che ottieni. Immaginando di poter dividere anche i granelli più piccoli, il gioco avrà
mai fine?
Alcuni filosofi dell’antichità’ si erano posti questa domanda: la materia e’ costituita
da particelle discrete oppure e’ continua e dunque si puo’ dividere all’infinito?
Per esempio, Democrito (460-370 a.C.), probabilmente influenzato dal suo maestro
Leucippo, riteneva che prima o poi si sarebbe giunti a un frammento di materia così
piccolo da non poter essere suddiviso ulteriormente. Defini’ questa ipotetica
particella atomos. Il filosofo ipotizzo’ che la materia fosse fatta da un’insieme di
questi atomi e che tra questi ci fosse spazio contenente nulla.
All’opposto, Platone (427-347 a.C.) e Aristotele (384-322 a.C.) pensavano che fosse
più ragionevole supporre che tutto potesse essere frammentato all’infinito. La loro
filosofia ebbe un’enorme influenza sul pensiero occidentale. Pertanto, le loro idee
anti-atomiste dominarono anche la scienza per secoli.
Tuttavia, gli atomisti continuarono a diffondere le loro idee, prima attraverso Epicuro
(341-270 a.C.), poi con Lucrezio (95-55 a.C.). Lucrezio, come appare evidente nel
seguente brano, intuì la possibilità di spiegare la materia e la natura esclusivamente
attraverso fenomeni naturali e descrisse un’immagine del mondo atomico
sorprendentemente simile alla nostra.
Gli atomi certo non si disposero in ordine ne’ per volere ne’ per fisso disegno
ne’ s’accordaron fra loro sui moti, che avrebbe ciascuno impresso al suo
corso. Ma in mille maniere da tempo infinito, muovendosi, glia atomi, urtati
da colpi e spinti e portati dallo stesso lor peso, in mille maniere si unirono
tentando aggruppati forme di vita: accadde così che agitati nel tempo,
provocando ogni specie d’incontro e di moto, pervennero infine a quel nesso
improvviso, a questa che fu la materia dei mondi, cioè della terra e del mare e
del cielo e del genere umano e animale. (Lucrezio, De Rerum Natura, V 419434)
Lucrezio ebbe un grande successo, ma nei secoli successivi con la diffusione del
Cristianesimo fu bollato come pensatore ateo. Le sue opere furono distrutte o
andarono perdute. Una sola sopravvisse e fu scoperta da Poggio Bracciolini nel 1417.
Mezzo secolo più tardi venne inventata la stampa e l’opera di Lucrezio fu uno dei
primi testi a essere pubblicati. Successivamente, fu il filosofo francese Gassendi
(1592-1655) a diffondere nel mondo occidentale l’opera di Lucrezio e la teoria
atomista.
Con l’affermarsi del metodo galileiano, l’atomismo, che nei 2000 anni che vanno da
Democrito a Gassendi era stato argomento di interminabili discussioni tra filosofi,
diventò oggetto di verifiche sperimentali. Nel 1662, Boyle, uno scienziato inglese,
realizzò un esperimento che in qualche modo suggeriva la realtà della materia
atomica. Egli si servì di un tubo di vetro a forma di J, col braccio corto chiuso e quello
lungo aperto. Boyle versò nell’apertura una certa quantità di Hg e osservò che
raddoppiando l’altezza di Hg il volume dell’aria imprigionata nel lato corto si
dimezzava (Legge di Boyle o legge isoterma).
La scoperta di Boyle non e’ una prova dell’esistenza degli atomi, tuttavia il
comportamento dell’aria sotto pressione si spiega facilmente se si accetta l’esistenza
degli atomi così come li aveva immaginati Democrito e cioè circondati dal vuoto.
Si puo’ infatti ipotizzare che l’aumento della pressione riduce lo spazio occupato da
vuoto.
Così, dopo Boyle accettare l’idea di Democrito, cioè l’idea che la materia non e’
continua, ma e’ formata da particelle microscopiche, diventò più facile.
Nell’arco del successivo secolo e mezzo, si sviluppò la chimica sperimentale che
indagava la materia col metodo galileiano con lo scopo anche di scoprire non solo gli
elementi che costituivano le varie sostanze, ma anche le loro quantità. In particolare,
tre furono i più importanti momenti della storia della chimica che diedero le basi
sperimentali all’ ipotesi atomista.
Il primo, nel 1789, e’ rappresentato dalla scoperta di Lavoisier (1743-1794), che da
scienziato galileiano affermava:
Mi son dato come legge di procedere sempre dal noto all’ignoto, e di non fare
alcuna deduzione che non sgorghi direttamente dagli esperimenti e
dall’osservazione.
La sua scoperta e’ quella che oggi noi chiamiamo la legge della conservazione della
massa. In altre parole, riuscì a dimostrare che le masse delle sostanze che reagiscono
in una qualsiasi reazione sono uguali a quelle dei prodotti che si formano nella stessa
reazione.
Il secondo e’ rappresentato dalla scoperta di Proust (1754-1826). Proust, nel 1799,
prese un campione di carbonato di rame e lo scompose nei suoi 3 elementi: Cu, C e O.
Scoprì che tutti i suoi campioni erano sempre costituiti da 5 parti in massa di Cu, 4
parti in massa di O e 1 di C (in realtà Proust verificò sperimentalmente il rapporto
63,5g di Cu : 48g di O : 12g di C). Quando cercò di preparare carbonato di calcio dagli
elementi, scoprì che l’eccesso di uno non entrava in reazione. Provò con altre
sostanze, giungendo alle stesse conclusioni. In suo onore oggi noi ricordiamo la sua
scoperta col nome legge di Proust o legge delle proporzioni definite: gli elementi che
formano un dato composto sono sempre presenti secondo rapporti in massa costanti e
definiti.
La legge delle proporzioni definite offriva un valido appoggio all’atomismo. Infatti,
supponendo l’esistenza degli atomi e supponendo che nella sostanza chiamata
carbonato di rame per ogni atomo di Cu ce ne sia uno di C e tre di O, e ammettendo
che tre atomi di O insieme abbiano la massa 4 volte di quella di un solo atomo di C e
ammettendo che l’atomo di Cu abbia la massa 5 volte superiore a quella dello stesso
atomo di C, si poteva giustificare la scoperta di Proust. Al contrario, accettando
l’ipotesi opposta della materia continua e non organizzata in particelle discrete,
diventava difficile spiegare perché mai non fosse possibile includere una quantità
corrispondente a mezzo atomo di Cu o 2/3 di C e via dicendo.
Il terzo momento cruciale della storia dell’atomismo e’ rappresentato da ciò che noi
oggi chiamiamo legge delle proporzioni multiple. Verificando sperimentalmente la
scoperta del suo collega francese, il britannico Dalton, nel 1803, scoprì che il C
reagiva con l’O con un rapporto di 3:4 per dare un composto tossico, il monossido di
carbonio, ma reagiva con un rapporto di 3:8 per darne un’altro, l’anidride carbonica.
In altre parole, 1g di C reagendo con 1,33g di O produce 2,33g di monossido di
carbonio. La stessa quantità di C, pero’, puo’ reagire con 2,66g di O, originando una
sostanza diversa.
Possiamo immaginare che Dalton fu colpito dal fatto che il rapporto 1,33/2,66 e’
riducibile a una frazione formata da numeri piccoli e interi: 1/2. Provò con altre
sostanze ottenendo sempre la stessa cosa, cioè che: quando un elemento (per
esempio O) si combina con una stessa quantità di un altro (per esempio C), le diverse
masse del primo stanno fra loro in rapporti costituiti da numeri interi (nel senso che
sia il numeratore che il denominatore sono numeri interi).
La scoperta di Dalton e’ un contributo alla teoria atomista davvero notevole. Infatti,
soltanto ammettendo l’esistenza degli atomi possiamo facilmente giustificare la legge
delle proporzioni multiple. Se gli atomi esistono, i rapporti tra le diverse quantità di
ossigeno reagenti con la stessa quantità di carbonio saranno necessariamente formati
da numeri interi perché riflettono il rapporto tra un numero di atomi. In altre parole:
una massa di ossigeno sarà sempre e comunque un multiplo intero (se esistono gli
atomi) della massa di un singolo atomo, quindi il rapporto tra due masse diverse di
ossigeno che reagiscono con la stessa massa di carbonio saranno necessariamente in
un rapporto esprimibile con numeri interi. In questo caso, il rapporto ha al
numeratore la massa di un atomo moltiplicato il numero di atomi in 1,33g e al
denominatore la massa dello stesso atomo (che quindi si può semplificare)
moltiplicato il numero di atomi in 2,66g. Inoltre, il rapporto e’ costituito da numeri
generalmente piccoli perche’ gli atomi sono organizzati in molecole costituite
appunto generalmente da un piccolo numero di un tipo di atomo legato ad un piccolo
numero di atomi di diversa specie. Non e’ seriamente sostenibile l’ipotesi secondo la
quale questi rapporti risultano sempre con numeri piccoli e interi a numeratore e a
denominatore per puro caso.
Nel 1808, Dalton raccolse le prove dell’atomismo nella sua opera Nuovo sistema di
filosofia chimica dove asserì che l’atomo e’ indivisibile e inalterabile. Tuttavia una
lunga serie di osservazioni e scoperte, che considererai nel proseguimento del
programma di chimica, dimostrarono che l’ipotesi di un atomo indivisibile e
inalterabile non corrispondeva alla realtà dei fatti.












