Malattia di Newcastle
Giovanni Cattoli e Anna Toffan
Centro Nazionale di Referenza e Laboratorio OIE
per la Malattia di Newcastle e l’Influenza Aviare,
Istituto Zooprofilattico Sper.le delle Venezie,
Legnaro (PD)
Storia
1926 Newcastle -upon-Tyne: primi focolai epidemici
in Indonesia e in Inghilterra; ha inizio la 1^panzozia (16
anni per diffondersi - non in USA)
1960 seconda panzozia: in 4 anni ha interessato
tutto il mondo (> sviluppo avicoltura moderna, sviluppo
del commercio degli uccelli da voliera)
1970 terza panzozia (originata da psittacidi?)
1985 quarta panzozia coinvolge in particolare la
popolazione dei piccioni, è dovuta al “ceppo piccione” del
vND ed è ancora in atto (ceppo piccione o PPMV1)
Classificazione APMV-1
• RNA virus a singolo filamento
• genere Avulavirus
• subfamiglia Paramyxovirinae
• famiglia Paramyxoviridae
• Ordine Mononegavirales
APMV-1
Un solo sierotipo: virus a bassa e ad alta
virulenza non sono distinguibili dal punto
di vista sierologico
Sono distinguibili dal punto di vista
genomico: i ceppi ad alta virulenza
contengono aminoacidi basici multipli nel
tratto di genoma corrispondente al sito di
clivaggio della proteina F
Definizione OIE
Per malattia di Newcastle si intende un’infezione
degli uccelli causata dal Paramyxovirus aviare
sierotipo 1 che possiede uno dei seguenti criteri
di virulenza:
a) Il virus ha un IPIC ≥ 0,7
b) Il virus possiede aa basici multipli al terminale C
della proteina F2 e la fenilalanina al residuo 117,
terminale N della proteina F1.
Patogenesi ed epidemiologia
Basi molecolari della patogenicità
Proteina F
Precursore glicoproteico F0
“Cleavage”in F1 ed F2
Mediazione proteasi ospite
Particelle virali infettanti
Patogenesi ed epidemiologia
Basi molecolari della patogenicità
Virus a bassa patogenicità
“Cleavage” da parte di proteasi
che riconoscono un solo aa
basico al terminale carbossilico
di F1 (enzima tripsina like)
Infezione solo nel tratto
respiratorio ed intestinale
Virus ad alta patogenicità
“Cleavage” da parte di
proteasi ubiquitarie
presenti in una grande
varietà di cellule e tessuti
Infezione sistemica fatale
Patogenesi ed epidemiologia
Basi molecolari della patogenicità
In tutti i virus, l’aminoacido al residuo 116
(terminale C della proteina F2) è l’arginina
Virus a bassa patogenicità
Virus ad alta patogenicità
Possiedono la leucina al
residuo 117 (terminale N
della proteina F1) e un aa
basico al residuo 113
Possiedono la fenilalanina al
residuo 117 (terminale N della
proteina F1) ed aa basici ai
residui 115, 112, 113 e 116, 113.
La sota: 111GGRQGR*L 117
Herts 33: 111GRRQRR*F 117
ICPI
Direttiva 92/66/EEC (DPR 657/96)
riconosce nella prova di patogenicità
intracerebrale la prova discriminante per
indicare se un ceppo è virulento
0.7
Indice di patogenicità
intracerebrale (i.c.p.i.)
Inoculazione di pulcini SPF di 1
giorno di vita per via intracerebrale
registrazione giornaliera della
mortalità per 8 giorni
Classificazione: Patotipo
I virus ND vengono classificati in 5 patotipi sulla base
dei sintomi osservati nei polli infetti:
1. Viscerotropi velogeni (VVND): forma altamente
patogena, con lesioni intestinali emorragiche (IPIC=1,52,0);
2. Neurotropi velogeni (NVND):forma caratterizzata da
elevata mortalità con sintomi respiratori e nervosi
(IPIC=1,5-2,0);
3. Mesogeni: forma caratterizzata da bassa mortalità con
sintomi respiratori, occasionalmente nervosi (IPIC=0,71,5);
4. Lentogeni o respiratori: infezione respiratoria lieve o
subclinica (IPIC=0,2-0,5);
5. Asintomatici-enterici: infezione intestinale subclinica
(IPIC=0,0-0,2);
Patogenesi ed epidemiologia
Riassumendo
Ceppi velogeni:grave sintomatologia , mortalità
100%
Ceppi mesogeni: segni respiratori, calo
dell’ovodeposizione, rari segni nervosi;
Ceppi lentogeni: segni respiratori nei giovani,
eventuale mortalità con infezioni complicanti;
PPMV-1: nei polli e piccioni causa segni nervosi e
diarrea; nei polli determina anche calo
dell’ovodeposizione ed elevata mortalità nei
giovani.
Classificazione: genotipizzazione
Sequenza del gene (338pb) che codifica per la
proteina di fusione (gene F)
Classificazione in 6 genogruppi principali
Identifica in tempi brevi il patotipo degli APMV-1
Uniformare le metodiche di tipizzazione
utilizzate a livello comunitario rendendo più
agevole la comparazione dei risultati
Annullare la necessità di utilizzare animali vivi
per la patotipizzazione degli APMV-1
Trasmissione
Virus più resistente dei virus influenzali
trasmissione aerogena
oro-fecale (alimenti ed acqua
contaminati)
vettori meccanici (animali, personale,
attrezzature, veicoli, ecc..)
Specie suscettibili
•Oltre 250 specie aviarie
appartenenti a 27 ordini dei 50
ordini esistenti.
•Tutte le specie aviarie di
maggiore o minore interesse
zootecnico
Distribuzione
•Diffusa in quasi tutto il mondo
•Presente in molte aree dell’Asia,
Africa e Americhe
•In Europa dal 1991 è stato
riscontrato un aumento
dell’incidenza
Diagnosi
Isolamento e identificazione del virus
Campioni
Animali vivi: tamponi cloacali e tracheali
Animali morti: feci o tratti intestinali,
stomaco ghiandolare, cervello, trachea,
polmoni, fegato, milza ed altri organi
eventualmente colpiti
Diagnosi
Isolamento: Uova embrionate
HI: per ricerca sierologica degli anticorpi
RT-PCR: per ricerca RNA virale
Sequenziamento gene proteina F
Prevenzione e controllo
profilassi diretta
Isolamento del gruppo colpito
Distruzione di tutti gli animali infetti o esposti
Rigorose pulizia e disinfezione delle strutture
Appropriato smaltimento delle carcasse
Controllo degli infestanti
Depopolamento seguito da un periodo di vuoto sanitario di
21 gg
Nessun contatto con volatili di stato sanitario sconosciuto
Controllo dei movimenti umani
Allevamento unica età (tutto pieno-tutto vuoto)
Prevenzione e controllo
profilassi indiretta
Vaccinazione
Vaccini vivi
IPIC<0,4
Es; Hitchner B1, La Sota
Vaccini inattivati
IPIC<0,7
Es; Ulster 2C
Legislazione
Direttiva comunitaria 92/66/CEE che istituisce
misure di lotta contro la malattia di Newcastle
O.M. 19 luglio 1991 “profilassi dell’influenza
aviare e della pseudopeste aviare”
D.P.R. 5 novembre 1996 n°657 “regolamento
per l’attuazione della direttiva 92/66/CEE che
prevede misure comunitarie contro la malattia di
Newcastle”
Malattia di Newcastle
in
ITALIA
2000-2001
Epidemia da ceppo C1 : 254 focolai nel 2000
(5 Maggio - 31 Dicembre)
Endemia da ceppo piccione
(dal 1981 ad oggi)
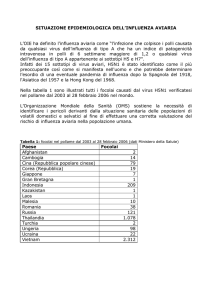
SINTOMATOLOGIA E LESIONI OSSERVATE NEL
CORSO DELL’EPIDEMIA
Torcicollo
Pedalamento
Incoordinazione dei movimenti
Emorragie nel proventricolo
Lesioni necroticoemorragiche nei
foci linfoidi
intestinali
Lesioni
necroticoemorragiche
nelle tonsille
cecali
Pancreatite nel
fagiano
Epidemia del 2000
(05.05.00 - 31.12.00)
SPECIE E CATEGORIE
Regione
Emilia Romagna
Friuli Venezia Giulia
Lazio
Lombardia
Marche
Piemonte
Toscana
Trentino
Umbria
Veneto
Broiler
Faraone
Ovaiole
Rurali
2
1
1
2
31
20
7
19
14
1
5
1
1
Tacchino da
Svezzatori
carne
4
1
1*
2
4
1
109
4
13
2
1
Totale focolai
11
2
Totale animali
400.917 34.270
(*) virus isolato da animali al macello
Struzzi
3
177.663
219
12.227
• 17 focolai in allevamenti intensivi
• 17 focolai negli “svezzatori”
• 219 focolai in allevamenti rurali
7
1
65
1
2.500
Totale
40
22
7
22
19
7
117
4
13
3
17
254
106.039 773.681
l
Focolai di
Malattia di
Newcastle
nell’epidemia
del 2000
..
IPOTESI DELL’INSORGENZA E DELLA
DIFFUSIONE DEI FOCOLAI
Epidemia da H7N1
Influenza aviare a bassa virulenza
(LPAI)
Influenza aviare ad alta virulenza
(HPAI)
(17.12.99-05.05.00)
HPAI (413 focolai)
á Tacchini riproduttori : 5
á Riproduttori broiler: 29
á Tacchini da carne : 177
á Broiler : 39
á Galline ovaiole : 121
á Faraone e quaglie : 14
á Rurali : 25
14 milioni di
á Struzzo : 3
volatili
Applicazione direttiva
92/40/ EC
“Stamping out” dei gruppi infetti
(interessati 14 milioni di volatili)
Eradicazione
Depopolamento della zona (allevamenti
intensivi, semi-intensivi e rurali)
Vuoto sanitario di minimo 60 giorni
Pulizia e disinfezione degli allevamenti
Ristrutturazione aziendale
Conseguenze
Carenza sul mercato nazionale di
pulcini broiler, importazione da
paesi dell’UE e da paesi terzi
Mescolamento, a livello di
incubatoio e di allevamento, di
popolazioni con diverso stato
immunitario e sanitario
Conseguenze
Necessità di soddisfare la domanda di
carne avicola
Accasamenti ad elevata densità di
allevamento nelle regioni indenni
Necessità di ridurre i costi e paura di
reazioni vaccinali avverse
Programmi vaccinali non effettuati
correttamente
RISULTATO
ND
DIFFUSIONE
Predominante ruolo degli incubatoi e
degli “svezzatori”
Focolai di ND legati
ad un incubatoio
che aveva importato
uova di provenienza
diversa
EPIDEMIA di ND in ITALIA nel 2000
COLLEGAMENTI EPIDEMIOLOGICI
SVEZZATORI
province di FC e RA
Emilia-Romagna
Veneto
31 focolai
2 focolai
Umbria
Friuli V.G.
13 focolai
20 focolai
Trentino
Lombardia
19 focolai
4 focolai
Marche
14 focolai
Toscana
109 focolai
Eradicazione
Misure di restrizione: limitazione delle
movimentazioni danni x gli allevamenti intensivi
Stamping out degli allevamenti infetti
come
indicato
dalla
direttiva
92/66/EEC
Programma di vaccinazione
obbligatoria
ENDEMIA DA CEPPO PICCIONE
“Ceppo piccione” (PPMV1)
endemico in Europa ed in Italia
convenzionalmente “mesogeno” con i.c.p.i. di
0.7-1.4, oggi soprattutto presenza di ceppi
“attenuati” con virulenza residua
raramente con i.c.p.i. tipici da ceppi molto
patogeni (1.6-1.8)
distinguibile dagli altri ceppi di NDV mediante
l’utilizzo del mAb 161/617
gruppo “P”
Focolai da ceppo piccione “classico”
i.c.p.i. 0.8-1.4 (1999-2000)
Focolai da ceppo piccione “attenuato”
i.c.p.i. 0.4 - 0.7 (1999-2000)
NDV come zoonosi
Agente infettivo di classe 2
(All. XI D.Lgs. 626/94)
moderato rischio individuale, limitato
rischio collettivo
NDV come zoonosi
Primo caso riportato nell’uomo risale al
1943 (congiuntivite)
Segnalazioni poco frequenti
Segni clinici riportati: congiuntivite e altri
segni di infezione oculare (edema
palpebrale, lacrimazione eccessiva,
arrossamento. Sintomi simil-influenzali
(febbre, mal di testa) riportati raramente
NDV come zoonosi
Trasmissione dovuta a contatto diretto con
elevate cariche virali (es. carcasse di
volatili infetti, materiale di laboratorio)
Teoricamente possibile, ma mai segnalata,
la trasmissione inter-umana
Categorie a rischio: personale di
laboratorio, addetti alla macellazione,
addetti alla vaccinazione
Grazie a tutti per
l’attenzione!