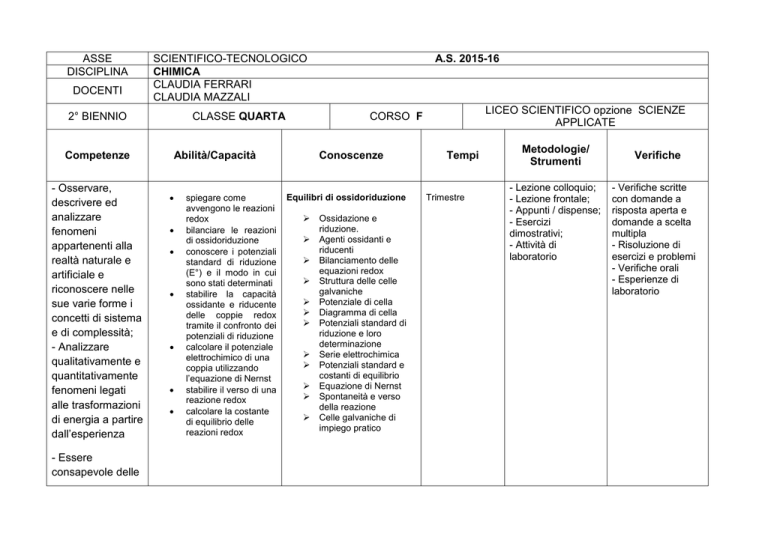
ASSE
DISCIPLINA
DOCENTI
SCIENTIFICO-TECNOLOGICO
CHIMICA
CLAUDIA FERRARI
CLAUDIA MAZZALI
2° BIENNIO
Competenze
- Osservare,
descrivere ed
analizzare
fenomeni
appartenenti alla
realtà naturale e
artificiale e
riconoscere nelle
sue varie forme i
concetti di sistema
e di complessità;
- Analizzare
qualitativamente e
quantitativamente
fenomeni legati
alle trasformazioni
di energia a partire
dall’esperienza
- Essere
consapevole delle
CLASSE QUARTA
•
•
•
•
•
•
spiegare come
avvengono le reazioni
redox
bilanciare le reazioni
di ossidoriduzione
conoscere i potenziali
standard di riduzione
(E°) e il modo in cui
sono stati determinati
stabilire la capacità
ossidante e riducente
delle coppie redox
tramite il confronto dei
potenziali di riduzione
calcolare il potenziale
elettrochimico di una
coppia utilizzando
l’equazione di Nernst
stabilire il verso di una
reazione redox
calcolare la costante
di equilibrio delle
reazioni redox
LICEO SCIENTIFICO opzione SCIENZE
APPLICATE
CORSO F
Abilità/Capacità
•
A.S. 2015-16
Conoscenze
Equilibri di ossidoriduzione
Ossidazione e
riduzione.
Agenti ossidanti e
riducenti
Bilanciamento delle
equazioni redox
Struttura delle celle
galvaniche
Potenziale di cella
Diagramma di cella
Potenziali standard di
riduzione e loro
determinazione
Serie elettrochimica
Potenziali standard e
costanti di equilibrio
Equazione di Nernst
Spontaneità e verso
della reazione
Celle galvaniche di
impiego pratico
Tempi
Trimestre
Metodologie/
Strumenti
- Lezione colloquio;
- Lezione frontale;
- Appunti / dispense;
- Esercizi
dimostrativi;
- Attività di
laboratorio
Verifiche
- Verifiche scritte
con domande a
risposta aperta e
domande a scelta
multipla
- Risoluzione di
esercizi e problemi
- Verifiche orali
- Esperienze di
laboratorio
potenzialità e dei
limiti delle
tecnologie nel
contesto culturale
e sociale in cui
vengono
applicate;
•
•
•
•
•
•
•
•
•
•
descrivere una cella
elettrolitica
prevedere i prodotti
che si formano
durante l’elettrolisi
calcolare la quantità
di prodotto formato o
di reagente
consumato durante
l’elettrolisi
descrivere i processi
di corrosione
Definire gli acidi e le
basi secondo le
teorie acido-base di
Arrhenius, di
Bronsted-Lowry e di
Lewis
Scrivere le reazioni
acido-base
Nota la
concentrazione di
+
H3O saper ricavare
quella di OH , il pH e il
pOH
Scegliere per ogni
titolazione l’indicatore
adatto
Calcolare la quantità
di acido o di base in
una soluzione
incognita tramite i dati
di una titolazione
acido-base
Distinguere dal punto
di vista qualitativo se
in soluzione acquosa
Elettrolisi e celle
elettrolitiche
Prodotti dell’elettrolisi
Legge dell’elettrolisi di
Faraday
Applicazioni
dell’elettrolisi
Corrosione
Equilibri acido-base
Gli acidi e le basi
secondo Arrhenius
Gli acidi e le basi di
Bronsted-Lowry
La forza degli acidi e
delle basi
Gli acidi e le basi
poliprotici
Gli acidi e le basi di
Lewis
Ossidi acidi, basici e
anfoteri
L’autoprotolisi
dell’acqua
e
la
costante di autoprotolisi
(Kw)
La dipendenza della
costante di autoprotolisi
dell’acqua
dalla
temperatura
La concentrazione degli
+
ioni H3O in acqua pura
e nelle soluzioni neutre,
acide e basiche
La scala del pH
Trimestre
- Lezione frontale;
- Esercizi / problemi
dimostrativi;
- Attività di
laboratorio
- Verifiche scritte
con domande a
risposta aperta e
domande a scelta
multipla
- Risoluzione di
esercizi e problemi
- Esperienze di
laboratorio
- Lezione frontale;
- Esercizi / problemi
dimostrativi;
- Attività di
laboratorio
- Verifiche scritte
con domande a
risposta aperta e
domande a scelta
multipla
- Risoluzione di
esercizi e problemi
- Esperienze di
laboratorio
•
•
•
•
•
una specie reagisce
acida, basica o neutra
Calcolare il pH di
soluzioni acquose di
acidi forti e deboli, di
basi forti e deboli, di
acidi deboli poliprotici
Prevedere e calcolare
il pH di soluzioni
acquose di sali
Conoscere la
differenza fra
tampone acido e
tampone basico
Eseguire i calcoli del
pH di tamponi
Eseguire i calcoli per
verificare il ΔpH dopo
l’aggiunta alle
soluzioni tampone di
acidi o basi forti
Il pH dell’acqua pura e il
pH di soluzioni neutre,
acide e basiche
La relazione tra pH e
pOH
Le costanti di acidità e
di basicità (Ka e Kb)
La relazione Ka e Kb di
una coppia coniugata
acido-base
Il calcolo del pH di
soluzioni acquose di
acidi e basi forti, acidi e
basi deboli
Il calcolo del pH di acidi
e basi poliprotici
La struttura molecolare
e la forza degli acidi
Il pH delle soluzioni
saline
Idrolisi acida e basica
Il calcolo del pH di
soluzioni di sali che
danno idrolisi acida o
basica o entrambe
Le soluzioni tampone
Tamponi acidi e basici
Le reazioni nelle
soluzioni tampone
Il calcolo del pH di
tamponi acidi e basici
Il calcolo del pH di
soluzioni tampone
prima e dopo l’aggiunta
di acidi forti o basi forti
La preparazione delle
soluzioni tampone
La capacità tamponante
I composti organici
•
•
•
•
•
•
•
•
•
classificare i composti
organici in base alla
struttura molecolare:
aciclici, carbociclici,
eterociclici
classificare i composti
organici in base ai
gruppi funzionali
scrivere le formule di
struttura dettagliate e
semplificate dei
composti organici
assegnare la carica
formale ad un atomo
in un composto
scrivere le forme
limite di risonanza per
una molecola o per
uno ione poliatomico
descrivere la struttura
dei composti organici
attraverso la teoria
dell’ibridazione
scrivere le formule di
struttura di tutti i
possibili isomeri, data
la formula molecolare
classificare e
denominare con le
regole IUPAC gli
idrocarburi
correlare le proprietà
fisiche degli
idrocarburi alifatici ed
Pentamestre
Definizione e
classificazione dei
composti organici in
base alla struttura
molecolare e ai gruppi
funzionali
Formule di struttura dei
composti organici
Carica formale degli
atomi
Risonanza
Isomeri di struttura
3
Orbitali ibridi sp del
carbonio e descrizione
della molecola del
metano, CH4
2
Orbitali ibridi sp del
carbonio e descrizione
della molecola
dell’etilene, C2H4
Orbitali ibridi sp del
carbonio e descrizione
della molecola
dell’acetilene, C2H2
Il legame sigma e il
legame pi-greco
Gli idrocarburi
Alcani: formula
generale, proprietà
fisiche, nomenclatura,
reattività
Sostituzione radicalica
Prodotti e meccanismo
dell’alogenazione del
metano
- Lezione colloquio;
- Lezione frontale;
- Appunti / dispense;
- Esercizi
dimostrativi;
- Attività di
laboratorio
- Verifiche scritte
con domande a
risposta aperta e
domande a scelta
multipla
- Risoluzione di
esercizi e problemi
- Esperienze di
laboratorio
- Lezione colloquio;
- Lezione frontale;
- Appunti / dispense;
- Esercizi
dimostrativi;
- Attività di
laboratorio
- Verifiche scritte
con domande a
risposta aperta e
domande a scelta
multipla
- Risoluzione di
esercizi e problemi
- Esperienze di
laboratorio
•
•
aromatici alla loro
struttura
conoscere la reattività
degli idrocarburi
prevedere i prodotti e
scrivere il
meccanismo delle
reazioni di
sostituzione
radicalica, addizione
elettrofila,
polimerizzazione
radicalica,
sostituzione elettrofila
aromatica
Prodotti e meccanismo
dell’alogenazione degli
alcani
Combustione totale e
parziale degli alcani
Alcheni e alchini:
definizione e
classificazione,
nomenclatura, proprietà
fisiche, isomeria cistrans, convenzione E-Z
per gli isomeri
geometrici cis-trans.
Addizione elettrofila agli
alcheni
Addizione di acidi
alogenidrici e di acido
solforico, addizione di
acqua in ambiente
acido, addizione di
alogeni: prodotti e
meccanismi di reazione
Addizione di reagenti
asimmetrici ad alcheni
asimmetrici: regola di
Markovnikov e relativa
spiegazione
Addizione di idrogeno
agli alcheni
Addizione radicalica
degli alcheni:
polimerizzazioni
Ossidazione degli
alcheni con
permanganato
Ozonolisi degli alcheni
Addizione di HBr in
presenza di perossidi
Reazioni di addizione
degli alchini: prodotti e
meccanismo
•
collegare l’isomeria di
struttura alle proprietà
dell’addizione di
alogeni, acidi
alogenidrici, acqua in
ambiente acido
Idrogenazione degli
alchini
Acidità degli alchini
Composti aromatici:
caratteristiche del
benzene. Struttura di
Kekulè, modello della
risonanza e modello
orbitalico del benzene.
Energia di risonanza
del benzene.
Sostituzione elettrofila
aromatica: prodotti e
meccanismo della
nitrazione,
solfonazione,
alogenazione e
alchilazione e
acilazione del benzene
Sostituzione elettrofila
aromatica sui derivati
del benzene: sostituenti
attivanti e disattivanti
l’anello, gruppi orto,
para-orientanti, gruppi
meta-orientanti
Prodotti e meccanismo
della sostituzione
elettrofila aromatica sui
derivati del benzene
Reazioni di sostituzione
elettrofila aromatica
nella sintesi organica
Isomeria
Isomeria di catena o di
posizione
- Lezione colloquio;
- Lezione frontale;
- Appunti / dispense;
- Verifiche scritte
con domande a
risposta aperta e
•
•
•
fisiche e chimiche dei
composti isomeri
classificare gli
stereoisomeri
rappresentare con le
proiezioni di Newman
e le forme a cavalletto
gli isomeri
conformazionali
assegnare la
configurazione
assoluta a
stereoisomeri
utilizzando la
convenzione R-S
•
•
•
•
denominare con le
regole IUPAC i
derivati degli
idrocarburi
conoscere la reattività
degli alogenuri
alchilici, degli alcoli,
dei fenoli
prevedere i prodotti e
scrivere il
meccanismo delle
reazioni di
sostituzione nucleofila
ed eliminazione
scrivere l’equazione
cinetica delle reazioni
organiche
Stereoisomeria: isomeri
conformazionali e
isomeri configurazionali
Conformazioni degli
alcani (sfalsata ed
eclissata)
Isomeria cis-trans nei
cicloalcani
Conformazione a sedia
del cicloesano
Isomeri
configurazionali: atomo
di carbonio stereogeno,
enantiomeri
Configurazione del
centro stereogeno e
convenzione R-S
Proiezioni di Fischer
Diastereomeri
Composti meso
I derivati degli idrocarburi
Composti organici
alogenati
Sostituzione nucleofila:
prodotti e meccanismi
SN1 e SN2 per gli
alogenuri alchilici
Reazioni dei nucleofili
all’ossigeno, all’azoto,
allo zolfo, all’alogeno e
al carbonio con gli
alogenuri alchilici
Confronto fra il
meccanismo SN1 e il
meccanismo SN2
Eliminazione: prodotti e
meccanismi E1 ed E2
per gli alogenuri alchilici
Competizione tra
- Esercizi
dimostrativi;
- Attività di
laboratorio
domande a scelta
multipla
- Risoluzione di
esercizi e problemi
- Esperienze di
laboratorio
- Lezione frontale;
- Appunti / dispense;
- Esercizi
dimostrativi;
- Attività di
laboratorio
- Verifiche scritte
con domande a
risposta aperta e
domande a scelta
multipla
- Risoluzione di
esercizi e problemi
- Esperienze di
laboratorio
sostituzione nucleofila
ed eliminazione
Composti alifatici
polialogenati
Alcoli e fenoli:
nomenclatura, proprietà
fisiche, acidità e
basicità
Disidratazione degli
alcoli ad alcheni:
prodotti e meccanismi
di reazione
Reazione degli alcoli
con gli acidi
alogenidrici: prodotti e
meccanismi di reazione
Altri metodi di
preparazione degli
alogenuri alchilici dagli
alcoli
Ossidazione degli alcoli
ad aldeidi e chetoni
Alcoli con più di un
gruppo ossidrilico
Sostituzione elettrofila
aromatica nei fenoli
Ossidazione dei fenoli










