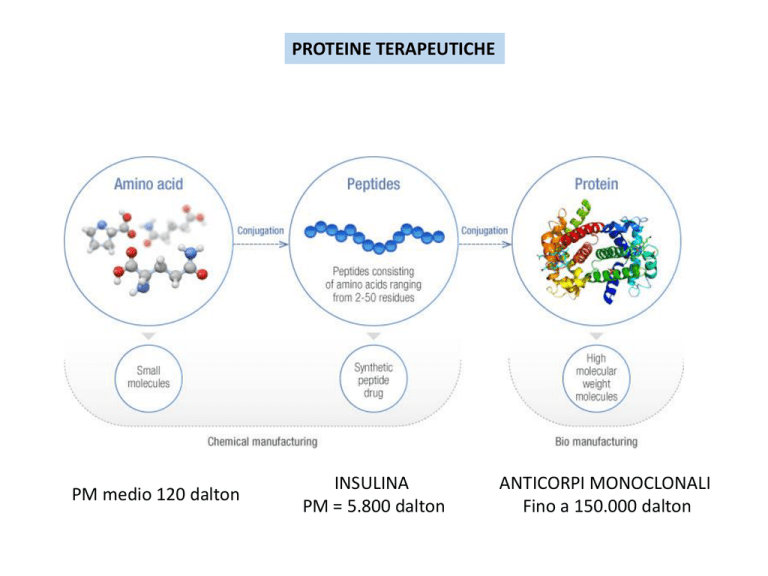
PROTEINE TERAPEUTICHE
PM medio 120 dalton
INSULINA
PM = 5.800 dalton
ANTICORPI MONOCLONALI
Fino a 150.000 dalton
FARMACI PEPTIDICI/PROTEICI
•
•
•
•
•
La stabilità delle proteine è in linea di massima maggiore rispetto a quella dei
peptidi
Le proteine sono generalmente più immunogeniche rispetto ai peptidi
I tempi di sperimentazione preclinica/clinica sono inferiori per peptidi e
proteine rispetto a quelli richiesti per le small molecules.
I costi di produzione delle proteine superano i costi di sintesi di farmaci
peptidici
Impossibile caratterizzare completamente la composizione di una proteina
terapeutica in quanto fortemente dipendente dal processo di produzione.
MODIFICHE POST TRADUZIONALI DELLE PROTEINE
Alcune proteine, sia eucariotiche che procariotiche, raggiungono
la loro conformazione biologicamente attiva solo dopo aver subito
una o più modificazioni.
MODIFICAZIONI DI SINGOLI AMMINOACIDI
GLICOSILAZIONE
LIPIDAZIONE
Prenilazione o isoprenilazione
di residui di cisteina
Coniugazione
con acidi grassi
NUMEROSE CICLIZZAZIONI
Foldasi: disolfuro isomerasi, chaperoni molecolari
PROTEINE MULTIMERICHE
Un consistente numero di proteine costituite da un certo numero di
catene polipeptidiche identiche, chiamate subunità, che si associano in
modo specifico a formare una molecola multimerica (STRUTTURA
QUATERNARIA). Le subunità possono funzionare in modo indipendente una
dall’altra oppure in modo cooperativo.
Altre proteine proteine sono costituite da catene polipeptidiche diverse
ciascuna con una diversa funzione.
FARMACO BIOLOGICO E FARMACO BIOTECNOLOGICO
Come ottenere proteine complesse a scopo terapeutico?
• Estrazione da fonti biologiche
• Ingegneria genetica
PROTEINE RICOMBINANTI
Manipolare il DNA ci consente di interrogare il nostro sistema di interesse.
Tutta LA RICERCA DI BASE richiede la capacità di interrogare un sistema
(una proteina, una cellula, un tessuto, un organismo) per capirne la
funzione.
Lo sviluppo di tecnologie per la produzione di proteine ricombinanti ha dato un
impulso enorme alla ricerca sulle proprietà strutturali e funzionali delle proteine
PROTEINE RICOMBINANTI
• Manipolare il DNA ci consente di manipolare il nostro sistema di interesse. la
tecnologia ricombinante consente di modificare le molecole, per migliorarne
l’efficacia, oppure di creare nuove molecole con attività d’interesse.
• La produzione di proteine ricombinanti ha ricadute industriali importanti
AMBITI DI APPLICAZIONE TERAPEUTICA DEI FARMACI PROTEICI
Ad oggi, a livello mondiale, milioni di pazienti hanno già beneficiato dei medicinali
biologici/biotecnologici approvati per cura o prevenzione di molte
malattie rare e gravi
I più importanti ambiti di applicazione terapeutica sono:
1. Oncologia,
2. Malattie autoimmuni,
3. Patologie infiammatorie,
4. Carenze ormonali,
5. Alterazioni dell'emostasi,
6. Deficit proteici/enzimatici ereditari.
PROTEINE RICOMBINANTI IN USO
I farmaci biotecnologici sul mercato sono
• ENZIMI
• ORMONI
• VACCINI
• CITOCHINE (interferoni, interleuchine, fattori di crescita ematopoietici)
• FATTORI DI COAGULAZIONE
• ANTICORPI MONOCLONALI
FARMACO BIOSIMILARE
Poiché i primi prodotti biotecnologici sono stati immessi sul mercato negli anni ottanta, la
copertura brevettuale di alcuni di essi è già scaduta o è in fase di prossima scadenza.
La scadenza della copertura brevettuale, unitamente agli enormi progressi compiuti in ambito
biotecnologico, ha dato la possibilità alle aziende farmaceutiche di produrre e
commercializzare prodotti con caratteristiche molto simili a quelle dei prodotti originali.
Questi prodotti biologici, il cui principio attivo è analogo, ma non identico per
caratterizzazione e produzione, a quello del medicinale di riferimento, sono denominati
BIOSIMILARI e più raramente BIOSIMILI o BIOGENERICI.
“Un biosimilare è una versione copia di un medicinale biologico/biotecnologico
già autorizzato [prodotto di riferimento] con dimostrata somiglianza nelle
caratteristiche fisico‐chimiche, efficacia e sicurezza, sulla base di un esauriente
esercizio di comparabilità” (Weise et al., Nature Biotechnology, 2011).
FARMACO BIO-BETTER
In taluni casi il farmaco biosimilare può essere derivato da processi produttivi più
innovativi rispetto a quelli del farmaco di riferimento, tali da far sì che il prodotto
presenti profili di efficacia e di sicurezza persino superiori rispetto all’originatore.
Ci si riferisce a tali prodotti come prodotti “bio‐better”.
TECNICA DEL DNA RICOMBINANTE
1. È necessario avere a disposizione il DNA/RNA che codifica per la
proteina di interesse.
2. Clonaggio della sequenza codificante nel vettore di espressione
3. Trasformazione dell’ospite (shock termico, elettroporazione, liposomi)
4. Selezione dei ricombinanti
5. Espressione e purificazione della proteina (intracellulare o secreta)
DNA
DNA
AMPLIFICAZIONE
DEL DNA
DNA introdotto in un
vettore di espressione
OSPITE
PRODUZIONE DELLA
PROTEINA DI INTERESSE
CLONAGGIO DI UN GENE IN UN PLASMIDE
Tramite il clonaggio molecolare è
possibile isolare un singolo gene dal
genoma di un organismo e produrne
molte copie identiche.
Consiste nell’inserire un frammento di
DNA (chiamato inserto) in un vettore
appropriato come un plasmide.
Il nuovo plasmide creato sarà poi
introdotto in una cellula ospite, in
generale E. coli. Essa sarà allora
selezionata e moltiplicata per ottenere
una grande quantità di plasmidi
d’interesse. In questo caso si parla di
clone perché tutti gli individui della
colonia batterica sono geneticamente
identici.
CLONAGGIO DI UN GENE IN UN PLASMIDE
VETTORI DI CLONAGGIO
Contengono almeno un marcatore selettivo
che permette di distinguere le cellule ospiti
che contengono il plasmide da quelle che non
lo contengono. Normalmente si utilizzano
come marcatori selettivi geni che conferiscono
la resistenza agli antibiotici, ossia la capacità di
crescere in presenza dell’antibiotico ampicillina
(amp) o tetraciclina (tet) o cloramfenicolo.
Le cellule batteriche, se non contengono il
plasmide che porta il gene per la resistenza ad
un antibiotico, sono “antibiotico-sensibili”,
ossia sono incapaci di crescere in un terreno di
coltura in cui sia presente l’antibiotico
BIOREATTORI FERMENTATORI
I bioreattori sono cisterne di acciaio inossidabile, dotate di
complessi meccanismi di controllo del brodo di coltura in cui
crescono grandi quantità di cellule.
SISTEMI DI ESPRESSIONE PER LA PRODUZIONE DI PROTEINE RICOMBINANTI
1) BATTERI (E. coli)
I microrganismi sono facilmente manipolabili, economici, modificabili
in tempi rapidi. Tuttavia, le proteine prodotte nei batteri sono prive di
modificazioni post-traduzionali. Spesso offrono proteine denaturate
che necessitano di refolding. Problemi con proteine multimeriche e
contenenti ponti disolfuro.
PRIMA SCELTA PER PROTEINE MEDIO-PICCOLE
2) LIEVITI (S. cerevisiae; Pichia pastoris)
Sono i sistemi eucariotici più semplici da coltivare. Metodo
economico, relativamente efficiente, la crescita è rapida. Consentono
di ottenere glicosilazioni, ma queste sono spesso specie-specifiche.
SISTEMI DI ESPRESSIONE PER LA PRODUZIONE DI PROTEINE RICOMBINANTI
3) LE CELLULE IN COLTURA DI INSETTO
Consentono di ottenere glicosilazioni, ma queste sono spesso specie-specifiche.
Coltura difficile e più costosa.
4) LE CELLULE IN COLTURA DI MAMMIFERO
Consente una corretta glicosilazione delle proteine. Le coltivazione è lenta,
costosa e difficilmente consente l’ottenimento di proteine in alta resa
PROBLEMI LEGATI ALLA PRODUZIONE DELLA PROTEINA
1) Incapacità della proteina di assumere la corretta struttura
3D nell’ambiente batterico
2) Assenza di cofattori essenziali
3) Mancata modificazione post-traduzionale
4) Degradazione proteolitica
5) Tossicità della proteina
6) Processi di purificazione complessi
ALTI COSTI DEL FARMACO BIOTECNOLOGICO
PHARMING
Animali come bioreattori
PROTEINE PRODOTTE IN FLUIDI BIOLOGICI DI ANIMALI
USATI COME BIOREATTORI
Sistema
Specie
Prodotto
Latte
Maiale
Fattore VIII
Topo
Attivatore plasminogeno tissutale umano
Ormone della crescita umana
Fibrinogeno umano
Coniglio
Eritropoietina umana
Pecora
1-antitripisina umana
Fattore IX
Capra
Attivatore plasminogeno tissutale umano
Siero (sangue)
Coniglio
1-antitripisina umana
Urine
Topo
Ormone della crescita umana
LA GREEN BIOTECHNOLOGY
La Green biotechnology o biotecnologia
agroalimentare, è il settore delle biotecnologie
che si occupa di utilizzare le piante come
sistema di espressione di molecole ad
interesse umano. Un importante esempio di
questa tecnologia è quello di aver modificato
la pianta di tabacco affinché produca vaccini.
• La manipolazione delle piante è meno
complessa (e più economica) di quella degli
animali. Non sono richieste condizioni di
Piante come bioreattori
sterilità. Tecniche di coltivazione standard.
• Le piante, sono sicure da possibili
contaminazioni di patogeni animali
• Sono organismi eucarioti, in grado quindi di
sintetizzare molecole complesse con il coretto
folding.
• Il costo della purificazione può essere completamente abbattuto se la proteina d’interesse
viene espressa in piante eduli; in questo caso la proteina non deve essere più estratta dai
tessuti vegetali, ma può essere somministrata direttamente dopo semplici processi di
concentrazione e dosaggio
IMPORTANZA DEL PROCESSO DI PRODUZIONE
Mentre i farmaci tradizionali costituiti da piccole molecole sono prodotti tramite sintesi
chimica, la maggior parte dei biofarmaci, essendo prodotti tramite biotecnologie che
operano su sistemi viventi (microrganismi o cellule animali) presentano numerosi
aspetti di eterogeneità legati alla cellula ospite utilizzata, ai plasmidi impiegati per
transfettare/infettare la cellula ospite e per trasferire il gene necessario al fine di indurre
l’espressione della proteina voluta, nonché alle condizioni di crescita e fermentazione e
alle differenti metodiche di purificazione.
Il processo di produzione di tali farmaci è talmente
caratterizzante che “ IL PROCESSO È IL PRODOTTO”
A differenza dei farmaci ottenuti per sintesi chimica, i medicinali
biologici/biotecnologici richiedono, per la loro caratterizzazione e controllo di
qualità, non solo una serie di esami fisico‐chimico‐biologici, ma anche informazioni
specifiche sul processo di produzione poiché la struttura molecolare è strettamente
dipendente dal processo di produzione.
ENZIMI
Proteine con attività enzimatica/regolativa possono essere impiegate
PER POTENZIARE UN PROCESSO FISIOLOGICO GIÀ ESISTENTE
Attivatore del plasminogeno tissutale
Alteplase
Reteplase
Tenecteplase
Lanoteplase
PER FORNIRE UNA NUOVA ATTIVITÀ BIOLOGICA
Dnase-Dronase alfa (Pulmozyme)
PER SOPPERIRE ALLA MANCANZA DI UNA PROTEINA
Imiglucerase (Cerezyme)
Alglucosidase alfa (Myozyme, Lumizyme)
Idursulfase (Elaprase)
ATTIVATORI DEL PLASMINOGENO TISSUTALE
Gli attivatori del plasminogeno sono delle sostanze appartenenti al gruppo
dei farmaci fibrinolitici/trombolitici. La fibrinolisi è il processo mediante il
quale un reticolo di FIBRINA viene dissolto per rimuovere un coagulo.
Meccanismo d’azione: convertono il PLASMINOGENO in PLASMINA.
ATTIVAZIONE FIBRINO SPECIFICA
ATTIVATORE DEL PLASMINOGENO TISSUTALE UMANO
• E’ una glicoproteina con 527 AA (ca. 70.000 dalton)
• 17 ponti disolfuro
• Dominio per la proteasi serinica al C terminale (260 residui)
ATTIVATORI DEL PLASMINOGENO TISSUTALE IN TERAPIA
Alteplase
(equivalente del t-PA umano)
Reteplase
(analogo semplificato con 355
amminoacidi senza glicosilazioni)
Lanoteplase
(sequenza ridotta e 1 residuo
modificato)
Tenecteplase
(ha 6 residui modificati rispetto a
t-PA umano)
INDICAZIONI
Infarto acuto del miocardio
(bolo)
Embolia polmonare acuta
(infusione endovenosa)
ATTIVATORI DEL PLASMINOGENO TISSUTALE
ENZIMI
Proteine con attività enzimatica/regolativa possono essere impiegate
PER POTENZIARE UN PROCESSO FISIOLOGICO GIÀ ESISTENTE
Attivatore del plasminogeno tissutale
Alteplase
Reteplase
Tenecteplase
Lanoteplase
PER FORNIRE UNA NUOVA ATTIVITÀ BIOLOGICA
Dnase-Dronase alfa (Pulmozyme)
PER SOPPERIRE ALLA MANCANZA DI UNA PROTEINA
Imiglucerase (Cerezyme)
Alglucosidase alfa (Myozyme, Lumizyme)
Idursulfase (Elaprase)
DNASE-DRONASE ALFA (PULMOZYME)
Farmaco impiegato nel trattamento della FIBROSI CISTICA.
Il dornase alfa idrolizza il DNA presente nell'espettorato e nel muco
delle vie aeree e ne riduce la viscosità a livello del polmone.
La ritenzione di secrezioni viscose purulente nelle vie respiratorie
riduce la funzionalità polmonare ed esacerba le infezioni. Le
secrezioni purulente contengono elevatissime concentrazioni di
DNA extracellulare, liberato nel processo di degenerazione dei
leucociti che si accumulano in risposta all'infezione.
Somministrato per via inalatoria (ampolle monodose 2.5
mL) non ha effetto sul DNA intracellulare.
ENZIMI
Proteine con attività enzimatica/regolativa possono essere impiegate
PER POTENZIARE UN PROCESSO FISIOLOGICO GIÀ ESISTENTE
Attivatore del plasminogeno tissutale
Alteplase
Reteplase
Tenecteplase
Lanoteplase
PER FORNIRE UNA NUOVA ATTIVITÀ BIOLOGICA
Dnase-Dronase alfa (Pulmozyme)
PER SOPPERIRE ALLA MANCANZA DI UNA PROTEINA
Imiglucerase (Cerezyme)
Alglucosidase alfa (Myozyme, Lumizyme)
Idursulfase (Elaprase)
ENZIMI PER IL TRATTAMENTO DI MALATTIE DA ACCUMULO LISOSOMIALE
Le malattie da accumulo lisosomiale o (LSD) acronimo
dall'inglese Lysosomial Storage Disease sono un'eterogenea famiglia di
patologie, circa 50, dovute a diversi tipi di difetti genetici, accomunate dalla
caratteristica di determinare un accumulo di metaboliti o sostanze
nei lisosomi con conseguente perdita di funzionalità cellulare. Le cause di
queste patologie sono sempre da ricondurre ad un'anomalia genetica
1. Imiglucerase (Cerezyme)
malattia di Gaucher
2. Alglucosidase alfa (Myozyme, Lumizyme)
malattia di Pompe
3. Idursulfase (Elaprase)
sindrome di Hunter
TERAPIA ENZIMATICA DELLA MALATTIA DI GAUCHER
Malattia genetica in cui si verifica un difetto dell’enzima glucocerebrosidasi.
GLUCOCEREBROSIDASI
1. Scinde il legame beta glucosidico del glucocerebroside, intermedio del
metabolismo glicolipidico (è una beta glucosidase).
2. Si trova nei lisosomi
3. E’ una proteina di 497 residui
MALATTIA DI GAUCHER
La carenza di glucocerebrosidasi comporta l’accumulo di cellule sovraccariche di
lipidi in varie parti dell’organismo, con conseguenze quali ingrossamento di milza e
fegato, anemia, sanguinamento eccessivo e facilità agli ematomi, osteonecrosi,
osteoporosi e altre alterazioni ossee, malattia ossea e con frequenza minore
patologie di altri organi e apparati (neuropatie).
Le complicanze ossee e le relative
conseguenze spesso irreversibili, sono
di solito l’aspetto più debilitante in
assoluto della Malattia di Gaucher.
Tale malattia, se non diagnosticata
e/o trattata adeguatamente può
causare, a lungo termine, una
riduzione dell’aspettativa di vita.
GLUCOCEREBROSIDASI E FARMACI ANALOGHI
•Imiglucerase (Cerezyme)
•Velaglucerase (Vpriv)
•Taliglucerase alfa (Elelyso)
Taliglucerase alfa resulted in mean decreases in spleen
volume (64.6%) and liver volume (24.4%). The drug
demonstrates continued improvement in disease
parameters with no new safety concerns (trattamento di
36 mesi).
TERAPIA ENZIMATICA DELLA MALATTIA DI POMPE
E’ una rara malattia ereditaria anche definita GLICOGENOSI DI TIPO II. Nei
pazienti affetti da questa malattia si osserva la carenza di un enzima chiamato
alfa-glucosidasi acida (GAA). Questo enzima normalmente converte il
glicogeno in glucosio.
MALATTIA DI POMPE
La carenza di questo enzima porta all’accumulo di glicogeno in varie tipologie tissutali –
principalmente quelli cardiaci, respiratori e nel muscolo scheletrico – provocando una
cardiomiopatia ipertrofica ed un progressivo indebolimento muscolare, inclusa la
compromissione della funzione respiratoria.
Nei neonati la malattia di Pompe è rapidamente progressiva e, in genere, senza
trattamento, la morte avviene entro il primo anno di vita
Nei bambini più grandi e negli adulti il decorso della malattia è molto variabile, ma è
comunque fatalmente progressivo, con morbilità significative e spesso mortalità
prematura.
TERAPIA ENZIMATICA DELLA MALATTIA DI POMPE
ALGLUCOSIDASE ALFA (MYOZYME, LUMIZYME)
• Myozyme si presenta sotto forma di polvere per la
preparazione di una soluzione per infusione
endovenosa.
• Ha dimostrato di aumentare significativamente la
sopravvivenza di soggetti affetti da malattia di Pompe. L’83%
dei pazienti trattati col Myozyme è sopravvissuto ed ha
raggiunto l’autonomia respiratoria a 18 mesi di età, in
confronto al 2% dei pazienti del gruppo storico.
• Ha ridotto il bisogno di ventilazione assistita.
• Migliora la capacità motoria e determina progressi nelle
funzioni cardiache insieme a miglioramenti e
stabilizzazione dei parametri di crescita.
• Più precocemente viene diagnosticata la malattia
e iniziato il trattamento ai piccoli pazienti,
migliori sono i risultati osservati.
SINDROME DI HUNTER
Chiamata anche Mucopolisaccaroidosi di tipo II. E’ una malattia genetica caratterizzata
da un difetto dell'enzima iduronato-2-solfatasi. La funzione dell'enzima iduronato-2solfatasi è quella di catabolizzare i glicosaminoglicani (GAG) nei lisosomi attraverso il
clivaggio delle frazioni solfato legate agli oligosaccaridi.
DERMATAN SOLFATO
Il quadro clinico è caratterizzato da una regressione precoce dello sviluppo
psicomotorio. Alla nascita i bambini sono normali e i sintomi compaiono
progressivamente. Nelle forme gravi i segni clinici comprendono i dismorfismi facciali
(macroglossia, bocca costantemente aperta, tratti del viso grossolani),
l'epatosplenomegalia, la ridotta motilità articolare, la bassa statura, ritardo mentale.
Nei pazienti con la forma più grave, le attese di vita sono molto ridotte, e di solito i
pazienti muoiono prima dei 20 anni, per complicazioni cardio-respiratorie. Nelle
forme intermedie, i pazienti sopravvivono in discrete condizioni fino all'età adulta e
talvolta, nei pazienti colpiti in maniera molto meno grave, fino oltre i 60 anni.
IDURSULFASE (ELAPRASE)
Elaprase è una forma purificata dell'enzima lisosomiale iduronato-2-solfatasi,
prodotto mediante tecnologia del DNA ricombinante su una linea cellulare
umana.
La soluzione del farmaco deve essere infusa per 1-3 ore e, sebbene la sua
emivita sia approssimativamente di 45 minuti, l’idursulfasi necessita di 1 sola
somministrazione settimanale
È uno dei farmaci più costosi mai prodotti; la terapia annua costa, infatti,
456.000 euro in quanto glicoproteina complessa prodotta con particolare
metodologia che fornisce un profilo di glicosilazione umano, analogo a quello
dell'enzima naturale.
Glicoproteina costituita da 525 aminoacidi
8 siti di N glicosilazione che sono occupati da catene oligosaccaridiche di tipo
complesso, ibrido e ad alto contenuto di mannosio.
INTERNALIZZAZIONE DEGLI ENZIMI LISOSOMIALI SOMMINISTRATI A SCOPO TERAPEUTICO
Le idrolasi lisosomiali sono prodotte nel
Reticolo Endoplasmatico Rugoso e sono
secrete al Golgi dove vengono vengono
glicosilate in più residui con residui di
mannosio i quali vengono poi
fosforilati.
Questa modifica post traduzionale
serve a direzionare gli enzimi che
vengono così consegnati ai lisosomi
attraverso un percorso mediato dal
recettore del mannosio-6-fosfato.
TRASPORTO SPECIFICO DELLE IDROLASI LISOSOMIALI DAL GOLGI AL LISOSOMA
INTERNALIZZAZIONE DEGLI ENZIMI LISOSOMIALI SOMMINISTRATI A SCOPO TERAPEUTICO
I recettori del mannosio 6-fostato (M6P) son espressi anche sulle membrane cellulari. Così,
gli enzimi lisosomiali possono essere somministrati per via endovenosa e internalizzati dalle
cellule seguendo un percorso endocitotico legandosi ai recettori del mannosio 6-fostato
esposti sulla membrana cellulare.
LE CITOCHINE
• Costituiscono un gruppo di proteine o glicoproteine a basso peso molecolare
(fino a 25 kD), prodotte dalle cellule del sistema immunitario, per mediare e
controllare la risposta immunitaria, la reazione infiammatoria e la fagocitosi.
(MEDIATORI SOLUBILI DELLA RISPOSTA IMMUNITARIA)
• Si legano a specifici recettori con affinità elevata e la risposta cellulare consiste
nella regolazione dell’espressione di geni (es. inducono l’espressione di
molecole di adesione endoteliale)
ANTIVIRALI
ANTITUMORALI
TRATTAMENTO MALATTIE AUTOIMMUNI
INTERFERONI
Gli interferoni (IFN) sono molecole proteiche naturali rilasciate dalle cellule in
risposta a infezioni virali. Scoperti nel 1957, sono stati così chiamati per la loro
capacità di “interferire“ con il processo di infezione virale.
Oggi è assodato che gli interferoni hanno un potenziale d’azione più esteso che si
riflette in:
• ATTIVITÀ ANTIVIRALE
• ATTIVITÀ IMMUNOMODULATORIA
• ATTIVITÀ ANTIPROLIFERATIVA
INTERFERONI
Essi sono tutti glicoproteine. In base all’origine e alle caratteristiche, sono
state individuate tre classi principali di interferoni:
INTERFERONE-α (IFN- α),
prodotto prevalentemente dai leucociti e macrofagi (detto anche
INTERFERONE LEUCOCITICO); Sono noti almeno 16 differenti tipi di IFN-α
umani (165-166 amminoacidi, PM circa 19kDa)
tipo I
INTERFERONE-β (IFN-β),
prodotto da fibroblasti, cellule epiteliali e macrofagi (detto anche
INTERFERONE FIBROBLASTICO). Proteina di 165 amminoacidi (18.5 kDa).
INTERFERONE-γ (IFN-γ),
prodotto dai linfociti T e dalle cellule NK (detto anche
IMMUNOINTERFERONE). Glicoproteina a catena singola di 143 aa (15.5
kDa) che forma dimeri (proteina omodimerica).
tipo II
Gli interferoni alfa e beta appartengono alla stessa sottoclasse di tipo I, mentre
l’interferon gamma appartiene ad una sottoclasse distinta, detta di tipo II.
ATTIVITÀ ANTIVIRALE DEGLI INTRFERONI
Il legame degli interferoni con i propri recettori induce la sintesi di diverse
proteine, che contribuiscono alla resistenza virale della cellula. La maggior
parte di queste proteine agisce mediante:
•
Inibizione della trascrizione degli RNA del virus.
•
Inibizione della traduzione degli RNA del virus.
•
Inibizione della glicosilazione delle proteine virali (glicosiltransferasi).
•
Inibizione della penetrazione del virus nella cellula.
•
Degradazione dell’RNA virale.
ATTIVITÀ ANTIPROLIFERATIVA DEGLI INTERFERONI
Sulle cellule tumorali, l’interferon alfa è in grado di aumentare l’espressione del
complesso maggiore di istocompatibilità di classe 1 e soprattutto di fare in
modo che poi queste cellule esprimano antigeni tali per cui possono essere
riconosciuti dai sistemi di difesa dell’ospite.
È anche in grado di diminuire la proliferazione della cellula tumorale
stessa. Questo è stato osservato in colture cellulari di alcuni tipi di tumori.
L’interferone viene usato quasi sempre in combinazione
con altri metodi, quali la chemioterapia, ed è attivo solo in
alcuni tipi di cancro.
INTERFERONE α
ANTIVIRALE
Come antivirale, l’interferone-α è indicato per il
trattamento di pazienti adulti affetti da epatite
cronica B ed epatite cronica C.
Nel trattamento dell’epatite cronica B,
l’esperienza clinica attuale indica che la terapia con
interferone-α può indurre una significativa
riduzione della morbilità e della mortalità.
L’uso ottimale dell’interferone-α per il trattamento dell’epatite cronica C è
in associazione a ribavirina. L’interferone-α in monoterapia, o in
associazione, è stato valutato in studi clinici randomizzati: nei pazienti con
epatite cronica C, che hanno ricevuto interferone-α in combinazione a
ribavirina, il tasso di risposta virologica ottenuta è stato pari al 47% (efficacia
almeno due volte superiore rispetto alla monoterapia).
INTERFERONE α
ANTITUMORALE
B cell
L’interferone-α ha dimostrato effetti antineoplastici in alcuni linfomi e
tumori solidi. Un’indicazione approvata è il trattamento di pazienti affetti
da leucemia a cellule capellute, per la maggior parte dei quali la
normalizzazione di uno o più parametri ematologici si manifesta entro uno due
mesi di trattamento. Per questo tipo di neoplasia, l’interferone- α
induce remissione della malattia nel 90% circa dei pazienti, mentre in altri
tipi di tumore i risultati sono meno significativi.
È, inoltre, indicato per la cura della leucemia mieloide cronica. La
somministrazione in associazione con citarabina migliora in modo
significativo la percentuale di risposte citogenetiche e prolunga al
sopravvivenza globale rispetto all’interferone-α in monoterapia.
Altre indicazioni, approvate dalla FDA, sono il trattamento del sarcoma di
Kaposi (associato all’AIDS); il melanoma
maligno, come terapia adiuvante in pazienti a rischio di recidiva e il
mieloma multiplo, in terapia di mantenimento.
Interferone-α2A ricombinante (ROFERON-A)
INTERFERONE α
Interferone-α2B ricombinante (INTRON-A)
I prodotti commerciali sono versioni ricombinanti costituite da una
catena proteica di 165 amminoacidi e differiscono solo per la
costituzione dell’amminoacido in posizione 23. L’interferoneα2A ricombinante (ROFERON-A ) contiene un residuo di lisina in
posizione 23; l’interferone-α2B ricombinante (INTRON-A)
contiene, nella stessa posizione, un residuo di arginina. Tali
biofarmaci si producono modificando geneticamente E. coli e
quindi sono proteine non glicosilate.
Sono disponibili anche in Italia i derivati coniugati con polietilenglicole
(PEG), rispettivamente, peginterferone-α2A (PEGASYS®) e peginterferone-α2B
(PEGINTRON®).
Un effetto secondario importante è la sindrome simil-influenzale
(caratterizzata da dolori muscolari, febbre, dolori articolari), che si
presenta nella maggior parte dei pazienti entro la prima settimana di cura.
Si raccomanda, per questo motivo, l’uso concomitante di paracetamolo.
INTERFERONE β
IFN β1b (BETASERON)
Forma ricombinante stabile (165 amminoacidi, 18.5 kDa). Prodotto in E coli.
Differisce dalla proteina naturale per un singolo amminoacido (serina invece di
cisteina in posizione 17).
IFN β1a (AVONEX)
Espresso in cellule di mammifero è analogo del naturale.
Trattamento della Sclerosi multipla
Avonex: 1 fiala alla settimana per via intramuscolare
L’esatto meccanismo di azione dell’interferone-β nella cura
della sclerosi multipla non è
conosciuto
INTERFERONE
IFN 1b (ACTIMMUNE)
Ha un’attività antivirale più modesta rispetto agli
interferoni di tipo I. L’effetto più importante di questo interferone è
l’attivazione dei macrofagi e dei monociti. Tale stimolazione promuove
l’attività fagocitaria, importante per la neutralizzazione del patogeno. Induce
la sintesi di enzimi lisosomiali (idrolitici) e di enzimi coinvolti nella produzione
di sostanze ossidanti altamente reattive, consentendo ai macrofagi di
espletare l’azione distruttiva nei confronti del patogeno.
L’interferone-γ è indicato per la riduzione della frequenza e della gravità
delle infezioni associate alla malattia granulomatosa cronica. Si tratta di
un disturbo ereditario caratterizzato da un difetto del metabolismo
ossidativo dei fagociti, che compromette la funzionalità delle cellule
preposta alla distruzione degli agenti infettivi (batteri, protozoi). Come risultato, i pazienti soffrono di
infezioni ripetute, molte delle quali necessitano di essere trattate a vita.
Altre applicazioni dell’interferone-γ, ancora in fase sperimentale, sono il
trattamento del carcinoma delle cellule renali, alcuni tipi di tumori
polmonari, varie malattie infettive e leishmaniosi, una patologia comune nelle aree
tropicali e subtropicali, causata da alcuni protozoi. La malattia è caratterizzata dalla presenza
di questi protozoi all’interno dei macrofagi, la cui azione tossica nei confronti del parassita è
potenziata dall’interferone-γ.
INTERLEUCHINE
Le interleuchine costituiscono un sottogruppo piuttosto eterogeneo di
proteine, il cui ruolo è fondamentale nella risposta immunitaria, sia naturale
che acquisita.
Il termine deriva da “interleucocita” in quanto,
sintetizzate da linfociti, monociti e macrofagi, esse fungono da messaggeri
solubili tra i leucociti, mettendoli in condizione di comunicare tra di loro.
Coordinano la risposta immunitaria così da permettere all’organismo di
fronteggiare un’infezione nel modo più efficace possibile.
POTENZIALE TERAPEUTICO
Potenziale applicabilità al trattamento di
infezioni, immunodeficienze e cancro.
Potenziale applicabilità al trattamento di
malattie autoimmuni
IL-1RA
ANAKINRA (KINERET)
ARTRITE REUMATOIDE
Immunosoppressore
L’antagonista del recettore dell’IL-1 (IL-1Ra), è una citochina prodotta
principalmente dai monocito-macrofagi e dai neutrofili; è un antagonista specifico
ad alta affinità, in grado di inibire in modo competitivo il legame dell’IL-1, al proprio
recettore.
L’interleuchina-1 (IL-1) è una citochina proinfiammatoria fondamentale che media
numerose risposte cellulari, comprese quelle importanti nell’infiammazione
sinoviale. IL-1 è riscontrabile nel plasma e nel liquido sinoviale dei pazienti
affetti da artrite reumatoide ed è stata descritta una correlazione fra le
concentrazioni di IL-1 nel plasma e l’attività della malattia.
Anakinra (Kineret) è la versione
ricombinante di IL-1RA prodotta in E.coli.
Kineret è indicato in pazienti adulti per il
trattamento dei segni e dei sintomi
dell’artrite reumatoide (AR) in
associazione con metotrexato.
IL-2
ALDESLEUCHINA (PROLEUKIN)
ANTITUMORALE
L’interleuchina-2 (IL-2) è il principale fattore di crescita autocrino dei
linfociti T. Viene fondamentalmente sintetizzata e secreta dai linfociti T
attivati dal contatto dell’antigene.
L’interleuchina-2 ricombinante di origine umana (aldesleuchina) è
disponibile in commercio con il marchio di PROLEUKIN®; è impiegata nella bioterapia
del cancro, termine che designa l’uso di sostanze terapeutiche di origine biologica, in
grado di aumentare le normali interazioni cellulari del sistema immunitario.
A differenza dei chemioterapici classici, che inibiscono direttamente la
proliferazione delle cellule cancerose, la bioterapia è piuttosto
un’immunoterapia, in cui il farmaco biologico attiva il sistema immunitario a
riconoscere ed eliminare certi tipi di cellule cancerose
Indicazioni approvate: carcinoma
metastatico delle cellule renali e melanoma metastatico.
IL-2
DENILEUKIN
DIFTITOX (ONTAK)
ANTITUMORALE
Una proteina di fusione citotossica, derivata da tecnologie di rDNA, è la
denileukin diftitox (Ontak). Essa strutturalmente è composta da una porzione
della sequenza amminoacidica della tossina difterica seguita dalla sequenza
amminoacidica dell’IL-2.
Denileukin diftitox è realizzata per dirigere
l’azione citotossica della tossina difterica alle
cellule che esprimono il recettore per IL-2.
Cellule maligne, che esprimono una o più delle
subunità del recettore per
l’IL-2, si trovano in certi tipi di leucemie e linfomi.
È stata approvata dalla FDA per il trattamento
di pazienti con linfoma cutaneo delle cellule T.
L’espressione in queste cellule della componente CD25 del
recettore per l’IL-2, indirizza la proteina di fusione
ricombinante citotossica sulla superficie cellulare delle
cellule T maligne, portando così la tossina
difterica ad uccidere direttamente il bersaglio.
TUMOR NECROSIS FACTOR
ETANERCEPT (ENBREL)
ARTRITE
REUMATOIDE
Immunosoppressore
Il TNF-α induce varie azioni proinfiammatorie nelle cellule endoteliali, tra
cui la produzione di citochine, l’espressione di molecole di adesione, la liberazione
di sostanze procoagulatorie e l’induzione di sintetasi dell'ossido nitrico (NOS).
L'etanercept (ENBREL) è una proteina di fusione, ottenuta tramite tecniche
del DNA ricombinante, dall'unione del recettore umano per il fattore TNF-alfa
con la frazione Fc dell'immunoglobulina umana IgG1.
La proteina funziona da recettore solubile
per il TNF-alfa e possiede alta affinità di
legame per il TNF-alfa.
È una molecola complessa, dall'alto peso
molecolare, circa 150 KDa, che si lega
al TNFα andando ad inibire la sua attività
nel processo evolutivo dell'infiammazione,
sia nell'uomo sia negli animali.
È indicato nel trattamento DELL'ARTRITE
REUMATOIDE GRAVE.
TUMOR NECROSIS FACTOR
ETANERCEPT (ENBREL)
ARTRITE
REUMATOIDE
Immunosoppressore
FATTORI DI CRESCITA EMATOPOIETICI
Regolano la formazione, la proliferazione e il differenziamento di globuli rossi
e bianchi del sangue e delle piastrine.
Comprendono IL-(3-7), eritropoietina, fattori di cellule staminali, fattori colonie
stimolanti granulociti-macrofagi (GM-CSF), fattori colonie stimolanti
granulociti (G-CSF), fattori colonie stimolanti macrofagi (M-CSF).
EPOIETINA ALFA (EPREX)
•
•
•
•
Glicoproteina (165 residui, 30.4 kDa)
Prodotta dal rene
Stimola la produzione di globuli rossi
Presenta 4 siti di glicosilazione e due ponti disolfuro indispensabili per l’attività
INDICAZIONI
• trattamento di anemie
associata a insufficienza
renale cronica
• trattamento specialistico in
pazienti sottoposti
a chemioterapia per tumori
solidi, linfoma maligno
o mieloma multiplo, per
ridurre la necessità di
trasfusioni.
• Pazienti chirurgici adulti
facenti parte di un
programma di predonazione
autologa.
DARBEPOETINA ALFA (ARANESP)
Glicosilazione modificata
E’ derivato di seconda generazione dell’epoietina alfa da cui differisce per la
presenza di siti di glicosilazione addizionali. A causa del maggiore contenuto di
carboidrati, darbepoetina alfa ha un’emivita più lunga (25 ore) e quindi una
maggiore attività in vivo. Nonostante queste modifiche molecolari, darbepoetina
alfa mantiene un’elevatissima specificità per il recettore dell’eritropoietina
MIRCERA
Forma pegilata
Rientra nella categoria degli attivatori continui del recettore per l'eritropoietina,
per le sue proprietà farmacocinetiche decisamente differenti rispetto alle altre
forme di eritropoetina. Questa molecola, presenta una lunga emivita, stimata
intorno alle 139 ore ed evidentemente superiore alle poche ore delle altre
forme, permette di ridurre la frequenza di somministrazione, mantenendo
comunque un'elevata efficacia.
ANTICORPI COME IMMUNOTERAPIA
IMMUNITÀ UMORALE =
IMMUNITÀ MEDIATA DA ANTICORPI
I linfociti B sono le cellule cardine
dell'immunità umorale
Risposta immunitaria acquisita
Risposta Immunitaria specifica
Risposta associata a memoria
Risposta in grado di discriminare
self da non-self
ANTICORPI
Gli anticorpi sono glicoproteine secrete da linfociti B specializzati
denominati plasmacellule.
ANTICORPI POLICLONALI
I primi studi sugli anticorpi analizzavano immunoglobuline presenti nel
sangue di soggetti immunizzati. Questa metodica, non condusse a grandi
conclusioni per la presenza di moltissimi anticorpi differenti fra loro e
specifici per porzioni diverse di un antigene (anticorpi policlonali).
ANTICORPI POLICLONALI
Dal momento che la maggior parte degli antigeni porta diversi
determinanti antigenici, un singolo antigene darà origine alla
produzione di una miscela di anticorpi, ciascuno prodotto da un
diverso clone di linfociti B. Si parla allora di risposta immunitaria
policlonale.
LIMITI
È difficile eliminare dal siero altri tipi di anticorpi, non
specifici per l’antigene che ci interessa.
L’affollamento di anticorpi diversi, ha l’inconveniente
che a volte il siero riconosce anche sostanze simili,
ma diverse, da quella cercata.
Inoltre la risposta anticorpale non è mai costante.
La quantità di anticorpi prodotti è in genere limitata.
ANTICORPI POLICLONALI e MONOCLONALI
Notevoli progressi furono effettuati esaminando il sangue di pazienti affetti da mieloma
multiplo, un tumore delle plasmacellule, che porta alla formazione di grandi quantità di
anticorpi uguali.
Sarebbe quindi necessario disporre di un clone di linfociti B che producesse grandi
quantità di un anticorpo in grado di legarsi a un solo determinante antigenico: un
anticorpo monoclonale. Anticorpi tra loro identici in quanto derivati da cloni originati da
un’unica cellula. Sono estremamente specifici nel legare una determinata sequenza
(epitopo) presente su un antigene. Ogni specifico anticorpo, che riconosce uno specifico
epitopo (DETERMINANTE ANTIGENICO), è prodotto da uno specifico linfocita B.
ANTICORPI MONOCLONALI
Tuttavia i linfociti B coltivati in
vitro, muoiono dopo
brevissimo tempo.
La scoperta degli anticorpi monoclonali (mAb) risale al 1975, quando 2 ricercatori
Cesar Milstein e Georges Kohler (che nel 1984 vinsero il premio Nobel per la
medicina) misero a punto la tecnica per la sintesi degli anticorpi monoclonali
PRODUZIONE DI ANTICORPI MONOCLONALI: TECNICA DELL’IBRIDOMA
Per produrre un anticorpo monoclonale
specifico per un certo antigene è necessario
immunizzare un topo con tale antigene (1), i
linfociti B vengono poi isolati dalla milza o dai
linfonodi dell’animale (2). Si procede poi alla
fusione dei linfociti B con la linea
immortalizzata adatta (3). Le linee di mieloma
sono i partners di fusione migliori per i linfociti
B, dato che queste cellule tendono a fondere
e dare origine ad ibridi stabili (4). Gli ibridi
generati vengono selezionati in terreni di
coltura selettivi in cui cresceranno e
sopravivranno solo gli ibridi (5). Le cellule fuse
vengono poi seminate e una volta identificati
i pozzetti positivi (ossia i pozzetti contenenti
l’anticorpo della specificità voluta), le cellule
vengono clonate. Per ottenere grandi quantità
di anticorpi è possibile far crescere i cloni di
ibridoma che producono anticorpi della
specificità voluta in colture su larga scala.
ANTICORPI: STRUTTURA
Gli anticorpi, pur appartenendo a diverse classi, hanno una stessa struttura di base: due coppie
di molecole proteiche, disposte a Y e legate fra loro mediante ponti disolfuro, ossia mediante
l’interazione di atomi di zolfo. Due catene proteiche hanno un elevato peso molecolare e sono
dette “pesanti”; le altre due hanno un peso inferiore e sono dette “leggere”. Sia nelle catene
leggere, sia in quelle pesanti vi sono regioni definite costanti, che hanno struttura simile negli
anticorpi di una stessa classe; le regioni variabili sono invece estremamente differenziate (cioè
formate da amminoacidi diversi) e permettono agli anticorpi il riconoscimento di una enorme
quantità di molecole estranee (antigeni).
ANTICORPI UMANI: ISOTIPI
Differenze presenti nella sequenza amminoacidica della regione costante
conferiscono una distinzione delle immunoglobuline in classi (denominate
anche isotipi).
ANTICORPI UMANI: ISOTIPI
ANTICORPI TERAPEUTICI: IgG
Tutti gli anticorpi terapeutici attuali sono della classe IgG.
• Costituiscono la principale Ig sierica (80 % ca).
• Hanno lunga emivita (ca 23 giorni).
• Producono opsonizzazione, attivazione del complemento, citotossicità
cellulare anticorpo dipendente.
Poiché l'obiettivo della terapia anticorpo è
uccidere direttamente la cellula bersaglio,
l'isotipo di scelta è IgG1, poiché questo
isotipo è ottimale per la fissazione del
complemento.
ANTICORPI TERAPEUTICI: IgG
N
CATENA LEGGERA
Regione variabile (VL)
Regione costante (CL)
CATENA PESANTE
Regione variabile (VH)
Tre regioni costanti (CH1, CH2, CH3)
C
I ponti disolfuro intercatena nella regione cerniera stabilizzano la struttura
complessiva
La glicosilazione influenza l’attività
Peso di circa 150.000 dalton
ANTICORPI TERAPEUTICI: IgG
6 regioni ipervariabili per ogni
braccio dell'immunoglobulina
Le regioni determinanti la complementarità (Complementarity-Determining
Regions, CDR) formano una superficie complementare all'antigene. Regioni ipervariabili
che identificano tratti della catena polipeptidica dove si riscontrano le maggiori variabilità
amminoacidiche che donano a ciascun anticorpo la specificità unica verso un antigene.
ANTICORPI MONOCLONALI: IMPIEGHI
• PURIFICAZIONE DI PROTEINE (immunoprecipitazione)
• IDENTIFICAZIONE E ISOLAMENTO DI POPOLAZIONI CELLULARI
(immunofluorescenza)
• REAGENTI DIAGNOSTICI (ELISA, enzyme-linked immunosorbent assay)
• ANTICORPI CATALITICI (abzimi)
• DETOSSIFICAZIONE DA FARMACI
• IMPIEGO DIAGNOSTICO
• IMPIEGO TERAPEUTICO
IMMUNOFLUORESCENZA
ELISA
ANTICORPI MONOCLONALI: AREE TERAPEUTICHE
A scopo terapeutico vengono somministrati per una vasta gamma di condizioni,
anche se la stragrande maggioranza sono utilizzati per il cancro, malattie
autoimmuni (morbo di Crohn, artrite reumatoide) e il trapianto. Altre indicazioni
comprendono la prevenzione della necrosi ischemica del miocardio secondaria a
trombosi coronarica e l’osteoporosi.
ANTICORPI MONOCLONALI: MECCANISMO D’AZIONE
I frammenti con sito di legame per l'antigene
(FAB = Fragment Antigen Binding) possono esercitare
effetti diretti attraverso interazioni di legame con
l'antigene (ad esempio, bloccando una proteina di
riconoscimento dell’ ospite o inibiscono una tossina o un
enzima di un agente patogeno).
Il frammento cristallizzabile
(FC = Fragment, crystallizable) interagisce con una varietà
di molecole accessorie al fine di mediare funzioni
effettrici indirette quali
• citotossicità cellulare anticorpo-dipendente (ADCC)
• fagocitosi cellulare anticorpo-dipendente (ADCP)
• citotossicità complemento-dipendente (CDC)
E’ importante anche per le caratteristiche
farmacocinetiche.
ANTICORPI TERAPEUTICI
La maggior parte degli anticorpi terapeutici sono costituiti dall’intera
struttura anticorpale piuttosto che dai soli frammenti Fab. I vantaggi
dell'utilizzo di anticorpi non modificati includono
• una più lunga emivita sierica a seguito di interazione con FcRn,
• migliorata funzione effettrice tramite interazione con una ampia
gamma di recettori Fc,
• neutralizzazione più efficace rispetto al corrispondente frammento Fab
LIMITI DEGLI ANTICORPI MONOCLONALI MURINI
• Inducono una risposta immunitaria
• Mostrano una emivita relativamente breve quando
somministrati all’uomo (24 ore circa)
• Si ha uno scarso riconoscimento del dominio fc degli
anticorpi murini da parte dei meccanismi effettori umani
PERTANTO VENGONO DI SOLITO RESI
CHIMERICI O UMANIZZATI
EVOLUZIONE DEGLI ANTICORPI MONOCLONALI
ANTICORPI MONOCLONALI: NOMENCLATURA
Terminano tutti con lo desinenza (-MAB)
la nomenclatura di un anticorpo monoclonale usa differenti parti
della parola a seconda della struttura e funzione.
EVOLUZIONE DEGLI ANTICORPI MONOCLONALI
La maggior parte degli anticorpi
monoclonali in commercio sono
umanizzati o totalmente umani
• Non inducono una risposta immunitaria
• Mostrano un’emivita più lunga (23 giorni contro le 24 ore dei
murini)
• Si ha adeguato riconoscimento del dominio fc da parte dei
meccanismi effettori umani
ANTICORPI MONOCLONALI: MECCANISMO D’AZIONE ANTITUMORALE
In base al meccanismo d’azione possono essere classificati in
ANTICORPI MONOCLONALI NUDI : lisano direttamente le cellule neoplastiche
Tossine
ANTICORPI MONOCLONALI CONIUGATI
Sostanze Radioattive
Farmaci
Enzimi attivatori di un profarmaco
ANTICORPI MONOCLONALI NUDI: MECCANISMO D’AZIONE ANTITUMORALE
Lisi della cellula target mediante:
Citotossicità dipendente dal complemento (CDC)
Comporta la lisi del target tramite fissazione del
complemento (IgG1 e IgG3)
• Generazione di fattori pro-infiammatori.
• Chemioattrazione di cellule fagocitiche.
• Potenziamento della fagocitosi attraverso la
produzione di proteine opsonizzanti.
• Formazione di pori sulla membrana del
microrganismo-uccisione di quest’ultimo.
ANTICORPI MONOCLONALI NUDI: MECCANISMO D’AZIONE ANTITUMORALE
Lisi della cellula target mediante:
Citotossicità dipendente dall’anticorpo
(ADCC)
Questo processo si attua quando un anticorpo
riconosce un antigene sulla membrana di una
cellula e reagisce con essa, lasciando libera la
sua frazione Fc. Le cellule con capacità
citotossica e recettori per Fc, come le cellule
NK ed i macrofagi, si uniscono al frammento Fc
della immunoglobulina e producono fattori
citotossici per la cellula presentante l'Ag.
Effetto opsonizzante del
frammento costante (Fc)
ANTICORPI MONOCLONALI NUDI: MECCANISMO D’AZIONE ANTITUMORALE
Lisi della cellula target mediante:
Induzione diretta dell’apoptosi della cellula
esprimente l’antigene
Alcuni anticorpi monoclonali agiscono mediante
legame con antigeni specifici espressi dalla cellula
tumorale inducendo apoptosi, inibendo la crescita, o
interferendo con una funzione chiave per la
proliferazione cellulare.
In alcuni casi, bloccano la connessione tra una
cellula tumorale e citochine che promuovono
la crescita cellulare - un'attività che è
necessaria per la crescita del tumore e la sua
sopravvivenza. Possono riconoscere la
citochina o il suo recettore
AZIONE NEUTRALIZZANTE
ANTICORPI MONOCLONALI NUDI: MECCANISMO D’AZIONE ANTITUMORALE
Alcuni anticorpi monoclonali
prevengono la crescita di vasi
sanguigni che nutrono il tumore.
Bloccano le interazioni proteinacellule necessarie per lo sviluppo di
nuovi vasi sanguigni.
ANTICORPI MONOCLONALI APPROVATI PER IL TRATTAMENTO DI VARIE FORME DI CANCRO
LA FAMIGLIA DEI RECETTORI DEI FATTORI DI CRESCITA
EPIDERMICI COME TARGET ANTITUMORALI DEGLI ANTICORPI
MONOCLONALI
•ErbB-1, also named epidermal growth
factor receptor (EGFR)
•ErbB-2, also named HER2
•ErbB-3, also named HER3
•ErbB-4, also named HER4
OMO O ETERODIMERI
The main transduction pathways regulated by the four HER family members—EGFR,
HER2, HER3, and HER4
Different ligands bind to the
extracellular domain of the
receptors, inducing
homodimerization or
heterodimerization to form
several receptor combinations.
HER2 is the preferred
dimerization partner for other
HER receptors. Receptor
phosphorylation results from
tyrosine kinase activity within
the cytoplasmic domains, which
in turn activates downstream
signaling pathways.
Fornaro, L. et al. (2011) Anti-HER agents in gastric cancer: from bench to bedside
Nat. Rev. Gastroenterol. Hepatol. doi:10.1038/nrgastro.2011.81
N
C
HER1 e HER2 sono stati individuati come possibili bersagli per il trattamento
con anticorpi monoclonali
Ce-tu-xi-mab (Erbitux, 2004)
Pani-tum-u-mab (Vectibix, 2006)
Neci-tum-u-mab (Portrazza, 2015)
L’EGFR (il recettore per il fattore di crescita epidermico) è una
glicoproteina transmembrana che fa parte di una sottofamiglia di
recettori tirosinchinasici. Quando attivato il recettore dimerizza con
conseguente attivazione del dominio tirosin chinasico citoplasmatico.
Questo promuove la crescita cellulare nei tessuti epiteliali normali,
inclusi la cute ed il follicolo pilifero.
Il prodotto proteico del proto-oncogene RAS è un trasduttore
centrale del segnale a valle per l’EGFR. Nei tumori, l’attivazione di
RAS tramite l’EGFR contribuisce ad un aumento della
proliferazione, della sopravvivenza e della produzione di fattori
pro-angiogenici mediati da EGFR. RAS è una delle famiglie di
oncogeni attivate più di frequente nei tumori umani.
EGFR viene sovraespresso in diversi tipi di cellule tumorali (colonretto, ovarico, polmone e cervello) dove appare mutato e
costitutivamente attivato favorendo proliferazione e
invasione/migrazione delle cellule tumorali che portano a metastasi
cellulare.
EGFR
Tumore colon-retto
Carcinoma polmonare non a piccole cellule (NSCLC)
Ce-tu-xi-mab (Erbitux, 2004)
Pani-tum-u-mab (Vectibix, 2006)
Neci-tum-u-mab (Portrazza, 2015)
EGFR
Cetuximab è un anticorpo monoclonale chimerico IgG1 specificamente diretto EGFR.
Cetuximab si lega all’EGFR con un’affinità che è circa 5-10 volte più alta di quella dei ligandi
endogeni.
1) Cetuximab blocca il legame con i ligandi endogeni dell’EGFR, inibendo così la funzione del
recettore.
2) Esso inoltre induce l’internalizzazione dell’EGFR, il che può provocare la down-regulation
dell’EGFR stesso.
3) Cetuximab inoltre indirizza le cellule immunitarie effettrici citotossiche verso le cellule
tumorali che esprimono l’EGFR (citotossicità cellulo-mediata anticorpo-dipendente, ADCC).
Panitumumab è un anticorpo monoclonale
ricombinante completamente umano del tipo
IgG2. Il suo meccanismo d’azione è analogo
Necitumumab è un anticorpo monoclonale
IgG1 umano approvato da FDA nel 2015
anche per il trattamento di alcune forme di
cancro polmonare.
Ce-tu-xi-mab (Erbitux, 2004)
Pani-tum-u-mab (Vectibix, 2006)
Neci-tum-u-mab (Portrazza, 2015)
EGFR
Indicati per il trattamento di pazienti affetti da carcinoma metastatico del colonretto con espressione del recettore per il fattore di crescita epidermico (EGFR)
• in associazione con chemioterapia a base di irinotecan (inibitore della DNA
topoisomerasi I)
• in prima linea in associazione con FOLFOX (5-fluorouracile, leucovorin e
oxaliplatino)
• in monoterapia nei pazienti nei quali sia fallita la terapia a base di oxaliplatino
e irinotecan e che siano intolleranti a irinotecan.
Indicati per il trattamento di pazienti affetti da carcinoma a cellule squamose di
testa e collo
• in associazione con radioterapia per la malattia localmente avanzata;
• in associazione con chemioterapia a base di platino nella malattia ricorrente
e/o metastatica.
Tras-tu-zu-mab (Herceptin, 1998)
Per-tu-zu-mab (Perjeta, 2012)
HER2
HER2 (il recettore 2 per il fattore di crescita epidermico umano) è
un recettore orfano di membrana del tipo tirosin chinasico,
coinvolta nelle vie di trasduzione del segnale che portano alla
crescita ed al differenziamento cellulare. L’iperespressione di HER2
si osserva nel 20 %-30 % dei tumori mammari primari. Studi svolti
indicano che i pazienti affetti da tumore mammario con
iperespressione di HER2 hanno una sopravvivenza libera da
malattia più breve rispetto ai pazienti affetti da tumore senza
iperespressione di HER2
Tumore al seno
Tumore dello stomaco
Proliferazione neoplastica
Tras-tu-zu-mab (Herceptin, 1998)
Trastuzumab è un anticorpo monoclonale IgG1
umanizzato ricombinante contro il recettore 2 del fattore
di crescita epidermico umano (HER2). Trastuzumab si lega
con un’elevata affinità e specificità al subdominio IV, una
regione perimembranosa del dominio extracellulare di
HER2.
1) Il legame di trastuzumab con HER2 ne inibisce
l’attivazione. Conseguentemente, inibisce la
proliferazione delle cellule tumorali umane che
iperesprimono HER2.
2) Il farmaco attiva il complemento.
3) Inoltre il trastuzumab è un potente mediatore della
citotossicità anticorpo dipendente cellulo-mediata
(ADCC). In vitro la ADCC mediata da trastuzumab ha
dimostrato di essere esercitata in maniera preferenziale
sulle cellule tumorali con iperespressione di HER2,
rispetto alle cellule tumorali che non iperesprimono HER2.
4) Il farmaco induce eliminazione endocitotica del
recettore.
HER2
Per-tu-zu-mab (Perjeta, 2012)
Perjeta è un anticorpo monoclonale IgG1
umanizzato ricombinante mirato
specificamente al dominio di
dimerizzazione extracellulare
(sottodominio II) del recettore del fattore di
crescita epiteliale umano 2 (HER2) e, quindi,
blocca la eterodimerizzazione ligandodipendente di HER2 con altri membri della
famiglia HER, compresi EGFR, HER3 e HER4.
L’associazione trastuzumab, pertuzumab
e docetaxel è stata approvata come
trattamento di prima linea per i tumori al
seno positivi per HER2.
HER2
L’ANTIGENE CD20 COME TARGET ANTITUMORALE DEGLI
ANTICORPI MONOCLONALI
TUMORI EMATOLOGICI
Ri-tu-xi-mab (Rituxan, Mabthera, 1997)
Ofa-tum-u-mab (Arzerra, 2009)
Obinu-tu-zu-mab (Gazyvaro, 2013)
CD20
L’antigene transmembranico CD20 è una fosfoproteina
Leucemie e linfomi
non glicosilata, che si trova sui linfociti B ma viene persa
durante il differenziamento a plasmacellule. L'antigene
viene espresso su oltre il 95 % di tutti i linfomi nonHodgkin a cellule B. Si trova anche nelle cellule B normali.
Presenta una regione idrofobica
che attraversa 4 volte la
membrana, rendendola simile
alla struttura di un canale
ionico. Entrambe le porzioni Nterminale e C-terminale della
molecola sono localizzate nel
citoplasma. L’esatta funzione
del CD20 rimane ancora
sconosciuta (CANALE Ca++?).
Ri-tu-xi-mab (Rituxan, Mabthera, 1997)
Ofa-tum-u-mab (Arzerra, 2009)
Obinu-tu-zu-mab (Gazyvaro, 2013)
CD20
Il rituximab è un anticorpo monoclonale IgG1 chimerico. Il dominio Fab del rituximab si
lega all'antigene CD20 sui linfociti B e il dominio Fc può attivare le funzioni effettrici del
sistema immunitario con lo scopo di provocare la lisi delle cellule B. I meccanismi possibili
della lisi cellulare mediata dall’effettore comprendono:
1) la citotossicità complemento-dipendente (CDC) attraverso il legame con il C1q e
2) la citotossicità cellulare anticorpodipendente (ADCC) mediata da uno o più recettori
Fcγ sulla superficie di granulociti, macrofagi e cellule NK.
3) È stato anche dimostrato che il legame del rituximab all’antigene CD20 sui linfociti B
induce la morte cellulare per apoptosi.
Ofatumumab è un anticorpo monoclonale umano (IgG1). E’ stato osservato che
ofatumumab induce lisi cellulare nelle cellule rituximab-resistenti.
Obinutuzumab è un anticorpo monoclonale anti-CD20 di tipo umanizzato della
sottoclasse IgG1. La glicoingegnerizzazione della regione Fc di obinutuzumab comporta
un’affinità maggiore per i recettori FcɣRIII presenti sulle cellule effettrici del sistema
immunitario, quali cellule NK (Natural Killer), macrofagi e monociti, rispetto agli
anticorpi non glicoingegnerizzati.
Ri-tu-xi-mab (Rituxan, Mabthera, 1997)
Ofa-tum-u-mab (Arzerra, 2009)
Obinu-tu-zu-mab (Gazyvaro, 2013)
CD20
MabThera è indicato per il trattamento di pazienti affetti da linfoma nonHodgkin, CD20 positivo, diffuso a grandi cellule B, in associazione a
chemioterapia (ciclofosfamide, doxorubicina, vincristina, prednisolone).
MabThera , Arzerra e Gazyvaro in associazione a chemioterapia sono
indicati per il trattamento di pazienti con leucemia linfatica cronica (LLC)
recidiva/refrattaria.
MabThera in associazione a metotressato è indicato per il trattamento
dell’artrite reumatoide attiva di grado grave in pazienti adulti che hanno
mostrato un’inadeguata risposta o un’intolleranza ad altri farmaci
antireumatici. I linfociti B secernono il Fattore Reumatoide (FR). I pazienti
positivi per il fattore reumatoide con bassa disabilità possono ottenere una
risposta clinica efficace quando trattati con Rituximab.
FATTORE DI CRESCITA DELLE CELLULE ENDOTELIALI VASCOLARI (VEGF)
COME TARGET ANTITUMORALE DEGLI ANTICORPI MONOCLONALI
Under pathologic conditions, VEGF is
secreted by tumor cells in the majority of
cancers and acts on endothelial cells of
existing blood vessels to promote new
blood vessel formation. VEGF release by
tumor cells initiates the angiogenic
process by activating endothelial cells
and promoting their migration.
Pathologic angiogenesis is critical to the
growth (by providing oxygen and other
nutrients) and malignant dissemination
(providing a route for metastases) of solid
tumors
Beva-ci-zu-mab (Avastin, 2004)
Bevacizumab, legandosi al fattore di
crescita delle cellule endoteliali vascolari
(VEGF), promotore chiave della
vasculogenesi e dell’angiogenesi, impedisce
a quest’ultimo di legarsi ai suoi recettori
sulla superficie delle cellule endoteliali.
VEGF
Carcinoma metastatico del colon-retto
Cancro seno
Cancro ovarico
Il blocco dell'attività biologica del VEGF fa regredire la vascolarizzazione dei tumori,
normalizza la vascolarizzazione tumorale residua, e inibisce la formazione di nuova
vascolarizzazione, impedendo perciò la crescita tumorale.
Beva-ci-zu-mab (Avastin, 2004)
VEGF
Bevacizumab in associazione con chemioterapia è indicato per il trattamento di
•
•
•
•
•
•
carcinoma metastatico del colon e del retto.
carcinoma polmonare, avanzato, metastatico.
carcinoma renale avanzato e/o metastatico.
carcinoma ovarico.
carcinoma alle tube di falloppio.
carcinoma della cervice persistente.
Bevacizumab in associazione con paclitaxel è indicato
per il trattamento in prima linea di pazienti adulti con
carcinoma mammario metastatico.
VEGF
Roche
Novartis
R-ANIBI-ZU-MAB (Lucentis, 2006)
VEGF
Ranibizumab è un frammento di un anticorpo monoclonale ricombinante
umanizzato diretto contro il fattore di crescita endoteliale vascolare umano A
(VEGF-A).
Categoria farmacoterapeutica: Oftalmologici, agenti anti-neovascolarizzazione
Lucentis è indicato negli adulti per:
• Il trattamento della degenerazione maculare neovascolare legata all’età
• Il trattamento della diminuzione visiva causata da neovascolarizzazione
coroideale, dall’edema maculare diabetico o dall’edema maculare
secondario ad occlusione venosa retinica.
Lucentis è somministrato con singola iniezione
mensile intravitreale sotto anestesia locale.
Rispetto al bevacizumab, Lucentis è una
molecola più piccola che ha delle proprietà
peculiari quali il minor peso molecolare (48 kD)
che giustifica la maggior capacità di penetrare
tutti gli strati della retina e quindi di diffondere
nello spazio sottoretinico dopo
somministrazione intravitreale.
USO INTRAVITREO DI AVASTIN
Avastin non è formulato per l’uso intravitreo
In seguito all’uso intravitreo non approvato di Avastin, costituito da
flaconcini approvati per somministrazione endovenosa in pazienti
oncologici, sono state segnalate gravi reazioni avverse oculari sia
individuali che in gruppi di pazienti. Queste reazioni includono
endoftalmite infettiva, infiammazione intraoculare come endoftalmite
sterile, uveite, vitreite, distacco di retina, lacerazione dell'epitelio
pigmentato della retina, aumento della pressione intraoculare,
emorragie intraoculari come emorragie intravitreali o emorragie
retiniche ed emorragie congiuntivali. Alcune di queste reazioni hanno
portato a vari gradi di perdita della vista, inclusa cecità permanente.
VEGF
Roche
Novartis
AFLIBERCEPT
VEGF
Aflibercept, conosciuto anche in letteratura come VEGF TRAP, è una proteina di
fusione ricombinante costituita dalle porzioni di legame con il VEGF dei domini
extracellulari dei recettori umani del VEGF fusi con la porzione Fc dell'IgG1 umana.
Aflibercept funge da recettore solubile di captazione che lega il VEGF con
un'affinità maggiore di quella dei recettori nativi.
ZALTRAP in combinazione con
chemioterapia è indicato nei pazienti
adulti con carcinoma colorettale
metastatico.
EYLEA è indicato nei pazienti adulti
con degenerazione maculare
neovascolare
Ramu-cir-u-mab (Cyramza, 2015)
VEGFR
Ramucirumab è un anticorpo
monoclonale umano IgG1 diretto contro il
recettore del VEGF e blocca il legame a
quest’ultimo di VEGF. Su queste basi
ramucirumab inibisce l’attivazione ligando
indotta e la cascata a valle dei secondi
messaggeri, comprese le proteine chinasi
mitogeno-attivate p44/p42, neutralizzando la
proliferazione e la migrazione delle cellule
endoteliali umane normalmente indotta dal
legame del ligando al recettore.
INDICAZIONI
In associazione a chemioterapici è indicato per il trattamento di pazienti adulti con
• carcinoma gastrico avanzato
• carcinoma del colon-retto metastatico
• carcinoma del polmone
L’attività antitumorale di anticorpi non modificati indirizzati al tumore è ridotta
quando questi vengono utilizzati per il trattamento di alcuni tumori solidi.
Queste limitazioni possono essere dovute ad uno scarso uptake dell’anticorpo
dalla massa neoplastica, e all’insorgenza di forme di resistenza.
ANTICORPI MONOCLONALI CONIUGATI come strategia di PHARMACODELIVERY
Diversi farmaci, sostanze radioattive e tossine
sono efficaci antitumorali che tuttavia sono
tossici per le cellule sane. Questo ne limita
l’impiego terapeutico.
Coniugare tali sostanze ad anticorpi può
limitarne gli effetti collaterali.
In questo senso l’anticorpo ideale dovrebbe
riconoscere solo antigeni esposti sulle cellule
tumorali. In realtà riconoscono antigeni
sovraespressi sulle cellule tumorali.
IMMUNOCONIUGATI: STRATEGIE
ANTICORPI MONOCLONALI APPROVATI PER IL TRATTAMENTO DI VARIE FORME DI CANCRO
CHEMOIMMUNOCONIUGATI
CHEMOIMMUNOCONIUGATI
Antibody Drug Conjugates (ADC)
• Mirano a sfruttare la specificità degli anticorpi monoclonali (mAb) per fornire
potenti farmaci citotossici selettivamente alle cellule tumorali che esprimono
l'antigene.
• L'anticorpo (o un suo frammento) è collegato tramite un legame chimico a un
farmaco citotossico (anti-cancerogeno) biologicamente attivo.
CHEMOIMMUNOCONIUGATI
Antibody Drug Conjugates (ADC)
L’EFFICACIA DI UN
CHEMOIMMUNOCONIUGATO
DIPENDE DA
Tipo di anticorpo: dovrebbe riconoscere un antigene ben caratterizzato con alta
espressione al sito tumorale e bassa espressione su tessuto normale per
massimizzare l'efficacia e ridurre gli effetti tossici.
Tipo e quantità di farmaco coniugato: se la quantità di farmaco coniugato è ridotta
si rischia bassa efficacia mentre coniugare con quantità eccessive di farmaco può
compromettere la farmacocinetica. Il numero medio di farmaci coniugati
all'anticorpo è il più importante fattore di qualità di un ADC (efficacia e sicurezza).
Linker: In genere bifunzionali. L'identità e la stabilità del linker sono fondamentali
per il successo di un ADC. Il linker deve essere stabile per consentire alla ADC di
circolare nel flusso sanguigno prima di raggiungere il sito tumorale senza liberare
prematuramente il farmaco "citotossico" e danneggiare il tessuto normale. Il linker
dovrebbe anche essere abbastanza labile per liberare efficacemente il farmaco dopo
che l'ADC trova il suo antigene bersaglio.
CHEMOIMMUNOCONIUGATI
Antibody Drug Conjugates (ADC)
APPROVATI
• Gemtuzumab ozogamicin (Mylotarg®): Approved 2000.
An anti-CD33 antibody conjugated to the cytotoxin calicheamicin: withdrawn
from market in 2010.
• Brentuximab vedotin (Adcetris®): Approved 2012; Takeda
An anti-CD30 antibody conjugated via cleavable linker to cytotoxic monomethyl
auristatin (MMAE) - Hodgkins lymphoma.
• Ado-trastuzumab emtansina (Kadcyla®) Approved 2013; Genentech
An anti-Her2 antibody conjugated to cytotoxic “DM-1”
(derivative of maytansine) - Her2 metastatic breast cancer.
CHEMOIMMUNOCONIUGATI
Antibody Drug Conjugates (ADC)
Meccanismo d’azione
LINKER SENSIBILI ALLE PROTEASI LISOSOMIALI
O AL PH ACIDO LISOSOMIALE
Mylotarg®
Adcetris®
Kadcyla®
CHEMOIMMUNOCONIUGATI
APPROVATI
Gem-tu-zumab ozogamicin (Mylotarg®):
• Approvato nel 2000. Ritirato dal commercio nel 2010 da Pfizer.
• E’ costituito da un anticorpo anti-CD33 (cluster di differenziazione) coniugato al
farmaco citotossico caliceamicina antibiotico antitumorale isolato dal batterio
Micromonospora echinospora. Caliceamicina lega il solco minore del DNA e ne provoca
la scissione.
• Veniva usato per il trattamento della LEUCEMIA MIELOIDE ACUTA. CD33 è un antigene
presente sulla superficie delle cellule della leucemia mieloide acuta (leucociti) nell’80%
circa dei pazienti e sembra coinvolto nei processi di adesione cellulare.
LINKER
ANTICORPO
ANTI-CD33
CALICEAMICINA
Gem-tu-zumab ozogamicin (Mylotarg®)
Gli effetti collaterali e la scarsa efficienza di Mylotarg sono probabilmente dovuti a
linker non sufficientemente stabile dal punto di vista chimico. Il meccanismo di
rilascio è prevalentemente dipendente dal pH. È stato riscontrato che una quantità
significativa di farmaco viene rilasciato nel flusso sanguigno.
CHEMOIMMUNOCONIUGATI
Antibody Drug Conjugates (ADC)
APPROVATI
Bren-tu-xi-mab vedotin (Adcetris®): approvato nel 2012.
E’ costituito da un anticorpo anti-CD30 coniugato al farmaco
citotossico monometil auristatina (MMAE).
ADCETRIS è indicato per il trattamento di pazienti adulti affetti da linfoma di Hodgkin CD30+
recidivante o refrattario. Il CD30 è implicato in numerosi meccanismi tra cui i processi di
proliferazione e sopravvivenza cellulare, la regolazione della produzione di citochine e
l’apoptosi, sebbene molti dettagli di tali azioni siano ancora da definire. Nei tessuti normali, il
CD30 ha un basso profilo di espressione limitato alle cellule T attivate, alle cellule B attivate e
alle cellule natural killer attivate.
LINKER
Anticorpo
ANTI-CD30
MMAE
Brentuximab vedotin (Adcetris®)
Dolabella auricularia
Diversi analoghi sono stati testati come antitumorali in studi clinici.
A causa di problemi di tossicità solo la coniugazione con un anticorpo
monoclonale ha consentito di arrivare in terapia.
Brentuximab vedotin (Adcetris®)
4 unità di MMAE per ogni IgG
Brentuximab vedotin (Adcetris®)
The purpose of the mc spacer is
to provide enough room so that
the vc group can be recognized
by cathepsin B, which cleaves
the citrulline-PABC amide bond.
Numerous studies have shown
that cathepsin B overexpression is
correlated with invasive and
metastatic phenotypes in cancers.
Brentuximab vedotin (Adcetris®)
CHEMOIMMUNOCONIUGATI
Antibody Drug Conjugates (ADC)
Trastuzumab emtansine (Kadcyla, 2013)
HER2
Tumore al seno
Tumore dello stomaco
È un anticorpo-farmaco coniugato che contiene la IgG1 umanizzata
anti-HER2, trastuzumab, legata in modo covalente all’inibitore dei
microtubuli DM1 (un derivato della maitansina). In media 3,5
molecole di DM1 sono coniugate a ogni molecola di trastuzumab. La
coniugazione di DM1 con trastuzumab conferisce selettività all’agente
citotossico per le cellule tumorali che sovraesprimono HER2,
aumentando di conseguenza il rilascio intracellulare di DM1
direttamente alle cellule maligne. Legandosi a HER2, trastuzumab
emtansine viene sottoposto a un’internalizzazione recettore-mediata
e successivamente a degradazione lisosomiale, con conseguente
rilascio di DM1.
Maitansine isolate dalla
corteccia di un albero del
genere Maytenus
HER2
Trastuzumab emtansine (Kadcyla, 2013)
Kadcyla, in monoterapia, è indicato per il
trattamento di pazienti adulti affetti da tumore
mammario HER2- positivo, inoperabile, localmente
avanzato o metastatico, sottoposti in precedenza a
trattamento con trastuzumab.
Tumore al seno
Tumore dello stomaco
Trastuzumab emtansine possiede il meccanismo d’azione sia di
trastuzumab sia di DM1:
● Trastuzumab emtansine, come trastuzumab, si lega al dominio IV
del dominio extracellulare di HER2 e ne impedisce l’attivazione.
Kadcyla come trastuzumab non coniugato attiva il complemento. In
aggiunta, trastuzumab emtansine, come trastuzumab, media la
citotossicità cellulomediata anticorpo-dipendente (ADCC) nelle
cellule di tumore mammario umano che iperesprimono HER2.
● DM1, il componente citotossico di trastuzumab emtansine, si lega
alla tubulina. Inibendo la polimerizzazione della tubulina, blocca il
ciclo cellulare nella fase G2/M, provocando in ultima analisi la
morte apoptotica della cellula.
Trastuzumab emtansine (Kadcyla, 2013)
HER2
Tumore al seno
Tumore dello stomaco
RADIO IMMUNOCONIUGATI
RADIO IMMUNOCONIUGATI
RADIO IMMUNOCONIUGATI
CD20
Ibri-tum-o-mab Tiuxetan (Zevalin, 2002)
L’ibritumomab tiuxetano è un anticorpo
monoclonale IgG1 ricombinante murino
specifico per l’antigene CD20 delle cellule B.
L’ibritumomab tiuxetano radiomarcato con
[90Y] si lega in modo specifico alle cellule B che
esprimono il CD20, incluse le cellule maligne.
L’isotopo ittrio-90 è un puro β-emittente con
una penetrazione media della radiazione nei
tessuti di circa 5 mm. Da questo deriva la sua
capacità di distruggere sia le cellule bersaglio
sia quelle vicine.
Zevalin radiomarcato con [90Y] è indicato per il
trattamento di pazienti adulti affetti da linfoma
non-Hodgkin follicolare a cellule B CD20+
recidivanti o refrattari a rituximab.
Leucemie e linfomi
IMMUNOTOSSINE
In fase di sperimentazione clinica
TOSSINE BATTERICHE
Pseudomonas Exotoxin A-based Immunotoxins (inibisce la sintesi proteica)
Diphtheria toxin-based Immunotoxins (inibisce la sintesi proteica)
TOSSINE VEGETALI
Ricin Toxin-based Immunotoxins
Vantaggi:
Sono molto potenti
Sono generalmente stabili
Svantaggi:
Rischi in fase di purificazione
Tossicità
Immunogenicità (anticorpi antitossina)
To construct immunotoxins, the binding domain of each toxin is removed
and replaced with an antibody or antibody fragment.
ANTIBODY-DIRECTED ENZYME PRODRUG THERAPY (ADEPT)
In fase di sperimentazione clinica
The enzyme is targeted to tumour by an antibody directed against a tumour associated
antigen. After clearance of antibody-enzyme from blood, a non-toxic prodrug that is
substrate for the enzyme is given. The enzyme converts the prodrug to a cytotoxic drug
within extracellular areas of tumour. The generated drug being a small molecule can
diffuse throughout the tumour mass killing tumour cells both antigen positive as well as
cells that do not express the antigen giving a by-stander effect. The enzyme also
provides an amplification effect generating high concentration of drug within tumours.
ANTICORPI MONOCLONALI: LIMITI NEL TRATTAMENTO DI TUMORI
• La distribuzione di antigeni sulle cellule neoplastiche può essere
eterogenea. Alcune cellule possono esprimere l’antigene altre no.
• L’irrorazione ematica del tumore non è sempre ottimale
• L’elevata pressione interstiziale all’interno del tumore può ostacolare
l’interazione con l’anticorpo monoclonale. Questa pressione ritarda
notevolmente il passaggio delle molecole attraverso la parete vasale,
ed è l’ostacolo principale alla perfusione dei tumori con molecole
anti-neoplastiche di peso superiore ai 5.000 Dalton (5 kDa) come i
MoAbs, questi ultimi di 150 kDa.
• Insorgenza di resistenze
MAB PER IL TRATTAMENTO DI PATOLOGIE
INFIAMMATORIE/IMMUNO-MEDIATE
Comprendono un gruppo di patologie croniche caratterizzate da meccanismi
patogenetici di natura immunitaria. Le malattie più note nell’ambito di questo
gruppo comprendono l’artrite reumatoide, la psoriasi, la malattia di Crohn.
È stato accertato che queste patologie dipendono da una alterazione dei meccanismi
regolatori del sistema immunitario che, a sua volta, determina una iperespressione e
iper-attivazione di citochine pro-infiammatorie, molecole di adesione, chemochine,
etc., con conseguente mantenimento di uno stato infiammatorio cronico, che
promuove una progressiva distruzione e rimodellamento patologico dei tessuti colpiti.
Sono disponibili farmaci antiinfiammatori e immunosoppressori tradizionali, che tuttavia
non sono soddisfacenti in termini sia di efficacia che di sicurezza di impiego. Per questa
ragione sono stati sviluppati e immessi nella pratica clinica anticorpi monoclonali in grado
di legare in maniera selettiva bersagli molecolari specifici, con conseguente
neutralizzazione delle loro funzioni pro-infiammatorie.
ANTICORPI MONOCLONALI: MECCANISMO D’AZIONE IMMUNOSOPPRESSORE
L’effetto immunosoppressore può essere ottenuto bloccando:
• Il riconoscimento dell’antigene: il target può essere costituito da molecole responsabili
dell’iniziazione della risposta immune cellulo-mediata (molecole complesso maggiore di
istocompatibilità, recettore T cellulare TCR)
• Molecole accessorie (quali corecettori CD4, CD8, costimolatori CD28) che inviano alla
cellula un segnale costimolatorio. Contribuiscono all’amplificazione del segnale trasmesso
dal TCR, affinché il linfocita si attivi.
• Molecole di adesione (CD11/
CD18, CD54, le selectine)
deputate tanto a mediare i
contatti intercellulari quanto la
migrazione cellulare nel sito di
flogosi.
• Fattori solubili, (ad esempio IgE
e citochine come TNF-alfa, IL)
coinvolte nell’ amplificazione
della risposta immune
INF-LI-XI-MAB (Remicade, 1999)
ADA-LIM-U-MAB (Humira, 2003)
GO-LIM-U-MAB (Simponi, 2009)
CERTO-LI-ZU-MAB (Cimzia, 2008)
TNFα
MALATTIA DI CHRON
ARTRITE REUMATOIDE
PSORIASI
Formano rapidamente complessi stabili con TNFα umano, sia nella sua forma
solubile che in quella associata alla membrana cellulare neutralizzandolo.
Infliximab è un anticorpo chimerico. Golimumab e Adalimumab sono
anticorpo monoclonali umani.
Cimzia non contiene il
frammento cristallizzabile (Fc).
E’ composto dal solo
frammento Fab ed è pegilato.
Cimzia ha mostrato di
neutralizzare in maniera dosedipendente il TNFα umano, sia
nella sua forma solubile che in
quella associata alla membrana
cellulare.
POSOLOGIA
Per i pazienti adulti che soffrono di artrite reumatoide la dose abituale è di 40 mg di
adalimumab ogni 15 giorni sotto forma di iniezione sottocutanea.
IL-2R
BASI-LI-XI-MAB (Simulect, 1998)
Basiliximab è un anticorpo monoclonale
chimerico diretto contro la catena α del
recettore dell’interleuchina-2 (antigene CD25),
che viene espresso sulla superficie dei linfociti T
in risposta ad uno stimolo antigenico. Impedisce
il legame con l’interleuchina-2, segnale critico
per la proliferazione dei linfociti T nella risposta
immunocellulare coinvolta nel rigetto del
trapianto.
PROFILASSI DEL RIGETTO D’ORGANO
Simulect è indicato per la profilassi del rigetto acuto
in pazienti adulti e pediatrici (1-17 anni) sottoposti
a trapianto renale allogenico. Deve essere usato in
associazione ad un trattamento
immunosoppressivo a base di ciclosporina e
corticosteroidi
DAC-LI-ZU-MAB (Zinbryta, 2016)
Daclizumab è un anticorpo monoclonale IgG1
umanizzato diretto contro la catena α del
recettore dell’interleuchina-2 (antigene CD25)
IL-2R
SCLEROSI MULTIPLA
Daclizumab, approvato in Europa nel 1999 con il nome di Zenapax, come
trattamento per il rigetto del rene, è stato ritirato dal mercato europeo nel 2009.
Dal 2016 il Daclizumab, con il nome commerciale di Zinbryta, è indicato
nei pazienti adulti per il trattamento della sclerosi multipla con una
diversa via di somministrazione (sottocutanea anzichè endovenosa).
Gli effetti della modulazione della via del segnale dell’IL-2, comprendono
l'antagonismo selettivo delle risposte delle cellule-T attivate.
Si ritiene che tali effetti immunomodulatori possano contribuire alla riduzione
della patologia del SNC nella sclerosi multipla e possano, pertanto, ridurre le
recidive e la progressione della disabilità.
OMA-LI-ZU-MAB (Xolair, 2003)
Omalizumab è un anticorpo monoclonale IgG1 umanizzato
che lega le IgE e ne previene il legame con i recettori
specifici posto su mastociti e basofili riducendo in tal modo
la quantità di IgE libera che può innescare la cascata
allergica.
IgE
Asma allergica e orticaria
Il rilascio in vitro di istamina dai basofili isolati dai
soggetti trattati con Xolair si è ridotto di circa il 90%
a seguito di stimolazione con un allergene rispetto ai
valori precedenti al trattamento.
Xolair è indicato, come terapia aggiuntiva, per
migliorare il controllo dell’asma in pazienti con
asma allergica grave persistente che hanno
ridotta funzionalità polmonare.
E’ anche indicato come terapia aggiuntiva, per il
trattamento dell’orticaria cronica
La dose appropriata e la frequenza di somministrazione
di Xolair sono determinate dai livelli di IgE basali, rilevati
prima di iniziare il trattamento, e dal peso corporeo.
Somministrazione sc.
BRONCOSPASMO
EDEMA
SECREZIONE DI MUCO
MEPO-LI-ZU-MAB (Nucala, 2015)
RES-LI-ZU-MAB (Cinqaero, 2016)
Sono anticorpi monoclonali umanizzati diretti contro l’interleuchina-5
umana (IL-5). Interferiscono con il legame dell’IL-5 con il suo recettore
sulla superficie degli eosinofili.
IL-5 è una citochina fondamentale, responsabile della differenziazione,
della maturazione, del reclutamento e dell’attivazione degli eosinofili
umani. Il blocco di IL-5 comporta una riduzione della sopravvivenza e
dell'attività degli eosinofili.
La presenza di un infiltrato significativo di eosinofili
attivati è una delle principali caratteristiche della fase
tardiva dell'infiammazione allergica nell'asma.
Gli eosinofili contribuiscono al danno tissutale delle vie
aeree rilasciando prodotti quali leucotrieni.
Sono indicati come terapia aggiuntiva in pazienti
adulti con asma non adeguatamente controllata
nonostante l’uso di corticosteroidi per via inalatoria.
Somministrazioni mensili sc (Nucala) o ev (Cinqaero)
IL-5
Asma GRAVE
a componente
eosinofila
MAB PER IL TRATTAMENTO DI PATOLOGIE
VARIE
DEN-OS-U-MAB (Prolia, 2010)
OSTEOPOROSI
DEN-OS-U-MAB (Xgeva, 2010)
FRATTURE OSSEE
DOVUTE A METASTASI
RANKL
Denosumab è un anticorpo monoclonale umano (IgG2) diretto contro il RANKL (ligando
dell’attivatore recettoriale del fattore nucleare kB), al quale si lega con elevata affinità e
specificità, prevenendo l’attivazione del suo recettore RANK, presente sulla superficie degli
osteoclasti. Il blocco dell’interazione tra RANKL e RANK inibisce la formazione, la funzionalità
e la sopravvivenza degli osteoclasti, riducendo in tal modo il riassorbimento osseo.
Prolia, indicato per il trattamento dell’osteoporosi (60 mg) in donne in post-menopausa e
in uomini ad aumentato rischio di fratture. Nelle donne in post-menopausa, Prolia riduce
significativamente il rischio di fratture vertebrali, non vertebrali e di femore.
Xgeva (120 mg) è indicato per
la prevenzione di eventi
patologici correlati
all’apparato scheletrico negli
adulti con metastasi ossee.
RANKL, è un mediatore
chiave della distruzione
dell’osso nella malattia ossea
metastatica
AB-CI-XI-MAB (ReoPro, 1997)
Abciximab è un anticorpo monoclonale chimerico
diretto contro il recettore glicoproteico IIb/IIIa a livello
delle piastrine.
Il blocco dei recettori
GPIIb/IIIa con antagonisti
impedisce la reticolazione
mediata dal fibrinogeno in
piastrine attivate,
prevenendo così la
crescita di trombi.
Viene utilizzato nel trattamento delle complicazioni
ischemiche in pazienti a rischio di infarto o sottoposti
ad angioplastica. Il trattamento con abciximab consente
l’inibizione dell’aggregazione piastrinica.
Glicoproteina IIb/IIIa
Terapie antitrombotiche
PALI-VI-ZU-MAB (Synagis, 1998)
Palivizumab è un anticorpo umanizzato diretto contro un epitopo del
virus respiratorio sinciziale (RSV). Questo è stato riconosciuto come il
più importante virus in patologia delle vie aeree del
bambino. Nell’adulto i sintomi del virus respiratorio sinciziale sono
lievi e di solito imitano il comune raffreddore. L’infezione può però
essere grave, soprattutto nei neonati prematuri e nei bambini con
precarie condizioni di salute di base.
L’anticorpo ha una potente attività
neutralizzante nei confronti del
meccanismo di fusione (proteina di
fusione F) del virus.
Palivizumab è impiegato nel trattamento
delle infezioni provocate dal virus
respiratorio sinciziale (RSV) in bambini
nati prematuri.
RSV
Antivirale
TOP SELLING PHARMA DRUGS IN 2016
TNFα Mab
TNFα
TNFα Mab
CD20 Mab
TOP SELLING PHARMA DRUGS IN 2016
VEGF Mab
HER2 Mab
VEGF
TOP SELLING PHARMA DRUGS IN 2016