I Gazzellini
- Emergenze -
revisione
Gang del Bosco
A. Fusco
INDICE
Introduzione … 1
La catena della sopravvivenza … 5
Arresto cardiaco improvviso e morte improvvisa … 9
La defibrillazione precoce semiautomatica … 10
Avanced Life Support (ALS) … 12
Supporto di base delle funzioni vitali (BLSD) … 18
Traumi … 22
Shock … 29
Il dolore toracico … 34
Cardiopatia ischemica … 43
Scompenso cardiaco … 56
Edema polmonare … 66
Farmaci antiaritmici … 67
Fibrillazione atriale … 68
Ictus … 70
Sincope … 71
Aritmie … 74
Dissezione aortica … 84
Emergenze ipertensive … 86
Sindrome da distress respiratorio acuto (ARDS) … 88
Insufficienza respiratoria … 90
Riacutizzazioni di BPCO … 93
Emorragie digestive … 96
Malattia peptica … 98
Fegato … 100
Intestino … 105
Pancreas … 108
Coma … 110
Annegamento, Ipotermia … 114
Folgorazione, Ustioni … 115
Tetano, Ossigenoterapia iperbarica … 116
Ipertermia maligna … 117
Intossicazioni … 118
Insufficienza renale acuta … 120
Equilibrio elettrolitico … 125
Emergenze endocrino-metaboliche … 127
Equilibrio acido base … 129
Parti gentilmente sciacallate in giro, autori citati quando noti
1.
ESA (European Society of Anaesthesiology) UEMS (Union Europeenne des Medecins Specialistes) approccio pre‐ospedaliero
di tipo territoriale governata da varie centrali; ci sono varie centrali predisposte sul territorio e, quando si chiama il 118, viene attivata la centrale più vici‐
na, la quale deve capire telefonicamente la problematica ed inviare sul luogo il mezzo più idoneo. Quindi ha un ruolo molto importante, cioè ca‐
pire telefonicamente quanto è importante la chiamata e decidere se pazien‐
secondo problema, cioè nel momento in cui si vede il malato tendenzial‐
non tutti gli ospedali possono offrire tutte le prestazioni, per cui ci si deve andare per gradi. Il problema è capire se si può aspettare per effettuare un trasporto in un centro superiore oppure se si debba stabilizzare prima il paziente e poi trasportarlo nel suddetto centro. problema è il mezzo di trasporto da utilizzare (autoambulanza, elicottero, ecc): tale problema è connesso anche alla geografia della nostra nazione e ad altri fattori; questo punto di vista (basti pensare ad un incidente che si verifica nella costiera amalfitana o nelle isole). Ci sono diverse gradazioni di emergenze: possiamo passare da un pazien‐
te con un codice giallo (non ha nulla di realmente preoccupante) a condi‐
4 1
zioni in cui i secondi, i minuti possono essere cruciali. Chiaramente lo spe‐
cialista che dovrà gestire queste situazioni è diverso e quindi diverso è medica è un internista perché deve gestire condizioni molto diverse fra loro, anche se di fatto la medicina interna non si occupa della grossa ur‐
genza, cioè di quella che necessita realmente di un trattamento molto ra‐
pido. emergenza si intende una situazione patologica che, se non trattata, porta ad un danno irreversibile o morte in pochi minuti. Invece n urgenza il tempo Quindi . Possiamo avere a che fare con Codici Bianchi (situazioni che possono an‐
che autolimitarsi), Codici Gialli (situazioni che vanno trattate, ma è possi‐
bile ancora posticipare il trattamento), Codici Rossi (situazioni in cui se il trattamento non viene fatto tempestivamente porteranno rapidamente alla morte). Quindi sso, mentre . Esistono perciò dei criteri che non si discutono che immeditatamente im‐
pongono ai sanitari di inquadrare o meno il pz nel trauma maggiore. Quali sono? ‐
(es dal secondo piano di un palazzo; indipen‐
dentemente dalle condizioni generali io lo inquadrerò come trauma maggiore, anche se il pz ride e scherza e sembra stare bene. Pertan‐
to gli faccio prima di tutto (eco per vedere se ci sono versamenti endoaddominali, cioè sangue fondamentalmente, o altri fluidi tipo urina se si è rotta la vescica); ‐ Impatto ad alta velocità (dopo incidente a 200/h ad es). Come fac‐
cio io sanitario a sapere che è avvenuto tale impatto? In genere ne‐
5 2
gli incidenti stradali al Pronto Soccorso ho anche una relazione della Polfer (? Polizia ferroviaria?) che mi segnala tutto quello che è avve‐
nuto: autostrada, alta velocità eccetera. Se non avete questa rela‐
su st
‐ Estrinsecazione complessa per gravi danni dal veicolo (se ho dovu‐
to estrarre il pz dalle lamiere con la fiamma ossidrica); ‐ Incendio del veicolo; ‐ Coinvolgimento di un mezzo pesante; ‐ Morte di un passeggero (anche se gli altri non hanno un graffio si considerano traumatizzati maggiori); ‐ Esplosioni; ‐ Ferite da arma bianca; ‐ Lesioni da arma da fuoco; ‐ Motociclista o ciclista sbalzato; ‐ R
. Valutazione rapida: respiro, coscienza, emorragia, movimenti spontanei. La valutazione del paziente traumatizzato, fondamentale, va fatta sem‐
pre seguendo questa progressione: A, Airwais: controllare la pervietà delle vie aeree e se il pz ha controllo dei movimenti del rachide. B, breathing: garantire una ventilazione efficace (cercare di estrinsecare la lingua se questa è caduta posteriormente nel pz non cosciente, estrarre eventuali corpi estranei presenti nelle vie aeree, valutare lesioni o frattu‐
6 3
re del massiccio facciale). Se ci sono ostruzioni vie aeree: apertura bocca, sollevamento del mento, possibilmente mettendo dietro le spalle qualco‐
sa che sopraeleva le regioni scapolari in modo che la testa vada in ipere‐
stensione, su
respiro si ventila artificialmente il pz. Se presenta il respiro invece si può dare ossigeno per aiutarlo e valutare la frequenza respiratoria. C, circulation: controllare eventuali emorragie e il circolo (controllare pol‐
si periferici, verificare se la pressione è normale; inutile ricordare che la riduzione della p differenziale indica insufficienza di circolo che non ga‐
rantisce la normale emodinamica del pz. Valutare se eventualmente il pz è cianotico). D, distress: valutare lo stato neurologico (se il pz è cosciente, reattivo e se risponde agli stimoli luminosi e verbali). E, exposure: svestire il pz per ispezionarlo e valutare la presenza di ec‐
chimosi, ferite o altre lesioni visibili a occhio nudo. vo se non avete riconosciuto e trattato quello precedente. Se la situazio‐
ne si modifica, ricominciare la valutazione dalla A. emergenza urgenza in ore o giorni. Un trauma del‐
ca, quindi non necessita di intervento immediato. Insieme ad esso ci sono varie altre sigle per indicare le sue varianti, come Support) e il PBLS (Paediatric Basic Life Support). 7 4
La catena della sopravvivenza ‐ Ogni volta che vi trovate in corso di emergenza, fate sapere se è possibile la situazione (allarme precoce). ‐ Rianimazione cardiopolmonare ‐ Defibrillazione precoce oppure Advanced Life Support (il successivo al BLS) Valutazione stato di coscienza. Controllate il primo punto, airway: se il pz respira lo si mette in posizione laterale di sicurezza, perché potrebbe vo‐
mitare e quindi sviluppare una polmonite ab ingestis per inalazione del vomito. Se invece non respira dobbiamo fare una ventilazione. Per quanto riguarda il punto tre, circulation, ci chiederemo: il polso presente? Conti‐
nua la ventilazione. Polso assente? Massaggio cardiaco esterno. Quindi, valutazione del primo punto: Airway. Valutiamo coscienza e respi‐
ro. Azione: avvertire il 118, apertura delle vie aeree se questo non avvie‐
ne. Breathing: è presente il respiro? Insufflazione. Circulation: valutare la presenza del polso, eventuale massaggio cardiaco. Come facciamo il mas‐
saggio cardiaco esterno? Possibilmente si mette un supporto a livello del‐
le regioni scapolari del pz per ottenere iperestensione del collo. Il soccor‐
ritore si pone alla sinistra del pz, in ginocchio. A volte si vede un massag‐
gio esterno su barella; ciò è impossibile, perché il massaggio deve essere fatto su pz posto su supporto rigido per poter essere efficace. Già la sem‐
plice iperestensione del collo facilita la pervietà delle vie aeree. La respi‐
razione bocca a bocca: il soccorritore è sempre a sinistra. Si usano ma‐
schera e pallone Ambu per insufflare. Come si fa adeguato? Il primo che si va a sentire è quello carotideo, se assente il pz è in arresto cardiaco. Massaggio cardiaco esterno: il rapporto compressione/ventilazione deve essere 30:2 (
secondo le ultime linee guida. Frequenza delle compressioni: 100/min. 8 5
Posizion
brio sternale ma va compressa la parte centrale dello sterno, con mano a piatto per avere un più ampio impatto superficie mano/superficie torace. Si parte con 30 compressioni e poi si nsufflazione: nel momento in cui si ci si sfinisce e ci sarà bisogno di un ci si posiziona sotto al sole poi lo shock. Se le vie aeree sono occupate da un corpo estraneo esso dovrà essere eliminato. Come? Con la manovra di Heimlich: se il pz è cosciente e può stare in piedi incociamo le nostre ma‐
ia controcorrente che con‐
Il codice rosso indica priorità assoluta, va trattato al più presto possibile. Codice giallo
tiva. Codice verde non urgente, può aspettare molte ore per cura definiti‐
va. Codice nero decesso. Codice bianco: il pz che non ha niente. Mentre sembrerebbe logico il trattamento prima del codice rosso, questo è intuitivo e logico da seguire nella traumatologia civile. In traumatologia bellica invece si soccorre prima il pz che può più rapidamente tornare a combattere, cioè i codici vengono invertiti perché la logica cambia. Vediamo i tempi di attesa per ciascun codice: Codice rosso: nessuno, immediato Codice giallo: 15 min Codice verde: 30 min Codice bianco: 60 min 9 6
Facciamo un esempio di come viene gestito un Codice Rosso, consideran‐
do un trauma della strada. La gestione è multifattoriale, infatti prevede: ‐ Approccio pre‐ospedaliero ‐ Approccio del dipartimento di emergenze (il paziente viene preso dalla strada e portato in ospedale) ‐ Approccio operatorio (sala operatoria) ‐ Approccio di terapia intensiva ‐ Approccio di chirurgia ricostruttiva o di tipo riabilitativo Solitamente si pensa che stare in ospedale significa essere protetti, in realtà non è così. Tutte le figure sanitarie devono essere in grado di porta‐
re il primo soccorso (massaggio cardiaco e respirazione assistita). Stiamo parlando di manovre che risalgono a 70 anni fa: il massaggio cardiaco era suggerito già negli anni 60 ed anche la respirazione assistita. Il problema è che anche in ospedale abbiamo una percentuale elevata di mortalità, sia perché si tratta di pazienti in condizioni gravi, sia perché non si riesce ad in termini di mortalità fra territorio ed ospedale. Una rianimazione cardio‐polmonare se ben fatta, ma soprattutto se fatta precocemente, dà ottimi risultati. Noi dovremmo essere in grado di gesti‐
re un malato in 3 minuti, che è il tempo entro il quale si sviluppa il danno da ischemia cerebrale. Sul territorio è più frequente un arresto improvvi‐
so in pieno benessere; in ospedale ciò è più raro, invece, è più frequente In ambito ospedaliero è importante, quindi, lavorare sulla rianimazione post‐evento e, soprattutt
intra ho‐
10 7
spital cardiac arrest) è 1‐5 casi ogni 1000 ricoveri (non ogni 1000 pazien‐
ti!!!). Gli arresti cardiaci che avvengono in terapia intensiva (quindi in pazienti più gravi rispetto ad un comune paziente ricoverato) hanno prognosi mi‐
gliore perché vengono individuati precocemente, dato che i pazienti sono sotto stretto controllo. Quindi la mortalità è molto più alta in caso di arre‐
sti che avvengono in reparto rispetto a quelli che si verificano in terapia che si sta verificando e della minore preparazione del personale circa ciò che bisogna fare in tali casi. ‐85% dei pazienti) presentano una serie di alterazioni che annunciano il successivo arresto: anomalie del polso, alterazioni della pressione sistolica, alterazione dello stato mentale, intervallo RR anomalo, dispnea documentata, ecc. tale, che comunque è indicativa del fatto che sta accadendo qualcosa. Esi‐
stono scores per i reparti in cui si vanno a valutare pressione sistolica, frequenza respiratoria ed altri parametri, in base ai quali si assegna un punteggio e, a sua volta, in base ad esso si può prevedere quale è il ri‐
schio che il soggetto ha di sviluppare un arresto e quindi la necessità di una centralizzazione in un luogo più protetto (per esempio terapia inten‐
braccio afferente (che attiva il soccorso) ed un braccio efferente (che at‐
tua il soccorso). Da quando sono nati questi teams per la gestione delle emergenze (anche multidisciplinari) si è ridotta notevolmente la mortalità intraospedaliera. 11 8
!
""
!
!"#$%
&%
%%'
%
%(%$)*$)+%
,
-!./0
1
""
+*$
&2343'+*$& 5+'
$
6
#
6
%
#$%%6
$
.&
'&
%
%%7
*'
!
&'
&
'7
4
$
%&%'8
+*$
.
6
+2%
9-
)9+
*%
$6
%
%
7
()*+,() !"#$%&'!
%!%
%
9
)*())+,()9:
C!"
&""7"?
'*& ",* -"7" "
&23'5>.0
&
"
,-
%
&
'D
1+
D
,,5&>.0
BA.
G/"70
0!"%G
>!"%-.0"A-
'
&
'%
A0!Q
7
%G!.C!
"
&'
&
'
+
$3$12+L+1$8$
1$*$)*991+
23
&23
'*8
23II
#
B.0
&
'6
0
&'%1+
$"
,-
&'
$C.A!
&'
D
$1+
%
-.>
)*
""
%
$%
H&
'%
1+%
1+
&
'%
&
%%
I'++$$
*
$
)*
-
1-
1+
%
6
"
%""
)*-
%1+%
10
?
"
%""!
%
0-
""?"%#
::B'
""
$H$
%1+
1+%
11
)*+,);
$H:+*
%
AAC%
*81
2
+J+$*9)
)*..)*
:(
+
6
A )*
- > B .
0 &""
5
6
*&"6
,
$D),
%?%
$
&
'%
5
*8
"7""
6
OA!!M%
,>!
%
$
D)&O!%A-'
!
*8
,
23
43
!
@
%#&
+3J'%3&
'%*+&
++3'
"!*
&
@'%
%.%%%
%%7
*9%%7
#2/
@
)
6
"9""&
?
'
7
C9""&
(
R
'7
&
%
'+
%
12
%%%%
%%
6@%%
%8
H
.6@%%%
+%$%
$6P>!N*
#
-5,
&
5
D)'
%
-5,
%
H$%
43
$"
,-!
*8%
%
*
6
6
5@(
%(%
1
6$#+%.%@%
1
6
+
+)
&'+2
&'%
5
&'
+0"
+
DD!
M6
(
(
&""
+
%
*8A-
&6
)
"
4323
5'
43
)
13
$
-56
"9
6
%
%
330.3/
9
!
&'
%
%
8A>
@
&A>'%
%
#!<:=
+
H.1&
%'
$
6
R
.6
@
5
&%
%
'
5
5
%
)*,>!&
'
"7%,)-!
7
"&&&%!
5
&
'
,
&>!6-'%
C.A!
&/.G'1
E!
%
S
""
6
%%6
%
%
1$$
""
!
&
14
&%%'
?%
%
,7
-.>
A!
%
0.G
&
%
'
"6
%!A!!"
!AA!
A6A!!!!%
>
?
$1$*+2+$2F22*91$L$9$1$+))29
!43M23
&B!F'
"
&!
T
-N
26
26
$6
$
$
$
"
$*9)
+#'>!
6
+H*1H
5,?
*M
)*-
-N)* )*
%
*8-
)*
&
'>N
)*1-
)*
*8
2&&
F#"
?&&
&'$%&
&D2
'%&
34%32
%
%5'
BN)*-
15
":;
"'
%%
)*9$2))9#)
*9#)$9$29)+*$*J
6
)*
)*
)*6
%
%
&A>.0
'&>
'I
$"%
"
&
'5D
$
$
5
,
&'.@$)L+1$3)+
+$29$+&9DF+*98F2+43923'$+*$89$1$*+29
C!. !
56
?
&
5'&
@
5'
)56!-!!+
&;
<'
D)
25D)%
5A!",
+)*
1-
%-
)*
>.0
S
65&+'
1
)*
5
D
6
)*
)*
%
%
&
'
69-A!!"
6
@6
A!"K
16
@6&UP-.-0M'U6-M
A!
6
A!"
6
6)
5)*
62P>!N>@
&
'
)*
2O>!N
6K
(6
(6
6
1
)*
?:&40.@!=
$6
&JPG%A'
&$)*'
@
2*+%%
17
Supporto di base delle funzioni vitali (BLSD)
BLSD: consiste in un insieme di procedure standardizzate di rianimazione volte a sostenere le
funzioni vitali del paziente, qualora queste siano compromesse per l’insorgenza di: perdita di
coscienza, arresto respiratorio, arresto cardiocircolatorio, ostruzione delle vie aeree da
corpo estraneo. Alla rapida fase di valutazione segue pertanto quella di azione di primo soccorso
verso la funzione deficitaria.
Prima di procedere alla valutazione dello stato di coscienza dell’infortunato, il soccorritore deve
sempre provvedere a controllare la sicurezza della scena e chiamare, laddove necessario, il 118.
Se questa non è sicura il soccorritore non deve entrare in azione. Bisogna che tutte le persone
siano allontanate ‘’a cerchio’’ e cercare di capire se il paziente è certamente NON traumatizzato
(metteremo in pratica la sequenza BLS) o certamente traumatizzato (metteremo in pratica la
sequenza Basic Trauma Care BTC). Successivamente e in non più di 5 secondi dobbiamo
valutare lo stato di coscienza attraverso la stimolazione verbale (bisogna chiamare l’infortunato,
chiedergli se può aprire gli occhi o se riesce a muoversi) e tattile ( vedere se reagisce quando gli
smuoviamo leggermente la spalla). Il paziente incosciente per il BLS è quello che non risponde
in modo verbale o motorio allo stimolo verbale o tattile, questa condizione impone la richiesta
immediata di un defibrillatore semiautomatico (DAE) e l’immediata applicazione della sequenza
BLS. IL BLS non va attivato quando il paziente presenti evidenti segni di morte certa quali:
rigidità cadaverica, evidente decomposizione tissutale, macchie ipostatiche, decapitazione. Se il
paziente invece è cosciente il soccorritore deve individuare rapidamente il problema principale e
mettere in atto le misure di primo soccorso, in attesa del team di soccorso avanzato (ALS) del
118. La RCP non va evitata se il paziente è anziano. Le funzioni vitali vanno controllate
periodicamente.
Procedure in caso di paziente incosciente:
Se l’infortunato giace in posizione prona dobbiamo metterlo a pancia in su. Se sospettiamo un
trauma, la manovra di supinazione deve essere eseguita mantenendo capo, collo e torace
costantemente in asse (long-roll) per evitare l’insorgenza di lesioni midollari a causa di
un’eventuale instabilità del rachide. La tecnica per ruotare il paziente prevede: soccorritore di
fianco, braccio del paziente allungato verso l’alto, mano del soccorritore a ventaglio che mantiene
la nuca mentre l’avambraccio sorregge il collo, mentre con l’altra mano il soccorritore afferra l’altra
spalla dell’infortunato e lo avvicini a se. L’infortunato va posizionato su un piano rigido (affinché
un eventuale massaggio cardiaco non sia vano) con capo, collo e tronco allineati. Va poi liberato il
collo da indumenti che intralciano la respirazione e scoperto il torace. Se il paziente è
incosciente dobbiamo procedere azione rianimatoria
A: Airway: apertura delle vie aeree. La perdita di coscienza determina ipotono muscolare e la
lingua può scivolare posteriormente e adagiandosi nella faringe può ostruire le vie aeree. Per
ottenere l’allontanamento della base della lingua dalla parete posteriore della faringe e pertanto la
pervietà delle vie aeree, si può effettuare la manovra di iper estensione del capo. Questa
consiste nel sollevamento del mento evitando di chiudere completamente la bocca, mentre l’altra
mano deve essere posta sulla fronte del paziente affinché premendo su di essa, senza eccessiva
forza, si raggiunga il livello massimo di estensione. Questa manovra è assolutamente
controindicata in tutti i sospetti traumatizzati cranici e spinali. In questi casi infatti, il soccorritore
deve utilizzare la manovra di sublussazione della mandibola (il soccorritore disposto
posteriormente alla testa della vittima spinge la mandibola in avanti e poi verso l’alto in modo che
si trovi davanti alla mascella) o di sollevamento del mento (manovra a due soccorritori: mentre
il primo soccorritore immobilizza con entrambe le mani il collo dell’infortunato, l’altro provvede con
18
una mano ad afferrare saldamente il mento e la mandibola, posizionando il pollice in
corrispondenza degli incisivi inferiori. Agganciando il mento abbassa così la mandibola, portandola
in avanti fino a che non si colloca anteriormente alla mascella).
Durante il BLS possono essere usati dispositivi ausiliari per il controllo delle vie aeree come la
cannula orofaringea. Quest’ultima può essere utilizzata nel paziente traumatizzato, evitando le
manovre di sollevamento del mento odi sublussazione della mandibola,ma non sostituisce la
manovra di iperestensione del capo nel paziente non traumatizzato. Non protegge, inoltre, le vie
respiratorie dall’inalazione e dall’ostruzione di corpi estranei. Va utilizzata prettamente nei pazienti
privi di coscienza, con mancanza di riflesso glosso faringeo, onde evitare vomito, rigurgito e
laringospasmo. La cannula deve essere della misura adeguata per il paziente e va inserita con la
concavità verso l’alto. Nel momento in cui tocca il palato deve essere ruotata a 180° con la
concavità verso il basso senza oltrepassare la lingua. La cannula può essere abbinata alla
ventilazione con maschera-pallone auto espansibile.
Valutazione dell’attività respiratoria impiegando complessivamente dai 6 ai 10 secondi.
Bisogna inoltre soffermarsi a comprendere se il paziente incosciente respira. In genere
l’approccio utilizzato è il GAS: il soccorritore inginocchiato avvicina il capo al volto della vittima
guardando se il torace e l’addome si muovono, ascoltando eventuali rumori respiratori e
sentendo sulla guancia la fuoriuscita di aria dal naso o dalla bocca. Il risultato della valutazione
può essere che il paziente incosciente respira e bisogna perciò disporlo in posizione laterale di
sicurezza, oppure che il paziente incosciente NON respira e bisogna, invece, iniziare
immediatamente la respirazione artificiale. La posizione di sicurezza (posizione di lato con
braccio sx piegato sotto la guancia dell’infortunato, mentre l’altro braccio viene tenuto dietro la
schiena per evitare che il paziente ricada sul dorso. La coscia dx è flessa con la gamba sx
posizionata al di sopra) evita gli ab ingestis, mantiene l’iper estensione e la pervietà aerea. Il
politraumatizzato con sospetta lesione spinale non deve MAI essere messo in posizione di
sicurezza. Qualora invece fossimo davanti a un paziente incosciente che non respira è necessario
iniziare un’eventuale azione rianimatoria
B: Breathing (rianimazione polmonare mediante respirazione artificiale RP). Questo col fine di
ossigenare in maniera anche parziale (l’aria espirata del soccorritore è al 16% di O2, contro il 21%
dell’aria esterna) il sangue del paziente artificialmente, evitando, così, un danno anossico
cerebrale irreversibile. Le tecniche di respirazione artificiale senza strumenti aggiuntivi sono la
tecnica bocca a bocca e la bocca-naso.
Tecnica bocca a bocca: nel paziente non
traumatizzato si deve mantenere il mento in iper estensione, tappargli il naso con l’altra mano ( se
il paziente è politraumatizzato e stiamo effettuando la manovra di sublussazione della mandibola,
il naso glielo tapperemo con la guancia) e, dopo una profonda inspirazione, espirare nella bocca
dell’infortunato l’aria, avendo cura di porre la bocca ‘’a ventosa’’. L’insufflazione deve considerarsi
efficace non appena produca un sollevamento visibile del torace. Vanno effettuate due
insufflazioni positive ogn’una non deve durare più di un secondo (bisogna evitare insufflazioni
troppo rapide che riducano il ritorno venoso, e picchi pressori di insufflazioni che inducano
distensione gastrica). Dopodiché è importante controllare, per non più di 10 secondi circa, la
presenza di segni di polso diretti (polso carotideo).
Metodo bocca-naso: nel caso non si riuscisse per gravi lesioni o non si voglia effettuare il metodo
bocca a bocca. L’unica differenza è che la bocca avvolge il naso e il soccorritore insufflerà in
questo.
La ventilazione può essere eseguita anche con strumenti aggiuntivi,
quali: ventilazione bocca-maschera, ventilazione maschera- pallone auto espansibile (che
evitano, quando possibile, il contatto diretto con il paziente). La prima è igienicamente sicura e si
pratica utilizzando la pocket-mask. Questa è provvista di una valvola monodirezionale che
19
consente di far arrivare l’aria al paziente, e, al contempo, evita al soccorritore di venire a contatto
con l’aria espirata dall’infortunato. Esiste una modalità a un soccorritore (tecnica laterale) e una a
più soccorritori (tecnica cefalica). La ventilazione maschera-pallone auto espandibile è un
sistema utilizzabile da personale sanitario addestrato. Abbiamo bisogno di un pallone auto
espandibile (2000 ml), dotato di una valvola unidirezionale, affinché l’aria espirata non sia re
inspirata dal paziente, una maschera che copra bocca e naso, e un reservoir d’ossigeno. La
manovra di ossigenazione può essere eseguita da uno o due soccorritori (più comoda) e la
maschera deve essere ben fissata perché sortisca effetto. Il solo pallone garantisce una
percentuale di O2 pari al 21%. Il pallone può collegarsi però a un reservoir che mantiene un flusso
di 15 l/min e può incrementare la % di O2.
Come già detto, dopo due
insufflazioni è necessario valutare, perdendo non più di 10 secondi, la presenza di attività
cardiocircolatoria emodinamicamente efficace.
Valutazione dell’attività cardiocircolatoria e eventuale azione rianimatoria
C: Cardiopolmonare abbinata a respirazione (RCP)
I segni di
circolo diretto che vengono considerati sono il polso carotideo (valutabile a livello del margine
anteriore dello sternocleidomastoideo all’altezza del pomo d’Adamo, anche quando c’è spiccata
ipotensione), altrimenti il polso femorale. Qualora fossero presenti dubbi sulla presenza di polso,
va intrapreso il massaggio cardiaco (RCD).
La valutazione dei segni di circolo può generare:
•
•
il riscontro di segni di circolo: il paziente è in arresto respiratorio ma non cardiaco. Si
continua a ventilare con un’insufflazione ogni 5 secondi (12 al minuto). Dopo due minuti (24
insufflazioni) cercare la presenza di segni di circolo.
L’assenza di segni di circolo: il paziente è in arresto cardio-respiratorio. Si mette in
pratica la RCP fintanto che si abbia ripresa dell’attività respiratoria spontanea (principale
segno di circolo) , disponibilità di un defibrillatore semi automatico (DAE), arrivo di un
team di soccorso avanzato (ALS).
La rianimazione cardio-polmonare consente di generare pressioni sistoliche leggermente
superiori a 60-80 mmHg. Sono pressioni molto basse ma che garantiscono comunque un certo
grado di perfusione coronarica, maggior determinante del successo della rianimazione.
La RCP se continua e ben effettuata (cambio ogni due minuti tra i soccorritori) è in grado di
triplicare la percentuale di sopravvivenza nei pazienti andati incontro ad arresto cardiaco se
eseguita immediatamente. Se ne i primi 3-5 minuti si associa anche la defibrillazione
semiautomatica, la sopravvivenza è del 74%. Per iniziare la RCP bisogna determina la metà
inferiore dello sterno del paziente (al centro della linea intermammillare), poggiaci la base
del palmo di una mano e metti l’altra sul dorso della prima in modo da sollevare le dita di
questa. Con le spalle perpendicolari all’area di compressione, spingi lo sterno verso il basso
in modo da abbassarlo di 4-5 cm, poi rilascia completamente senza però sollevare le mani (il
rilascio favorisce un più adeguato riempimento ventricolare in diastole). La fase di
rilasciamento dovrà avere la medesima durata di quella della compressione, con rapporto 1:1.
La frequenza ottimale è di 100 compressioni al minuto.
Nel paziente con
arresto cardiocircolatorio e respiratorio, la ventilazione artificiale e il massaggio cardiaco
esterno sono manovre che si integrano reciprocamente (sia nella sequenza a 1 che a 2
soccorritori): si dovrebbero alternare 30 compressioni a 2 insufflazioni (a ritmo staying alive).
Segni di efficacia della RCP possono essere la comparsa di polso femorale associata alla
compressione (se ci sono due soccorritori), ripresa di colorito, tentativi di deglutizione,
contrazione del diametro pupillare in seguito a stimolazione luminosa (midriasi bilaterale non
20
reattiva è un segno di danno cerebrale severo ma non necessariamente irreversibile). E’
necessario continuare la RCP fino a quando sopraggiunge il personale medico del 118.
La rianimazione con sole compressioni toraciche viene raccomandata quando il soccorritore
sia inesperto o non voglia eseguire la respirazione artificiale con tecnica bocca a bocca o bocca.
In caso di due soccorritori vanno ripartiti i compiti in maniera intelligente. Il primo si posiziona
accanto al paziente e inizia la RP (tecnica cefalica) mentre l’altro subentra dopo aver chiamato il
118 e esegue le compressioni toraciche. Il cambio dei ruoli deve garantire la maggiore continuità
possibile delle compressioni.
Ostruzione delle vie aeree da corpo estraneo
L’ostruzione improvvisa delle vie aeree si verifica spesso durante i pasti (carne). I pazienti
anziani e/o con protesi dentaria e i bambini, sono più colpiti. In genere questi pazienti sviluppano
improvvisamente difficoltà respiratoria, diventano cianotici e perdono coscienza senza causa
apparente. L’ostruzione può essere parziale (consente o meno lo scambio gassoso) o totale (non
c’è scambio gassoso). Quando lo scambio gassoso è sufficiente, il paziente tossisce con forza,
ci sono sibili espiratori e può parlare con voce normale o modificata. Essendo un’ostruzione lieve
non si deve interferire con i tentativi della vittima di espellere il corpo (tosse) e, qualora le
condizioni peggiorino, va chiamato il 118.
Se lo scambio gassoso è
insufficiente il paziente tossisce debolmente, parla debolmente e, in breve tempo, compare
cianosi e difficoltà respiratoria. Se abbiamo, invece, ostruzione totale delle vie aeree il paziente
porta le mani alla gola (segno universale), ha uno sguardo atterrito, non riesce a tossire, non
emette voce, diventa rapidamente cianotico, ha difficoltà respiratoria. In questi ultimi due casi
l’ostruzione è severa perciò se il paziente è tuttavia cosciente, si prova con 5 colpi dorsali tra le
scapole e eventualmente con la manovra di Heimlich (determina un aumento di P a livello laringo
tracheale facilitando la mobilitazione verso l’alto e l’espulsione del corpo. La manovra si effettua
con il soccorritore che passa le braccia sotto le ascelle della vittima, circondandogli il torace nella
zona tra l’ombelico e il processo xifoideo. Il soccorritore esercita poi una brusca compressione a
scatto, all’interno e verso l’alto per spingere il diaframma verso l’alto). La manovra di Heimlich è
controindicata in obesi e donne incinte.
Qualora il paziente sia
incosciente bisogna distenderlo e scoprire collo e torace. La bocca gli deve essere aperta con la
manovra a dita incrociate (l’indice preme contro l’arcata dentaria superiore e il pollice sulla
inferiore). Se il corpo estraneo è chiaramente visibile procedi alla disostruzione dislocando
velocemente (con movimento a scatto) il corpo, altrimenti non introdurre dita alla cieca nel cavo
orale (il corpo può facilmente essere spinto più in basso). Se con la manovra GAS vediamo che il
paziente non respira, iniziare RCP.
21
Politrauma
Il paziente politraumatizzato è un paziente che presenta lesioni multiple in più apparati. Il
polifratturato ha lesioni multiple localizzate in un solo apparato.
Epidemiologia: nel mondo è la principale causa di morte sotto i 40 anni. Sono causa di mortalità e
di invalidità. Le cause principali sono gli incidenti stradali, le cadute e le violenze.
La mortalità ha una distribuzione trimodale, ossia tre picchi temporali:
1. Morte immediata: dovuta a lesioni del SNC, midollo, cuore, aorta e grandi vasi.
2. Prime ore: dovuta a lesioni parenchimali, spesso risolvibili con manovre di emergenza.
3. Giorni: dovuta a sepsi, MOF (disfunzione multi organo) o altre complicanze.
Negli ultimi tempi sta diminuendo la quota di morti evitabili nelle prime ore grazia alle procedure
di intervento precoce (BTC), utilizzo di tecniche di rianimazione avanzate (ATC), ricovero precoce
del paziente in un centro specializzato (Trauma center).
Definizioni: Trauma: lesione prodotta da qualsiasi causa esterna che agisca con violenza
sull’organismo. È fondamentale distinguere se si tratta di un trauma maggiore o minore:
• Trauma maggiore: il paziente è incosciente, con arresto cardiaco, etc. Si può valutare in
base alla pericolosità dell’incidente, ad esempio pazienti che hanno subito: cadute superiori
a 3 metri, incidente ad alta velocità, riduzione dell’abitacolo, morte di altre persone
coinvolte, investimento da parte di un veicolo, proiezione fuori dall’abitacolo. In generale
condizioni di elevata energia d’impatto, applicazione di forze, esposizione all’impatto. In
questi pazienti si controlla Emocromoa, EAB ogni 30’, ecofast in pronto soccorso
(procedura di esecuzione rapida dell’ecografia per individuare immediatamente
versamenti pericolosi come l’emotorace o condizioni come lo pneumotorace).
• Politraumatizzato: paziente portatore di lesioni multiple in due o più organi/apparati. Non
è tanto il numero di lesioni a definirlo, quando la prognosi quoad vitam che dipende
dall’associazione tra i singoli danni che può aumentare o diminuire la gravità.
• Varietà: i traumi sono distinti in base al tipo di lesioni (ustione, ferita, contusione) ed alla
differente sede colpita.
• Rischio: Vitale: rischio per la vita del paziente. Funzionale: perdita di funzione di un
organo o apparato. A volte per diminuire il rischio vitale bisogna danneggiare la funzione,
come nel caso delle amputazioni per gangrena.
Fisiopatologia: il risultato del trauma non dipende dalla somma dei singoli danni, bensì dal danno
finale (molto maggiore di tale somma). Per esempio una rottura splenica abbassa la PO2 per shock
ipovolemico, un pneumotorace anche la abbassa. La somma dei due la abbasserà di una
percentuale maggiore rispetto a quanto farebbero le due lesioni isolate. Vi sono perciò relazioni di:
• Addizione: lesioni multiple. Ricordare che il risultato è maggiore della semplice addizione.
• Moltiplicazione: risultato dei danni esponenzialmente maggiore dei singoli danni.
• Sottrazione: stato comatoso/shock ipovolemico. Non si riferisce ai sintomi, benzì alla
risultate fisiopatologica dei traumi. Ad esempio: trauma spinale e rottura del colon. La
rottura del colon dà peritonite che causerebbe addome acuto e contrattura della parete. La
lesione midollare impedisce la contrazione e trae in inganno il medico.
- Shock: uno dei problemi principali del traumatizzato, è quasi sempre ipovolemico.
Richiederà pertanto una trasfusione. Altro possibile shock è da deficit di pompa
(tamponamento cardiaco, pneumotorace) o primitivo (contusione cardiaca, IMA). Bisogna
valutare quanto sangue il paziente potrebbe aver perso. In genere: Emotorace: 30-40%
massa circolante. Emoperitoneo: 50-60%. Frattura pelvica: 1000-2000 cc. Frattura femore:
500-1500 cc. Ematoma di 5-10 cm: 500cc. Ematoma interstiziale: 25% massa circolante.
Risposta al trauma: vi è una risposta finalizzata a mettere al riparo gli organi nobili (cervello
piuttosto che splancnici). Vi è risposta endocrina (citochine, chemochine, ipofisi-surrene), non
endocrina (adattamenti cardiocircolatori), metabolica (ipoperfusioneacidosicompensi).
Catena della sopravvivenza: insieme di azioni svolte a salvare il paziente. Si distingue una fase
pre-ospedaliera, una ospedaliera ed una riabilitativa. Perché tutte le fasi funzionino vi è bisongo di
organizzazione. Prima viene l’allarme il dispatch (dalla chiamata, all’invio dell’equipe idoena. Poi
triage sulla scena del trauma (riconoscere le lesioni e trasportare alla struttura ospedaliera più
adeguata, tra le più adeguate la più vicina). Dovrà poi iniziare il supporto delle funzioni vitali.
Allertare l’ospedale all’arrivo per far si che si preparino i mezzi. L’ospedale dovrà garantire sale di
emergenza ed equipe adeguate, sangue 0 Rh-, un laboratorio di analisi, TAC, etc.
22
Sul luogo dell’incidente si dovrà eseguire: esame della scena, soccorso, trasporto, scelta del centro
adeguato. In ospedale: valutazione secondaria e trattamento.
Approccio iniziale
Valutare la sicurezza della scena (auto protezione dei soccorritori!).
Posizionamento adeguato sulla scena: per permettere le manovre di supporto delle funzioni vitali
è indispensabile che il paziente sia disposto in posizione adeguata, ossia su di un piano rigido, in
posizione supina ed allineata. Se non si trova già in questa posizione bisogna effettuare la
manovra di supinazione, mantenendo teste-collo-torace costantemente allineati sullo stesso asse di
rotazione. Questa manovra è detta anche log-roll: soccorritore in ginocchio di lato alla vittima,
mano del soccorritore aperta “a ventaglio” dietro la nuca, con l’altra mano il soccorritore afferra la
spalla del paziente ruotandolo a sé.
Triage
Processo di valutazione attraverso cui vengono stabilite le priorità di soccorso e le priorità di
trasporto allorquando ci si trovi di fronte a più pazienti da soccorrere. In generale si utilizzano dei
codici generali: Codice Rosso: estrema urgenza, funzioni ABC assenti, trattare subito. Codice
giallo: urgenza differibile, funzioni ABC instabili, trattare in 2-5 minuti. Codice verde: urgenza
secondaria, funzioni ABC stabili, trattare in 30-60 minuti. Codice bianco: nessuna urgenza.
In pratica è necessaria una rapida valutazione in ordine ABCDE così come accade nella
metodologia di supporto delle funzioni vitali. Un metodo molto utilizzato è il recise trauma score
(RTS) che si basa sul calcolo del punteggio tenendo conto di 3 variabili fisiologiche: stato di
coscienza attraverso il Glasgow coma score, funzione respiratoria, funzione vitale circolo. Si
assegna a ciascuna variabile un punteggio da 0 a 4. Se RTS<11 è un trauma grave.
BTC, Basic trauma care
Bisogna ricordare come nel BLS l’ordine delle azioni da eseguire, ovvero sempre ABCDE,
prendendo alcune accortezze particolari trattandosi di un paziente politraumatizzato.
È necessario rimuovere ogni ostacolo alla rotazione del paziente, alla sua valutazione ed alla sua
stabilizzazione. Nei motociclisti ad esempio togliere sempre il casco. Il casco va tolto per: valutare
lo stato del cranio, effettuare le manovre rianimatorie, evitare di aggravare una lesione spinale
durante il trasposto, poter vedere un’eventuale otorragia. La manovra di rimozione deve essere
fatta da due soccorritori: Slacciare il cascoIl secondo operatore immobilizza il colloIl primo
operatore sfila il casco lentamenteLa testa del paziente viene adagiata lentamente.
A) Pervietà delle vie aeree superiori e immobilizzazione del rachide cervicale: bisogna
immobilizzare il rachide cervicale. Il rachide dopo la supinazione deve essere immobilizzato dal
soccorritore posto dietro la sua testa, con due mani. Dopo aver valutato la pervietà delle vie aeree
bisognerà poi posizionare un collare cervicale.
B) Valutazione e sostegno di base della respirazione: in questi pazienti occorre sempre
somministrare ossigeno ad alto flusso (maschera e pallone di Ambu). Se la frequenza respiratoria è
<10/min o >35/min occorre insufflare ossigeno attraverso ventilazione assistita. Nel paziente
politraumatizzato incosciente che respira va evitata la posizione laterale di sicurezza.
C) Valutazione e sostegno di base della circolazione: l’assoluta priorità è l’emostasi delle
emorragie pericolose per la vita. In emergenza si può fare: compressio su sito di emorragia,
medicazione compressiva, sollevamento dell’arto, applicazione del laccio emostatico (solo se arto
amputato, le altre manovre non bastano o si devono soccorrere altre persone).
D) Valutazione di base delle funzioni neurologiche: AVPU: A=Alert, coscienza. V=Verbal,
reazione a stimolo verbale. P=Painful, stimolo doloroso. U=Unresponsive, non reagisce affatto.
Bisogna poi valutare le pupille: isocoria, normoreattività. Valutare motilità e sensibilità.
E) Esposizione, immobilizzazione, prevenzione ipotermia: Bisogna svestire il paziente (ruotare
sempre con procedura di log-roll) esponendo torace, addome, nuca, ascelle, inguini. Il paziente
deve essere immobilizzato su asse spinale lunga, ancorato da un sistema di cinghie e da un
fermacapo correttamente applicati. Deve essere coperto da un telo isotermico per prevenire
l’ipotermia.
23
ATC, Advanced Trauma Care
Il professore ricorda alcune cose:
1) Valutazione prognostica: per capire che possibilità ha il paziente di salvarsi. Valutare: turgore
delle giugulari (se assente è shock ipovolemico), Schema di Alghevar: si calcola P.sistolica/FC, se
il valore è <1 è shock. Segni clinici di inadeguata perfusione (obnubilamento del sensorio,
tachicardia, ipotensione, oliguria, acidosi, cianosi), Emogasanalisi, Funzione cardiopolmonare:
questa potrà essere stabile (cute rosa, normali escursioni respiratorio, polso e pressione normali),
instabile (cute pallida, dispnea, rientramenti, polso e pressione alterati), compromessa (no
respirazione, no polso)
2) Legge del tubo: nel politraumatizzato è indispensabile predisporre tutte le vie di accesso
possibili, prima che divengano irreperibili o la situazione peggiori: tubo laringo tracheale (per
ventilazione invasiva), accessi venosi periferici (da prendere quanto prima perché è difficile
durante lo shock), accesso venoso centrale (subclaveare o giugulare), catetere vescicale, sonda
nasale per O2, sondino naso gastrico (per evitare ab ingestis o soffocamenti).
3) Tattica rianimatoria/operatoria nel politraumatizzato: si distinguono diversi approcci:
aggressivo (valutazione contemporanea di tutte le lesioni), intermedio (trattamento urgente delle
lesioni vitali e in differita delle altre), approccio graduale (trattare le lesioni separatamente).
4) Golden Hour: la gestione ottimale della prima ora è fondamentale. L’approccio rapido ed
efficace in questo lasso di tempo è quello con maggiore influenza sulla prognosi quoad vitam e
quoad valitudinem.
5) Regole d’oro: la mortalità è direttamente proporzionale all’intervallo libero terapeutico. La
prima cosa da fare sono i gesti elementari di sopravvivenza. La sequenza delle procedure deve
seguire uno schema rigoroso e automatico.
6) Errori: l’inesperienza ed il dilettantismo sono le principali cause di decesso in emergenza. Non
bisogna confondere la competenza tra emergenza e reparti di emergenza. Non confondere
l’emergenza con la medicina o la chirurgia d’urgenza, il pronto soccorso, etc. Misconoscimento
della gravità della situazione. Non applicare protocolli di reparto al paziente in emergenza.
A) Pervietà delle vie aeree: Valutazione: valutare eventuale risposta verbale, segni di ostruzione
delle vie aeree (stridore laringeo, respiro stertoroso, difficoltà di fonazione, impiego muscoli
accessori, apnea, cianosi). Presenza di edemi, corpi estranei, sangue o vomito.
Azione: non si esegue la manovra di iperestensione del capo (il rachide cervicale deve essere
immobilizzato da un secondo operatore bimanualmente), si fa sublussazione della mandibola e
sollevamento del mento. Tramite una cannula oro o nasofaringe si assicura che la lingua non
tornerà ad ostruire le vie. Metodiche avanzate: Intubazione tracheale: è indicata in caso di shock,
arresto respiratorio, segni di insufficienza respiratoria acuta (FR>40/min, saturazione 95%
nonostante maschera O2 con reservoir, RTS<10), segni di ostruzione delle vie aeree, GCS<8, molto
sangue dalla bocca. Se falliscono 3 tentativi di intubazione si usano, se possibile combi tube o
maschera laringea, altrimenti cricotirotomia. L’asportazione di manuale estraneo può essere fatta
invece manualmente (dito ad uncino) oppure tramite aspiratore portatile elettrico.
Posizionamento del collare cervicale: dopo aver garantito la pervietà delle vie aeree si deve
posizionare al più presto il collare mantenendo il rachide in posizione neutra, allineata.
B) Ossigenazione e ventilazione: Valutazione: valutare il tipo di respiro e la frequenza
respiratoria oltre che segni di trauma toracico. Effettuare palpazione delle irregolarità (eventuali
fratture della parete o enfisemi sottocutanei), percussione (pneumotorace o emotorace),
auscultazione, saturimetria. L’emogasanalisi è fondamentale. Nel paziente intubato si può valutare
la pressione parziale di CO2 a fine espirazione.
Azione: è sempre fondamentale somministrare ossigeno al 100%. Attraverso maschera con
reservoir se è possibile la respirazione spontanea, altrimenti ventilazione assistita.
C) Stabilizzazione del circolo e controllo emorragie: è fondamentale riconoscere uno stato di
shock con riscontro di segni di ipoperfusione e poi di ipotensione. Valutazione: lo shock
traumatico può essere misto ed avere componente: ipovolemia (emorragie), cariogena (contusioni,
embolie), ostruttiva (pneumotorace, tamponamento cardiaco), neurogena (lesione midollare alta),
settica (in genere più tardiva, 24-48h dopo il trauma). La forma più comune è lo shock
ipovolemico per causa emorragica. Si ha sindrome emodinamica da bassa gittata: cute fredda e
sudata, estremità pallide, tachicardia, polso piccolo e frequente, tachipnea, depressione della
coscienza dalla confusione al coma, ipotensione, oliguria.
24
L’ipotensione non è un segno precoce. In genere fino al litro di sangue possono non esservi
sintomi. Questi compaiono con perdite in genere superiori a 1,5 litri con attivazione di
catecolamine e tachicardia. A questo punto si comincia ad avere anche ipotensione.
Azione: Stabilizzazione del circolo: adeguata ossigenazione, stabilire un accesso vascolare.
Fluidoterapia: tecnica di boli successivi di cristalloidi di 1,5-2 litri ciascuno. La quantità dipende
dal grado di emorragia: I: 750 ml, 2 litri di cristalloidi. II: fino a 1,5l, 3-4 l di cristalloidi. III: 1,5-2 l,
5-6 litri di cristalloidi. IV: >2l, >6 l di cristalloidi. In pratica i cristalloidi devono essere infusi con la
regola del 3:1. Possono essere associati a colloidi.
In caso di emorragia critica (massiva), cioè totale nelle 24 ore o 50% in 3 ore o di 150ml/min, serve
un protocollo di trasfusione massiva (è necessario che il pronto soccorso abbia sempre disponibili
unità di sangue 0 Rh-). In pratica dopo 4 unità di emazie concentrate bisogna infondere plasma, e
dopo 10 unità un pool piastrinico.
Monitoraggio: monitorare costantemente dopo la re infusione per valutare la risposta del paziente.
Ricordare che la concomitanza di acidosi, ipotermia e coagulopatia rappresenta la cosiddetta
triade letale del politraumatizzato, in quanto causa frequente di morte.
D) Valutazione neurologica: l’indice di valutazione neurologica pià completo e preciso è il
Glasgow Coma Scale (descritto nel capitolo del coma). Prende in considerazion i parametri di
apertura degli occhi, risposta verbale, risposta motoria. Punteggio da 3 a 15.
In seguito bisogna valutare le pupille e la risposta alla luce. Poi motilità e sensibilità.
E) Esposizione, esame esterno e protezione, informazioni aggiuntive: già sulla scena bisogna
raccogliere informazioni aggiuntive circa l’incidente. Il paziente deve essere spogliato
completamente (magari con le forbici taglia-abiti) sempre mantenendo il rachide immobile.
Visualizzare la regione dorsale, le regioni ascellari e inguinali e del bacino. Valutare la presenza
di una frattura del bacino (incapacità di flettere l’anca, anomalie di lunghezza arti inferiori,
ematomi, sangue dal meato uretrale esterno). Può essere necessaria l’immobilizzaizione degli arti e
caricare il paziente sull’asse spinale (tavola rigida a cui è stretto tramite cinghie).
Fratture e ferite degli arti: bisogna garantire l’emostasi e controllare il polso periferico. Allineare
l’arto in leggera trazione in caso di frattura non esposta. In caso di frattura esposta bisogna invece
immobilizzare l’arto nella posizione in cui si trova.
Protezione termica: teli termici, coperte, etc. per garantire protezione dall’ipotermia.
Traumi cranici
I traumi cranici possono essere: aperti (con fuoriuscita di sostanza cerebrale) o chiusi. Sono dovuti
a forze meccaniche esterne che agiscono sul cranio. Dalla più superficiale alla più interna avremo:
ferite lacero-contuse del cranio, ematoma sottogaleale, fratture ossa craniche (lineari e comminute),
ematoma epidurale o subdurale, ematoma intracerebrale, emorragia sub aracnoidea, lacero
contusione cerebrale, lesione assonica diffusa.
• Lacerazioni cutanee o sottocutanee: vengono trattate in pronto soccorso.
• Frattura ossa craniche: si accompagna a ematoma extra durale, con raccolta ematica
dunque tra dura madre e teca interna.
• Ematoma epidurale: in genere da rottura dell’arteria meningea media. Si ha azione
compressiva sul temporale che causa erniazione uncuale con anisocoria per compressione
del II nervo, emiplegia, disturbi motori.
• Ematoma subdurale: rottura dei vasi tra aracnoide e pia madre. Il trattamento è più
difficoltoso che per l’epidurale. Si associa spesso a focolai lacerocontusi intracerebrali che
possono causare anche gravi invalidità.
Spesso nei traumi cranici alla lesione si associa edema cerebrale ed aumento della pressione
intracranica. Complicanze: sono possibili aneurismi traumatici, lesione dei nervi cranici,
formazione di focolai epilettogeni.
Terapia in emergenza: bisogna sempre proteggere il rachide cervicale. Valutare il GCS. Anche
nei pazienti con traumi minori (GCS=14-15) è indicata l’esecuzione della TC cranio a 6 ore e
successivamente dopo 12-24 ore prima della dimissione. Intubare i pazienti con GCS<9.
Ventilazione e ossigeno. Evitare però l’ipocapnia (rischio di vasocostrizione e ischemia cerebrale).
La pressione non deve mai scendere troppo. Se è presente ipertensione endocranica è indicata la
somministrazione di mannitolo e furosemide (ogni 4 ore). Chirurgia: se l’ipertensione
endocranica non si risolve con la terapia medica si fa decompressione ossea.
25
Traumi spinali
La colonna vertebrale ha funzione statica (consente di rimanere fermi), di stabilità (assicura che le
vertebre mantengano le stessi distanze anche durante il movimento), neuro protettiva.
Le fratture del rachide devono essere sospettate sempre nel paziente politraumatizzato. La
maggior parte delle fratture avvengono tra T10 e L2. Vi sono lesioni spinali non dovute a traumi
come quelle che si verificano in corso di osteoporosi. Vi sono diversi tipi di lesioni:
• Lesioni da compressione: (gruppo A di Magerl) per esempio per caduta dall’alto. Avviene
schiacciamento e quindi cuneizzazione della vertebra lesionata. È stabile e il danno
neurologico acuto è infrequente.
• Lesioni da distrazione (gruppo B) e da rotazione (gruppo C): vi è instabilità dolorosa,
prognosi più incerta (vi è spesso danno a legamenti). Più probabile il danno neurologico.
Clinica: dipende molto dalla presenza o assenza di danno neurologico:
• Fratture mieliche: dolore locale, possibile deformazione, contrattura di difesa.
• Fratture amieliche: sintomi che vanno dal formicolio degli arti alla paresi. Quanto iù la
lesione è craniale tanto più la prognosi è grave. C1-C2paralisi respiratoria.
Terapia: in emergenza bisogna sempre immobilizzare con collare il rachide cervicale. Nel
politraumatizzato in genere (tranne se molto craniali) non sono lesioni che mettono a rischio la
vita, pertanto ci si occupa prima di altri traumi (bacino, perdite ematiche importanti, etc.).
In seguito si potrà pensare ad una terapia incruenta (collari, mezzi contenitivi, etc.) o cruenta
(interventi di riduzione e stabilizzazione delle fratture, in genere con artrodesi).
Traumi del bacino
Sono abbastanza frequenti e spesso pericolosi in quanto possono associarsi a gravi emorragie e
lesioni degli organi pelvici. Bisogna immobilizzare mediante fascia pelvica durante il trasporto.
Eseguire poi una radiografia per valutare se la frattura è a rischio di gravi emorragie interne.
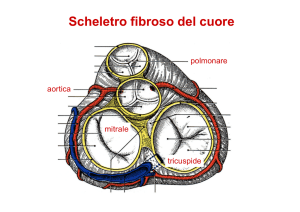
Traumi toracici
Bisogna sempre considerare che vi sono due tipi di trauma: aperto (continuità tra esterno e
interno) o chiuso. Un pneumotorace può essere causato sia da un trauma aperto (es. ferita da
lama), che chiuso (es. pugno al torace). Possono essere traumi molto gravi che richiedono
immediata esecuzione delle manovre rianimatorie. Vi sono diversi tipi di lesioni:
1. Fratture costali: in genere non danno grossi problemi, eccetto quando la rima della frattura
è doppi e riguarda più coste in successione. In questo caso si crea il cosiddetto lembo
costale mobile (o volet costale), ossia segmento della parete toracica in discontinuità con il
resto che non segue le escursioni respiratorie del torace. Si ha un respiro paradosso:
affossamento del volet durante l’inspirazione e fuoriuscita durante l’espirazione. Questa
componente polmonare risulta esclusa dalla ventilazione e tanto è maggiore, maggiore è il
rischio di insufficienza respiratoria acuta. Esame obiettivo: si nota il respiro paradosso, si
può palpare un crepitio, riduzione MV nel volet. Possibile agitazione, dolore e dispnea.
Terapia: supporto con O2, se necessario intubazione e ventilazione meccanica.
2. Pneumotorace: normalmente nel cavo pleurico vi è una pressione negativa. In caso di PNX,
a causa di una lesione esterna o una rottura di un bronchiolo si perde la pressione negativa
e si genera una pressione positiva che causa collasso polmonare.
Classificazione: lo pneumotorace può essere spontaneo (anche in un soggetto normale, spesso per
aumentata pressione intratoracica), traumatico (non è necessario un forte trauma), iatrogeno (da
puntura ad esempio dell’apice polmonare nell’incannulamento della succlavia). Si distingue poi:
• Aperto: l’aria può entrare ed uscire. È poco pericoloso. Le cause sono in genere ferite.
Terapia: in genere è sufficiente drenaggio toracico e riparazione chirurgica della ferita.
• Chiuso: l’aria entrata non può più uscire, ma non ne entra altra. È stabile.
• Iperteso: insorge quando si verifica un meccanismo a valvola: l’aria entra con
l’inspirazione, ma non esce con l’espirazione. In questo modo la pressione intratoracica
aumenta sempre di più. Le cause sono traumi penetranti, chiusi con lesione parenchimale,
rottura di bolle, etc. Esame obiettivo: Vi è dolore toracico trafittivo. Dal lato del
pneumotorace vi sono muscoli gonfi, spazi intercostali rigonfiati, spazio pleurico pieno
d’aria, polmone collassato. Vi è iperespansione e ipomobilità dell’emitorace interessato.
Controlaterlamente: sono compressi il polmone, i grossi vasi, le vene cave, il cuore. Il
meccanismo è quello dello sbandieramento mediastinico con chiusura delle vene cave e
26
quindi blocco del ritorno venoso al cuore. Si può avere pertanto shock ostruttivo con segni
di ipoperfusione periferica e ipotensione.
Rx: si confronta l’immagine con quella del polmone contro laterale. La trama polmonare nel
polmone colpito è poco o per nulla visibile.
Terapia: la terapia non chirurgica è l’inserzione di un ago cannula di grosso calibro
(toracentesi?!) a livello del 2° spazio intercostale. Si può fare anestesia locale con lidocaina. In
genere si fa una puntura iniziale, poi allargata con bisturi e poi si inserisce il tubo. Bisogna
penetrare subito sopra il margine superiore della terza costa per non ledere il fascio vasculonervoso che passa vicino al bordo inferiore. Il tubo di drenaggio deve essere collegato ad un
sistema aspirativo con valvola unidirezionaleb (di Heimlich) che permette all’aria di uscire, ma
non di entrare. Altro sistema è quello della valvola ad acqua: il tubo collegato al polmone pesca
nell’acqua, così le bollicine di aria drenate finiscono in acqua e fuoriescono dal secondo tubo
collegato all’esterno. Quando si ripristina la pressione negativa nel cavo pleurico un po’ di acqua
risale il tubo (menisco, mai fino alla pleura) e questo vuol dire che il polmone si trova “a parete”.
3. Emotorace: presenza di sangue nel cavo pleurico. Condizione di estrema urgenza. Le cause
sono spesso traumi penetranti con lesione di vasi mammari, ilari o intercostali. Clinica:
shock emorragico (si possono perdere fino a 3 litri di sangue), abolizione del MV, suono
ottuso alla percussione, vene del collo vuote. Se la perdita è >1,5 l si parla di emotorace
massivo. Terapia: si richiede supporto in caso di shock emorragico con infusione di liquidi,
possibile intubazione, inserzione di un tubo di drenaggio al 4° o 5° spazio intercostale. In
caso di emopneumotorace (non infrequente) si usa un tubo plurifenestrato con più forellini
e che permette il passaggio sia di aria che di sangue.
Se c’è urgenza e nell’indecisione tra pneumo ed emotorace si può effettuare drenaggio ad
un’altezza intermedia tra 2° e 5° costa (che cazzo vuol dire?! Terza costa e mezzo???).
4. Altre lesioni toraciche: Tamponamento cardiaco: da lesioni che causano versamento di
sangue intrapericardico. Causa turgore delle giugulari, ipotensione arteriosa, ottundimento
dei toni cardiaci (triade di Beck). È una causa di shock ostruttivo con associata sindrome da
bassa gittata, spesso aritmie gravi. Si deve effettuare pericardocentesi d’urgenza. Rottura
di grossi vasi: rara la sopravvivenza, programmare al più presto cardiochirurgia. Rottura
dell’esofago: causa una mediastinite e rapido shock. Bisogna intervenire con esofagostomia
cervicale e gastrostomia. Altro: contusioni polmonari o cardiache, lesione diaframma, etc.
Traumi dell’addome
Sono spesso associati a traumi toracici. In caso di rottura del diaframma si ha risalita di visceri in
torace (possibili occlusioni) e compressione polmonare. Vi sono due tipi di condizioni: peritoniti
(rottura di visceri cavi) e emorragia (interessamento organi parenchimatosi). Un eventuale
associazione con traumi cranio-spinali può dare sottrazione dei sintomi (meno dolore o mancata
contrattura muscolare ad esempio).
Diagnosi: bisogna eseguire Eco fast. Se vi è sospetto all’ecografia eseguire una TAC.
Sindrome emorragica: polso piccolo e frequente, ipotensione, pallore, dolore, riduzione ematocrito
Sindrome perforativa: dolore addominale diffuso, segno di Bloomberg, leucocitosi, ileo dinamico.
Dopo 12-24 ore segue solitamente shock settico (febbre, riduzione pressione, MOF sino a morte).
A) Traumi aperti: Semplice ferita: sutura. Colpo d’arma da fuoco: foro d’entrata e d’uscita.
B) Traumi chiusi: Milza: si distinguono 2 tempi: prima accumulo sottocapsulare e poi rottura
capsula ed emoperitoneo. Servono supporto emodinamico e vitamina K. Chirurgia d’asportazione.
Fegato: per lesioni gravi si effettua packing (garze laparotomiche attorno al fegato per comprimere
l’emorragia). Organi cavi: sutura e resezione del tratto interessato.
Traumi complessi degli arti
Un trauma complesso egli arti può manifestarsi con sintomi ischemici ed emorragici. L’ischemia
consegue alla rottura di un’arteria che non riesce a veicolare il sangue alle estremità. Mentre
l’emorragia può estrinsecarsi o rimanere sotto fasciale come ematoma. L’ischemia è spesso
associata ad assenza di polso periferico (ma può esserci danno, vi può essere ematoma e parte del
sangue comunque arrivare e dare polso).
Nei traumi complessi l’ordine di priorità nel trattamento è emorragia, osso, vasi, nervi, muscoli.
Nel triage bisognerà: controllare l’emorragia, e prevenire contaminazione batterica.
Complicanze: contaminazione, frattura scomposta che dà osteosintesi con placche, presenza di
corpi estranei, dispersione dell’ematoma.
27
Diagnosi: va posta il prima possibile. Bisogna indagare:
• Lesioni vascolari: ricerca dei polsi. Attenzione a trombosi e spasmi arteriosi che possono
dare falsi positivi. Vanno ricercati anche thrill e soffi (fratture scomposte).
• Lesioni scheletriche: valutare deformità ed impotenza funzionale (a volte neurologica).
Ciò che più condiziona la prognosi sono le lesioni vascolari. Se i vasi sono integri si può salvare
l’arto con buone probabilità. È sempre opportuna una radiografia ed una ecodoppler per i vasi.
Shock, ischemia, soffio e thrill sono segni del danno vascolare. Soffio e thrill indicano che vi è una
contemporanea lesione arteriosa e venosa. Il thrill si apprezza come una vibrazione, il soffio
attraverso il fonendoscopio.
Classificazione di Kimmonth delle lesioni vascolari:
• Uno o più strati di parete intatta: spasmo, può causare assenza reversibile dei polsi. È in
genere dovuto a contusioni o trombosi.
• Tutti gli strati discontinuati: da ferite, perforazioni, lacerazioni. Se tonaca avventizia,
media ed intima sono lese abbiamo emorragia.
• Aneurisma: pressione all’interno dell’arteria che crea la deformazione aneurismatica.
• Fistola arterovenosa: dovuta a processi infiammatori o ferite penetranti.
Oltre all’esame obiettivo possono essere utili ecodoppler o anche angiografia.
Lesioni da arma da fuoco: vi è in genere foro d’entrata e di uscita (ma può anche rimbalzare). Le
lesioni quindi possono essere anche non solo lungo la traiettoria. Cercare sempre foro d’uscita e
proiettile.
Lesioni nervose: sono presenti nel 2-3% dei casi. Provocate da tagli, contusioni, trazioni. Si
manifestano con deficit motorio o sensitivo, turbe trofiche e vasomotorie. RMN e TC possono far
individuare la lesione di grossi tronchi nervosi (cingolo scapolare e pelvico).
Edema: dolore intenso, aumento della pressione, impotenza funzionale, polsi periferici a volte
normali. Sindrome compartimentale: edema e necrosi della cute (si richiede fasciotomia d’urgenza
per allentare la pressione del compartimento). Il ritardo nella terapia può causare retrazione del
muscolo o anche ischemia e quindi necrosi dei tessuti dell’arto.
Terapia d’urgenza:
1. Trattare l’emorragia: emostasi temporanea: no pinze emostatiche! La compressione deve
essere manuale o se non si riesce si usa laccio o manicotto emostatico.
2. Riparazione ossea: bisogna effettuarla prima della riparazione vascolare, perché altrimenti
si potrebbero dover riparare i vasi due volte. Durante la riparazione ossea è utile
incannulare i vasi arteriosi per mantenere la perfusione distale (bypass temporaneo) e poi
ricostruzione venosa e arteriosa. Da evitare immobilizzazione col gesso (per evitare
complicanze e anche per poter mantenere il controllo sulle lesioni venose).
3. Riparazione della lesione venosa: dalla semplice sutura all’innesto autologo. Talora si può
temporaneamente creare a valle una piccola fistola arterovenosa. Facendo rapidamente
riparazione venosa si evitano gli edemi da difficoltoso scarico venoso.
Bypass extra-anatomici: nei traumi infetti non possono essere usate protesi e si usano bypass. Si
usano in caso di ischemia dell’arto. I principali bypass sono il femoro-femorale e l’axillo
(succlavia)-femorale. Sono superficiali, con scarso trauma operatorio.
28
Shock
È una sindrome clinica a patogenesi multifattoriale ed evoluzione progressiva, solo inizialmente
reversibile, caratterizzata da grave disfunzione bioenergetica cellulare sistemica, associata
soprattutto a disossia. È prodotta da uno stato di insufficienza macro e micro circolatoria acuta:
perfusione tessutale multi organica ridotta e disomogenea (riduzione del trasporto di ossigeno a
livello cellulare) e incompleta rimozione dei cataboliti cellulari. Causa l’insorgenza di una
sindrome da disfunzione multi organo (MODS).
Fisiopatologia: si ha una drammatica ipoperfusione per compromissione del flusso ematico a
livello micro vascolare, con mortalità elevata (almeno intorno al 50%). Si verifica: compromissione
della perfusione efficace, severa sofferenza cellulare su base ipossica (prima reversibile, poi
irreversibile), alterazione del metabolismo ossidativo, accumulo di CO2 tissutale, disfunzione
d’organo (da danno ischemico, dovuta ai fattori della risposta infiammatoria sistemica e da danno
da riperfusione), rischio elevato di arresto cardiaco.
Classificazione: lo shock può essere distinto in:
• Shock a bassa gittata: Cardiogeno, Ipovolemico, Extracardiaco Ostruttivo.
• Shock a gittata normale/aumentata: Shock distributivo: Neurogeno, Settico, Anafilattico.
Shock a bassa gittata
Vi è riduzione della gittata cardiaca e trasporto di ossigeno ai tessuti con evoluzione verso la morte
cellulare. La causa può essere: ipovolemia, cardiogena, ostruttiva extracardiaca.
1) Shock ipovolemico: stato di shock dovuto ad una grave e spesso improvvisa riduzione del
volume ematico circolante da perdita effettiva di liquidi (ipovolemia assoluta), o ad un mutato
rapporto tra la volemia e la capacità del sistema vascolare (ipovolemia relativa). Distinguiamo:
• Shock ipovolemico emorragico: traumi, emorragie interne o sanguinamenti.
• Non emorragico con deplezione di liquidi: vomito, diarrea, poliuria, ustioni, ma anche
edemi, sequestrazione di fludi (ascite ad esempio).
• Non emorragico da venodilatazione: shock settico, anafilattico, neurogeno, anestesia, etc.
Clinica: un’ipovolemia lieve (<750ml) determina una lieve tachicardia e pochi segni. I segni
principali di ipoperfusione sistemica sono: estremità pallide, fredde, sudate, etc.
Ipovolemia modesta (sino 1,5l): stato ansioso, tachipnea, tachicardia moderata, ipotensione
posturale, spesso oliguria.
Ipovolemia grave: (>1,5l): ipotensione arteriosa anche in posizione supina, polsi che non sono più
palpabili (pressione <80mmHg), tachicardia (>120), oliguria, confusione poi progressione al coma.
2) Shock cardiogeno: grave e spesso improvvisa riduzione della funzione di pompa cardiaca. Vi
è spesso rischio di aritmie maligne. In generale ipovolemia, ipossia e acidosi. Distinguiamo:
• Shock cardiogeno miopatico: IMA, contusione miocardica, miocarditi, cardiomiopatie,
miocardio depressione settica o correlata a SIRS (politraumi, ustioni) o farmacologica.
• Meccanico: valvulopatie, rottura di un papillare o del setto o della parete ventricolare.
• Aritmico: da bradicardie o tachicardie.
Clinica: Prevalentemente sinistro: edema interstiziale, edema polmonare. Tachipenea, dispnea,
espettorato schiumoso rugginoso, rantoli polmonari. A valle: ipoperfusione periferica: cute
pallida, fredda, sudata. Ipoperfusione centrale: Ipotensione arteriosa (sistolica <90 dà oliguria,
acidosi metabolica, alterazione coscienza fino al coma), scompenso acuto (3° e 4° tono, soffi).
Prevalentemente destro: Congestione venosa sistemica: turgore giugulare, dolore in ipocondrio
destro e reflusso epato-giugulare. A valle: ipoperfusione periferica e centrale: come nel sinistro.
Nello shock destro i campi polmonari sono caratteristicamente liberi.
3) Shock extracardiaco ostruttivo: severa ostruzione al flusso ematico situata nel grande o
piccolo circolo che riduce la gittata cardiaca drasticamente. Si distingue in:
• Ridotto riempimento diastolico: tamponamento cardiaco, pneumotorace iperteso,
ostruzione della vena cava, tumori intratoracici ostruttivi, ventilazione meccanica.
• Ostacolata eiezione sistolica: tromboembolia polmonare, dissezione aortica.
Fisiopatologia: Tamponamento cardiaco: versamento pericardico tale da causare ostacolo al
riempimento ventricolare. Reflusso di sangue dall’atrio alle cave e alle giugulari (le cause sono
29
ferita cardiaca o delle coronarie, aneurisma dissecante aortico, rottura parete ventricolare). Si
osserva la Triade di Beck: pressione sistolica <90, toni cardiaci parafonici, distensione giugulari.
C’è tachicardia, dispnea, polso paradosso, ipoperfusione periferica e centrale (shock).
Pneumotorace iperteso: sbandamento del mediastino e compressione-distorsione delle cave. Segni
di ipotensione e ipoperfusione, insufficienza respiratoria acuta, dolore acuto del torace, deviazione
laterale della trachea, distensione delle giugulari. Segni tipici all’esame obiettivo dell’emitorace.
Tromboembolia polmonare massiva: ipertensione e disfunzione ventricolare destra. Iporensione e
ipoperfusione, insufficienza respiratoria, dispnea ad esordio improvviso o anche sincope, dolore
toracico acuto, assenza di rantoli polmonari all’auscultazione.
Shock a gittata normale o aumentata: in genere da riduzione delle resistenze sistemiche.
4) Shock settico: causato dalla risposta dell’organismo a un’infezione grave.
Definizioni: è una sindrome complessa, per attivazione abnorme del sistema immunitario (SIRS)
che può condurre fino alla disfunzione multi orfano.
• SIRS: Sindrome da risposta infiammatoria sistemica: caratterizzata dalla presenza di 2
fra: temperatura >38 (o <36), FC>90bpm, FR>20 (o PaCO2<32), leucocitosi (>12000 o <4000).
• Sepsi: risposta infiammatoria sistemica ad un’infezione, caratterizzata dalla presenza di 2
fra: temperatura >38 (o <36), FC>90bpm, FR>20 (o PaCO2<32), leucocitosi (>12000 o <4000).
• Sepsi severa: SIRS o sepsi associate a segni di disfunzione d’organo o ipoperfusione con
acidosi lattica, ipotensione, oliguria o deterioramento dello stato mentale.
• Shock settico: sepsi severa con ipotensione non responsiva a fluido terapia.
• MODS: Sindrome da disfunzione multi organo: alterata funzionalità d’organo in un
paziente acuto la cui omeostasi non può essere mantenuta senza intervento terapeutico.
La classificazione PIRO valuta il grado di shock prendendo in considerazione (condizioni
Predisponenti, Infezione, Risposta dell’ospite, disfunzione d’Organo).
Esiste però un più preciso Sepsis Score, il quale è finalizzato soprattutto alla valutazione clinica, la
strategia terapeutica e la monitorizzazione della risposta. Questo score valuta:
• Segni e funzioni vitali: temperatura corporea (se <36 o >38-39), coscienza, FR, SO2, FC, PA.
• Segni clinici di infezione: cute, respiratorio, cardiovascolare, digerente, urinario, SNC.
• Indici di disfunzione d’organo: ipossiemia, oliguria, lattacidemia, leucocitosi(>12000),
leucopenia (<4000), trombocitopenia, bilirubinemia.
La somma dei punteggi assegnati a ciascun parametro permette la valutazione della severità.
La diagnosi rapida e l’infusione di antibiotici è fortemente correlata alla prognosi.
Eziologia: la causa più frequente sono batteri Gram negativi (ad esempio Pseudomonas). Tra i
Gram positivi: Stafilococco, Streptococco e Clostridium. Tra i funghi: Candida e Aspergillus.
Fisiopatologia: viene prodotta una grande quantità di mediatori che a livello sistemico causano
una risposta immuno-infiammatoria, alterazioni di microcircolo e macrocircolo e in ultimo una
disfunzione multi organo. Vi è infatti produzione di una grande quantità di citochine pro
infiammatorie (TNFalpha, IL-1-6-3-8-12), attivazione del complemento, chinine, coagulazione
(meno proteina C e antitrombina III), aggregazione piastrinica, proteine di fase acuta. Si ha
aumento ella sintesi di metaboliti dell’acido arachidonico, radicali liberi dell’ossigeno, ossido
nitrico, rilascio massivo di proteasi (quadro si SIRS). Nel complesso si producono:
vasodilatazione diffusa, ostruzione parziale dei capillari, aumento della permeabilità capillare,
edema interstiziale generalizzato, ipossia tissutale, acidosi metabolica, miocardio-depressione,
insufficienza d’organo. Vengono anche rilasciati mediatori anti-infiammtori (sindrome CARS da
risposta anti-infiammatoria compensatoria) che causa una relativa immunodepressione (detta
immunoparalisi). L’aumentata richiesta di ossigeno ed il ridotto post-carico da vasodilatazione
causano inizialmente un aumento della gittata. Il consumo di ossigeno ed il trasporto di esso sono
aumentati. Questo aumento è però inadeguato e si sviluppa comunque acidosi lattica. Questo a
causa di una disfunzione del microcircolo (aumento di capillari ipoperfusi, di ostruzioni e di
shunt artero-venosi pervi) e di una disfunzione mitocondriale. Si ha così lesione cellulare.
A decretare l’irreversibilità è l’attivazione massiva dell’apoptosi cellulare. Successivamente
l’ipovolemia, la miocardio depressione portano dalla fase iperdinamica a quella ipodinamica in
cui la gittata cardiaca è ridotta e le resistenze periferiche aumentate.
Clinica: Fase iperdinamica: ipotensione, aumento pressione differenziale, polsi periferici ampi,
cute calda, segni di ipoperfusione centrale e insufficienza respiratoria.
Fase ipodinamica: ipotensione, pressione differenziale ridotta, polsi periferici non palpabili, cute
fredda e pallida, segni di ipoperfusione centrale e insufficienza respiratoria.
30
5) Shock anafilattico: riconosce moltissime cause: da antibiotici e chemioterapici, antiflogistici,
ormoni ed enzimi, farmaci del SNC e altri, m.d.c., emoderivati, vaccini, sostanze ed alimenti.
Reazione anafilattica: si realizza un processo di sensibilizzazione in cui l’allergene stimola la
produzione delle IgE. A seguito di una nuova esposizione si realizza una gran reazione (mastociti,
basofili, istamina, altri mediatori) che causa vasodilatazione, aumentata permeabilità capillare
contrazione muscoli lisci, miocardio depressione, aumentata secrezione ghiandolare.
Reazione anafilattoide: non IgE mediata, innescata da anticorpi di altre classi o dal complemento
o da fattori osmotici o anche fisici.
Clinica: la reazione causa arresto cardiaco in 5-120 minuti, a volte ritardata (8-12 ore). Abbiamo:
Ipotensione arteriosa, pressione differenziale aumentata, aritmie, sincope. Vie respiratorie:
ostruzione vie respiratorie superiori (raucedine, tosse, stridore, tirage) o inferiori (sibili),
insufficienza respiratoria acuta (dispnea, tachipnea, cianosi), sintomi cutanei (prurito,
angioedema, esantema), neurologici (ansia, alterazione coscienza), gastrointestinali (vomito,
diarrea, dolore addominale), oculari (edema palpebre), orali (prurito, edema lingua).
6) Shock neurogenico: shock da improvviso deficit del tono vasomotorio simpatico.
Eziologia: Da farmaci: barbiturici, narcotici, tranquillanti. Da lesioni prossimali a T1:
vasodilatazione, ipovolemia e riduzione portata. Tra T1 eT6: bradicardia e ipotensione.
All’inizio la gittata cardiaca è normale o aumentata, ma vi è bradicardia (tono vagale).
Clinica: ipotensione, differenziale ridotta, bradicardia, cute calda, rosea e asciutta.
Approccio in emergenza: bisogna chiedersi:
1) Vi sono segni di ipoperfusione sistemica? Segni precoci: dispnea e polipnea, ipotensione
ortostatica in caso di perdita ematica. Tachicardia (bradicardia in caso di gravi emorragie, grave
insufficienza respiratoria, shock neurogenico o overdose da farmaci), alterazione dello stato
mentale (inizialmente ansia, poi confusione fino al coma), oliguria, acidosi metabolica.
L’ipotensione da sola non è un segno specifico, ma se <30mmHg è certo lo shock.
2) È uno shock ad alta o bassa gittata? Alta gittata: cute calda, rapido riempimento capillare, polsi
arteriosi pieni, e schioccanti, pressione differenziale aumentata (la diastolica è bassa per via delle
basse resistenze periferiche), forte itto apicale. Bassa gittata: cute fredda, pallida e sudata, lento
riempimento capillare, polsi filiformi o assenti, differenziale ridotta, debole itto apicale.
3) Il riempimento cardiaco è sufficiente? Ci permette di distinguere uno shock ipovolemico da
uno cardiogeno. Nell’ipovolemico abbiamo: vene giugulari collassate, cuore e polmone normali
all’esame obiettivo, Rx normale, ECG normale, segni di sanguinamento o perdita di liquidi. Nello
shock cardiogeno invece: giugulari distese, 3°o 4° tono, soffio sistolico puntale (ischemia
papillari), segni di edema polmonare all’ECG, edemi periferici, possibili alterazioni ECG.
Nell’ostruttivo ci sono segni peculiari: giugulari distese, distensione inspiratoria della giugulari
(segno di Kussmaul, tamponamento cardiaco), esame obiettivo del torace caratteristico
(pneumotorace), segni ECG o ecocardiografici indicativi.
Anamnesi: diabete, ipertensione, pregresso infarto, scompenso cronico, disfunzioni tiroidee,
insufficienza renale, cirrosi, etc. Recente intervento chirurgico, recenti traumi o ustioni, allergia a
farmaci o allergeni, esposizione a tossici, trasufusioni, m.d.c., patologie immunitarie.
Metodologia clinica in emergenza
• Accesso vascolare venoso: due cannule di grosso calibro e corte, perfernzialmente alle vene
cefalica o basilica, o vene centrali (giugulari o succlavie) o vena safena (malleolo mediale).
• Prelievo ematico venoso: emocromo e gruppo, creatinina, azotemia, glucosio, albumina,
transaminasi, LDH, amilasi, elettroliti, lattidacemia.
• Emogasanalisi: saturazione, CO2, equilibrio acido-base.
• Posizionamento di un catetere vescicale: e misurazione della diuresi oraria.
• ECG: per valutare tutte le eventuali modifiche specifiche di quadri patologici.
• Ecocardiogramma: utile per distinguere un cardiogeno da uno ostruttivo extracardiaco.
• Rx torace
• Rx diretta addome: in caso di addome acuto.
• Ecografia addominale e pelvica: eco fast in caso di traumi o patologia vascolare acuta.
Monitoraggio del paziente: segni vitali (coscienza, FC, FR, temperatura), pressione, ECG,
saturimetria, PVC (da vena centrale), laboratorio (elettroliti, emogasanalisi, acido lattico, enzimi
31
sierici, assetto emocoagulativo). CID: presenza di trombocitopenia, allungamento PTT e riduzione
PT, fibrinogeno basso, antitrombina III bassa, D-dimeri elevati.
APACHE 2: È composto da: A (4 punti max per ciascuna delle variabili: FC, temperatura, FR,
pressione, PaO2, pH, ematocrito, Na, K, creatinina, leucociti; e 15-GCS), B (età, max 6 punti se>75),
C (5 punti per insufficienza d’organo cronica). A+B+C: 0-71. >25= rischio di mortalità del 50%.
Approccio terapeutico in emergenza: applicare già in fase preospedaliera il BLS nella sequenza
ABC (poi D ed E). Pertanto:
A) Vie aeree: Intubare il paziente con distress respiratorio e alterazione marcata dello stato di
coscienza (anche tutte le altre indicazioni di intubazione). Qualora serva un anestetico è meglio
utilizzare ketamina (scarso effetto sulla gittata cardiaca).
B) Ventilazione: somministrare sempre ossigeno. Maschera di venturi o ventilatori meccanici,
per mantenere l’obiettivo di un saturazione >92%. Utilizzare ossigeno al 100%.
C) Circolazione: importante garantire l’alta saturazione oltre che una concentrazione di
emoglobina almeno di 10g/dl ed ematocrio non inferiore al 30%.
1) Azione sul precarico: ripristino volemia (infusioni di boli di cristalloidi). Ogni bolo di 250-500
ml deve essere calibrato sualla risposta clinica al bolo precedente. Da arrestare in presenza di segni
di riempimento cardiaco (tipo rantoli polmonari).
2) Azione sull’inotropismo: dipende dai valori pressori sistolici:
• Sotto i 60 mmHg: Noradrenalina. Se non c’è risposta: Noradrenalina + Dopamina.
• Sotto i 70 mmHg: Dopamina. Se non c’è risposta: Noradrenalina + Dopamina.
• Tra 90 e 100mmHg: Dobutamina + Dopamina.
• Sopra i 100mmHg: Dobutamina.
3) Azione sul post-carico: bisogna puntare ad una riduzione delle resistenze periferiche. Si può
associare alla dobutamina (inotropo che riduce le resistenze vascolari) un inibitore della
fosfodiesterasi. Nelle condizioni con pressione bassa si associano dobutamina e noradrenalina.
Correzione dell’acidosi metabolica: Se il pH scende sotto i 7,2 si dà bicarbonato. Da evitare
nell’insufficienza respiratoria (aumenta la CO2). Un eccesso può causare alcalosi metabolica, da
evitare perché riduce la cessione di ossigeno nei tessuti.
Terapia dello shock settico: sempre ossigeno ed eventuale intubazione.
1. Supporto antibiotico: deve essere il più precoce possibile. Si usano Ceftazidime +
Imipenem-Ciclastatina+ Tecioplanina. È un’associazione che copre Gram positivi e
negativi, oltre a pseudomonas e stafilococco MRSA. Anche Meropenem + Teicoplanina o
Piperacillina/Tazobactam. Terapia empirica ipotizzando la causa dello schock.
2. Supporto emodinamico: Ripristino della volemia: deve essere tempestivo, per ristabilire
l’apporto di ossigeno. Si inizia con alemeno 1 litro di cristalloidi o 500ml di colloidi in 30
minuti. Possono essere necessari boli ripetuti. Gli obiettivi della fluido terapia sono:
FC<100, pressione sistolica >90, diuresi>0,5ml/kg/h. (1l al giorno circa).
3. Supporto emodinamico: Inotropi positivi: si usano se l’ipotensione arteriosa si dimostra
persistente nonostante i cristalloidi. Inizialmente si usa Dopamina. Se non basta si associa
Dopamina + Noradrenalina. Raggiunti valori accettabili si inizia la terapia con
Dobutamina (o Milrinone). In alternativa Vasopressina. Se tutte queste misure non
bastano, in extrema ratio: Glucagone (bolo poi infusione continua).
4. Altro: Proteina C attivata: solo in pazienti con shock grave (APACHE >25), serve a inibitre
trombosi e infiammazione. Steroidi: Idrocortisone nei pazienti che richiedono terapia
vasopressoria oltre ai liquidi. Eritrociti: emazie concentrate se Hb<7. Glicemia: da
mantenere <150, altrimenti Insulina.
Terapia dello shock ipovolemico emorragico: sempre ossigeno ed eventuale intubazione.
Serve controllo dell’emorragia (compressione manuale, poi altro). Adrenalina se la pressione è
<60. Utilizzo di cristalloidi o colloidi. Emazie concentrate se persistono segni di ipoperfusione
(emoglobina almeno a 10 ed ematocrito almeno 30%). Se il PT>1,5 volte il normale: plasma fresco.
Piastrine nel paziente traumatizzato con sanguinamento attivo e conta piastrinica bassa.
Dopamina se serve nonostante il ripristino volemico. Vitamina K ( se c’è coagulopatia).
32
Terapia dello shock cardiogeno: Se c’è concomitante insufficienza destra può trarre beneficio da
un aumento, con cautela, della volemia con cristalloidi (solo se non c’è edema polmonare!). Solita
terapia per ipotensione e inotropi positivi. Se non risponde: glucagone o Levosimendan. Gli
interventi di trombo lisi o PTCA o bypass, in caso di shock cardiogeno da IMA, se precoci possono
ridurre l’elevata mortalità di questa sindrome. Contropulsatore aortico (attesa trapianto).
Terapia dello shock anafilattico: Adrenalina. Cristalloidi. Metilprednisolone. Antistaminici
(Difenidramina anti-H1 e Ranitidina anti-H2 per ridurre l’effetto cardiotossico e miocardio
depressivo dell’istamina). Beta2 agonisti: Salbutamolo in caso di broncospasmo. Se l’ipotensione
persiste: colloidi, dopamina. Glucagone eventualmente in pazienti che assumono salbutamolo.
Terapia dello shock neurogeno: Cristallodi. Noradrenalina. Atropina per la bradicardia.
Eventuale utilizzo di Metilprednisolone (controverso) per azione antiinfiammatoria e anti-edema.
Fluidoterapia
Consiste nella somministrazione di liquidi allo scopo di ripristinare e mantenere la portata
cardiaca. Le sostanze utilizzate devono essere considerate dei veri e propri farmaci. Questi liquidi
posseggono infatti una propria farmacocinetica e dinamica, dosaggi indicati, contro indizioni ed
effetti collaterali. Tra le sostanze utilizzate distinguiamo:
• Cristalloidi: vasta famiglia di ioni inorganici e piccole particelle organiche. Il loro volume
di distribuzione comprende l’intero volume extracellulare (interstiziale + intravascolare).
3-3,5L di cristalloidi rimpiazzono 1 l di sangue perso. L’utilizzo di elevati volumi può
causare acidosi ipercloremica (Ringer Lattato) o edema. Contengono concentrazioni di
sodio simili alla fisiologica. Di solito si usano infatti fisiologica 0,9% o Ringer lattato. Sono
facilmente reperibili, a basso costo e non danno reazioni allergiche. Sono la prima scelta in
caso di shock ipovolemico emorragico in quanto in seguito a trauma si ha una perdita di
liquido sia intravascolare che interstiziale ed i cristalloidi li rimpiazzano entrambi.
• Colloidi: si distribuiscono restando più a lungo a livello intravascolare. Sono costituite da
sostanze ad alto peso molecolare che esercitano un’importante pressione oncotica, con
richiamo di liquidi nel compartimento endovascolare. Il volume da infondere è pertanto
uguale a quello perso. Si usano soprattutto gelatine, destrani, albumina. Hanno un costo
più elevato e possono generare reazioni anafilattiche. Si preferiscono in caso di perdite
ematiche maggiori. Le soluzioni ipertoniche determinano accumulo di sodio.
Di solito nello shock emorragico di classe I si usano cristalloidi. Classe II cristalloidi e colloidi.
Classe III e IV si ricorre anche alle trasfusioni.
33
320Prof. Cittadini_4/03_1° ora NB.: il prof ha praticamente letto le slides che ho quindi integrato con le poche cose che ha aggiunto. IL DOLORE TORACICO Epidemiologia • Angina pectoris e/o IMA nel 14% della popolazione adulta • Dolore toracico atipico nel 24% • E’ alla base di circa ¼ delle chiamate alla centrale operativa dei servizi di emergenza • Tra questi, nel 40% si conferma diagnosi di ischemia miocardica • E’ causa del 20% di tutti i ricoveri non chirurgici Fisopatologia Le diverse strutture presenti all’interno del torace presentano diversa sensibilità algogena. ‐ Trachea: recettività algogena scarsa. ‐ Esofago (e quindi le patolgie ad esso correlate come ad esempio le esofagiti): recettività algogena intermedia ‐ Parenchima polmonare: recettività algogena assente. ‐ Parete toracica: nel suo contesto dobbiamo distinguere o Dolore miogeno o Dolore osteogeno o Dolore artrogeno La parete toracica ha una recettività algogena importante e quindi dolori toracici atipici a partenza dalla parete toracica possono presentarsi con notevole intensità pur essendo perlopiù a buona prognosi. ‐ Pleura parietale: recettività algogena elevata. ‐ Pericardio: recettività algogena scarsa. Principali cause di dolore toracico. • Malattie cardiache: • Patologie aortiche: prognosi grave (ad e. una dissezione aortica) • Malattie polmonari (polmonite, embolia polmonare, etc.) • Malattie muscoloscheletriche • Malattie neurologiche • Malattia da reflusso gastro‐esofageo: ricordate che può presentarsi spesso in maniera simile al dolore cardiaco pur avendo modalità di insorgenza diversi e pur essendo scatenati da cause diverse, le modalità e la qualità dei dolori possono essere simili. • Dolore toracico di origine psichiatrica • Malattie extra‐toraciche Malattie cardiache • Origine ischemica ‐ Angina pectoris: dura di norma pochi minuti; un dolore di durata maggiore, prolungato, se di origine cardiaca di solito è riferibile o ad un infarto o ad una angina instabile. ‐ Infarto acuto del miocardio • Origine non ischemica ‐ Pericardite: talvolta la qualità del dolore e il quadro ECG di una 34
Malattie aortiche Malattie pleuro‐polmonari Malattie muscolo scheletriche Patologie neurologiche Disturbi gastrointestinali pericardite possono simulare un infarto • Dissezione • Rottura Sono patologie gravi che richiedono di solito un trattamento chirurgico tempestivo. • Embolia polmonare: di solito sono le embolie massive a dare dolore, mentre episodi piccoli e ripetuti di embolia possono non dare dolore ma dare problemi emodinamici a lungo termine (disfunzione del ventricolo destro). • Infarto polmonare • Pleurite • Pneumotorace • Tumore • Polmonite • Artrite • Costo‐condrite • Spasmi muscolari • Patologie del disco intervertebrale: ad esempio un’ernia discale cervicale può dare dolore toracico. • Neurite intercostale • Herpes zoster: dolori violenti che seguono uno specifico metamero. Se non c’è ancora la lesione cutanea tipica (che spesso compare solo dopo il dolore toracico) la diagnosi differenziale può essere difficile. • Reflusso gastro‐esofageo: è importante l’anamnesi, cioè valutare il rapporto del dolore con i pasti, se compare soprattutto in clinostatismo e ovviamente l’ECG per escludere un problema cardiologico quale possibile causa del dolore. • Disordini motori esofagei (spasmi): una cosa importante sugli spasmi esofagei è la difficoltà diagnostica; molto spesso, infatti, il cardiologo sostiene che se il dolore regredisce con i nitroderivati allora è di origine cardiaca, in realtà anche il dolore da spasmo esofageo regredisce con i nitroderivati. • Colica biliare, colecistite acuta: dolore in ipocondrio destro spesso riferio alla punta della scapola e/o alla spalla destra. • Ulcera peptica e gastrite • Pancreatite acuta In ogni caso in presenza di dolore toracico/epigastrico, in pronto soccorso bisogna sempre eseguire un ECG per escludere che il dolore sia dovuto ad una patologia cardiaca, indipendentemente dal sospetto diagnostico iniziale. Caratterizzazione del dolore toracico. • Modalità di insorgenza o acuta o cronica: se è insorto da molto tempo o se è presente da molto. Se un paziente riferisce un dolore continuo da giorni e al PS ci sarà ECG negativo enzimi negativi è improbabile che il dolore possa essere dovuto ad una ischemia miocardica. Se invece lo stesso dolore viene riferito da un’ora il sospetto di ischemia miocardica è maggiore. 35
•
•
•
•
•
Fattori precipitanti o Esercizio fisico: un dolore di parete toracica difficilmente aumenta con l’esercizio fisico, mentre un dolore da angina stabile tipicamente peggiora o compare con lo sforzo fisico. o Posizione: i cambi di posizione di solito non influenzano i dolori da ischemia miocardica mentre influenzano i dolori da pleurite e da costo condrite. o Respirazione: generalmente non influenza il dolore da ischemia miocardica ma peggiora il dolore da pleurite o il dolore di parete toracica. o Digiuno: il pasto influenza molto il dolore da cause gastroesofagee ma non influenza il dolore da ischemia miocardica. Carattere o Viscerale: il dolore viscerale è tipicamente un dolore profondo, poco localizzato che si accompagna spesso a fenomeni neurovegetativi (ad es.: nausea, vomito, pallore, tachicardia, etc..). o Pleurico: è un dolore superficiale e ben localizzato. o Superficiale o Intensità: in caso di infarto, pancreatite, dissezione aortica l’intensità è particolarmente grave. Il dolore da pancreatite è estremamente violento che compare in epigastro e che poi si estende agli ipocondri (“a sbarra”) e posteriormente (“a cintura”) che raggiunge la massima intensità entro mezz’ora e che poi rimane stabile nel tempo. Il dolore da dissezione aortica è particolarmente violento e da una sensazione al paziente di “morte imminente”. Irradiazione: il dolore cardiaco si irradia verso la mascella, la mandibola, al giugulo, braccio e avambraccio, di solito a sinistra, e talvolta verso l’epigastrio. Il dolore da herpes zoster e quello da patologia discale hanno un’irradiazione a fascio. Durata. Sintomi associati: dispnea, nausea, vomito… Angina pectoris: Sicuramente nell’ambito del dolore toracico l’angina pectoris la fa da padrone. 1) Angina stabile Eziopatogenesi: La domanda miocardica di O2 cresce oltre l’offerta assicurata dal flusso ematico, solitamente ridotto per la stenosi aterosclerotica del lume coronarico (angina stabile). Dolore retrosternale percepito come sensazione di tensione, pesantezza, compressione o bruciore a carattere non focale. Presentazione tipica: ‐ Può essere irradiato alla spalla o al braccio sinistro, oppure al collo e alla mandibola ‐ Tipicamente esacerbato dallo sforzo fisico o dallo stress emozionale ‐ Solitamente comincia gradualmente e dura 2‐10 minuti ‐ Si interrompe precocemente con il riposo o con la somministrazione di “nitroglicerina sublinguale”; ricordate che anche lo spasmo esofageo può regredire con la nitroglicerina. 2) Angina instabile ‐ Solitamente è il risultato di una fissurazione di una placca aterosclerotica con sovrapposizione di un trombo piastrinico, motivo per cui in questo caso il dolore può comparire anche a riposo (quindi indipendentemente da un aumento delle richieste di O2) in quanto è notevolmente ridotto se non del tutto impedito il flusso ematico a valle del trombo. ‐ L’inizio dei sintomi è imprevedibile 36
3) Angina di Prinzmetal È dovuta ad uno spasmo transitorio delle arterie coronarie. Spesso sono compresenti stenosi coronariche fisse. ‐ Forma più frequente tra i giovani ‐ Simile all’angina stabile per sede e carattere del dolore ‐ Caratteristicamente a riposo ‐ Risposta alla terapia con nitroglicerina ‐ Spesso i soggetti presentano altri sintomi correlati al vaso‐spasmo (emicrania migrante, fenomeno di Raynaud…). 4) Infarto del miocardio • Il dolore toracico molto è forte e prolungato nel tempo (> 30 min) • Non attenuato dalla somministrazione di nitroglicerina sublinguale • Solitamente scatenato da un considerevole esercizio fisico o da uno stress • Può irradiarsi ad entrambe le braccia, fino alla mandibola e talvolta all’epigastrio • Solitamente accompagnato da nausea e sudorazione profusa (come i dolori viscerali tipici). I sintomi neurovegetativi sono più accentuati negli infarti inferiori. • Può non essere presente ad esempio nel soggetto anziano o diabetico per la presenza di una disfunzione autonomica. In questi casi l’infarto pregresso viene diagnosticato a posteriori in corso di indagini diagnostiche. ‐Sintomatologia di scarso rilievo in circa il 20% dei soggetti, in questi casi si parla di infarto silente. Pericardite: dolore solitamente ad insorgenza acuta, coinvolge l’area toracica retrosternale, irradiandosi al collo e alla spalla sinistra. Può manifestarsi come isolato senso di compressione toracica retro sternale. È difficilmente distinguibile da quello dovuto a IMA. Spesso esacerbato dagli atti del respiro e dalla posizione sdraiata. Il dolore si allevia flettendo il corpo sulle gambe e stando seduti. Il cambiamento del dolore con il decubito e con gli atti del respiro permette di distinguerlo da un dolore da ischemia miocardica; inoltre nel caso di un dolore da ischemia miocardica noi abbiamo una importante elevazione degli indici di miocardio necrosi, indiche che sono normali o solo moderatamente elevati nella pericardite. Dissezione aortica: Dolore assolutamente improvviso, intenso e prolungato nel tempo. Può irradiarsi alla schiena. I pazienti riferiscono di non aver mai provato nulla di simile in tutta la loro vita (“sensazione di morte imminente”). Solitamente correlata con una storia di ipertensione arteriosa. Può associarsi alla sindrome di Marfan. Voglio ricordarvi che nella malattia di Marfan, in cui è alterato il collagene, la frequenza di dissezione aortica è molto alta e questo si traduce in una diversa indicazione alla terapia chirurgica; infatti, mentre in un paziente normale, l’indicazione all’intervento chirurgico si pone per una dilatazione dell’aorta superiore ai 5 mm, in un paziente con sindrome di Marfan, data la più alta incidenza di dissezione, si pone indicazione all’intervento già per un diametro aortico di 45 mm. Ricordate sempre che l’anamnesi e l’epidemiologia sono fondamentali per il sospetto diagnostico: uno stesso tipo di dolore se compare in un soggetto giovane e senza comorbidità associate mi fa orientare verso una serie di patologie che richiederanno indagini specifiche, mentre se compare in un soggetto in età avanzata e con una storia di comorbidità e fattori di rischio mi farà orientare verso altre patologie. Reflusso gastroesofageo: causa comune di dolore viscerale in regione epigastrica e retrosternale. Diffusa sensazione di bruciore: Pirosi. Talvolta il dolore è associato a spasmo esofageo con caratteristiche del dolore simile all’angina pectorisil dolore può talvolta alleviarsi dopo l’ assunzione di nitroderivati o può 37
essere acuito dall’ingestione abbondante di alimenti, dal clinostatismo, dal torchio addominale. Può associarsi a disfagia, sono talora presenti dispnea e tosse notturna stizzosa (spesso gli otorini riscontrano all’esame laringoscopico la presenza di lesioni laringee in pazienti con reflusso gastroesofageo; è probabile che siano proprio queste lesioni a causare la tosse notturna). Ulcera peptica: Sede in epigastrio, ma occasionalmente può essere trasmesso come dolore retrosternale. Solitamente regredisce ingerendo cibo o antiacidi. Può sopraggiungere anche di notte. Pancreatite acuta: Solitamente localizzato all’epi‐mesogastrio, ma può irradiarsi alla spalla e alla schiena, come pure al fianco e in fossa iliaca. E’ severo e spesso costante, può aggravarsi in posizione supina. Tende ad attenuarsi inclinando il tronco in avanti. Frequenti nausea e vomito associati al dolore. Importanti gli esami di laboratorio per la ricerca di amilasi e lipasi. Colica biliare: è raro che il dolore sia toracico solitamente è di tipo acuto, molto intenso o oppressivo con sede in epigastrio o in ipocondrio destro. Molto frequente l’irradiazione alla scapola. Può durare da una a diverse ore prima di attenuarsi ed è spesso seguito da una sensazione di fastidio nell’area sottocostale destra; è accompagnato da nausea e vomito. Costo‐condrite: è estremamente comune, saraà capitato sicuramente anche a voi di avere, durante una giornata più fredda un dolore anteriore acuto della durata di pochi secondi o minuti. Quindi è un dolore anteriore, acuto e di breve durata, o smorzato e duraturo (da alcune ore ad alcuni giorni). Di solito acuito dai movimenti toracici e dalle profonde inspirazioni. Talvolta è possibile riscontrare un trauma minore o attività fisica inusuale all’anamnesi quali possibili cause del dolore. Dolore cervicale: conseguente alla compressione di radici nervose, localizzato al collo e alla parte posteriore della testa, irradiato alla spalla e al braccio. Occasionalmente confuso con l’angina pectoris. Quando presente, il dolore alle braccia è continuo e spesso accompagnato ad alterazioni sensoriali, come ad esempio formicolii e parestesie. Il dolore cervicale di solito compare più spesso la notte. Il dolore è sollecitato dai movimenti del collo. Una conseguenza della radicolite può essere anche l’ipostenia dell’arto superiore. Herpes Zooster: inizia con un forte dolore nella fase prodromica localizzato ad un dermatomero, successivamente (di solito dopo 1‐3 giorni) compaiono le manifestazioni cutanee sempre distribuite lungo un dermatomero. Può esitare una nevralgia post‐erpetica soprattutto negli anziani (il dolore non recede, talvolta anche per più di un anno, dalla scomparsa dell’eruzione cutanea). Dolore pleurico: spesso unilaterale, esacerbato dai movimenti del torace. Solitamente ad insorgenza brusca; può essere secondario ad affezioni di origine polmonare. Il dolore può essere attenuato in presenza di versamento. Dolore polmonare: diverse cause: • Pneumotorace: Violento dolore toracico accompagnato a dispnea • Polmonite: sensazione di peso toracico associato a febbre e tosse produttiva. Di solito il dolore in corso di polmonite è dovuto ad un concomitante interessamento pleurico. • Embolia polmonare: dolore toracico simil‐IMA se massiva; di accompagna a dispnea (soprattutto se è massiva) per interruzione del circolo di importanti rami polmonari. • Infarto polmonare: dolore pleurico con eventuale riscontro di emottisi (ATTENZIONE: l’emottisi può suggerire la presenza di una neoplasia occulta. 38
Dolore toracico ansia correlato: è molto frequente, soprattutto tra i giovani e soprattutto tra le donne. È possibile che vi sia un’alterazione della sensibilità toracico; può assumere forme diverse: ‐ Focale e a sede precordiale ‐ Temporaneo e di tipo trafittivo ‐ Generalmente non correlato con lo sforzo Possono essere presenti palpitazioni e iperventilazione. Variabile risposta agli agenti analgesici. Con questi pazienti è molto importante il colloquio: può infatti capitare che durante il colloquio il paziente, distratto, per vari secondi non lamenta più il dolore. Ricapitolazione Come intervenire? Scala diagnostica: casaMMG118AmbulanzaPS (pronto soccorso/ospedale e diagnosi completa) Corsia rapida: casaPS Generalmente l’episodio di dolore toracico comincia al domicilio del paziente e dovrebbe intervenire innanzitutto il MMG (cosa che raramente accade). La tappa successiva dovrebbe essere la chiamata al 118, l’arrivo dell’ambulanza e l’accesso al PS. Il ruolo del MMG è quindi quello di filtro tra il paziente ed il PS ma, soprattutto nelle nostre zone, questa funzione di filtro manca e questa è una delle cause del sovraffollamento dei dipartimento di emergenza. Il ruolo del MMG è quello di capire se il dolore toracico richiede o meno necessità di accesso al PS, perché ad esempio, se le caratteristiche del dolore e l’anamnesi suggeriscono fortemente un dolore da reflusso gastro‐esofageo, ed il MMG esegue anche un ECG che risulta negativo, allora basta tranquillizzare il paziente e prescrivergli al massimo una EGDS che potrebbe essere fatta a distanza di 7‐10 giorni, non necessariamente d’urgenza. Gestione iniziale: E’ importante distinguere in breve tempo: i pazienti ad alto rischio percorso rapido (ricovero in urgenza) i pazienti nei quali il sospetto di una patologia minacciosa per la vita è scarso o assente osservazione ed indagini diagnostiche in elezione Ovviamente la responsabilità di distinguere i pazienti ad alto rischio quelli a basso rischio spetta al MMG o alla guardia medica di zona. La stratificazione dei pazienti in queste due classi di rischio (alto e non alto) e fondamentale perché influenzerà tutto l’iter diagnostico‐terapeutico successivo. 39
Approccio •
•
•
•
•
Anamnesi Esame Obiettivo Esami ematochimici o Routine o Enzimi cardiaci (MB‐CK, TnI), Amilasi, D‐dimero, BNP… Gli enzimi caridiaci sono utili per la diagnosi di infarto, D‐dimero per l’embolia polmonare, l’amilasi per la pancreatite acuta, il BNP è utile soprattutto nel paziente gravemente dispnoico per capire se la dispnea è di origine cardiaca (BNP alto) o polmonare (BNP basso). Ad esempio il paziente con grave dispnea da riacutizzazione di BPCO il BNP sarà basso mentre in un paziente con dispnea da infarto del miocardio troveremo il BNP alto. o Emogasanalisi Esami strumentali di primo livello o ECG o Rx torace Esami strumentali di secondo livello o Ecocardiografia transtoracica/transesofagea o Scintigrafia miocardica/Scintigrafia ventilazione‐perfusione se sospetto embolia polmonare. o TC torace con m.d.c.: se sospetto un aneurisma dell’aortao una dissezione aortica. 1) Anamnesi: • Patologie pregresse • Fattori di rischio cardiovascolari • Familiarità per patologie cardiovascolari • Farmaci assunti • Caratterizzazione del dolore 2) Esame obiettivo: • Espandibilità degli emitoraci • Valutazione MV e FVT • Percussione toracica • Palpazione addominale 3) ECG • Permette di identificare i pazienti con ischemia miocardica: o Il sopraslivellamento del tratto ST è il marker ECG più sensibile e specifico IMA o Il sottoslivellamento del tratto ST o L’inversione simmetrica dell’onda T è un segno aspecifico o Comparsa di una nuova onda Q all’ECG • Fornisce indicazioni su patologie extra‐infartuali o Embolia polmonare o Pericardite • Permette di decidere se il paziente deve essere gestito con un percorso rapido • La prognosi sia a breve che a lungo termine è chiaramente correlata all’ECG all’ingresso in ospedale 4) Esami ematochimici • Enzimi cardiaci (non mi soffermo perché li vedremo nella lezione successiva sulle SCA) o Confermano il dato ECG di ischemia 40
o Troponine T e I, mioglobina, creatinchinasi (CK)‐MB, sono i più adoperati o da 3 a 6 ore dall’inizio dei sintomi, la mioglobina è il marker migliore • D‐dimero (utile come marker di embolia polmonare) o indica un processo fibrinolitico in atto o utile come marker predittivo negativo di embolia: se è negativo permette di escludere una embolia polmonare. Se positivo aumenta solo la probabilità che si tratti di embolia polmonare ma non è sufficiente a fare diagnosi. • BNP o indica una dilatazione delle camere cardiache o utile come marker di insufficienza cardiaca acuta 5) Tecniche di imaging • Rx torace molto utile, ad esempio, per la diagnosi di pneumotorace, versamento pleurico… • Imaging scintigrafico o nucleare viene usato per studiare, con calma, il paziente con ischemia miocardica. • Ecocardiografia bidimensionale e/o trans esofageo: per vedere se c’è una dilatazione ventricolare, un problema valvolare, permette di vedere, in caso di dissezione (soprattutto dell’aorta ascendente) il tipico segno del flap intimale con doppio lume, segno confermato poi alla TC del torace con m.d.c. • TC torace con m.d.c. • Ecografia addominale Vediamo infine l’algoritmo diagnostico del dolore toracico. 41
In caso di dolore toracico ischemico Dolore toracico non ischemico: caratteristiche associate. Emanuele Gallinoro 42
Cardiopatia ischemica
Fisiopatologia coronarica: i vasi coronarici possono essere suddivisi in vasi di conduttanza ossia
le grosse arterie epicardiche ed i loro rami e in vasi di resistenza ossia le per arteriole e i piccoli
rami intramiocardici che sono il principale determinante delle resistenze coronariche.
La circolazione coronarica è influenzata e controllata dalle richieste di ossigeno da parte del cuore.
Queste richieste aumentano con la frequenza cardiaca, la contrattilità e lo stress di parete. Il livello
di estrazione di ossigeno del miocardio è del 70%, molto elevato. Pertanto se vi è un’aumentata
richiesta metabolica, l’unico meccanismo che permette un adeguato apporto di ossigeno è la
vasodilatazione del vasi di resistenza con conseguente diminuzione della resistenza al flusso.
La riserva coronarica è la massima capacità di vasodilatazione e conseguente flusso in risposta ad
uno stimolo. Il fabbisogno miocardico di ossigeno regola pertanto la vasodilatazione dei vasi
intramiocardici (che normalmente hanno grande capacità di dilatarsi) che costituiscono pertanto
un particolare microcircolo dotato di capacità di regolazione metabolica e di autoregolazione
dipendente più dal fabbisogno cardiaco che dal controllo sistemico.
L’aumento della richiesta miocardica pare si esplichi in un aumento dell’idrolisi di ATP con
conseguente rilascio nell’interstizio di adenosina, la quale vaso dilata i rami intramiocardici con
incremento del flusso in proporzione alla richiesta. Il flusso coronarico è generalmente fasico, in
quanto è possibile solo durante la diastole (nelle tachiaritmie pertanto può ridursi a causa della
diminuzione del tempo di diastole) perché in sistole i vasi intramiocardici sono occlusi dalla
contrazione. Gli strati sub endocardici sono quelli maggiormente esposti all’ischemia.
L’ischemia è una riduzione del flusso che si associa naturalmente a danno cellulare (di vario
grado). La principale causa di ischemia è l’aterosclerosi coronarica in quanto la placca ateromatosa
ostruisce il flusso con diminuzione del calibro delle arterie. L’ischemia miocardica può verificarsi
anche, molto più raramente, da spasmo, da trombi o emboli, da anomalie congenite come l’origine
del ramo discendente anteriore della coronaria sinistra dall’arteria polmonare (ischemia e infarto
in età infantile), grave ipotrofia ventricolare da stenosi aortica (ma anche ipetrofia ventricolare con
associata maggiore richiesta), e inoltre la soglia ischemica può essere ad esempio ridotta da una
riduzione della capacità di trasporto di ossigeno.
Aterosclerosi coronarica: l’aterosclerosi è la prima causa di ischemia e ha sede principalmente
nelle arterie coronarie epicardiche (il circolo coronarico è in generale una delle sedi preferite
dall’aterosclerosi). I fattori come l’aumento delle LDL e la diminuzione delle HDL, il fumo,
l’ipertensione e il diabete provocano (insieme a fattori di minore importanza, all’omicisteinemia,
all’età, all’obesità, al sesso) la cosiddetta disfunzione endoteliale (che non è per forza una lesione)
che favorisce l’inizio della formazione delle placche ateroma tose.
Le placche tendono a concentrarsi nei punti in cui il flusso passa da laminare a turbolento come le
diramazioni delle arterie epicardiche.
La prima lesione è la stria lipidica che comincia ad osservarsi già intorno ai vent’anni in molti
soggetti. È un’area giallastra con monociti ed esteri del colesterolo. Questa può evolvere in una
vera e propria placca ateromatosa costituita da lipidi, macrofagi, cellule muscolari lisce , fibroblasti
e piastrine,la quale è frutto di un processo infiammatorio cronico mediato, oltre che da vari
mediatori di infiammazione, da LDL ossidate e macrofagi (cellule schiumose).
La placca tende ad ingrandirsi con ulteriore deposito di materiale grasso e fibroso e può condurre
ad una progressiva stenosi del vaso.
Quando la stenosi riduce il diametro dell’arteria epicardica del 50% non basta un pieno incremento
del flusso per rispondere agli aumenti delle esigenze metaboliche (ad esempio sotto sforzo), se
l’ostruzione è del 75-80% il flusso può essere ridotto anche a riposo.
All’inizio i vasi a valle provano a dilatarsi per compensare questo flusso ridotto, ma con il tempo si
giunge ad ischemia miocardica soprattutto quando un aumento delle richieste del miocardio non
riesce ad essere compensato da una vasodilatazione già a riposo molto elevata. Questo spiega
perché spesso risultano asintomatici anche pazienti con alto grado di stenosi delle coronarie. La
gravità e l’insorgenza dell’ischemia dipende anche dal punto in cui si verifica l’ostruzione (più
grave se prossimale, tipo nel tronco comune della coronaria di sinistra) e dalla possibilità (in
genere presente, soprattutto se l’ostruzione è graduale) di sviluppo di circoli collaterali.
Le placche ateromatose possono andare incontro a varie lesioni come: calcificazione (arterie
rigide), rottura e ulcerazione (si liberano sostanze trombo geniche con possibile sviluppo di trombi
a valle).
43
Generalità sulla cardiopatia ischemica: la cardiopatia ischemica è una condizione di insufficiente
apporto di ossigeno al miocardio. La cardiopatia ischemica può essere sintomatica o meno (e
magari essere rilevabile solo con coronarografia o ECG sotto sforzo) e persino l’IM pare restare
non diagnosticato nel 25% dei pazienti. La fase sintomatica è invece caratterizzata da dolore
toracico dovuto ad angina pectoris o infarto acuto del miocardio.
Le conseguenze dell’aterosclerosi coronaria e dell’ischemia possono essere:
1) Aritmie fatali: l’ischemia causa instabilità elettrica con eccitazione di focolai ectopici che
causano extrasistoli, tachicardie e fibrillazioni ventricolari con conseguente morte improvvisa.
2) Cardiomiopatia ischemica: condizione dovuta a ripetuti danni miocardici che si presenta con
cardiomegalia e scompenso cardiaco (ventricolo sinistro danneggiato) che non hanno determinato
alcun sintomo prima dell’insorgenza di insufficienza cardiaca.
3) Formazione di trombi: Nell’angina stabile l’endotelio che ricopre la placca è liscio, nell’angina
instabile la superficie tende a ulcerarsi con fenomeni di aggregazione piastrinica. A seguito di
rottura o ulcerazione delle placche (che sono instabili a causa di fattori come il trombossano
prodotto dalle piastrine) possono formare un trombo che può depositarsi a valle e causare
condizioni cliniche differenti: 1) Se non occlude il vaso coronarico si manifesta un incremento della
gravità del quadro anginoso. 2) Se la progressione è rapida ma comunque non occlude il vaso si
ha infarto sub endocardico (non Q) 3) Se l’occlusione è completa si ha infarto trans murale (infarto
Q).
Indagini diagnostiche per cardiopatia ischemica:
ECG: la patologia ischemica, modificando l’attività elettrica dei miociti, comporta anche della
alterazioni elettrocardiografiche (prevalentemente riguardanti il ventricolo sinistro, più
frequentemente sede di episodi ischemici) quali:
1) Onda T invertita simmetrica: è un segno più evidente nelle derivazioni toraciche. Indica
un’ischemia subepicardica (trans murale). Nella sindrome di Wellens c’è un’onda T invertita in
V2 e V3 (stenosi della coronaria anteriore discendente).
2) Sopraslivellamento del tratto ST: indica la presenza di una lesione ischemica (nell’infarto
indica un episodio acuto). È presente nell’angina variante (transitorio). Può essere di varia entità.
Una pericardite o un aneurisma ventricolare possono provocare innalzamenti del tratto ST (nella
sindrome di Brugada è soprasilvellato in V1 e V3 e c’è BBD). Se non associato a onda Q può
indicare un infarto non Q.
3) Sottoslivellamento del tratto ST: segno di intossicazione da digitale, ma soprattutto di infarto
sub endocardico. L’ST appare sottoslivellato e appiattito. È un infarto non Q e non transmurale.
Può essere un’immagine indiretta di sopraslivellamento del tratto ST.
4) Onda Q: un’onda Q significativa (almeno 1mm di ampiezza o 1/3 dell’altezza del QRS) è indice
di necrosi e quindi di infarto. È un segno che in genere non scompare e permane per tutta la vita.
ECG da sforzo: test provocativo in grado di indurre ischemia in soggetti con ostruzione delle
coronarie. La manifestazione ischemica appare in genere come un sottoslivellamento del tratto
ST.
Scintigrafia con tallio 201: il tallio 201 è un isotopo che si fissa al miocardio in una concentrazione
dipendente dal flusso coronarico regionale ed evidenzia quindi alterazioni della perfusione
coronarica in presenza di stenosi emodinamicamente significative (soprattutto di IVA). Pertanto
permette di vedere dove sono ostruzionie e se l’ischemia è reversibile (alterazioni che scompaiono
dopo circa quattro ore) o meno.
ECG secondo Holter: registrazione continua per 24-48 ore. Con la collaborazione del paziente
permette di evidenziare disturbi del ritmo e anomalie di ripolarizzazione ventricolare tipiche delle
fasi ischemiche e di metterle in relazione con la sintomatologia e la frequenza cardiaca del paziente
durante la giornata. Si possono così vedere anche eventuali attacchi ischemici asintomatici ed
aritmie verificatesi nel contesto o meno di tali attacchi.
Arteriografia coronarica: o coronarografia, è l’indagine più specifica per le patologie coronariche.
È un esame invasivo tramite un catetere inserito per via venosa (più femorale) che giunge fino agli
osti coronarici dove poi viene iniettato un mezzo di contrasto per l’esame radiologico delle
coronarie che vengono ben evidenziate. In genere si esegue anche una ventricolo grafia per
valutare contrattilità e valvole ventricolari. Trova indicazioni per valutare una dubbia cardiopatia
ischemica o per quantificare l’ostruzione delle coronarie in paziente con malattia coronarica già
avanzata. In genere si esegue quando la terapia medica non controlla bene i sintomi o se l’angina è
instabile. È un esame non privo di rischi quali l’infarto miocardico (0,7%) e accidenti
cerebrovascolari (0,07%).
44
Classificazione generale della cardiopatia ischemica: i pazienti con cardiopatia ischemica si
dividono in due grandi gruppi:
1) quelli con malattia coronarica cronica che in genere si presentano con angina pectoris stabile;
2)quelli con sindromi coronariche acute (SCA) che possono essere pazienti con:
- infarto miocardico acuto (IMA) con sopraslivellamento del tratto ST all’ECG (STEMI)
- angina instabile o infarto miocardico acuto senza sopraslivellamento del tratto ST
(AI/NSTEMI).
Angina pectoris stabile
Definizione: sindrome clinica relativa ad un’ischemia miocardica transitoria. È una malattia
coronarica cronica.
Clinica: il tipico paziente è un uomo oltre 50 anni o una donna oltre 60 che lamenta disturbi al
torace in genere descritti come senso di pesantezza, pressione, oppressione, soffocamento e solo
più raramente come vero e proprio dolore (che comunque è un dolore toracico retro sternale
costrittivo). Il dolore può irradiarsi al collo, alla regione intrascapolare (se al trapezio è più
pericardite), alla mascella, ai denti, all’epigastrio e alle braccia (più sinistro). A volte il dolore può
non insorgere in sede retro sternale bensì solo nelle sedi secondarie.
Gli episodi sono tipicamente scatenati dallo sforzo fisico o dalle emozioni e cessano con il riposo,
ma è possibile anche che si verifichino durante il riposo specie in posizione supina (angina da
decubito o angina a riposo) e il paziente può persino essere svegliato di notte da dispnea e dolore
tipico. Dolori taglienti e immediati o prolungati e lievi sono angina solo molto raramente. Nausea e
vomito sono meno comuni che nell’infarto.
L’ECG può mostrare modificazione dell’ST, inversione dell’onda T e segni di ipertrofia
ventricolare che non sono specifici a meno che non siano concomitanti alla sintomatologia.
Terapia: si basa su
1) Misure generali e stile di vita: il paziente potrà condurre le normali attività lavorative ed
extralavorative (tranne lavori manuali pesanti), magari solo conducendo il tutto più lentamente.
2) Trattamento dei fattori di rischio: cardiomiopatia ipertrofica o valvulopatie ed inoltre patologie
quali obesità, ipertiroidismo ed ipertensione, diabete ed eliminare il fumo di sigaretta. È
importante una dieta che limiti l’apporto di grassi saturi e di sale, monitorare eventuale
dislipidemia che può richiedere terapia con inibitori della HMG-CoA reduttasi (statine).
3) Terapia farmacologica: ha lo scopo di ridurre gli eventi di angina e l’incremento improvviso di
frequenza cardiaca e pressione arteriosa che innalzano il lavoro cardiaco.
Nitroderivati: sono in uso da più di 125 anni, hanno azione benefica, immediata, nel ridurre gli
episodi di angina: vasodilatazione delle arterie coronariche (aumentando il flusso miocardico) e di
tutto il circolo sistemico. La loro azione si esplica sia sulle arterie (riducendo il post-carico, la
pressione arteriosa) che sulle vene (aumento della capacitanza venosa e quindi riduzione del precarico). Vengono assorbiti più rapidamente e completamente attraverso le mucose (pertanto,
soprattutto nell’immediato, si predilige l’assunzione sublinguale). Per un effetto a lungo termine
sono possibile anche l’assunzione trans dermica (unguento di nitroglicerina) o per os.
Gli effetti collaterali sono tachicardia e aumento della contrattilità in risposta alla diminuita
pressione arteriosa, ma anche tolleranza al farmaco, cefalea pulsante e ipotensione ortostatica. Il
più utilizzato è la nitroglicerina, ma anche l’isosorbide dinitrato.
Beta-bloccanti: provocano una riduzione della richiesta di ossigeno, effetto inotropo e cronotropo
negativo (inoltre soprattutto durante l’esercizio fisico più che a riposo). Sono molto utili in
associazione con i nitrati, in quanto prevengono l’aumento della frequenza e della contrattilità che
provocano questi ultimi. Come effetti collaterali provocano bradicardia, claudicatio intermittens,
peggioramento dell’asma bronchiale e dell’ipoglicemia (ad esempio se insieme ad antidiabetici). I
più utilizzati sono atenololo e metoprololo oltre a propanololo e nadololo.
Calcio antagonisti: vasodilatatori coronarici che determina riduzione della domanda di ossigeno,
di pressione arteriosa e di contrattilitàI più usati sono diltiazem e verapamil, ma anche nifedipina
e amlodipina. Il verapamil (soprattutto) e il diltiazem (negli scompensati) non sono da associare ai
beta-bloccanti per la loro azione inotropo-negativa che potrebbe peggiorare una disfunzione
ventricolare sinistra. L’angina di Prinzmetal risponde bene ai calcio-antagonisti (diidropiridinici).
Nell’approccio iniziale sono preferibili i beta-bloccanti perché rispetto ai calcio-antagonisti
determinano un miglioramento dell’aspettativa di vita. Se però i beta-bloccanti non funzionano, o
sono controindicati (asma o BPCO) o hanno comportato effetti collaterali, o il paziente è affetto da
angina di Prinzmetal, si preferiscono i calcio-antagonisti.
45
Angina instabile/infarto miocardico senza sopraslivellamento del tratto ST: AI/NSTEMI.
L’angina instabile una volta detta angina preinfartuale o insufficienza coronarica acuta è una
forma di angina che ha alta probabilità di evolvere in infarto miocardico acuto.
La diagnosi e anche la definizione di AI è basata sulla presentazione clinica, è infatti un’angina
pectoris che ha una di queste caratteristiche: 1) compare a riposo (o con minimo sforzo) e di solito
dura più di 10 minuti (l’angina stabile dura meno ed è più associata allo sforzo), 2) è intensa e di
recente insorgenza (pazienti con angina insorta nelle ultime 3-4 settimane) 3) si verifica seguendo
un pattern in crescendo (nel tempo la sintomatologia anginosa è divenuta più grave, prolungata o
frequente).
La diagnosi di NSTEMI viene posta se alla clinica di AI si aggiungono segni di necrosi
miocardica evidenziata dall’aumento degli enzimi di danno miocardico.
Patogenesi: è ovviamente causata da un disequilibrio tra apporto e richiesta di ossigeno che causa
ischemia miocardica. Il processo alla base di quest’ischemia può essere: rottura o erosione di placca
con trombi non occlusivi, che sono la causa più comune, ostruzione dinamica (tipo spasmo
coronarico angina di Prinzmetal), ostruzione meccanica progressiva ma comunque non completa
(cosa che spesso causa infarto sub endocardico, non Q) e AI secondaria a maggiore richiesta o altre
cause di minore apporto (anemia o tachicardia che causa riduzione dei tempi di diastole). A volte
queste cause si presentano insieme. Il 40% dei pazienti ha patologia monovasale (soprattutto IVA),
il 5% ha ostruzione del tronco comune, il 10% nessuna ostruzione critica (spesso questi hanno
Prinzmetal). La lesione responsabile visibile all’angiografia è più spesso un trombo bianco
(piastrine) rispetto all’IM. Spesso ci sono placche multiple e può essere utile valutarne il numero, la
percentuale e la localizzazione delle ostruzioni.
Clinica: sintomi e segni sono come quelli dell’angina stabile, in questo caso però il dolore toracico
è abbastanza intenso da essere riconosciuto come doloroso. Se il paziente ha un’ampia area
necrotica di NSTEMI si possono avere segni e sintomi tipici dell’infarto STEMI. ECG: si ha in
genere un sottoslivellamento del tratto ST o anche un’onda T invertita. (le onde T sono meno
specifiche se non sono abbastanza profonde cioè >0,3mV). Nuove alterazioni dell’ECG in pazienti
con sintomi di AI sono segni prognostici negativi.
Il paziente riferisce in genere dolore toracico, di durata in genere inferiore a 20-30 minuti, con
possible associazione di: ansia, nausea, vomito, sudorazione, palpitazioni, dispnea.
Esame obiettivo: spesso normale, ma si può rilevare: terzo e/o quarto tono; soffio sistolico
puntuale, congestione polmonare, distensione venosa giugulare, aumento della pressione.
Enzimi di danno miocardico: livelli elevati di enzimi come CK-MB e troponina comportano
rischio maggiore di morte o recidiva infartuale (cioè però vale solo per pazienti con chiara storia
clinica di ischemia, per cui c’è relazione diretta tra aumento troponina e mortalità).
Diagnosi: bisogna prima di tutto determinare la probabilità che i sintomi siano dovuti a sindrome
coronaria. Dolore ischemico, precedente infarto, segni chiari all’angiografia, nuove alterazioni
ischemiche all’ECG, scompenso cardiaco sono molto indicativi. In secondo luogo contano i fattori
di rischio per patologia coronarica. Gli strumenti diagnostici principali sono anamnesi, ECG,
enzimi e test da sforzo. Bisogna verficare se c’è infarto (ECG ed enziimi), valutare se c’è ischemia a
riposo o grave malattia coronarica (dopo test da sforzo). Incrementi di enzimi o nuove alterazioni
dell’ECG mentre il paziente è ricoverato sono segno di AI/NSTEMI.
Risultano pertanto utili: ECG seriati; Rx torace; Ecocardiogramma.
Indagini di laboratorio: Enzimi cardiaci, elettroliti, creatininemia, Azotemia, Glicemia, etc.
Prognosi: mortalità tra 1-10% in 30 giorni e rischio o recidiva d’infarto tra 3-10%. Fattori di rischio
per malattia coronarica, età superiore a 65 anni, sviluppo di sintomi nonostante terapia con acido
acetilsalicilico, slivellamento del tratto ST maggiore o uguale a 0,5mm peggiorano la prognosi.
Terapia: il paziente deve essere messo a riposo (ricoverato) con monitoraggio ECG continuo. La
terapia prevede l’uso di nitrati e beta-bloccanti oltre ad un trattamento con antitrombotici quali
acido acetilsalicilico o anche eparina non frazionata o enoxaparina (eparina a basso peso
molecolare). Il trattamento a lungo termine è in tutto e per tutto uguale a quello dei pazienti con
angina, anche per quanto riguarda le misure generali.
46
Angina variante di Prinzmetal
Definizione: è una forma di angina che compare prevalentemente a riposo associata ad un
transitorio sopraslivellamento del tratto ST. L’evidenza all’ECG è presente solo durante l’attacco e
dura in genere, a differenza dell’IM, 5-20 minuti, risultando invece un ECG normale nel resto della
giornata. Gli attacchi tendono a comparire nelle stesse ore e dissociati dallo sforzo.
La sindrome è dovuta ad uno spasmo focale di un’arteria epicardica (più la destra, ma spesso
varie) cui consegue un’ischemia miocardica. In alcuni pazienti lo spasmo arterioso è sistemico
(sincope, fenomeno di Raynaud, emicrania). La causa dello spasmo è forse un’ipercontrattilità
della muscolatura liscia vascolare dovuta al rilascio di fattori vasocostrittori, leucotrieni,
serotonina, etc. In genere lo spasmo si verifica entro 1 cm da una placca aterosclerotica (che quindi
comunque è presente anche in questi pazienti, che però in genere, a parte il fumo, hanno meno
fattori di rischio per patologia coronarica e sono più giovani). Lo spasmo coronarico transitorio
visto all’angiografia è l’elemento diagnostico fondamentale. A volte possono aversi episodi di
ischemia silente (asintomatica) o anche lievi aumenti di CK-MB e troponina.
Prognosi: dopo un periodo acuto di 3-6 mesi in cui c’è anche un maggiore rischio di infarto
miocardico non fatale (che in 5 anni è del 20%) la sopravvivenza a 5 anni è eccellente (90-95%). La
prognosi è peggiore in pazienti con gravi ostruzioni o che sviluppano importanti aritmie durante
gli episodi.
Terapia: nitrati e soprattutto calcio-antagonisti.
Ischemia asintomatica
Definizione: anche detta silente. I pazienti con IMA, ischemia transitoria e coronaropatia
ostruttiva sono spesso asintomatici anche se hanno segni evidenti all’ECG. Questi episodi
comportano comunque un rischio elevato di sviluppo di infarto miocardico (e talvolta morte) e in
base a test da sforzo, all’ECG e all’età deve essere scelta comunque una terapia adeguata.
Infarto miocardico con sopraslivellamento del tratto ST: STEMI
Definizione: L’infarto miocardico costituisce la necrosi tissutale del muscolo cardiaco che si
verifica in seguito ad un’ostruzione delle coronarie. STEMI è una diagnosi associata ad alta (30%)
mortalità precoce (ossia nei 30 giorni successivi) con metà dei decessi avvenuti prima dell’arrivo in
ospedale. La mortalità resta alta (1/25) nell’anno successivo all’episodio e dipende molto dall’età.
Una volta posta diagnosi di sindrome coronarica acuta (sintomatologia tipica) è principalmente
l’ECG che permette di distinguere il tipo di patologia.
La sindrome coronarica acuta può infatti essere senza sopraslivellamento del tratto ST o con
sopraslivellamento del tratto ST. Nel primo caso in un’alta percentuale dei casi non vi sono
proprio enzimi di danno e pertanto non vi è necrosi, perciò non è infarto bensì angina instabile. In
una percentuale comunque alta vi sono enzimi di danno, dunque vi è infarto, ma è un infarto non
Q (se il tratto di ST non è normale ma è sottoslivellato potrebbe essere un infarto sub
endocardico) ossia non vi sono le tipiche onde Q che indicano necrosi all’ECG (sono ben pochi i
casi di sindrome coronarica acuta con assenza di sopraslivellamento del tratto ST, ma presenza di
onde Q -questo è un quadro comune se l’infarto magari è pregresso-).
Nel caso di sopraslivellamento del tratto ST nella maggior parte dei casi l’infarto è con onde Q e
solo in una minoranza dei casi è un infarto non Q.
Patogenesi: è ben noto che la causa principale di IHD (cardiopatia ischemica) sia l’aterosclerosi
coronarica. Questa può causare ostruzione più o meno grave dei vasi coronarici (per lo più
epicardici) e può coinvolgere uno o più spesso diversi vasi. Mentre generalmente le stenosi fisse
causano patologie come l’angina e in genere tanto gravemente quanto grave è la lesione (75%
occlusione ischemia da sforzo, 90% ischemia anche a riposo), le sindromi coronariche acute
dipendono generalmente da impreviste e brusche trasformazioni della placca aterosclerotica quali
rottura o fissurazione, ulcerazione, erosione. In breve, generalmente:
1) Angina stabile: è causata da un’ostruzione fissa (senza rottura della placca) e da un’ischemia da
aumentata richiesta del miocardio (raro che ci sia necrosi perché si riesce in genere a formare una
rete di vasi collaterali, dato che l’ostruzione si ingrossa lentamente).
2)Angina instabile: si ha rottura della placca, ma il trombo è solo parzialmente occlusivo.
3) Infarto miocardico: a causa dell’alterazione della placca si forma un trombo che occlude
47
totalmente il vaso, e rapidamente, in modo che non si riesce a formare un circolo collaterale e si ha
pertanto necrosi.
In pratica la sequenza di eventi risulta questa:
Le placche aterosclerotiche hanno una composizione dinamica (per esempio il cappuccio fibroso
va incontro a rimodellamento) e in particolare risultano “vulnerabili” quelle con core lipidico ricco
di cellule schiumose, quelle con molte cellule infiammatorie o con cappucci fibrosi sottili.
Si ha pertanto un’improvvisa modificazione della placca ateromatosa (ulcerazione, emorragia
intramurale, erosione, rottura o fessurazione) con relativa esposizione delle componenti
altamente trombo gene (come il collagene subendoteliale) della placca che causano un’attivazione
piastrinica anche a seguito del rilascio di agonisti. Si ha rilascio di trombossano A2 e ulteriore
attivazione piastrinica e d esposizione del fattore tissutale con relativa attivazione della cascata
della coagulazione. Il risultato è la formazione di un trombo murale che occlude rapidamente il
vaso.
Altre cause come emboli, anomalie congenite, vasospasmo possono causare infarti, ma molto più
raramente.
L’ostruzione arteriosa causa ischemia nell’area irrorata dall’arteria occlusa, definita area a rischio.
Il miocardio perde la sua funzione contrattile, avvia un metabolismo anaerobico (di acido lattico,
potenzialmente dannoso), ma soltanto a seguito di un’ischemia severa (meno del 10% del flusso) e
duratura (20-30 minuti almeno) si ha necrosi dei cardiomiociti (ossia danno irreversibile) con
rottura della membrana e fuoriuscita di proteine miocardiche. Un danno permanente di notevole
entità si ha dopo un periodo di 2-6 ore dall’inizio dell’ischemia (dipende anche dal livello di
circolo collaterale) e pertanto risulta fondamentale una rapida diagnosi e intervento.
Anatomia patologica: la forma di infarto più frequente è quella completa, ossia l’infarto trans
murale che coinvolge appunto l’intero spessore della parete ventricolare.
Soprattutto se il trombo si è sciolto rapidamente per trombo lisi può verificarsi un esclusivamente
un infarto sub endocardico (terzo o metà interna della parete) ossia concentrato solo nella sezione
più sensibile all’ischemia (in quanto peggio irrorata).
Quasi tutti gli infarti sono localizzati nella parete del ventricolo sinistro e risparmiano solo una
sottile rima (0,1mm) di miocardio sub endocardico direttamente irrorata dal sangue contenuto nel
lume ventricolare. La sede dell’infarto dipende naturalmente dalla coronaria occlusa:
1) Coronaria discendente anteriore sinistra (40-50%): infarto “anteriore” che coinvolge la parete
anteriore del ventricolo sinistro, l’apice e la parte anteriore del setto interventricolare.
2) Coronaria destra: “infarto posteriore” (ma solo in caso di dominanza destra) che coinvolge la
parete inferiore/posteriore del ventricolo sinistro, la parte posteriore del setto interventricolare e,
nel 15-30% dei casi, parte del ventricolo destro.
3) Coronaria circonflessa sinistra: infarto “laterale” che coinvolge la parete laterale del ventricolo
sinistro, ma non l’apice.
Vi sono anche sedi meno consuete come il tronco comune della sinistra oppure rami secondari.
Le aree miocardiche danneggiate vanno incontro ad una serie di modificazioni che partono dalla
necrosi coagulativa e continuano on processi di infiammazione e riparazione (anche se l’aspetto
dipende naturalmente dalla sopravvivenza del paziente). Macroscopia: Nelle prime 12 ore gli
infarti non sono in genere affatto riconoscibili macroscopicamente. Successivamente è prima
visibile come un’area rossastra ( a causa del ristagno ematico), poi è apprezzabile un colorito giallo
a causa dell’infiltrato infiammatorio. Lo spessore della parete cardiaca appare ridotto perché il
tessuto necrotico è progressivamente rimosso. In seguito il centro giallognolo è circondato da una
zona iperemica di tessuto di granulazione (entro 2 settimane). Dopo circa un mese l’area diviene
grigiastra sino alla formazione di una cicatrice dura successivamente.
Microscopia: le cellule non mostrano segni prima delle 12 ore. Dopo un giorno si nota la necrosi
cellulare e la perdita delle fibre e successivamente infiltrato infiammatorio che tramite la
liberazione di enzimi da parte dei neutrofili e la fagocitosi dei cardiomiociti morti da parte dei
macrofagi eliminano il tessuto necrotico, che già dopo una settimana viene sostituito da
abbondante tessuto di granulazione. Si ha poi lentamente, nel corso del primo mese, la
sostituzione del tessuto di granulazione con tessuto fibroso e almeno entro sei mesi la formazione
finale della cicatrice. Una volta guarita una lesione non è più databile. Nell’infarto trans murale
queste modificazioni sono molto più evidenti e nette che nell’infarto sub endocardico.
Clinica: Il sintomo più caratteristico è il dolore. Il dolore è profondo e viscerale, in genere descritto
come pesante, opprimente o a morsa. Può essere retrosternale, ma anche epigastrico o
48
interscapolovertebrale e si può irradiare alle braccia (più il sinistro) a collo, mandibola, addome e
schiena, anche fino all’occipitale ma mai sotto l’ombelico. A differenza di quella della pericardite
acuta non si irradia al trapezio. Può assomigliare al dolore dell’angina pectoris, ma, anche se in in
curca il 30% dei casi è preceduto da un fattore precipitante (stress fisico o emotivo, patologia), in
genere si presenta a riposo e comunque non è alleviato dal riposo e dura più di venti minuti.
Viene indicato spesso dal paziente con la mano aperta o pugno chiuso sul petto (segno di Levine).
È di intensità elevata, spesso in crescendo, avvertito con senso di morte imminente.
In genere non recede alla somministrazione di nitroglicerina sublinguale. Il dolore può essere
accompagnato da sintomi diversi quali astenia, nausea, vomito, dispnea, sudorazione.
Un quarto dei casi di infarto anteriore è associato ad un ipertono adrenergico con tachicardia,
ipertensione, agitazione e tremore; mentre la metà dei casi di infarto inferiore si associa ad un
ipertono vagale con bradicardia, nausea, vomito e collasso. L’infarto può anche essere silente
(asintomatico), più comunemente nei pazienti anziani e soprattutto nei diabetici (minore sensibilità
dolorifica e funzionalità del SNA). Può esserci dispnea soprattutto se è presente insufficienza
ventricolare sinistra. In qualche caso possono sopraggiungere pericolose aritmie.
Diagnosi: fondamentali l’ECG e gli enzimi cardiaci sierici.
Esame obiettivo: dolore toracico retro sternale di durata superiore a 30 minuti, pallore e
sdorazione sono suggestivi di STEMI. Ci possono essere segni di disfunzione ventricolare: l’itto
così come il polso carotideo sono ridotti, ci possono essere un terzo e un quarto tono,
indebolimento del primo tono e sdoppiamento paradosso del secondo, soffio sistolico mitralico,
pressione arteriosa a volte ridotta di 10-15mmHg.
ECG: costituisce un mezzo fondamentale nella diagnosi di infarto, soprattutto in fase acuta. È
inoltre in grado di individuare un infarto pregresso. Tramite l’ECG si distinguono infarti con o
senza sopraslivellamento del tratto ST, e infarti Q e non Q (suddivisioni che combaciano spesso,
ma non sempre). L’area miocardica colpita presenta delle alterazioni nella conduzione degli
impulsi che vengono rilevate.
I principali segni di cardiopatia ischemica e infarto sono:
Onda T invertita: segno di ischemia.
Tratto ST sottoslivellato: segno di ischemia in ECG da sforzo, comune nell’infarto sub
endocardico, ma può anche essere un’immagine indiretta di lesione.
Tratto ST sopraslivellato: segno di lesione (immagine diretta), è presente anche in altre
condizioni. In un ECG da sforzo in paziente con pregresso infarto può essere un segno di
discinesia ventricolare (vedi ECG cardiopatia ischemica).
Onda Q: è un segno di necrosi. Il tessuto necrotico è del tutto incapace di condurre impulsi e
pertanto crea un vuoto o finestra elettrica che l’ECG è in grado di rilevare. L’elettrodo positivo più
vicino alla zona infartuata rileva infatti l’assenza di vettori nella propria direzione mentre,
attraverso questa specie di finestra elettrica, vede i vettori che si propagano dalla parte opposta e
dunque nella direzione opposta. Il risultato è una profonda deflessione negativa, un’onda Q
appunto. Questa è significativa (e non una normale onda q del complesso QRS dovuta alla
propagazione dell’impulso attraverso il setto interventricolare da sinistra a destra) solo quando ha
un’ampiezza maggiore di 1mm o un’altezza almeno di 1/3 del QRS.
Solitamente le lesioni causate dall’infarto vengono distinte in tre o quattro stadi.
1) Modificazioni iperacute: le onde T divengono alte ed ampie.
2) Modificazioni acute: compaiono i segni di lesione come il sopraslivellamento del tratto ST.
Della lesione si può avere, come anche per l’ischemia, un’immagine diretta (da parte degli
elettrodi che guardano l’area lesa) e un’immagine indiretta (da parte degli elettrodi che guardano
l’area opposta) che mostrerà dunque un sottoslivellamento del tratto ST.
3) Modificazioni precoci: comparsa di onde Q patologiche, segno di necrosi. Non sempre!
4) Modificazioni tardive: in genere dopo almeno 48 ore: inversione dell’onda T (segno di
ischemia, che in realtà può anche essere presente prima, magari in pazienti con angina o
comunque con episodi ischemici).
Successivamente le onde T e le variazioni del tratto ST tendono a scomparire lasciando come unico
segno l’onda Q o meglio il complesso QS.
È possibile localizzare l’infarto valutando in quali derivazioni si presentano queste alterazioni. Si
può fare il discorso pensando alle sole onde Q, ma naturalmente è valido anche per il tratto ST e
per le onde T invertite (infarti anteriore, laterale, inferiore o posteriore). Gli infarti si associano
spesso ad emiblocchi (ischemia branche) e quindi anche a deviazioni dell’asse cardiaco.
49
Esami di laboratorio: a parte una lieve leucocitosi polimorfo nucleata con lieve aumento della
conta dei bianchi e anche lieve aumento della VES, il segno più specifico di infarto sono gli enzimi
cardiaci sierici. Normalmente infatti, gli enzimi miocardici hanno una bassa concentrazione in
circolo, quando però vi è un danno miocardico le proteine contenute all’interno dei cardiomiociti
vengono liberate nel sangue, raggiungendo concentrazioni molto superiori alla norma e
costituendo un importante indice diagnostico.
Ogni marker cardiaco sierico ha una sua cinetica, ossia un suo picco di concentrazione e un suo
tempo di comparsa e di scomparsa. Interventi di rivascolarizzazione possono modificare questa
cinetica. Valutando gli enzimi cardiaci si può integrare l’esame clinico e l’ECG per confermare la
diagnosi di infarto, soprattutto nei casi di ECG non diagnostici (assenza di onde Q, da ciò si
deduce che sono un valido supporto in caso di infarti non trans murali). I principali enzimi sono:
Troponine miocardio-specifiche T e I, TnT e TnI: insieme alla troponina C hanno il compito di
regolare lo spostamento della tropo miosina e in generale l’interazione tra actina e miosina tramite
un meccanismo di risposta calcio-dipendente (la troponina C rappresenta il sito di legame con il
calcio). Le troponine I e T miocardiche hanno (a differenza della C), una composizione
aminoacidica diversa rispetto a quelle di altri tessuti muscolari e pertanto sono specifiche di danno
miocardico. Il dosaggio si effettua tramite specifici anticorpi monoclonali. Nell’infarto possono
aumentare anche di 20 volte. TnI e TnT sono i marcatori sierici preferiti per IM, soprattutto quando
ci sono valori al limite di CK-MB. Comparsa: 2-6h; Picco: 10-24h. Durata: 5-14gg.
Mioglobina: rilascio precoce: 2-3h. Ritorno alla normalità in 8-10h. Meno sensibile delle
troponine, soprattutto negli infarti datati. Ma è il marker più precoce.
Creatin fosfochinasi, CK: aumenta entro 4-6 ore dall’inizio dei sintomi, raggiunge il picco nelle
16-24 ore e scompare dopo circa 2-3 giorni. Ha una specificità limitata perché può aumentare in
ogni danno muscolare e in altre patologie. L’isoforma CK-MB è invece tipicamente cardiaca anche
se aumenta anche in interventi di cardiochirurgia e miocarditi oltre alla cardioversione elettrica
(che causa spesso aumento anche di altri enzimi) che è un comune intervento in caso di aritmie
pericolose come la fibrillazione ventricolare.
Altri enzimi sono: transaminasi glutammico-ossalacetica (GOT, compare con la CK e torna a
valori normali in 5-7 gg) e lattato-deidrogenasi (LDH, torna alla normalità in 10 giorni). I pazienti
che fanno terapia trombo litica o interventi di rivascolarizzazione hanno, a causa della maggiore
perfusione, un rilascio degli enzimi molto più rapido, con picco di concentrazione e ritorno alla
normalità in meno tempo. In questo modo la quantità di enzima rilasciata è minore, e questo
indica pertanto anche un minore danno miocardico.
Imaging cardiaco: Ecocardiogramma: permette di valutare le conseguenze di un infarto
miocardico. Non è in grado di distinguere un infarto miocardico pregresso da un evento acuto, né
è in grado di definire bene le dimensioni dell’infarto in quanto non distingue un tessuto necrotico
da un tessuto ischemico. È però semplice e rapido e permette di valutare le anomalie della cinesi
parietale (100% deigli infarti Q e 80% dei non Q) e il diminuito spessore delle zone miocardiche
colpite, potendo in tal modo ipotizzare anche quale vaso sia occluso in base alla localizzazione
dell’infarto. Permette in generale la rilevazione di complicanze come l’aneurismo ventricolare, la
preforazione del setto interventricolare e l’insufficienza mitralica ed inoltre permetta la
valutazione della funzionalità del ventricolo sinistro (eventuali disfunzioni ventricolari,
diminuzione della frazione di eiezione). È inoltre in grado di valutare l’efficacia di interventi di
riperfusione coronarica.
Scintigrafia miocardica: con tallio o tecnezio, rileva segni di ischemia residua postinfartuale.
Ventricolografia con tecnezio: serve a localizzare la necrosie valutare la frazione di eiezione e
quindi la funzione ventricolare. Le tecniche radioisotopiche sono in genere cmq meno usate perché
indaginose e spesso poco specifiche.
La risonanza magnetica con gadolinio è un’alternativa.
Tomografia a emissione di positroni: (PET) permette tramite l’impiego di FDG
(fluorodesossiglucosio) di valutare il metabolismo di glucosio da parte del tessuto miocardico e di
considerare la presenza o meno di zone miocardiche vitali. Possono esservi zone che, pur restando
vitali, hanno caratteristiche particolari. Si distinguono:
Attuale criterio diagnostico di infarto del miocardio: Riscontro di innalzamento di biomarker
cardiaci (troponina) con un valore al di sopra del 99° percentile e presenza di almeno uno tra:
sintomi di ischemia miocardica, alterazioni ECG indicative di ischemia, onde Q patologiche, MCI,
necessità di una PTCA o un BPAC, evidenza a test d’immagine di perdita di miocardio vitale.
50
Complicanze: quadri clinici che possono presentarsi durante l’infarto o in tempi successivi:
1) Disfunzione ventricolare e scompenso cardiaco congestizio: a seguito di un infarto si hanno
dei fenomeni di rimodellamento ventricolare con ingrandimento del ventricolo a seguito
dell’allungamento delle fibre nell’area infartuata e successivamente anche intorno. La dilatazione è
associata ad una disfunzione ventricolare che può evolvere (anche in anni) in uno scompenso
cardiaco (sistolico da ridotta gittata o diastolico da ridotta compliance). Il deficit di pompa è la
principale causa di morte dopo IMA, e ha come segni un terzo o quarto tono e congestione
polmonare (radiografia al torace). I pazienti con scompenso presentano un’aumentata pressione di
riempimento ventricolare e dell’arteria polmonare (verificate con inserimento di un catetere a
palloncino). Una funzione ventricolare anomala è in genere associata ad un deficit di contrattilità
di almeno il 20-25% del ventricolo (oltre il 40% si può avere shock cardiogeno ossia un deficit di
pompa con volumi ventricolari di riempimento che risultano aumentati e forte ipotensione che
può portare anossia cerebrale, nell’80% dei casi risulta mortale). La terapia per lo scompenso
cardiaco congestizio dopo IMA è la stessa del normale con diuretici, vasodilatatori (nitrati) e ACEinibitori e/o ARB. I diuretici possono peggiorare la situazione causando ipovolemia.
L’insufficienza può essere prevalentemente sinistra con: bassa gittata ed ipoperfusione sistemica
(a valle) e congestione polmonare sino all’edema polmonare acuto (a monte). I sintomi della
congestione polmonare sono dispnea, rantoli polmonari, cianosi, sudorazione e agitazione. I
sintomi della bassa gittata e dello shock cardiogeno sono: bassa pressione sistolica, cute fredda e
pallida, anuria o oliguria, alterazioni dello stato di coscienza e acidosi metabolica.
L’insufficienza può anche essere prevalentemente destra con: congestione venosa sistemica (a
monte) e bassa gittata e ipoperfusione sistemica (a valle). I sintomi della congestione venosa sono
distensione venosa giugulare, epatomegalia, reflusso epato-giugulare, edemi periferici. I sintomi
della bassa gittata e dello shock cardiogeno sono gli stessi dell’insufficienza sinistra.
2) Aritmie: l’incidenza delle aritmie in pazienti con IMA è molto alta in quanto queste possono
essere causate da squilibri del SNA, disturbi elettrolitici, ischemia e rallentamento di conduzione
nelle aree necrotiche. Le aritmie possono aggravare la necrosi diminuendo la perfusione coronarica
e incrementando il consumo di ossigeno (le tachiaritmie riducono il tempo di diastole e aumentano
il lavoro cardiaco) o aggravando il deficit di pompa (bradi aritmie).
Tachiaritmie:
- Extrasistoli ventricolari: i battiti ectopici ventricolari sono comuni e sono dovute all’ipossia e
aggravate da eventuali squilibri idroelettrici quali ipopotassiemia e ipomagnesemia (che sono
aggravanti di molte forme aritmiche e devono essere corretti!). Di per sé non rappresentano un
fenomeno preoccupante perché non compromettono la funzione emodinamica, ma se molto
precoci possono favori l’insorgenza di TV e FV (fenomeno R/T). I beta-bloccanti le riducono
notevolmente.
- Tachicardia ventricolare e fibrillazione ventricolare: sono potenzialmente molto pericolose (si
aggiunge a queste anche la torsione di punta) in quanto possono compromettere la condizione
emodinamica. Anche se la terapia profilattica antiaritmica con lidocaina non è più raccomandata si
usano i beta-bloccanti per prevenire queste condizioni. Si trattano con amiodarone, o, se le
condizioni del paziente sono gravi, con cardioversione elettrica (scarica non sincronizzata di 200300J, se non funziona si associa ad adrenalina). L’impianto di un ICD è indicato in pazienti con
frazione di eiezione ventricolare inferiore al 40% con episodi di TV e FV post-STEMI.
- Ritmo idioventricolare accelerato: il ritmo idioventricolare può avvenire solo se la funzione del
NSA come pacemaker dominante viene a mancare. È una forma di tachicardia ventricolare in
genere quindi associata a bradiacardia sinusale. Non è tendenzialmente pericolosa perché il ritmo
è di 90-100bpm e non è un preludio a FV, può essere trattata con atropina per favorire un aumento
dell’attività del NSA (tachicardia sinusale).
- Aritmie sopraventricolari: la più comune è la tachicardia sinusale che a meno che non sia
sostenuta (100-120 bpm) e duratura (2 ore, e in tal caso si usa defibrillatore) non è particolarmente
preoccupante. Si può trattare con beta-bloccanti perché in genere è associata a ipertono simpatico.
Ritmi idiogiunzionali accelerati sono possibili.
Bradicardie:
- Bradicardia sinusale: è comune nell’infarto inferiore ed è in genere associata ad ipertono vagale.
Il trattamento con atropina è indicato se c’è compromissione emodinamica. Se persiste si pratica
pacing.
- Blocchi di conduzione atrioventricolare e intraventricolare: possono avere cause differenti.
Negli infarti inferiori i blocchi AV sono dovuti in genere a ipertono vagale, negli anteriori
principalmente alla necrosi e ostruzione delle coronarie che vascolarizzano anche le branche del
51
sistema di conduzione. Il malfunzionamento su base ischemica del sistema di conduzione è alla
base anche dei frequenti emiblocchi o blocchi di branca che si verificano comunemente in caso di
IMA. Il BAV è la condizione più grave e deve essere trattato in caso di compromissione
emodinamica con pacing (magari preceduto da elettrostimolazione temporanea esterna non
invasiva). Comunque è indicato in tutti i casi di blocco bi fascicolare, Mobitz II, BAV di terzo
grado, se non rispondono a terapia medica e presentano bradicardia.
Altre complicanze, meno comuni e/o importanti sono:
3) Infarto ventricolare destro: più che una complicanza è una condizione che può avvenire in
concomitanza all’infarto del ventricolo sinistro (30% si infarti laterali). Si può associare a segni di
scompenso cardiaco destro e si può notare in genere un sopraslivellamento del tratto ST nelle
derivazioni precordiali destre dell’ECG.
4) Aneurisma del ventricolo sinistro: è una discinesia o espansione parietale del ventricolo
sinistro. In genere è associato ad infarti anteriori e coinvolge la parete antero-settale . La parete
ventricolare perde il tessuto muscolare che viene sostituito da tessuto fibroso acinetico e sottile
(ben visibile all’esame ecocardiografico). Può associarsi a disfunzione ventricolare o scompenso e
ad aritmie ventricolari. Con il tempo la zona può dilatarsi e diventare sede di ancoraggio di trombi
(con un rischio, raro, di fenomeni embolici sistemici).
La terapia è chirurgica e consiste nell’aneurismectomia ventricolare sinistra. Quest’intervento è
eseguito in ipotermia moderata (28°) e circolazione extracorporea con infusione cardioplegica
potassica a 4°C. L’aneurisma deve essere inciso e i asportato lasciando però dei margini di tessuto
necrotico sui quali poi dovranno essere passati dei punti con sutura in Tevdek 2-0 a punti staccati
su quadratini di Teflon. Se nella parete ventricolare ci sono dei trombi questi dovranno essere
rimossi con cautela. Dopo l’asportazione dell’aneurisma bisogna eseguire interventi di
rivascolarizzazione miocardia mediante applicazione di by-pass.
5) Insufficienza mitralica acuta secondaria: può aversi per rottura dei muscoli papillari e delle
corde tendinee a causa di un grosso infarto antero-laterale, ma può essere anche conseguenza di
una progressiva ischemia dei muscoli papillari. Si può avere dispnea da sforzo fino anche
scompenso cardiaco (e anche shock cardiogeno). La terapia è chirurgica con sostituzione della
valvola con una protesi.
6) Perforazione del setto interventricolare: in genere si manifesta 3-5 giorni dopo l’infarto e può
essere localizzato nella parete inferiore del setto (infarto antero-settale inferiore per ostruzione
IVP) o all’apice del setto (infarto antero-settale apicale per ostruzione di IVA). La conseguenza è
uno scompenso cardiaco grave e il trattamento è chirurgico con intervento eseguito in ipotermia
moderata dopo clampaggio aortico e protezione miocardica con cardioplegia potassica a 4°C.
Viene incisa la zona infartuarta e riparata la perforazione con innesto di un patch in Dacron
suturato con punti staccati ad U di Tevdek 2-0 su Teflon.
7) Dolore toracico ricorrente: nel 25% dei pazienti si sviluppa un’angina residua.
8) Pericardite: il dolore acuto che si estende al trapezio può facilitarne la distinizione dal dolore
toracico ricorrente. La pericardite, definita epistenocardica, si può verificare nella regione
sovrastante la necrosi tra il 2° e il 4° giorno post-infarto. Si può trattare con acido acetilsalicilico.
9) Tromboembolia: possono esserci segni evidenti nel 10% dei pazienti, anche se almeno un altro
10% presenta fenomeni silenti. Episodi trombo embolici a livello polmonare e sistemico sono più
comuni in infarti estesi, per lo più anteriori, soprattutto se complicati da scompenso e ancor più in
caso di aneurima ventricolare, in cui i trombi murali nel ventricolo sinistro sono una complicanza
comune.
Terapia: la prognosi di STEMI è in gran parte condizionata dal verificarsi di complicanze
meccaniche (deficit di pompa) ed elettriche. La maggior parte dei decessi extraospedalieri
avvengono per fibrillazione ventricolare che quasi nella metà dei casi si verifica nella prima ora. È
essenziale quindi che il paziente venga portato il prima possibile in ospedale (conta molto che sia
educato a dare il giusto peso ai sintomi e che chiami presto soccorso).
Lo scopo principale della terapia è, soprattutto nella fase iniziale, evitare l’insorgenza di
complicanze meccaniche ed elettriche e di iniziare al più presto un adeguato trattamento (medico o
chirurgico) che permetta riperfusione e dunque una limitazione dell’area infartuata. Una volta
giunti in ospedale i pazienti vengono ammessi nell’unità di terapia intensiva coronarica dove vi è
un monitoraggio continuo delle funzioni vitali del paziente, della frequenza, del ritmo e della
pressione arteriosa. Vengono eseguiti ECG ed esami di laboratorio urgenti per verificare IMA e
52
sono comunque disponibili defibrillatori, respiratori, pacemaker trans toracici e altre
apparecchiature. Il trattamento nella fase ospedaliera consiste prima di tutto in alcune misure
generali:
1) Attività: bisogna evitare i fattori che aumentano il lavoro e quindi il consumo di ossigeno da
parte del miocardio, pertanto nelle prime 12 ore almeno il paziente deve restare a letto. I pazienti
devono essere incoraggiati ad assumere posizione eretta nelle prime 24 ore in modo da ridurre la
pressione capillare polmonare ma soprattutto per dare incoraggiamento psicologico. Già dal
secondo-terzo giorno i pazienti possono camminare per la stanza e provvedere da soli al’igiene
personale, successivamente possono fare anche 200 metri di cammino due o tre volte al giorno.
2) Dieta e alvo: nelle prime (12) ore è indicato digiuno e dieta idrica. Successivamente la dieta deve
essere equilibrata con adeguato introito soprattutto di potassio e magnesio oltre che di fibre per
evitare la stipsi che spesso i narcotici possono causare (si può anche aggiungere un emolliente
fecale, il dioctil-sulfosuccinato sodico, e se non basta somministrare lassativi). Le restrizioni
riguardano i grassi ed il colesterolo, oltre che i carboidrati (normali per un paziente sano, da
evitare nel diabete).
3) Terapia del dolore e sedazione: si può somministrare sin da subito nitroglicerina sublinguale
per diminuire il dolore toracico (oltre a favorire la vasodilatazione coronarica e un minore sforzo
cardiaco). Sono da evitare in pazienti ipotesi, o con infarto del ventricolo destro o che hanno
assunto sildenafil. La morfina a piccole dosi e in piccoli boli per ev è molto efficace, ma può
causare, soprattutto all’inizio, stipsi, nausea e vomito (per la sua azione anticolinergica, per la
quale potrebbe causare anche blocco AV e bradicardia). I beta bloccanti sono utili perché riducono
la richiesta di ossigeno e l’ischemia (e quindi il dolore ad essa associato). Possono essere
somministrate benzodiazepine (tranquillanti) per facilitare il riposo del paziente, il cui sonno può
essere disturbato da ansia e da fastidio per il monitoraggio continuo soprattutto il primo giorno.
4) Ossigeno: la somministrazione di ossigeno è indicata nel caso in cui la saturazione sia diminuita
(spesso).
Terapia farmacologica:
Antitrombotici: la fibrinolisi è una strategia fondamentale, e la terapia sarebbe bene che fosse
iniziata entro 30 minuti dalla presentazione dei sintomi. Lo scopo è quello si eliminare il trombo
nella coronaria occlusa riassicurando la perfusione e di evitare episodi trombotici a livello
sistemico. La terapia fibrinolitica può ridurre il rischio di morte ospedaliera del 50% riducendo
l’area infartuata, limitando la disfunzione ventricolare sinistra e l’incidenza di complicanze gravi
come perforazione del setto interventricolare, shock cardiogeno ed aritmie fatali. I benefici sono
notevoli se iniziata entro le preme 1-3 ore e forse anche fino a 6-12. È preferita la trombo lisi
rispetto all’intervento di rivascolarizzazione percutanea in tutti i pazienti che si presentano nella
prima ora, o nei vari casi in cui l’interveto non sia possibile.
Gli agenti utilizzati sono: t-PA (attivatore tissutale del plasminogeno), streptokinasi, e il
complesso attivatore streptokinasi plasminogeno anisoilato (APSAC). Questi farmaci
favoriscono l’attivazione del plasminogeno in plasmina che lisa i trombi. Il farmaco più utilizzato è
il t-PA con 15mg di bolo iniziale, 50mg ev nella prima mezz’ora, 35mg ev nella successiva ora.
Controindicazioni assolute: pregresso ictus cerebrale emorragico nell’ultimo anno, emorragia
interna o dissezione aortica in atto, ipertensione grave (sistolica >180mmHg), neoplasie
intracraniche.
Controindicazioni relative: età avanzata, intervento chirurgico recente, ulcera peptica attiva.
Complicanze: le principali sono reazioni allergiche (principalmente alla streptokinasi) ed
emorragia (da banali sanguinamenti a ingenti che richiedono trasfusioni, a emorragie gravi
gastrointestinali o cerebrali come l’ictus emorragico). In aggiunta alla fibrinolisi si usano farmaci
anticoagulanti (antitrombinici ed antipiastrinici) sempre per assicurare una perfusione adeguata.
Già in pronto soccorso viene somministrato acido acetilsalicilico (160-325mg) che comporta
inibizione della COX2 con riduzione dei livelli di trombossano. Dovrebbe poi essere seguita da
somministrazione giornaliera.
Anticoagulanti: servono perché può capitare che una placca residua possa con l’attivazione della
cascata coagulativa rioccludere precocemente il vaso. Il farmaco di scelta è l’eparina non
frazionata (ENF) per ev (bolo da 5000 unità poi per ev continua di 1000 unità). La sinergia tra
acido acetilsalicilico, eparina e un trombo litico comporta diminuzione del rischio di mortalità
senza un grande aumento del rischio emorragico.
Farmaci per la protezione del miocardio: Beta-bloccanti: sia in fase acuta che cronica, comportano
diminuzione della richiesta di ossigeno, blocco dell’ischemia e dunque miglioramento anche del
53
dolore ed hanno un effetto antiaritmico. ACE-inibitori: bloccano il sistema renina-angiotensinaaldosterone che si attiva durante la fase acuta dell’IMA. Nitrati: la nitroglicerina per ev è poco utile
in caso si diano ACE-inibitori + beta-bloccanti. Calcio-antagonisti: non vi è indicazione precisa e
sicura.
Rivascolarizzazione coronarica: viene essenzialmente eseguita mediante due modalità:
l’angioplastica coronarica transluminale percutanea (PTCA, o più in generale interventi
coronarici percutanei, PCI) e bypass coronarico.
La PTCA, introdotta nel 1977 ma notevolmente rimodernata fino ai giorni nostri, ha ormai un
ruolo dominante nel trattamento della coronaropatia, e ha portato alla creazione di una nuova
disciplina nota come cardiologia interventistica.
Indicazioni terapeutiche e criteri di scelta: Scegliere quando effettuare una rivascolarizzazione
piuttosto che semplicemente una terapia medica e, soprattutto, scegliere tra la PTCA ed il bypass
non è facile. La terapia medica nel trattamento della cardiopatia ischemica risulta estremamente
rilevante, ma molti pazienti traggono giovamento dalla rivascolarizzazione coronarica in
associazione con la terapia medica. La rivascolarizzazione è indicata sia in pazienti con sindrome
coronarica acuta, sia in alcuni casi di cardiopatia ischemica non ben controllati dalla terapia.
Distinguiamo diversi tipi di PTCA, al seconda del momento in cui vengono eseguiti.
• PTCA primaria: è più efficace della terapia farmacologica. Si esegue negli infarti con tratto
ST sopraslivellato, entro 90 minuti dall’insorgenza dei sintomi. È indicata anche in caso
di shock cardiogeno o per i casi in cui è controindicata la terapia farmacologica.
• PTCA facilitata: preceduta da terapia fibrinolitica o antitrombotica.
• PTCA di salvataggio: si attua quando la trombo lisi si considera fallita (cioè se dopo 90
minuti lo livellamento del tratto ST non si è ridotto almeno di del 50%).
• PTCA dilazionata: effettuata nelle giornate succesive all’episodio infartuale (indicazione
piuttosto dubbia).
La scelta tra bypass e PTCA è ancora più complessa. Con il tempo il numero di rivascolarizzazioni
eseguite con PTCA ha raggiunto e poi anche superato il numero di rivascolarizzazioni eseguite con
bypass grazie soprattutto alle innovazioni tecniche che hanno migliorato di molto l’efficacia di
questa procedura. Un tempo la PTCA presentava grosse limitazioni in condizioni anatomiche,
valutabili con coronarografia, quali lesioni eccentriche calcifiche, occlusioni croniche totali delle
coronarie o ad esempio lesioni localizzate in biforcazioni. Adesso queste limitazioni sono meno
nette. La valutazione deve comunque essere individuale e molto dipendente dall’anatomia
coronarica del paziente, dall’età, dall’insufficienza ventricolare e da malattie concomitanti.
In generale la PCI è consigliata in pazienti con malattia monovasale (o anche bivasale) con lesioni
anatomiche idonee, mentre il bypass aortocoronarico è consigliato in pazienti con malattia
trivasale, lesioni complicate o ostruzioni totali, malattia bivasale che include la coronaria sinistra
discendente prossimale o il tronco comune, alterata frazione di eiezione ventricolare sinistra e
pazienti affetti da diabete mellito, oppure quando è fallita la PTCA primaria.
La PCI presenta un maggiore rischio di ristenosi rispetto al bypass in quanto mentre la PCI si
focalizza sulla risoluzione delle lesioni responsabili, il bypass pone rimedio non solo al tratto
interessato, ma fornisce una via di perfusione anche qualora si sviluppino lesioni native prossimali
all’anastomosi dell’impianto del vaso nativo.
La PCI ha un minore rischio di mortalità a breve termine (intervento meno invasivo e meno
rischioso), ma ha una maggiore mortalità a lungo termine (es. 5 anni).
54
Trattamenti in emergenza
Trattamento in emergenza degli infarti STEMI:
Fattore tempo: è fondamentale disostruire la coronaria nel minor tempo possibile, per ridurre le
dimensioni dell’infarto. La riperfusione precoce presenta infatti i massimi vantaggi se eseguita
entro le prime 2 ore dall’inizio dei sintomi. Vi è un tempo decisionale (tempo che impiega il
paziente per chiamare soccorso), tempo casa-ospedale (trasporto), tempo intraospedaliero
(dall’arrivo in ospedale fino alla terapia riperfusiva con farmaci o PTCA). Quest’ultimo dovrebbe
esser ridotto a 30’ per l’inizio della terapia farmacologica e 90’ per l’inizio della PTCA.
Approccio terapeutico extraospedaliero:
Una volta verificato tramite ECG l’infarto STEMI:
Prima di tutto decidere il percorso:
• Dolore insorto da oltre 12 ore: non si possono fare trombo lisi e PTCA, trasportare il
paziente all’UTIC di riferimento. Portarlo in emodinamica se vi sono complicanze.
• Dolore insorto tra 6-12h: si deve trasportare il paziente all’UTIC di riferimento.
• Dolore insorto da meno si 6 ore:
o IMA non ad alto rischio: effettuare trombo lisi, anche in ambulanza.
o IMA ad alto rischio: si intende pazienti >75 anni, pressione sistolica <100, ST
sopraslivellato in 5 o più derivazioni, frequenza cardiaca >100, segni di
compromissione emodinamica come edema polmonare o shock cardiogeno. Si
effettua PTCA. Si porta il paziente in emodinamica direttamente per la PTCA
primaria. Se non si arriverebbe a tempo, si fa prima trombo lisi (con tombolitici o
inibitori della glicoproteina IIb/IIa) e poi PTCA facilitata.
In ogni caso: se il paziente è incosciente effettuare le misure di BLS etc.
Se il paziente è cosciente: monitoraggio continuo di ECG, pressione e saturazione con
pulsiossimetro. Ossigeno con cannula nasale, Accesso venoso periferico, Aspirina (per os o in
alternativa ev), Analgesia con nitroglicerina sublinguale (se la pressione è>90mmHg) ogni 5
minuti per un massimo di 3 volte e se non risponde alla nitroglicerinaMorfina (una eventuale
depressione respiratoria si correggerà con naloxone).
Si effettua poi: trombo lisi preospedaliera con: Tenecteplase (TNK-TPA) in unica
somministrazione.
Pronto soccorso: nel dipartimento di emergenza il paziente viene rivalutato con esami di
laboratorio (enzimi cardiaci, elettroliti, creatinine mia, etc) e strumentali (ECG seriati, ecocardio, rx
torace). Successivamente:
• Analgesia: Nitroglicerina sublinguale o se non risponde Morfina.
• Beta-bloccanti: Atenololo o Metoprololo o Esmololo (a meno che la frequenza non sia <60,
la pressione <100, segni di ipoperfusione, BAV di II o III grado, Asma o BPCO severa).
• Eparina: eparina sodica in pazienti non ammessi alla terapia trombo litica. Oppure in caso
di terapia con t-PA o TNK-TPA per prevenire la riocclusione.
• Ace-inibitori: captopril, enalapril, etc. Soprattutto ai pazienti con insufficienza sinistra.
• Statine: uso precoce delle statine dal primo giorno.
• PTCA: indicata in alternativa alla terapia fibrinolitica o in caso di shock cardiogeno.
• Trattamento delle complicanze.
Trattamento in emergenza degli infarti NSTEMI:
• A livello extraospedaliero: monitoraggio continuo di ECG, pressione e saturazione con
pulsiossimetro. Ossigeno con cannula nasale, Accesso venoso periferico, Aspirina (per os
o in alternativa ev), Nitroderivati (se la pressione è >90 mmHg) sublinguali, ogni 5 minuti
per un massimo di 3 volte.
• Pronto soccorso: se il paziente presenta ancora dolore toracico: Nitroderivari se la
presssione è >90 mmHg: nitroglicerina per ev; Beta-bloccanti: atenololo o metoprololo o
esmololo. Il paziente in crisi di angina instabile deve essere sottoposto a beta-bloccanti.
Antiaggreganti piastrinici: clopidogrel in aggiunta all’aspirina. Antagonisti dei recettori
IIb/IIIa: nei pazienti ad alto rischio e in cui si è programmata PTCA. Eparina.
55
Scompenso cardiaco
Definizione: detto anche insufficienza cardiaca, è la situazione fisiopatologica in cui il cuore non è
in grado di pompare una quantità di sangue adeguata alle richieste metaboliche dell’organismo,
oppure ci riesce solo tramite un forte aumento della pressione venosa (aumentato ritorno venoso).
Può essere causato da una ridotta portata e quindi meno sangue pompato oppure da un aumento
delle esigenze. Si hanno due conseguenze principali: ipoperfusione periferica e congestione
venosa. Se sono presenti sintomi è reale scompenso, se il paziente è asintomatico si parla di
disfunzione ventricolare. Si può avere una riduzione della portata ossia disfunzione sistolica
(ridotta capacità contrattile) oppure un difetto di riempimento ossia disfunzione diastolica
(ventricolo poco distendibile e meno compliance = maggiore rigidità).
Eziologia: è in genere dovuto a condizioni che alterano la struttura o la funzione ventricolare,
quasi sempre si ha un’insufficienza miocardica che può essere dovuta a: 1) perdita anatomica o
funzionale di parte del tessuto contrattile (tipo IM), 2) compromissione diffusa delle fibre
miocardiche (cardiomiopatie) 3) sovraccarico cronico di pressione (ipertensione, stenosi) 4)
sovraccarico cronico di volume: per esempio per una quota di sangue rigurgitata a causa di
un’insufficienza valvolare. Queste quattro condizioni sono associate a portata ridotta, tipicamente
associata a cause cardiache. 5) scompenso ad alta gittata: in pratica una forma con sovraccarico di
volume perché determinata da condizioni che impongono un maggiore flusso ematico.
Principalmente sono dovute ad un aumento delle “esigenze” e pertanto a cause extracardiache.
Queste sono ad esempio: a) Ipertiroidismo: aumento del MB e della gittata cardiaca, inoltre sintesi
di diverse proteine contrattili, si ha tachicardia e fibrillazione atriale b) Deficit di B12: come nel
beri-beri o alcolismo cronico. Si notano sintomi neurologici e una marcata vasodilatazione
periferica che aumenta il ritorno venoso e pertanto la gittata (Starling). Si può avere anche
compromissione del metabolismo cardiaco e con l’alcol una cardiomiopatia dilatativa. C) Fistole
artero-venose: come la malattia di Paget, poichè vengono saltati i capillari, per migliorare la
perfusione il cuore aumenta la gittata (o portata). D) Anemia: per mantenere il trasporto di
ossigeno c’è aumento del flusso ematico. Si ha anche ipossia miocardica. E) altre condizioni:
esercizio fisico intenso, stress, dieta, infezioni, gravidanza.
Le cause principali sono pertanto: cardiopatia ischemica, cardiomiopatie, valvulopatie,
cardiopatie congenite, sindromi da alta portata, infezioni, malattie del pericardio, ipertensione
polmonare, modificazioni strutturali. Fattori precipitanti sono: ischemie, crisi ipertensiva,
valvulopatia, fibrillazione atriale, embolia polmonare, terapia inappropriata, infezioni, anemia,
diabete, ipertiroidismo, disturbi elettrolitici, abuso di alcol o farmaci.
Lo scompenso viene definito in modi diversi: acuto (edema polmonare acuto, shock cardiogeno) e
cronico, sistolico (come nella cardiomiopatia dilatativa, ridotta contrattilità) e diastolico (come
nella cardiomiopatia restrittiva, ridotta distensibilità), destro (congestione venosa sistemica) e
sinistro, a bassa gittata (minore portata) o ad alta gittata (aumento esigenze), retrogrado (sangue
“a monte”) e anterogrado (inadeguato apporto di sangue in periferia).
Patogenesi: Si distinguono un po’ artificiosamente (poiché spesso sono associate) due forme di
scompenso: sistolico o anterogrado (portata inadeguata) e diastolico o retrogrado (elevate
pressioni di riempimento) che sono rispettivamente un deficit di pompa o di distensione.
Un’altra distinzione, anche questa prevalentemente didattica è tra scompenso destro e sinistro.
Nella maggior parte dei casi le cause di scompenso agiscono per lo più sulle cavità sinistre del
cuore perché: la pressione è più elevata nel circolo sistemico (è comune l’ipertensione e un
sovraccarico cronico di pressione sul ventricolo sinistro), le patologie valvolari acquisite sono più
frequenti nelle sezioni sinistre così come la cardiopatia ischemica (ventricolo sinistro). Il cuore
destro è quindi meno colpito a meno che non ci sia patologia polmonare (cuore polmonare) o sin
da subito uno scompenso globale. È una divisione abbastanza didattica, infatti spesso uno
scompenso sinistro comporta anche uno scompenso destro e comunque il miocardio dei due
ventricoli è separato da un setto comune (interventricolare) e le alterazioni biochimiche e
strutturali di uno finiscono per coinvolgere anche l’altro. Ha senso nei casi acuti o iniziali. I sintomi
sono però diversi: Sinistro difficoltà di scarico delle vene polmonari edema polmonare.
Destro difficoltà vene cave edemi periferici. Il cuore risponde ad una riduzione della gittata
con meccanismi di compenso. Si parla di scompenso quando questi sono insufficienti, prima è solo
disfunzione ventricolare.
56
Clinica: è possibile riscontrare una sintomatologia varia, intensa o sfumata. In generale i sintomi
più importanti sono dispnea, astenia marcata, edema. Non hanno correlazione stretta con la
severità della malattia. Vi sono sintomi più tipici dello scompenso destro (stasi venosa, edemi
declivi, stasi epatica) o più del sinistro (dispnea, astenia, cianosi, edema polmonare).
Classificazione funzionale dei pazienti con scompenso cardiaco di NYHA (associazione
cardiologica di New York): Classe I: pazienti asintomatici per normale attività (sani) II: pazienti
che stanno bene a riposo, ma con sintomi (dispnea per lo più) per sforzi di ordinaria intensità. III:
bene a riposo, sintomi per sforzi lievi. IV: sintomatici anche a riposo.
Esame obiettivo: Il paziente si presenta affaticato, con difficoltà a respirare e necessità di
mantenere una posizione verticale. Cuore: ingrandimento dell’aia cardiaca (si ha un itto
prolungato e palpabile su due interspazie per ipertrofia del ventricolo sinistro). A causa
dell’ipertono simpatico si ha tachicardia e ritmo di galoppo. Si ha infatti un terzo tono
protodiastolico. Il polso è piccolo, frequente e a volte alternante (pulsazione forte poi debole).
Nelle fasi finali si ha bradicardia. La PA sistolica è ridotta (meno gittata) e la diastolica è aumentata
(aumento resistenze periferiche). La PVC è anche sopra i 20. Cute: la cute appare fredda e pallida
per la vasocostrizione. Possono comparire edemi, all’inizio con fovea. Poi possono indurirsi e
pigmentarsi (specie alle caviglie). Nei casi gravi si ha anasarca. Gli edemi sono nelle parti declivi e
se il paziente è a letto nella regione presacrale. Gli edemi da scompenso sono in genere deprimibili
e con fovea, bilaterali e meno evidenti al mattino. Il paziente può lamentare scarpe strette ad
esempio. Giugulari: con il paziente semidisteso, a 45° con la testa sollevata, si nota un anormale
riempimento delle giugulari, che collabiscono più in alto del normale (stima della PVC= altezza
sangue giugulari dallo sterno + 5cm). Si ha forte distensione delle giugulari con pressione
prolungata all’ipocondrio destro (riflesso epatogiugulare). Torace: si possono avvertire rantoli
crepitanti alle basi polmonari, e sempre a causa dell’edema interstiziale e la congestione bronchiale
si possono avere ronchi e asma cardiaca. A volte si ha un versamento pleurico (spesso bilaterale, se
unilaterale per lo più destro). Addome: per aumento della PVC si può avere epatomegalia (fegato
anche dolente) e anche ascite (tardiva). Con il tempo anche atrofia e insufficienza epatica.
L’astenia è marcata. In tempi passati si parlava di cachessia cardiaca in quanto i livelli di TNFalpha e catecolamine erano tanto elevati da avere effetti negativi sul tropismo muscolare.
Complicanze: le più comuni sono aritmie ed edema polmonare acuto.
Aritmie: la fibrillazione atriale è molto comune in pazienti scompensati. Il farmaco di prima scelta
per ripristinare il ritmo sinusale è l’amiodarone (antiaritmico di classe III). La morte improvvisa
per fibrillazione ventricolare rappresenta quasi il 50% delle cause di morte (il resto per lo più
muore per insufficienza della pompa cardiaca) pertanto bisogna si possono usare i defibrillatori
cardiaci impiantabili (ICD) in pazienti con NYHA II-III sotto terapia. In pazienti con ritmo
sinusale può essere utile (NYHA III-IV) un pacing bi ventricolare.
Edema polmonare acuto: il paziente è agitato con fame d’aria e ansia, dispnoico (dispnea spesso
improvvisa), tachipneico, tachicardico con diastolica aumentata e differenziale diminuita, cute
fredda, sudata e pallida ed estremità cianotiche. Si possono avere su tutti campi polmonari rantoli
inspiratori e tosse con escreato schiumoso e/o roseo. Si ha ipossia e acidosi, compromissione anche
cardiaca, attivazione adrenergica, aumento resistenze e ulteriore compromissione cardiaca.
Altro: shock cardiogeno, trombosi venose.
La terapia si distingue in:
1. Terapia causale:
2. Sintomatica: si divide in
a. Misure generali
b. Terapia farmacologica: vedi di seguito.
c. Terapia di risincronizzazione cardiaca: elettrostimolazione bi ventricolare regolata
dall’atrio. Indicata nelle classi NYHA III-IV con FE<35% e ritmo sinusale
mantenuto.
d. Defribrillatore impiantabile: ICD, riduce la letalità totale di un 30%.
3. Trapianto cardiaco: in caso di scompenso cardiaco refrattario.
Terapia farmacologica: Per la terapia dello scompenso si può immaginare il cuore in difficoltà
come dei cavalli che trainano una carrozza in salita e che non ce la fanno.
57
Cavalli = cuore; Salita = Post-carico (resistenze periferiche per lo più, pressione arteriosa);
Carrozza con persone a bordo = Pre-carico (volemia, ossia quantità di liquidi in circolo). Noi
siamo il nocchiere. Possiamo:
1) Scegliere la strada più lunga, ma meno ripida = vasodilatatori: ACE-inibitori: sono la scelta a
partire dalla classe I NYHA. Esempi sono captopril, enalapril, lisinopril. In pazienti con ridotta
FE sono fondamentali. Riducono il post-carico (cioè riducono la salita). Bloccano la conversione
in angiotensina II e upregolano la bradichinina. Rallentano il rimodellamento cardiaco. Possono
essere inefficaci se non si è risolta la ritenzione idrica. Come effetti collaterali ci può essere
ipotensione e aumento azotemia. Il rafforzamento delle chinine può dare angioedema e tosse non
produttiva. I pazienti intolleranti possono fare uso di ARB (o sartani, tipo valsartan, candesartan,
losartan) cioè inibitori del recettore dell’angiotensina II. L’impiego di ACE inibitori e sartani ha
diminuito la mortalità di ¼ (25%).
2) Facciamo rallentare i cavalli = Beta-bloccanti: (cavedilolo, metoprololo, bisoprololo). Si usano
a partire dalla classe II NYHA oppure dalla I se il paziente è iperteso. Riducono il post-carico
(diminuiscono il lavoro rallentando la frequenza e la diminuendo la gittata) e migliorano la
sintomatologia del paziente scompensato, che in buona parte è dovuta all’ipertono adrenergico.
Sono inotropo negativi. Questo può sembrare un controsenso in pazienti con ridotta gittata (con
scompenso, cioè che non ce la fanno) eppure la stimolazione adrenergica è un fattore prognostico
negativo. I vantaggi pertanto superano gli svantaggi. Infatti riducono la mortalità di un 35%.
Devono però essere dosati con cura perché possono portare peggioramento dell’insufficienza
cardiaca, caduta della pressione, bradicardia, peggioramento dell’asma (che è una
controindicazione all’uso). Si usano nei pazienti stabili e con un aumento lento della posologia.
3) Facciamo scendere le persone = Diuretici: Diminuiscono il pre carico (scendono le persone =
meno liquidi). Diuretici d’ansa (furosemide, torasemide) e tiazidici (idroclorotiazide,
clortalidone che è a effetto protratto). Aumentano l’eliminazione renale di NaCl e acqua. In ogni
caso devono essere associati ad una dieta iposodica. Quelli d’ansa agiscono sull’ansa di Henle, i
tiazidici agicono sul tubulo contorto distale. I diuretici d’ansa hanno un maggiore effetto (che
consiste principalmente nella riduzione del pre-carico e pertanto riduzione dei sintomi congestizi e
accumulo di liquido negli interstizi), i tiazidici possono essere associati se persiste ritenzione idrica
(ma sono meno potenti e inefficaci in caso di insufficienza renale) nei casi di resistenza ai diuretici
d’ansa (dovuta a iponatremia o a FANS). Si utilizzano a partire dalla III classe NYHA. Principale
effetto collaterale è l’ipokaliemia (aumento del rischio di aritmie) e il peggioramento dell’azotemia.
Bisognerebbe sempre iniziare con bassi dosaggi e poi somministrare dosi crescenti fino a
stabilizzazione della diuresi. Si usano solo nel paziente sintomatico con ritenzione idrica.
Antagonisti dell’aldosterone: tipo spironolattone, sono diuretici risparmiatori di potassio. Non
si usano in monoterapia, ma in associazione con i tiazidici e sono controindicati in insufficienza
renale. L’amiloride è risparmiatore di potassio, ma indipendente dall’aldosterone. Nei pazienti a
lungo a letto si fa uso anche di anticoagulanti e antiaggreganti.
Nell’insufficienza acuta si usa di solito un diuretico d’ansa ev. (furosemide), nella cronica un
tiazidico ogni 2 giorni. Se in monoterapia si dà potassio o terapia a base di potassio o in
associazione con spironolattone. Se i tiazidici non bastano si aggiunge un diuretico d’ansa.
4) Frustare i cavalli = farmaci inotropo-positivi. Inotropo positivi: agiscono attraverso inibizione
della pompa sodio/potassio con aumento della concentrazione intracellulare di sodio, inibizione
della pompa sodio/calcio e maggiore concentraizione di calcio che aumenta la contrattilità. Ha un
indice terapeutico ridotto (distanza tra dose tossica e terapeutica) ed inoltre molto influenzato
dalla concentrazione plasmatica di elettroliti. Sono pertanto molto rischiosi. Aumentando la
concentrazione di potassio si riduce la tossicità digitalica. Si usano per la loro azione vagomimetica (cronotropa negativa), riducono infatti la frequenza a riposo. Sono principalmente
digossina e digito tossina (che rispetto a questa non è eliminata solo per via renale). Si indicano a
partire dallo stadio III di NYHA, ma non nell’insufficienza diastolica. Sì in presenza di
tachiaritmie come fibrillazione atriale. Sono rischiose, l’intossicazione da digitale è più comune in
casi di insufficienza renale, ipopotassemia, ipercalcemia, interazioni con farmaci (calcio
antagonisti, amiodarone, tetracicline, levodopa), etc. Sintomi dell’intossicazione da digitale:
vomito e diarrea, visione colorata (in giallo), aritmie. In caso di intossicazione lavanda gastrica e
antitossina digitalica come antidoto, oltre all’aumento della potassemia.
58
Insufficienza cardiaca Acuta
Lo scompenso cardiaco acuto è una patologia estremamente interessante perché ha una
elevatissima incidenza e prevalenza nella popolazione generale e tende ad aumentare con il
tempo, ciononostante la maggior parte delle raccomandazioni sulle linee guida sono di un livello
di evidenza molto basso, generalmente C (opinioni di esperti), quindi c'è molto da lavorare in
questo settore.
Definizione: Acute Heart Failure (AHF): E' un rapido peggioramento dei segni e dei sintomi dello
scompenso cardiaco. È una condizione grave e pericolosa per la vita che richiede un'attenzione
medica immediata e porta quasi sempre l'ammalato all'ammissione ospedaliera. Molti studiosi
dell'argomento preferiscono alla definizione dello scompenso acuto, la definizione di sindromi
dello scompenso cardiaco acuto, perché lo scompenso acuto può essere dovuto non ad un'unica
patologia ma ad un insieme di disordini tra loro correlati.
In pratica i pazienti con scompenso cardiaco acuto si presentano con un quadro clinico di:
peggioramento scompenso cardiaco cronico (congestione sistemica e polmonare), edema
polmonare (distress respiratorio, tachipnea, saturazione di ossigeno <90), scompenso cardiaco
ipertensivo (pressione elevata), shock cardiogeno (marcata ipoperfusione tissutale con riduzione
della sistolica e diuresi scarsa o assente, congestione polmonare).
Epidemiologia: negli ultimi anni abbiamo assistito ad un aumento del 90% di ammissioni
ospedaliere per AHF. La prevalenza sta aumentando moltissimo nel corso degli anni, si è passati
da 3.5 milioni di pazienti affetti nel 1991, 4.8 milioni nel 2001 e si aspettano 10 milioni di pazienti
affetti nel 2037. In percentuale la prevalenza è il 2% tra i 40 e i 59 anni, aumenta progressivamente
al 10% per i soggetti >70 anni. Il paziente con AHF che si reca al pronto soccorso è in genere
anziano, spesso con comorbidità (ipertensione, cardiopatia ischemica, FA, diabete, etc.).
Eziologia: le cause di insufficienza cardiaca acuta sono molteplici, le principali risultano essere:
1. Cardiopatia ischemica acuta: è probabilmente la causa più comune di shock cardiogeno. Vi è
disfunzione contrattile (per discinesie o per riduzione della massa contrattile) del
ventricolo, principalmente il sinistro. Vi può essere disfunzione sistolica e/o diastolica.
2. Cardiomiopatie: la dilatativa causa deficit della funzione sistolica, la ipertrofica deficit della
funzione diastolica, la aritmogena del ventricolo destro (degenerazione fibroadiposa del
miocardio ventricolare destro) causa alterazioni e aritmie. Le cardi miopatie sono però
soprattutto responsabili di scompenso cardiaco cronico piuttosto che acuto.
3. Miocarditi: possono svilupparsi in modo acuto e fulminante.
4. Pericarditi: un versamento pericardico può determinare compressione o tamponamento
pericardico. Dipende molto dall’entità e soprattutto dalla rapidità del versamento. Lo
scompenso cardiaco acuto è più probabile se il versamento è improvviso.
5. Valvulopatie: Stenosi mitralica, Insufficienza mitralica, Stenosi aortica, Insufficienza
aortica, Stenosi tricuspidale, Insufficienza tricuspidale, Stenosi polmonare,
Insufficienza polmonare. Specie se acute possono essere causa di scompenso.
6. Crisi ipertensive: improvviso aumento della pressione associato a danno organico
(emergenze). Il marcato aumento della pressione tele sistolica genere scompenso acuto.
7. Aritmie: indipendentemente dalla condizione di base possono essere una causa precipitante.
Vi sono anche altre cause: stress, traumi, infezioni, etc.
Fisiopatologia: la patogenesi non è del tutto nota. Chiaramente la causa iniziale può essere molto
variabile. Il risultato è il deficit della funzione sistolica (quindi capacità di pompa) o diastolica
(elasticità e dilatazione) del ventricolo.
Clinica: vi sono tipi di pazienti differenti a seconda del tipo di scompenso prevalente:
• ICA con prevalente deficit sistolico: Sintomi: tosse, dispnea, astenia. Segni: segni di bassa
gittata: cute pallida, fredda o cianotica, respiro frequente. Possibile versamento pleurico
e rantoli polmonari alle basi. Possibile presenza di terzo e/o 4 quarto tono cardiaco. Il
polso può apparire piccolo. Vi è spesso ipotensione e contrazione della diuresi.
• ICA con prevalente deficit diastolico: si ha spesso congestione venosa polmonare o
sistemica, edemi e ritenzione di fluidi. I segni sono simili alla funzione sistolica.
• Insufficienza del ventricolo destro: c’è soprattutto depressione della funzione ventricolare
destra. Vi è con minore frequenza congestione ed edema polmonare. I sintomi sono per lo
più astenia, dispnea, nausea e sazietà precoce. Segni: ittero ed edemi periferici,
distensione venosa giugulare, terzo e quarto tono cardiaci, ascite ed epatomegalia. Tipica
dell’infarto al ventricolo destro è ad esempio la triade composta da ipotensione, distensione
venosa giugulare e campi polmonari chiari.
59
Diagnosi: si basa principalmente su anamnesi ed esame clinico. L’anamnesi deve focalizzarsi su
familiarità per cardiopatia ischemica, cardiopatie preesistenti, malattie sistemiche, terapie in corso,
fattori di rischio coronarico. I sintomi riferiti dal paziente possono essere vari (sincope, astenia,
dolore toracico o addominale, febbre) e ci aiutano ad indirizzarci sull’eziologia. I segni clinici sono
quelli descritti: eseguire esame di torace, cuore e addome. Sempre valutare la pressione arteriosa.
Esami di laboratorio: enzimi cardiaci, D-dimero, elettroliti, emogasanalisi possono aiutarci ad
orientarci. La valutazione del peptide nariuretico BNP e del suo precursore NT-proBNP ha un
discreto valore predittivo negativo.
Indagini strumentali: ECG, Rx torace (segni di congestione polmonare come strie di Kerley alle
basi, versamento pleurico, ingrandimento silhouette cardiaca, infarto polmonare, pneumtorace),
ecocardiografia, TC.
Serve una diagnosi precoce, ma può non essere semplice. Si è pertanto elaborato uno score, il
PRIDE SCORE: questo valuta (massimo di 14 punti): elevazione NT-proBNP (vale 4 punti),
edema polmonare visibile all’Rx, ortopnea, febbre, età >75 anni, tosse, etc. È AHF se >6 punti.
Terapia
Il paradosso dell’insufficienza cardiaca acuta è che nonostante l'incidenza e prevalenza altissime,
le linee guida si basano su livelli di evidenza molto bassi, solitamente livello di evidenza C (Il prof
ricorda che il livello di evidenza A è quello che deriva da studi molto forti, con campione alto, a
doppio cieco, etc; il livello C è basato essenzialmente sul parere di esperti del campo). Questo
succede perché non è un'unica patologia, bensì una famiglia di patologie. È quindi difficile
identificare un singolo paziente da inserire nel trials, intrinseca eterogeneità.
1) Misure generali: il paziente deve essere tenuto sotto monitoraggio dei parametri vitali, ECG a
12 derivazioni, saturazione con pulsi ossimetro, è necessario assicurare un accesso venoso. In
pronto soccorso sarà possibile effettuare un ecocardiogramma e un Rx torace.
2) È necessario somministratre Ossigeno al 100% con maschera Venturi. In caso di alterazione
della coscienza, segni di distress respiratorio (forte tachipnea >40), ipossiemia refrattaria alla
somministrazione di ossigeno con maschera, richio di ab ingestis si procede all’intubazione.
3) In presenza di dolore intenso somministrazione di Morfina.
4) In presenza di marcato broncospasmo somministrazione di Aminofillina
• Se il paziente ha edema polmonare acuto:
o
Pressione >100mmHg: Furosemide ev. Può essere eventualmente associata ad un
tiazidico (attenzione a ipovolemia, ipokaliemia e disfunzione renale). L’approccio
low dose strategy o quello high dose strategy sono equivalenti.
o
Pressione <90mmHg: si somministra Dopamina (non si capisce bene perché ha
effetto, pareva avesse funzione nefroprotettiva soprattutto dei diuretici, ma forse
non è vero e non serve) e Dobutamina (inotropo positivo, tendenzialmente non si
usano perché causano aritmie ed aumentano il consumo di ossigeno).
o
Paziente con shock cardiogeno: Dopamina + Levosimendan (inotropo positivo
inibitore della fosfodiesterasi), Noradrenalina (da associare agli inotropi per la
potente azione vaso costrittiva, per mantenere accettabile la pressione arteriosa).
Vengono utilizzati anche vasodilatatori come nitro prussiato o nitroglicerina.
Inoltre abbiamo: Salina ipertonica: di solito prima della somministrazione di diuretico in bolo, è
uso comune dare una salina ipertonica perché si ha un effetto diuretico maggiore, ma non c'è mai
stato uno studio su questo. Ultrafiltrazione: l'ultrafiltrazione dovrebbe funzionare meglio di un
diuretico, perché il LEC contiene 140Meq di Na, mentre il Na nelle urine di pz in terapia con
furosemide è circa 60meq → c'è una differenza di 80meq di sale non risolto (sono urine
ipotoniche)→ quindi il paziente tende ad accumulare sodio con tutto ciò che questo comporta,
come il peggioramento della funzione renale. Con l'ultrafiltrazione si riesce ad eliminare tutto il
sodio e non si hanno le conseguenze da sale non risolto. Però ci sono pareri differenti nei vari
trials: Ad oggi l'ultrafiltrazione non si usa di routine al pronto-soccorso ma si usa solo se il
paziente è resistente totalmente alla terapia diuretica.
Nuovi farmaci: Relaxin: la relaxina è un peptide endogeno inizialmente scoperto come un ormone
che è attivo in gravidanza→ i pz con relaxin avevano miglioramento di sintomi e indici tra cui
riammissione in ospedale e mortalità. Omecamtiv mecarbil: attivatore miosina, è un inotropo che
aumenta la forza di contrazione miocardica senza aumentare il consumo di ossigeno e il calcio
intracellulare, limitando così il rischio di aritmie. Ularitide: nuovo trial, induce diuresi.
60
Ipertensione polmonare
Definizione: IP, è caratterizzata da un cronico incremento della pressione in arteria polmonare
(PAP) e incremento delle resistenze polmonari (PVR) che inducono ipertrofia e dilatazione del
ventricolo destro. È definita da una pressione arteriosa media >25mmHG a riposo (valori medi 1216mmHg), >30 mmHg durante lo sforzo, o una PAP sistolica >35mmHg (picco sistolico normale
18-25 mmHg). L’IP si definisce lieve quando la PAP media è tra 19-25, moderata se 26-40mmHg,
severa se >40mmHg. L’IP nella sua forma arteriosa è un’affezione rara (5/100000), ma l’IP in senso
generale può essere associata ad affezioni cardiache e respiratorie croniche molto comuni, pertanto
la sua incidenza è decisamente superiore.
Classificazione: si distingue un’ipertensione polmonare arteriosa, un’ipertensione associata a
malattie del cuore sinistro (che interessano atrio o ventricolo, valvulopatie), un’ipertensione
associata a malattie polmonari e/o ipossiemia (BPCO, malattia interstiziale polmonare, sleep
apnea, ipoventilazione alveolare), un’ipertensione dovuta a malattia trombotica cronica o
embolia, e miscellanea (da sarcoidosi, tumori e adenopatie comprimenti i vasi polmonari, etc).
Fisiopatologia: L’aumento delle resistenze vascolari causa alterazioni: Respiratorie: si ha aumento
delo spazio morto funzionale (vi sono unità ad alto rapporto v/p) e limitazione nella diffusione
alveolo capillare con conseguente ipossiemia e ipocapnia con aumento della ventilazione
necessaria ad eliminare CO2. Cardiache: ipertrofia delle sezioni destre con aumento della pressione
di riempimento del ventricolo destro, ipertensione atriale destra e stasi del circolo venoso
sistemico. Può esserci un progressivo deterioramento della portata sistemica con ipotensione ed
ipoperfusione dei microcircoli renale, coronario e cerebrale (conseguenze sistemiche).
Clinica: all’inizio asintomatica, comparsa dei sintomi in media dopo due anni. Si ha: dispnea da
sforzo, sintomo freuquente all’esordio, poi anche a riposo. Si può avere astenia, angina, sincope
(40%) in rapporto a diminuzioni della portata cardiaca. Ortopnea e DPN suggeriscono
ipertensione polmonare (da scompenso sinistro). Eventuali segni tipo fenomeno di Raynaud e
artralgie indicano connettivopatie. L’anamnesi può orientare verso una sindrome ostruttiva da
apnee notturne (apnee, russamento, sonnolenza, cefalee al mattino). Si può utilizzare una
classificazione dello stato funzionale (riadattamento di quella del NYHA per scompenso sinistro).
Classe I: no limitazioni nell’attività fisica ordinaria. II: sintomi di dispnea e fatica con attività fisica
ordinaria. III: sintomi con attività fisica minore dell’ordinaria. IV: sintomi anche a riposo.
All’esame obiettivo nel 90% dei pazienti c’è un’accntuazione del II tono sulla polmonare dovuta
all’incremento della pressione arteriosa polmonare, soffio diastolico da insufficienza in area
polmonare, soffio sistolico da rigurgito tricuspidalico per l’eventuale dilatazione destra. Anche
epatomegalia, edemi, distensione delle giugulari a causa dello scompenso destro.
Diagnosi: dopo l’anamnesi e l’esame obiettivo le indagini strumentali prevedono: ECG: poco
sensibile e specifico, ci può essere ipertrofia ventricolare destra. Radiografia dl torace: nel 90% dei
casi dilatazione dei vasi polmonari in regione ilare con aspetto ad albero potato dei vasi periferici.
Può evidenziare patologie responsabili di un’IP secondarie. Ecocardiografia trans-toracica: TTE,
forte correlazione con I risultati ottenuti con cateterismo cardiaco destro. Misurando la velocità di
reflusso tricuspidalico si stima la pressione sistolica in arteria polmonare PAPs che è uguale alla
pressione sistolica nel ventricolo destro (RVSP) in assenza di ostruzioni dell’arteria polmonare.
Esami funzionali respiratori: spirometria e emogasanalisi escludono patologie polmonari o
bronchiali. Si ha una riduzione della diffusione alveolo capillare DLCO (per le alterazioni di
capillari e piccole arterie) mentre capacità vitale forzata e indice di Tiffenau sono normali.
Riduzione di DLCO e incremento del gradiente transtricuspidalico sono segni di IP iniziale. La
PaO2 è un po’ ridotta così come pal PCO2 per iperventilazione. Nelle connettivopatie riduzione
isolata di DLCO. Se all’IP è associata fibrosi polmonare ci può essere indice di Tiffenau alto.
Polisonnografia per valutare le apnee notturne. Scintigrafia ventilo-perfusiva polmonare: molto
sensibile e specifica (oltre il 90%) per distinguere tra IPAH e IP post-TEP (nella prima è normale,
ella seconda difetti perfusivi). TC: un aspetto a vetro smerigliato con ispessimento dei setti
interlobulari con adenopaite o velature pleuriche indica malattia polmonare veno-occlusiva. TC
con mezzo di contrasto: distingue IP arteriosa e post-TEP (si vedono I trombi). Test del cammino
in 6 minuti: 6MWT, correla con la prognosi. Cateterismo cardiaco destro: glod standard per
individuare IP e valutarne la severità. Bisogna valutare PAP (s,d e media, >25mmHg), RAP, PWP
61
(pressione di incuneamento capillare ≤15mmHg per istinguere IP arteriosa e venosa), portata
cardiaca e test di vasoreattività a vasodilatatori (caduta dei valori di PAPm di almeno 10mmHg.
BNP: prodotto dai ventricoli quando sottoposti a sovraccarichi di volume e pressione. Aumenta
nell’IP perchè il ventricolo destro è sottoposto a sovraccarichi di pressione. I valori plasmatici di
BNP correlano con lo stato funzionale (NYHA e 6MWT), valori pressori e prognosi. Altri esami
sono l’angiografia (TEP), ecografia addome (IP portale), dosaggio anticoripi nelle collagenopatie.
Terapia: prima si riteneva non ci fosse terapia. Si possono usare diuretici (furosemide) per riduerre
il precarico, anticoagulanti per evitare fenomeni di trombosi in situ, calcio antagonisti se il test
acuto di vasodilatazione è positivo (si rischia vadoilatazione sistemica e morte). Farmaci che hano
effetti su mortalità e qualità di vita sono I prostanoidi (epoprostenolo) e altri vasodilatatori
(antagonisti recettore endotelina, adenosina, sildenafil).
Cuore polmonare
Definizione generale: dilatazione o ipertrofia del ventricolo destro in risposta ad aumento del
post-carico (ipertensione polmonare) causata da affezioni del parenchima polmonare, della gabbia
toracica e del controllo respiratorio. Le patologie che possono causare CPC sono vasculopatie
polmonari (ipertensione polmonare primitiva, tromboembolia, arteriti), patologie neuromuscolari
e deformità ossee, malattie polmonari che alterano gli scambi gassosi (malattie parenchimali
ostruttive quali brochite cronica eed enfisema polmonare e restrittive quali deficit neurologici e
muscolari, obesità, ostruzione delle vie aeree, fibrosi). Inoltre ostruzioni, infiammazioni,
compressioni dei vasi polmonari e sindromi da ipoventilazione alveolare cronica. Si definisce
ipertensione polmonare (da lieve in su) un aumento della PAP (pressione arteria polmonare) oltre i
20mmHg. Quest’aumento determinerà modificazioni del ventricolo destro, le quali possono essere
acute o lente a seconda che il sovraccarico di pressione sia rapido (come nell’embolia polmonare,
cuore polmonare acuto) o lento (cuore polmonare cronico). Spesso si usa cuore polmonare come
sinonimo di cuore polmonare cronico. Ipertensione polmonare e cuore polmonare non collimano
sempre in quanto possono esserci condizioni cardiache alla base dell’ipertensione polmonare
(scompenso sinistro, cardiopatie congenite) e anche un’ipertensione non così grave da causare
alterazioni del VD. Non ci può essere cuore polmonare senza ipertensione.
Cuore polmonare cronico
Definizione: CPC, consiste nel 10-20% delle ospedalizzazioni cardiache in età adulta, e il 40% dei
pazienti con BPCO (con VEMS<1L) presenta cuore polmonare.
Patogenesi: la massa muscolare del VD è 1/6 del VS, il VD è più dilatabile e pertanto mantiene
bassa la pressione venosa, ma ha scarso adattamento al sovraccarico pressorio (accorciamento
limitato delle fibre). Da qui la frase: “il ventricolo sinistro è una camera a pressione, il ventricolo
destro è una camera a volume”. Il post-carico del VD dipende dalle resistenze dei vasi polmonari e
dalla compliance delle arterie polmonari (70% del carico per rispondere al carico meccanico delle
geometria ventricolare e alle resistenze vascolari polmonari, il 30% per distendere le arterie
elastiche polmonari). Le patologie che causano ipertensione polmonare possono anche causare
cuore polmonare. . In una prima fase si osserva dilatazione ed ipertrofia del cuore destro con
incapacità del ventricolo di superare il progressivo aumento di post-carico che comporta aumento
della pressione tele diastolica del VD con ipertensione atriale destra, aumento PVC e stasi venosa
sistemica. Inoltre la patologia può aggravarsi con uno scompenso destro con edemi declivi,
epatomegalia e ascite. Con il tempo l’ipertrofia destra disturba anche la funzione del cuore sinistro
(bassa portata ed ipotensione).
Clinica: è una patologia insidiosa con manifestazioni aspecifiche e sintomi spesso coperti o
attribuiti a quelli della patologia polmonare di base. Con il tempo e l’avanzamento verso lo
scompenso destro si ha epatomegalia, ascite, edemi declivi e a volte lieve ittero, inoltre si ha una
ritenzione idro-salina (alterazioni renali) e con il peggioramento dell’ipossiemia e a causa della
bassa portata si possono avere disturbi cerebrali. Si può ascoltare sdoppiamento del II tono
(comparsa III solo se c’è scompenso).
62
Diagnosi: La diagnosi della patologia di base è comunque in genere precedente. Esame obiettivo:
è possibile ascoltare un’accentuazione della componente polmonare del II tono ed in genere uno
sdoppiamento, inoltre sono comuni tachicardia ed un soffio di rigurgito tricuspidale olosistolico
per insufficienza della valvola (oltre ai segni dello scompenso destro se presente). ECG: un’onda P
di maggiore ampiezza e durata è un segno di ipertensione polmonare (dilatazione atrio destro),
inoltre vi sono segni di ipertrofia ventricolare destra. È possibile che si sviluppino aritmie da
blocco della conduzione (fino al BBD completo) ed extrasistole atriali o anche tachicardia
sopraventricolare e fibrillazione atriale. Radiografia del torace: segni di ipertensione sono
dilatazione dei vasi polmonari con aspetto ad “albero potato”. Ecocardiografia trans toracica:
rileva dilatazione dell’atrio e del ventricolo destro oltre a poter stimare la PAP in base alla velocità
di rigurgito tricuspidalico. Cateterismo cardiaco: è raramente richiesto perché invasivo, ma serve a
documentare la pressione in arteria polmonare, atrio sinistro e vene polmonari. Esami di
laboratorio: si può avere poliglobulia, all’emogasanalisi aumento PCO2 e diminuzione PO2.
Prognosi e terapia: la prognosi dipende dalla patologia polmonare di base, ma spesso è grave
(50% di mortalità a cinque anni). La terapia si basa principalmente sulla risoluzione della patologia
respiratoria di base. I pazienti possono trovare giovamento dall’ossigenoterapia (con
PO2<60mmHg), diuretici se c’è ritenzione idrosalina, anticoagulanti per evitare trombo embolie. Se
sfocia nello scompenso è bene usare diuretici, e vasodilatatori usati nella terapia dello scompenso
per ridurre pre e postcarico.
Cuore polmonare acuto ed embolia polmonare
Definizione: CPA, in pratica si tratta di Tromboembolia polmonare. Infatti è una condizione nella
quale vi è una brusca dilatazione del ventricolo destro dovuta ad una grave ed improvvisa
ipertensione polmonare. La causa più frequente è l’embolia polmonare, ma anche altre condizioni
(come atelettasia massiva e pneumotorace), se gravi possono causarlo. L’embolia polmonare, EP, è
un’ostruzione dei vasi polmonari da parte di emboli (materiali estranei, generalmente provenienti
dal sistema venoso profondo). È una condizione di emergenza respiratoria con alto rischio di
mortalità senza terapia giusta (10% a 30 giorni, 25% senza terapia anticoagulante). A volte è
complicato porre diagnosi per mancanza di segni clinici patognomici, pare infatti che più della
metà delle embolie polmonari restino non diagnosticate.
Epidemiologia ed eziologia: ha una frequenza di 70-100/100000 all’anno, nel 75-80% dei casi
l’embolo viene a formarsi a seguito di TVP (trombosi venosa profonda) agli arti inferiori. 1 TVP su
10 si complica con EP. È facilitato da alcuni fattori di rischio quali: trombofilie (fattori primari,
rischio tromboembolico fino a 20 volte superiore) e fattori cumulativi (gravidanza, cateteri venosi
centrali, fumo, obesità, chirurgia, traumi, scompenso, contraccettivi orali, lunghi viaggi).
In sostanza la trombosi venosa profonda ed il distacco dell’embolo sono condizioni quasi sempre
associate. La sede più frequente di embolia polmonare è l’arteria polmonare destra.
Solo il 25% delle TVP è sintomatico prima di dare embolia polmonare.
Fattori scatenanti: può essere sufficiente l’alzarsi al mattino, sforzi fisici di vario genere, aumento
della pressione intraddominale.
Patogenesi: non sempre l’embolia causa cuore polmonare acuto in quanto il polmone ha una
notevole riserva funzionale di vasi e pertanto solo un grosso embolo o tanti piccoli emboli possono
causare il CPA. In effetti le ripercussioni respiratorie e cardiocircolatorie dipendono dalle
dimensioni dell’embolo e dell’area ostruita (oltre che dalle condizioni del paziente) e si
distinguono pertanto embolie massive (più del 50% del letto vascolare polmonare è interessato) e
non massive. Nell’EP massiva si riscontra instabilità emodinamica con una pressione arteriosa
sistemica <90mmHg, instabilità respiratoria con dispnea ingravescente a riposo con ipossiemia
grave. La EP sub massiva è caratterizzata da stabilità emodinamica, ma da segni ecocardiografici
di disfunzione del ventricolo destro (dilatazione del settore destro con sbandamento del setto
interventricolare destro). La ripercussione cardiocircolatoria è l’aspetto più grave dell’EP (anche se
dipende oltre che dal grado di ostruzione anche dalle condizioni antecedenti). EP con più del 55%
di ostruzione comporta: caduta della frazione di eiezione del VD, tachicardia, aumento del
precarico del VD, diminuzione del flusso coronarico con possibile ischemia. Le alterazioni del VD
comportano automaticamente una riduzione del flusso anche al VS con conseguente: diminuzione
della pressione arteriosa, riduzione del volume ventricolare sinistro e della gittata cardiaca. La
riduzione della gittata comporta ipoperfusione sistemica e ipoperfusione dei vari microcircoli
63
(anche cerebrale) che possono causare dolore anginoso (coronarico), vertigine, sincope e anche
shock. L’embolia però si associa solo raramente ad infarto polmonare in quanto la perfusione
dell’organo è garantita dal circolo arterioso bronchiale (a meno che non ci sia una pregressa
cardiopatia sinistra). Questo è ciò che accade a valle dell’ostruzione, mentre a monte, nel cuore
destro si ha progressiva disfunzione ventricolare. Questa è dovuta all’ipertensione polmonare,
quindi aumento del post-carico a cui all’inizio il ventricolo destro risponde dilatandosi, poi (a
causa del minore meccanismo di Starling rispetto al VS) si giunge alla disfunzione ventricolare e
talvolta all’insufficienza tricuspidale che aggravano la stasi venosa. Dal punto di vista respiratorio
si ha ipossiemia a causa della comparsa di un notevole spazio morto funzionale (>>V/P) e di un
conseguente squilibrio (<V/P) dei territori ancora normoperfusi. L’iperventilazione reattiva
comporta anche ipocapnia in quanto la CO2 è eliminata più facilmente poiché ha una diffusione
più rapida. La tachipnea non è in grado però di mantenere un’adeguata ossigenazione. Si riscontra
un alto gradiente alveolo-arterioso e meno CO2 nell’aria ispirata (perché l’aria che entra nello
spazio morto ne esce con la stessa concentrazione di CO2).
Si possono avere atelectasie polmonari a causa della riduzione del surfactante, entro 24 ore.
Clinica: Anche se l’EP è generalmente sintomatica, i sintomi variano con il grado di ostruzione, il
tempo intercorso dall’esordio, malattie cardiorespiratorie concomitanti. Nel 95% dei pazienti sono
presenti dispnea improvvisa (in genere da cause non evidenti) associata a tachipnea e tachicardia.
Dolore toracico trafittivo in genere dorsale che si esacerba con gli atti respiratori, oppressione
precordiale. I sintomi sono prevalentemente respiratori nella non massiva e cardiaci nella massiva
(più di due arterie lobari ostruite). Si può avere esordio con ipotensione, polso accelerato, pallore
, dispnea, sudorazione e , quando il VD è insufficiente, epatomegalia e segni di stasi venosa. Si
può avere un arresto cardiaco associato a emoftoe (addensamenti polmonari) o sincope (sindrome
neurologica), shock circolatorio.
Complicanze: pleurite, versamento pleurico, infarto polmonare con emottisi, insufficienza del
cuore destro, se recidivante cuore polmonare cronico, etc.
Diagnosi: non è quasi mai facile in quanto l’EP non presenta segni e sintomi specifici. Una buona
anamnesi ed un corretto esame del paziente possono indirizzare verso la soluzione (e
contribuiscono nella definizione della probabilità clinica di EP). Il paziente si presenta in genere
con dolore e dispnea e a volte con palpitazioni, tosse, emoftoe, shock, sudorazione, polso
accelerato, etc. Importante verificare la presenza di fattori di rischio quali: TVP, obesità,
allettamento, intervento chirurgico recente, trombofilie. All’ascoltazione si avverte la componente
polmonare del II tono in ritardo (sdoppiamento) e rinforzata, possibile soffio sistolico da
insufficienza tricuspidale. Tra gli strumenti diagnostici si distinguono test di primo livello e
indagini diagnostiche di certezza. Queste ultime non possono essere però adoperate per tutti i
pazienti presentanti i sintomi aspecifici e possono essere adoperate solo in condizioni di forte
sospetto di EP o al termine di un determinato percorso diagnostico.
I test di primo livello sono:
• Dosaggio dei dimeri D della fibrina: test semplice e rapido, che permette di escludere con
buona sicurezza l’EP (alto valore predittivo negativo!!!) anche se ha scarsa specificità
(presente anche in traumi, spesi, polmonite, fibrinolisi, gravidanza). Dosa i prodotti della
recente attivazione di un processo emocoagulativo.
• Troponina e BNP: la troponina (indice di danno miocardico) negativa e il BNP (indice di
stress di parete del ventricolo destro) basso sono indici prognostici positivi, specie se
associati a mancanza di segni di disfunzione ventricolare destra.
• Emogasanalisi: ipossiemia ed ipocapnia. Molto aspecifica e se normale non esclude EP.
• ECG: vi sono alterazioni tipiche solo nel 25% dei casi. Vi può essere Tachicardia sinusale.
Anche sindrome S1Q3T3 ossia con S allargata in D1, Q allargata e T invertita in D3 e inoltre
aspetto di BBD.
• EcocardiocolorDoppler: può apparire del tutto normale, ma l’individuazione di alterazioni
della funzione ventricolare destra hanno significato prognostico negativo. Può individuare
discinesia del ventricolo destro, valutazione della pressione sistolica nella polmonare,
eventuale individuazione del trombo nel cuore destro o nell’arteria polmonare.
• Radiografia del torace: possibili alterazioni come la sopraelevazione dell’emidiaframma, la
dilatazione dell’arteria polmonare discendente dx, trasparenza dei campi polmonari, segni
di infarto polmonare, versamento pleurico unilaterale, ingrandimento cardiaco acuto,
comparsa di amputazioni vascolari.
64
Con questi esami (e magari una valutazione con ecocolordoppler degli arti inferiore per ricercare
segni di TVP) è possibile tentare di definire la probabilità di EP:
Probabilità clinica di EP: Alta: (80-100%) presenza di fattore di rischio e dispnea e/o dolore
toracico non spiegabile da altre cause + alterazioni radiografiche ed emogasanalitiche non
spiegabili da altre cause. Bassa: fattori di rischio assenti e sintomi toracici e alterazioni spiegabili
da altre cause. Intermedia: né alta né bassa.
Indagini diagnostiche di certezza:
• Scintigrafia polmonare di perfusione: alta sensibilità e buona specificità, ma può essere
limitata da condizioni che limitano la visibilità (fibrosi, neoplasie, BPCO). Visualizza zone
con deficit di perfusione e zone (non ostruite) con iperperfusione, eseguita con
microembolizzazione dei capillari polmonari con aggregati di albumina marcata.
• TC-angiografia o RM-angiografia spirale: permette di vedere trombi nelle polmonari sino
alle arterie sub-segmentarie (con m.d.c.). È ormai preferita anche all’angiografia.
• Angiografia polmonare: dovrebbe essere riservata ai pazienti per i quali non è stato
possibile formulare una diagnosi senza. Permette riconoscere presenza e distribuzione
degli emboli. È invasiva e non priva di rischi.
DD: talvolta è difficile la diagnosi differenziale con altre partologie cardiache e respiratorie come
l’IM (ECG tipico, dolore precordiale, biomarker), dissezione aortica (shock), pneumotorace (basta
la radiografia per vederlo), polmoniti, esordi neoplasie, scompenso, affezioni dolorose della parete
toracica. Molto utili nelle diagnosi differenziali i dimeri D e la scintigrafia (no lesioni).
Iter diagnostico: primi passi sono pertanto clinica ed anamnesi.
In seguito si effettua Wells-Score per la previsione di EP: valuta sintomi di TVP recente, frequenza
cardiaca (se alta), immobilizzazione o intervento chirurgico recente, TVP o EP pregressa, etc.
Successivamente Dimero-D e laboratorio, dimostrazione di disfunzione ventricolare destra
all’ecocardiogramma e di ipossiemia, indagini di certezza. Infine dimostrazione TVP arti inferiori.
Prognosi: severa. Il 90% dei pazienti con embolia massiva muoiono entro le prime due ore.
Dipende molto dal livello di gravità. Se emodinamicamente stabile e senza disfunzione (stadio I)
o con (stadio II) la mortalità è modesta. In caso di shock o necessità di rianimazione (stadi III e IV)
è piuttosto elevata. Dipende anche da età, malattie di base, complicanze, tempo di diagnosi.
Terapia: ha due obiettivi: prevenire la recidiva di un’embolia e ridurre la letalità.
• Terapia di emergenza in caso di embolia polmonare acuta: Decubito semiootopnoico e
trasporto in ospedale; Sedazione e trattamento del dolore; Somministrazione di ossigeno
con maschera di Venturi (40-60%) antagonizza la vasocostrizione causata dall’ipossiemia.
In caso di fallimento si può procedere all’intubazione del paziente. Può essere necessaria
rianimazione cardio-polmonare. Ottenere un accesso venoso. Può esserci shock e
sindrome da bassa gittata: in tal caso somministrare inotropi positivi (dobutamina con o
senza dopamina o anche noradrenalina). Liquidi e boli di cristalloidi (inferiori a 500 ml).
• Terapia anticoagulante:
o Paziente emodinamicamente stabile: stadi I e II, si somministra eparina (a basso
peso molecolare come l’Enoxaparina che non richiedono monitoraggio dell’aPTT o
eparina non frazionata) che ha effetto anticoagulante pressoché immediato. In caso
di emorragie la coagulazione è ripristinabile con solfato di protamina. L’eparina è in
genere somministrata fino a raggiungere un PTT di 1,5-2,5. INR tra 2 e3. Per non più
di una settimana e viene in genere incrociata con dicumarolici (non meno di 6 mesi)
La trombo lisi non è sempre indicata a questi stadi.
o Paziente emodinamicamente instabile: Trombolisi: si utilizzano streptochinasi
urochinasi o t-PA. In alternativa è possibile eseguire trombo lisi mediante
cateterismo (ultrasuoni, fibrinolisi locale). Possibile anche embolectomia chiurgica.
Terapia a lungo termine: proseguire con eparina o anticoagulanti orali.
Prevenzione: prevenzione della TVP (mobilizzazione paziente, calze elastiche, etc.) anche con
farmaci come eparina o anticoagulanti orali.
65
Edema polmonare
Definizione: trasudazione massiva di liquido dai capillari polmonari nell’interstizio e alveoli.
Eziologia: l’edema polmonare si verifica quando la quantità di liquidi che dal sangue va ad
interstizio ed alveoli è maggiore di quella che ritorna al sangue o è drenata da linfatici. Lo scambio
di liquidi avviene attraverso la barriera alveolo capillare. I linfatici sono in grado di aumentare la
velocità di drenaggio. Le cause di edema polmonare si distinguono in cardiache e non cardiache:
• Cause cardiache: insufficienza cardiaca sinistra da varie cause (infarto del miocardio,
disfunzione ventricolare, aritimie), stenosi o insufficienza mitralica.
• Cause non cardiache: diminuzione pressione oncotica nel sangue (per esempio se c’è
insufficienza renale), diminuzione pressione alveolare, edema polmonare da alta quota (per
diminuzione della pressione alveolare), toracentesi troppo veloce di un grosso versamento
pleurico, aumento della permeabilità dei capillari polmonari (allergica o tossica), altro
come sepsi, politrauma, pancreatiti, annegamento, reazione a farmaci.
Patogenesi: l’insufficienza respiratoria che si ha nell’edema polmonare è dovuta a: diminuzione
della compliance polmonare e della capacità vitale, aumento delle resistenze nelle vie respiratorie.
Clinica: qualunque sia la causa dell’edema la sequenza dell’accumulo di liquidi è la stessa:
• Stadio I: aumento del movimento di liquidi dai capillari all’interstizio, ma senza aumento
di acqua interstiziale (aumentato drenaggio linfatico): può esserci dispnea da sforzo e
tachipnea. L’emogasanalisi (EGA) può mostrare diminuzione di PO2 e PCO2.
• Stadio II: il passaggio di liquidi eccede la capacità di drenaggio, accumulo di liquidi
nell’interstizio: dispnea per sforzi minimi, rantoli polmonari fini (alle basi poi all’apice).
All’EGa ulteriore riduzione di PO2 e PCO2.
• Stadio III: inondamento alveolare: ai rumori fini si aggiungono sibili espiratori (distinguere
l’asma cardiaco dall’asma bronchiale!). All’EGA PO2 bassa, ma PCO2 normale o alta.
1) Edema polmonare cardiogeno: provocato da un’insufficienza di pompa. Vi è aumento della
pressione di incuneamento polmonare secondario ad aumento della pressione venosa.
Eziologia: Cause meccaniche: sovraccarico di pressione (stenosi aortica, ipertensione),
sovraccarico di volume (insufficienza valvolare, shunts), ostacolo al riempimento ventricolare
(stenosi mitralica o tricuspide), pericardite costrittiva (tamponamento), aneurismi ventricolari.
Cause muscolari miocardiche: miocardiopatie, miocarditi, tossici, ischemia, infiammazione, etc.
Alterazioni di ritmo e conduzione: fibrillazione atriale, tachi-bradicardie, disturbi di conduzione.
Clinica: dispnea ad esordio improvviso, frequenza respiratoria elevata, espettorato schiumoso,
impiego dei muscoli respiratori accessori, dolore toracico, tosse, ansia, pallore, sudorazione fredda,
narici dilatate. Segni: rantoli crepitanti, con sibili diffusi. III e IV tono.
La pressione arteriosa può essere elevata (crisi ipertensiva) o bassa (shock cardiogeno).
Terapia d’urgenza: Decubito ortopnoico (posizione seduta) con gambe pendenti (calo pressione
idrostatica polmonare). Predisporre un accesso venoso. Ossigeno con occhialini nasali +
aspirazione del secreto. Valutare con prelievo venoso: emocromo, elettroliti, creatinine mia, etc.
EGA e SaO2. ECG: anormale, aspecifico. Ecocardiogramma: non necessario in fase acuta.
Radiografia del torace: va effettuata a letto del paziente. Si osserva eventuale cardiomegalia,
sfumatura del disegno vasale, specie in sede ilare. Inoltre strie B di Kerley (orizzontali,
laterobasali su ambo i lati). Il liquido edematoso tende a raccogliersi alle basi polmonari, ma in
alcuni casi agli ili con aspetto a parailare a farfalla.
Terapia: controllo vie aeree, Ossigeno 100% con maschera di Venturi, individuare e corregere le
cause reversibili. Morfina in caso di dolore intenso (diminusce anche il consumo di O2):
• Paziente con pressione arteriosa normale o alta: Diamo vasodilatatori come
Nitroglicerina, Nitroprussiato di sodio. Furosemide. Per di più tecniche di ventilazione
meccanica quali la CPAPP, che ha reso sempre più raro il ricorso all’intubazione tracheale.
• Paziente con pressione arteriosa bassa: Dobutamina. Se <80: Dopamina e Noradrenalina.
2) Edema polmonare non cardiogeno: è conseguente ad aumento della permeabilità alveolocapillare. Distinguiamo: ALI (danno polmonare acuto) e ARDS (sindrome da distress respiratorio
acuto), forma grave di ALI. Le cause sono infezioni, aspirazione di tossici, pancreatiti, reazione a
farmaci, politraumi, etc. Si ha improvvisa dispnea, tachipnea e tachicardia. Ipotensione se sepsi
Terapia: in urgenza le misure generali sono le stesse dell’edema cardiogeno. All’RX torace non
sono presenti le linee di Kerley. All’EGA abbiamo alcalosi respiratoria e ipossiemia, in un secondo
momento acidosi. Si somministra Ossigeno in modo da avere una saturazione >90%.
66
Farmaci antiaritmici:
A) Antiaritmici in senso lato: hanno funzione antiaritmica la digitale (riduce la frequenza
ventricolare per rallentamento della conduzione del nodo AV), parasimpaticolitici (per una
bradicardia), simpatico mimetici (per una bradicardia).
B) Antiaritmici in senso stretto: Classificazione secondo Vaughan Williams:
1. Classe I: antiaritmici bloccanti i canali del sodio: possono avere effetti pro aritmici, specie
in caso di insufficienza cardiaca (la disopiramide anche fibrillazione ventricolare). Sono
controindicati pertanto in caso di insufficienza cardiaca e infarto (specie gli IC).
a. Classe IA: Antiaritmici chinidinici: Chinidina: via di eliminazione epatica. Indicata
per la fibrillazione atriale. Effetti collaterali: gastrointestinali, ematologici, cardiaci
(da evitare in pazienti con patologia cardiaca strutturale). Diminuisce la clearance
della digossina. Ajmalina: TV, in Italia ritirata per i suoi effetti pro aritmici.
b. Classe IB: Antiaritmici lidocainici: Lidocaina: in Italia si usa al posto dell’Ajmalina.
c. Classe IC: Propafenone: eliminazione epatica. Indicata per WPW, tachicardie
sopraventricolari e fibrillazione atriale (sempre senza patologie cardiache
organiche). Sempre azione pro aritmica, gastrointestinali, SNC. Ha anche attività
betabloccante (disturbi respiratori ostruttivi). Fleicainide: = ma no beta-bloccante.
2. Classe II: Antiaritmici betabloccanti: spiazzano le catecolamine dei recettori, diminuendo
la stimolazione simpatica del cuore. Hanno effetto batmotropo, cronotropo, inotropo e
dromo tropo negativo. Migliorano la prognosi di ipertensione, cardiopatia coronarica,
insufficienza cardiaca. Riducono la pressione, effetto antischemico (riducono il consumo
miocardico di ossigeno). I cardioselettivi hanno preferenza per i recettori cardiaci. Alcuni
hanno un’intrinseca attività simpatico mimetica. Abbiamo propranololo (durata 10h),
bisoprololo (durata 24h) e altri (atenololo, metoprololo, carvedilolo che è anche
vasodilatatore, durata media 12-24h). Indicati in: extrasistoli,tachicardie sopraventricolari,
tachicardia da ipertiroidismo. Migliorano la prognosi in pazienti con infarto, si usano in
ipertensione arteriosa, angina, terapia insufficienza cardiaca (associazione con ACE-I).
Controindicazioni: insufficienza cardiaca scompensata, forte bradicardia, forte
ipotensione, malattia del nodo del seno, asma. Con la BPCO basta fare attenzione.
Effetti collaterali: stanchezza, ipotonia (soprattutto all’inizio del trattamento), sensazione
di freddo, vertigini, cefalea, peggioramento insufficienza cardiaca all’inizio, etc. Non
associare con altri antiaritmici tipo calcio-antagonisti (verapamil blocco AV) e non
sospendere in modo brusco (effetto rebound con iperattivazione del simpatico).
3. Classe III: antiaritmici bloccanti i canali del potassio: Amiodarone: meccanismi di azione
delle classi I e IV. Si indica nella fibrillazione atriale fortemente sintomatica. Anche
tachicardie sopraventricolare e ventricolare nei pazienti con insufficienza cardiaca. Può
causare riduzioni visione, fotosensibilità, azione pro aritmica, disfunzioni tiroidee. Da
controllare la funzionalità tiroidea prima della somministrazione. Sotalolo: indicato nella
fibrillazione atriale. Può avere effetti pro aritmici e collaterali simili ai beta-bloccanti.
4. Classe IV: antiaritmici calcio antagonisti: sono di tipo finilalchilaminico (come verapamil
e gallopamil) o di tipo benzotiazepinico (come il diltiazem). Nella fibrillazione atriale per
rallentamento della conduzione AV o nelle tachiaritmie da rientro AV. Possono dare effetti
collaterali a livello GI e del SNC, oltre che cardiaci (bradicardia, ritardi di conduzione, etc.).
Non associare a beta-bloccanti. Il verapamil aumenta la concentrazione di altri farmaci.
5. Adenosina: si dà nella tachicardia con QRS stretto. Blocco di breve durata della
conduzione AV. Effetti collaterali: dispnea, flush, broncospasmo.
Elettroterapia dei disturbi del ritmo cardiaco: distinguiamo tre tipo di interventi terapeutici:
1) Terapia con pacemaker:
A) Pacemaker antibradicardici: si utilizzano 5 lettere per definire il tipo:
• 1° lettera: indica il punto di stimolazione (A= atrio; V= ventricolo; D= duale, entrambi).
• 2° lettera: indica il punto di percezione (A, V, D, stesse lettere).
• 3° lettera: tipo di funzionamento (I= inibizione, T= eccitazione; D= doppio, I+T).
• 4° lettera: adattamento alla frequenza: R= rate modification.
• 5° lettera: stimolazione multifocale. Stesse lettere del punto 1.
Il pacemaker a richiesta entra in funzione quando la frequenza minima è al di sotto di un certo
livello. Programmabilità: è la possibilità di programmare la frequenza dello stimolo e l’energia
67
dell’impulso. Isteresi: ritardo programmato nell’innesco dell’impulso da pacemaker (es:pacemaker
tarato per andare a 70/min si attiva quando la frequenza giunge a 60/min). Distinguiamo quind:
1. Pacemaker mono-ventricolare:
a. VVI (ventricolare): in caso di bradi aritmia con fibrillazione atriale. La
stimolazione non è fisiologica in quanto è direttamente ventricolare con imput
retrogrado all’atrio (sistole atriale non ritmica).
b. AAI (atriale): in caso di disturbi del nodo del seno con conduzione AV intatta.
2. Pacemaker bi-ventricolare: DDD: (sequenziale AV) si usa nei pazienti che possono avere
necessità sia di bypassare la conduzione AV che di stimolare il nodo del seno.
3. Pacemaker che adattano la frequenza: VVI-R o DDD-R, in grado di aumentare la
frequenza di stimolazione in base al carico. Utilizzano un sensore di attività (piezocristallo)
oppure un sensore di volume respiratorio/minuto che è un sensore fisiologico, che ha
l’unico svantaggio di garantire una risposta ritardata.
4. Altre funzioni disponibili: appiattimento delle frequenza (in caso di pause del seno sottosforzo) o mode-switching (cambio automatico di modalità da DDD o DDI).
Indicazione all’impianto di pacemaker: bradicardia sintomatica (sindrome del NSA, sindrome
del seno carotideo), blocco SA o AV grave (AV almeno di II grado).
B) Sistemi antitachicardici:
1. ICD: defribillatotre/cradiovertitore impiantabile, utile nelle tachicardie ventricolari e
fibrillazione ventricolare. In caso di TV tenta una cascata preprogrammata di sovra
stimolazioni. In caso di fibrillazione esegue una defibrillazione interna.
2. WCD: cardiovertitore/debrifrillatore portatile, nei casi in cui l’ICD non è stato ancora
impiantato o di dubbia utilità o sospeso, riduce la mortalità per MCI.
Indicazioni: prevenzione secondaria di MCI, prevenzione di morte cardiaca in pazienti con
scompenso cardiaco e frazione di eiezione bassa o sindromi congenite ad alto rischio (es.QT lungo)
3. Pacemaker antitachicardico/bradicardico: PCD, pacemaker cardiovertitore/defibrillatore
con funzione di cardioversione/defibrillazione, sovrastimolaizione, stimolazione
antibradicardica.
4. TRC: terapia di risincronizzazione cardiaca. Una sonda trans venosa atriale e due sonde
ventricolari vengono collocate nel setto ventricolare destro e attravero il sistema coronarico
venoso nel ventricolo sinistro. Si usa in casi di scompenso cardiaco con bassa frazione di
eiezione, blocco di branca sinistra.
Follow-up: regolari controlli della funzione del pacemaker: il primo entro 3 mes, poi dopo 6-12
mesi. Controllo della risposta dello stimolo, della percezione, carica delle batterie.
2) Cardioversione elettrica e defibrillazione esterna: Indicazione: Assoluta: tachicardie
sopraventricolari o ventricolari con minaccia di shock cardiogeno o fibrillazione ventricolare.
Relativa: mancanza di risposta alla correzione farmacologica della fibrillazione atriale. Vengono
depolarizzate le cellule cardiache contemporaneamente attraverso una scarica di corrente continua
applicata al torace. Si riattiveranno prima le cellule con minore stabilità della membrana a riposo,
ossia le cellule del nodo del seno. Però possono continuare a prevalere foci ectopici.
Scelta dell’energia: Fibrillazione e tachicardia ventricolare polimorfa: Scarica a 200 J, in caso di
insuccesso altre scariche a 360 J. Tachicardia ventricolare monomorfa o fibrillazione atriale: Scarica
a 200 J. Il paziente cosciente viene anestetizzato leggermente per via endovenosa (endomitato), Se
vi è rischio di trombosi bisogna trattare il paziente con anticoagulanti.
3) Elettroablazione (ablazione con catetere = ablazione HF): si tratta dell’eliminazione ad alta
frequenza di tessuto aritmogeno mediante un catetere munito di elettrodi, previa identificazione
tramite mapping intracardiaco. Può essere del nodo AV, delle vie di consuduzione accessorie, etc.
Fibrillazione atriale
Epidemiologia: è la più frequente tachiaritmia sopraventricolare. L’incidenza aumenta con l’età,
fino a raggiungere il 6-7% negli anziani.
Eziologia: può essere primaria (idiopatica, 15% dei casi) o secondaria. Le cause di fibrillazione
atriale secondaria possono essere cardiache: alterazioni mitraliche, malattia coronarica/infarto,
insufficienza cardiaca (>50% in pazienti con NYHA IV), cardiomiopatie, interventi al cuore,
sindrome del nodo del seno. Cause extracardiache sono: ipertensione arteriosa, embolia
polmonare, ipertiroidismo, intossicazione da alcol o farmaci, obesità. In particolare è importante
l’associazione con scompenso cardiaco cronico: le elevate pressioni di riempimento ventricolare si
ripercuotono dando elevate pressioni atriali e fenomeni di stretch della parete atriale che possono
essere uno stimolo elettrico per l’insorgenza di fibrillazione atriale.
68
La fibrillazione atriale aumenta la mortalità nello scompenso cardiaco sia per il peggioramento
della condizione emodinamica sia per possibili fenomeni embolici.
Patogenesi: i circuiti di rientro causano una frequenza atriale di circa 350-600 bpm, che non
corrisponde sempre a una contrazione atriale. Il NAV limita la conduzione al ventricolo che però
avrà tempi di diastole e di sistole irregolari con gittata cardiaca variabile.
Pare che in caso di FA vi sia spesso perdita di massa muscolare atriale e fibrosi atriale. In ogni
caso la fibrillazione causa dilatazione atriale. Vi è una teoria che la causa della FA in un’origine
focale, ed una che la vede in multiple onde caotiche che si distribuiscono all’atrio. Le teorie
potrebbero coesistere (nei pazienti giovani pare essere più comune l’origine focale).
Decorso: Episodio unico: sintomatico o asintomatico. FA ricorrente: 2 o + episodi di durata >30sec
Fibrillazione atriale parossistica: FA ricorrente che termina spontaneamente in genere entro le
48h (anche 7 giorni). Fibrillazione atriale persistente: termina in solo in risposta alla terapia
farmacologica o elettrica. Fibrillazione atriale permanente: di lunga durata e in cui i tentativi di
cardioversione non hanno dato risultati.
ECG tipico: il NAV fa sì che la frequenza ventricolari non superi generalmente i 100-150 bpm. VI è
assenza di onde P, intervalli RR irregolari, frequenza ventricolare molto variabile. Il fondo del
tracciato può essere piatto o con piccole onde F di fibrillazione irregolari. Possiamo avere:
• FA ad elevata risposta ventricolare: più nei giovani, senza problemi di conduzione.
• FA a bassa risposta ventricolare: tipica del paziente anziano con turbe di conduzione.
Clinica: spesso è del tutto asintomatica. Specialmente nella forma parossistica possono comparire
palpitazioni, astenia, dispnea, affaticabilità, agitazione, manifestazioni ischemiche cerebrali. Anche
polso irregolare e ridotto, possibile poliuria, vertigine e sincope. L’EHRA score distingue: EHRA I:
no sintomi; II: pochi sintomi; III: influisce sull’attività quotidiana. IV: sintomi disabilitanti.
Complicanze: la principale complicanza è la formazione di trombi atriali con pericolo di embolia
arteriosa, specialmente embolie cerebrali (20% di tutti gli ictus). Il rischio diviene più alto
soprattutto in caso di FA cronica. Fattori di rischio trombo embolico: età >75 anni, pregresso ictus
o TIA, insufficienza cardiaca, sostituzione valvole cardiache, stenosi mitralica, ipertensione e
diabete, riscontro di dilatazione e trombi atriali tramite ecocardiogramma trans esofageo.
Classificazione del rischio CHADS: C: insufficienza Cardiaca H: Hipertension A: Age >75 D:
Diabete S: Stroke (ictus).
Diagnosi: Anamnesi (ritmo cardiaco percepito, frequenza episodi, durata episodi, anamnesi
patologica, abuso di alcol, familiarità).
Terapia:
1) Paziente emodinamicamente instabile: cioè con pressione arteriosa in calo, segni di shock,
scompenso cardiaco acuto, angina: si provvede alla eparinizzazione (eparina sodica ev) del
paziente e successiva cardioversione elettrica (da 100 a 360 J).
2) Paziente emodinamicamente stabile: in questo caso vi sono due strategie terapeutiche
praticamente equivalenti dal punto di vista prognostico:
• Rate control: controllo della frequenza e prevenzione tromboembolismo. Si preferisce in
pazienti anziani o nei lievemente sintomatico. Si utilizzano beta-bloccanti (Esmololo), ma
anche digossina (si preferiscono i beta bloccanti) o calcio-antagonisti (Diltiazem e
Verapamil, non somministrare mai quest’ultimo con beta-bloccanti).
• Rhythm control: ristabilimento del ritmo sinusale e prevenzione delle recidive
(mantenimento). Si preferisce in giovani o fortemente sintomatici. Si punta a ristabilire il
ritmo sinusale tramite cardioversione. Questa può essere farmacologica: (in pazienti con
insufficienza cardiaca si preferisce amiodarone, in quelli senza propafenone) (in pazienti
con fibrillazione parossistica si può usare l’approccio pill in the pocket in cui il paziente
stesso in presenza di sintomi usa amiodarone ad esempio). La cardioversione può anche
essere elettrica (200J). Se la fibrillazione atriale dura da più di 48 ore al momento di
effettuare la cardioversione si somministrano anticoagulanti per almeno 4 settimane.
Prevenzione tromboembolismo: il gold standard è il Warfarin. L’utilizzo della sola ASA può
essere fatto nei pazienti senza fattori di rischio (con sistema CHADS), altrimenti meglio i
dicumarolici. Questi richiedono però controllo dell’INR ogni due settimane, in quanto deve essere
compreso tra 2 e 3 (rischio emorragico).
Prevenzione recidive: può essere somministrato amiodarone, in quanto le recidive di fibrillazione
atriale dopo cardioversione sono di circa del 75% entro l’anno.
69
Ictus: è una sindrome polieziologica con deficit focale neurologico a esordio improvviso di origine
vascolare. La causa può essere ischemica (80%) o un’emorragia spontanea intracerebrale (in caso
di ipertensione severa o in pazienti che assumono anticoagulanti). L’ischemia può avere origine da
arterie cerebrali extra-craniche, in genere la carotide interna (soprattutto a livello della
biforcazione carotidea) oppure da arterie cerebrali intracraniche (circolo di Willis e ramificazioni).
Epidemiologia: molto più comune in età avanzata, è frequente causa di mortalità e disabilità.
Eziologia dell’infarto ischemico: la causa di gran lunga più comune è l’aterosclerosi (70%), in
particolar modo della carotide interna. L’ipertensione arteriosa è infatti il principale fattore di
rischio (il 75% di tutti i pazienti con ictus è iperteso). Un’altra causa può essere un’embolia
arteriosa di origine cardiaca o aterosclerotica da arterie periferiche.
Patogenesi: stenosi di piccole arterie cerebrali possono causare infarti lacunari o encefalopatia
subcorticale arteriosclerotica (in genere disturbi lievi e reversibili). La stenosi della carotide
interna è la prima causa. Stenosi con restringimento del lume minore del 75% sono in genere
asintomatiche. In ogni caso la gravità del danno dipende molto dalla presenza di anastomosi e
dall’estensione e sede dell’area cerebrale colpita dall’ischemia.
Clinica: si distinguono quattro stadi di patologia occlusiva della carotide interna:
1. Stadio I: stenosi asintomatica (se <75% generalmente lo è).
2. Stadio II: TIA: attacco ischemico transitorio. Disturbi visivi, debolezza agli arti e disturbi
della parola che regrediscono in genere in 10 minuti o comunque entro 24 ore.
3. Stadio III: RIND: deficit neurologico ischemico reversibile: la regressione del deficit
neurologico richiede un periodo >24 ore.
4. Stadio IV: infarto cerebrale completo: regressione parziale o assente del deficit
neurologico. Disturbi della coscienza, emiparesi, disturbi della parola e sensoriali.
In caso di occlusione della carotide interna: dipende molto dalle anastomosi, si ha emiparesi
sensitivo-motoria contro laterale, amaurosis fugax, possibili disturbi di coscienza e del
linguaggio, eventuale deviazione della testa dal lato colpito.
In caso di occlusione di tipo vertebro-basilare: vertigine, nistagmo, vomito, disturbi vista.
In caso di emorragia sub aracnoidea: rigidità nucale (!!!), possibile paralisi dei nervi cranici, se
grave anche disturbi della coscienza, emiparesi, fino al coma profondo.
Diagnosi: prima di tutto anamnesi e clinica tipiche. Si valutano paresi facciale, paresi brachiale,
disturbi del linguaggio. Poi anche disturbi visivi (riduzione campo visivo), paresi dela gamba,
emipoestesia.
Poi diagnostica per immagini: TC cranio (spesso negativa prima di 12 ore) che differenzia la causa
ischemica (ipodensità) da quella emorragica (iperdensità). L’RMN da risultati più precocemente e
distingue il tessuto ischemico da quello perinfartuale. Si esegue anche cografia dei tronchi
sovraortici, diagnostica cardiaca (ECG per valutare fibrillazione atriale, ecocardio, etc.).
Terapia: si ricovera il paziente in una Stroke unit.
Misure generali (controllo funzioni vitali, ossigeno, inizio precoce di trattamento con
antiaggregante piastrinico come ASA, ma solo dopo conferma che non si tratta di un evento
emorragico). La pressione viene mantenuta a livelli un po’ più alti della norma.
Successivamente Rivascolarizzazione: la terapia trombo litica con alteplase ev. è valida solo entro
3 ore dai sintomi.
Riabilitazione: terapia riabilitativa del paziente.
Prognosi: l’80% sopravvive, ma 2/3 hanno importanti lesioni permanenti. 20% recidiva.
Prevenzione: utilizzo di antiaggreganti piastrinici (ASA o clopidogrel) dopo evento CV (TIA,
infarto). Se si individua una stenosi asintomatica >80% della carotide interna o sintomatica >50% si
può effettuare PTA (angioplastica transluminale percutanea, meno invasiva) della carotide o TEA
(chirurgica, gold standard, tromboendoarterectomia e angioplastica).
70
Sincope: per sincope si intende un’improvvisa perdita di coscienza accompagnata da caduta e
seguita da un rapido, completo e spontaneo recupero. Dura da 15 secondi a 2-3 minuti. La presincope o lipotimia indica la sensazione di imminente perdita di coscienza, senza che si realizzi. Il
meccanismo patogenetico è lo stesso, nella maggior parte dei casi una caduta della pressione
arteriosa sistemica, ma vi sono pure altre cause. Le frequenza e le conseguenze di sincope negli
anziani sono molto maggiori (fratture, etc.) oltre alla successiva paura di cadere.
Epidemiologia: frequente, 11/1000 all’anno nei soggetti tra 70-80, aumenta con l’età.
Fattori di rischio: con l’età si riduce l’efficacia dei meccanismi di controllo e compenso della
pressione arteriosa sistemica e della perfusione cerebrale:
• Diminuita efficienza barocettiva: baro riflesso alterato
• Predisposizione all’ipotensione ortostatica (ridotto adattamento della frequenza, etc.)
• Predisposizione all’ipotensione per ipovolemia (diminuita azione sistema RAA, sete, etc.)
• Ridotta efficienza auto regolativa del flusso cerebrale (da arteriolosclerosi, etc.).
Il baro riflesso alterato è il fattore più importante. Normalmente nel passaggio dal clino
all’ortostatismo vi è una diminuzione di pressione cui fa seguito un aumento della frequenza
cardiaca. Nell’anziano la sensibilità dei barocettori è diminuita così come la capacità del cuore di
aumentare la frequenza. Se non si alza lentamente può avere sincope.
Altri fattori: disabilità, comorbilità, polifarmacoterapia (maggiore rischio di effetti collaterali).
Il rischio di sincope aumenta quasi proporzionalmente al numero di farmaci assunti. Tra i farmaci i
più rischiosi sono ACE-inibitori e sartani, diuretici, vasodilatatori, antiaritmici associati a
torsione di punta, digossina, beta-bloccanti, alfa-litici, infine benzodiazepine e altri psicoattivi.
Eziologia e classificazione: distinguiamo:
1. Sincope di origine cardiaca: 14% dei casi, dovuti ad una cardiopatia come stenosi aortica.
Nell’anziano è due volte più frequente che nella popolazione generale. È la forma correlata alla
più alta mortalità. Può essere secondaria a:
• Malattia strutturale cardiaca o cardiopolmonare: stenosi aortica, altre valvulopatie, infarto
del miocardio (qualora non muoia), cardiomiopatia ostruttiva.
• Aritmie: sindrome del nodo del seno, BAV, tachicardie parossistiche sopraventricolari e
ventricolari, malfunzionamento del pacemaker, farmaci.
Le cause più comuni sono malattia del nodo del seno, tachicardia ventricolare, mentre il 20% di
tutti i casi di sincope è dovuto ad aritmia, per questo ECG e Holter sono spesso diagnostici.
2. Sincope di origine non cardiaca: 66% neuro mediata (rientra l’ipotensione ortostatica).
Gruppo molto eterogeneo, di cui la causa più comune è l’ipotensione ortostatica, poi anche
l’ipersensibilità del seno carotideo e l’alterata risposta neuro-mediata vaso-vagale:
• Neuro-mediata: Vaso-Vagale, ipersensibilità del nodo del seno, situazionale (tosse,
emorragia, post-minzionale, post-esercizio fisico, post-prandiale etc.).
• Da ipotensione ortostatica: L’ipotensione ortostatica è definita come la caduta di almeno 20
mmHg della pressione sistolica nel passaggio dal clino all’ortostatismo. La sua frequenza
aumenta con l’età. Nei soggetti con sistolica alta è più frequente. Nel passaggio in piedi
500-800 ml di sangue vengono dislocati alle estremità inferiori e a livello splancnico. Questo
causa un decremento del ritorno venoso a livello centrale con una riduzione della portata
cardiaca e quindi una stimolazione dei barocettori che di riflesso aumentano il tono
simpatico e le resistenza vascolari aumentando la frequenza cardiaca. Negli anziani vi è:
deterioramento della regolazione della pressione, possibili patologie che alterino
l’efficienza del sistema autonomo, frequente polifarmacoterapia che può accentuare la
disfunzione. I farmaci, le patologie cardiovascolari e neurogeniche possono accentuare
l’effetto di queste disfunzioni (stenosi aortica, insufficienza cardiaca, aritmie, insufficienza
adreno-surrenalica, alcool, disidratazioni, nefropatie, atrofie cerebrali, diabete, neuropatie).
• Da causa cerebrovascolare: sintromi da furto vascolare.
3. Sincope di origine ignota o indeterminata: più del 20%, spesso multifattoriale.
Pseudosincope: non rientra nella classificazione. È una perdita di coscienza che dura più tempo di
15 min (per lo più associata ad ictus o epilessia). La sincope vera dura molto meno.
Clinica: spesso la sincope può essere preceduta da sintomi premonitori (presincope) quali:
nausea, sudorazione, debolezza e turbe della visione. Differenze tra diversi tipi di sincope:
• Neuromediata: no malattia cardiaca, dopo suoni o odori spiacevoli o dolore, può essere
associata a stazione eretta, sforzo, pasti, compressione del collo.
• Da ipotensione ortostatica: caduta della pressione in ortostatismo >20mmHg o pressione
inferiore a 90<mmHg, Dopo stazione eretta o farmaci ipotensivi o sforzo.
71
•
•
Cardiaca: patologia cardiaca, anche posizione supina, dolore toracico, familiarità.
Cerebrovascolare: associata ad esercizi con le braccia, differenza tra polsi delle due braccia.
Diagnosi: prima di tutto valutazione iniziale del paziente con perdita transitoria di coscienza:
1. Distinzione tra sincope vera o pseudo-sincope:
a. Sincope: effettuare la diagnosi eziologica.
b. Pseudo-sincope: confermare con test specifici o valutazione specialistica.
2. Diagnosi eziologica: possiamo trovarci di fronte a:
a. Diagnosi eziologica certa: cominciare il trattamento.
b. Diagnosi incerta: effettuare una preliminare stratificazione del rischio.
3. Stratificazione del rischio: distinguere il paziente in:
a. Alto rischio: sono pazienti con rischio di eventi gravi a breve termine. Serve una
valutazione precoce e trattamento.
b. Basso rischio con sincope ricorrente: si effettuano test per la diagnosi di sincope
cardiaca o neuro-mediata poi trattamento in relazione alla positività ECG.
c. Basso rischio con sincope isolata: non serve ulteriore valutazione.
In generale i pazienti a basso rischio gestiti in modo adeguato non necessitano ricovero, quelli ad
alto rischio devono essere ospedalizzati. Si definisce ad alto rischio un paziente con: grave
patologia arteriosa strutturale o alle coronarie, dati clinici o ECG che suggeriscono una sincope
dovuta ad aritmia, comorbidità importanti (anemia severa, disturbi elettrolitici).
La sincope che si sviluppa dopo esercizio fisico è in genere benigna, mentre quella che si sviluppa
durante l’esercizio fisico ha una prognosi generalmente peggiore e sarebbe da indagare.
Oggi esistono le OBI, strutture di osservazione a breve intensità nelle quali i pazienti che accedono
al pronto soccorso sono tenuti 48h sotto osservazione e si indaga sulle possibili cause.
Algoritmo diagnostico: si deve giungere alla diagnosi definitiva e quindi al trattamento. Inizia con
1. Anamnesi, esame obiettivo, ECG, pressione arteriosa in clino e ortostatismo:
a. Diagnosi definitiva e quindi trattamento oppure sospetto diagnostico.
2. Sospetto diagnostico: le cause possono essere:
a. Cardiache:
• Aritmie: Si esegue: massaggio carotideo e ECG 24h SEF Tilt table-test
• Bassa portata: Si esegue: ECG, Prova da sforzo, TAC polmone, Coronarografia
Massaggio carotideo e Tilt table-test.
b. Neurologiche: possibile pseudo sincope. Se esegue: Doppler carotideo, EEG, TAC
craneale Massaggio carotideo e Tilt table-test.
c. Neuromediate: Si esegue: Massaggio carotideo e Tilt table-test, Holter pressorio
24h Prova da sforzo e ECG 24h.
3. Se tutti i test risultano negativi: Valutazione psichiatrica o Loop recorder (registrazione
del ritmo cardiaco registrata per 6 mesi con dispositivo impiantabile sottocute).
Anamnesi: deve riguardare le circostanze precedenti l’attacco (posizione, attività in corso, fattori
predisponenti), modalità d’esordio (eventuali sintomi precursori), decorso (caduta, durata,
coscienza o meno, respiro, morsicatura della lingua). Importante l’anamnesi patologica e familiare.
Valutazione dei prodromi: ci permettono una distinzione preliminare tra sincope cardiaca e non
cardiaca. I prodromi della cardiaca sono soprattutto: dispnea. Della non cardiaca: nausea, vomito
e visione offuscata. Predittivi di sincope cardiogena sono: palpitazioni pre-sincope, cardiopatia o
ECG patologico, sincope durante lo sforzo, da supino, etc.
Esame obiettivo: valutare colorito, idratazione, temperatura, pressione arteriosa in clino e
ortostatismo, auscultazione cardiaca, segni di traumi, tono muscolare ed eventuali deficit
neurologici focali, morsicatura della lingua.
ECG: possono essere rilevanti aritmie, disturbi di confuzione, QT lungo, bradicardia sinusale o
blocco seno atriale, ipertrofia ventricolare, onde Q di infarto, sindrome di Brugada, onde epsilon.
Sospetto di sincope cardiaca: è importante l’indagine strumentale. La principale è il Tilt table test.
La TC in pronto soccorso è più utile per individuare eventuali danni da caduta.
1) Tilt-table test: diagnostico nel 66% dei casi. Per potenziare il tilt test si può somministrare
nitroglicerina per ridurre ancora il pre-carico. Si è notato infatti che spesso, come nella sincope
vaso-vagale, è la minore efficacia del simpatico e quindi la forte vasodilatazione il primo fattore.
Pertanto la nitroglicerina potenzia la reazione vagale. Il tilt test è infatti soprattutto diagnostico in
72
caso di causa cardiaca (sincope vaso-vagale, azione di farmaci, ipotensione ortostatica). Il paziente
è posto su supino su di un lettino inclinabile verso l’ortostatismo (in genere 60°). Si esegue
minotoraggio ECGgrafico continuo durante il test. Interpretazione: Classificazione di VASIS:
• Vasis tipo I: Risposta mista: al momento della sincope vi è riduzione della frequenza
cardiaca (che si mantiene superiore a 40 bpm o inferiore per meno di 10 secondi).
Riduzione della pressione arteriosa prima del calo della frequenza cardiaca.
• Vasis tipo IIA: Risposta cardioinibitoria senza asistolia: al momento della sincope vi è
riduzione della frequenza cardiaca anche al di sotto di 40 bpm, ma senza asistolia (o per
<3 secondi). Riduzione della pressione arteriosa prima del calo della frequenza cardiaca.
• Vasis tipo IIB: Risposta cardioinibitoria con asistolia: al momento della sincope vi è una
asistolia > 3sec. Riduzione della pressione arteriosa prima o insieme alla frequenza.
• Vasis tipo III: Risposta vaso depressiva pura: la frequenza cardiaca sale dall’inizio del
test e non scende mai più del 10%. La PA cala fino a causare sincope.
Il VASIS IIb indicherebbe l’utilizzo di un pacemaker (al loop recorder noteremo una genesi
aritmica della sincope) anche se questo non previene l’effetto della vasodilatazione e quindi
ulteriori possibili sincopi.
2) Massaggio carotideo: si massaggia con 3 dita per almeno 10 secondi la carotide del apziente
nella sede di massima pulsatilità. Il tutto si esegue in clino e orto statismo, a destra e a sinistra,
prima e dopo la somministrazione di atropina e con monitoraggio ECGgrafico continuo.
Interpretazione: Ipersensibilità seno-carotideo: caduta della pressione sistolica >50 mmHg
oppure asistolia > 3sec a seguito del massaggio.
Sindrome del seno carotideo: riproduzione della sincope in presenza di ipersensibilità.
Terapia: In ogni caso in un paziente con sincope attivare la sequenza (valutazione coscienza poi
ABC) del BLS. Successivamente iniziare le valutazioni diagnostiche.
Eziologia nota: in generale nelle cause non cardiache possono essere utili: Presidi dietetici:
aumentare l’introito di liquidi e sali. Presidi comportamentali: evitare luoghi caldi e affollati,
prolungata stazione eretta, uso di calze elastiche, manovre di contro-pressione, tilt training.
• Sincope neuro mediata: mantenere il paziente disteso con le gambe sollevate per favorire il
ritorno venoso verso il cuore. Se vi è bradicardia dare atropina. Se vi è ipotensione
persistente somministrare idrocortisone + soluzioni saline o plasma expanders. Evitare gli
alcolici, rassicurare il paziente. Ricovero per valutare l’uso di un pacemaker.
• Sincope seno-carotidea: evitare colletti stretti. Eventuale pacemaker.
• Sincope ortostatica: controllare terapie farmaceutiche con ACEI, sartani, diuretici,
vasodilatatori, alfa-litici, sostanze psicoattive, benzodiazepine, ganglioplegici, etc. Questi
risultano essere la causa principale.
• Sincope cardiaca: in questo caso è necessario il ricovero e il trattamento della patologia
cardiaca specifica. In caso di sincope aritmica: Bradicardia sinusale: pacemaker con
stimolazione atriale o bicamerale. Blocco AV di II grado avanzato o III grado: pacemaker.
Tachicardia sopraventricolare: ablazione trans catetere. Tachicardie ventricolari: impianto
di defibrillatore automatico.
Impianto di un defibrillatore: possono giovarne pazienti con sincope associata a tachicardie
ventricolari, cardiopatia ischemica pregressa, ridotta funzine sistolica del ventricolo sinistro,
sindrome del QT lungo o cardiomiopatia aritmogena del ventricolo destro o sindrome di Brugada.
73
Aritmie
Classificazione dei disturbi del ritmo:
1. Disturbi di formazione dello stimolo:
a. Origine nel nodo del seno: aritmia sinusale, bradicardia e tachicardia sinusale.
b. Origine da foci ectopici: i foci posson essere ventricolari o sopraventricolari:
• Ectopia passiva: interventi sostituitivi in caso di malfunzionamento del nodo
del seno: sistoli o ritmi sostitutivi, sindrome del pacemaker migrante.
• Ectopia attiva: extrasistoli, extraritmie (foco ectopico più veloce del ritmo
sinusale): come ritmo giunzionale accelerato e idioventricolare accelerato.
2. Disturbi di conduzione dello stimolo: Blocco senoatriale (SA), blocco atrioventricolare
(BAV); blocchi di branca.
3. Forme speciali: sindrome del nodo del seno e ipersensibilità seno carotideo.
4. Tachicardie: tachicardia del nodo AV da rientro, tachicardia AV da rientro (tipo WPW).,
tachicardia focale atriale, tachicardia giunzionale ectopicoa, tachicardia atriale da rientro,
flutter e fibrillazione atriale, tachicardia ventricolare, flutter e fibrillazione ventricolare.
5. Morte cardiaca improvvisa: MCI, arresto cardio-circolatorio.
1) Disturbi di formazione dello stimolo:
a) Origine nel nodo del seno:
• Aritmia sinusale: Respiratoria: fisiologico aumento della frequenza durante l’ispirazione e
riduzione nell’espirazione. Non respiratoria: espressione di un danno al nodo del seno.
• Bradicardia sinusale: riduzione della frequenza di scarica del nodo del seno inferiore a 60
bpm. È una aritmia che può manifestarsi in seguito a ipotiroidismo, iperstimolazione
vagale che può aversi in malattie sistemiche, ma anche durante il vomito. La cardiopatia
ischemia e la sindrome del nodo del seno possono rallentare la frequenza così come farmaci
come digitale, beta-bloccanti ed amiodarone. La frequenza in genere non scende sotto i 40
bpm e la sequenza P-QRS è conservata. È fisiologica in giovani sani, spesso se atleticamente
allenati (per iperstimolazione vagale, ad esempio durante il sonno), ed è difficile
distinguerla da una patologica. Gli anziani possono avere sintomi anche sopra i 40 bpm.
• Tachicardia sinusale: aumento della frequenza degli impulsi, a partire dal NSA, con
aumento della frequenza oltre i 100 bpm. Spesso è una risposta ad uno stimolo fisiologico,
come l’esercizio fisico, ma è soprattutto comune in soggetti ansiosi. È possibile anche in
caso di febbre, anemia o ipotensione, tireotossicosi, nelle intossicazioni da caffè o
tabacco, digestione, uso di farmaci come l’atropina (blocco parasimpatico), amine
simpatico-mimetiche. Raro che superi i 150 bpm (il limite critico dovrebbe essere 220-età).
Se è associata a cardiopatia organica e si manifesta in condizioni di riposo indica
insufficienza cardiaca. L’onda P è normale, perché c’è in genere normale attività atriale e
normale conduzione. Può essere comune nelle donne giovani, spesso ansiose, con prolasso
della valvola mitrale e cosiddetta sindrome da iperbetastimolazione adrenergica con
aumento della frequenza in ortostatismo. Si ha un’ottima risposta ai beta-bloccanti. La
sequenza P-QRS è conservata e raramente supera i 130 bpm. La terapia è in genere evitare
sostanze eccitanti, correggere eventuale patologia di base (tipo ipertiroidismo), fare uso di
beta-bloccanti solo in caso di pericolo come con un paziente che con cardiopatia ischemica.
Terapia: trattamento fattori scatenanti, atropina (bradicardia sinusale), betabloccanti (tachicardia)
b) Origine da foci ectopici: i foci attivi possono causare extrasistoli o veri e propri ritmi:
• Foci ectopici passivi: quando il NSA scarica ad una frequenza troppo bassa o in presenza
di disturbi della conduzione come BAV, si verifica una sostituzione da parte di altri foci
ectopici del segnapassi fisiologico. Si può avere solo una sistole sostitutiva (un solo
impulso) o l’entrata di un ritmo sostitutivo. Il pacemaker sostitutivo può essere a livello
atriale inferiore o del nodo AV (ritmo 50 bpm circa) oppure ventricolare (bradicardia di 2030 bpm, critica). Pacemaker migrante: variazione transitoria tra ritmo sinusale e più di un
focus ectopico secondario (per abbassamento temporaneo frequenza NSA). No terapia.
• Ritmogiunzionale e idioventricolare accelerato: i foci ectopici si attivano ad un ritmo
maggiore di 100 bpm, sovrastando il pacemaker fisiologico del NSA. Avviene in caso di
infarto recente, intossicazione da digitale, raramente in bambini con cuore sano.
Extrasistoli: sono molto frequenti anche in soggetti sani, possono essere avvertite
soggettivamente come un battito saltato. Fattori scatenanti possono essere in soggetti sani:
74
labilità neurovegetativa, stress emotivo, ipertono vagale, alcool, caffeina, nicotina. Possono
essere causate da molte patologie cardiache, ipopotassemia, farmaci, ipertiroidismo, etc.
• Extrasistoli sopraventricolari: sono definite le extrasistoli atriali e giunzionali.
Extrasistole atriale: può provenire da un qualsiasi punto degli atri e depolarizzare il tessuto
circostante. All’ECG è rilevata come un’onda P’ che indica una depolarizzazione atriale “fuori
tempo”. La depolarizzazione prodotta da un focolaio ectopico, diverso dal NSA, può essere
condotta o non condotta attraverso il NAV e quindi provocare o meno la comparsa di un
complesso QRS. Inoltre potrebbe anche non essere in grado di condurre bene per tutto l’apparato
di conduzione ventricolare e dare in questo modo un complesso QRS leggermente allargato, si ha
cioè un’extrasistole con conduzione ventricolare aberrante. Ad ogni modo, la depolarizzazione è
in grado di depolarizzare anche il NSA il quale si risincronizza in base al tempo in cui è avvenuta
l’extrasistole. La sua attività di pacemaker riparte in sincronia con il battito prematuro. L’intervallo
tra la sistole normale e l’extrasistole è definito copula, quello tra l’extrasistole e la successiva sistole
è la pausa. Questa pausa può essere compensatoria o non compensatoria. Nell’extrasistole
sopraventricolare è dovuta alla risincronizzazione del NSA, nell’extrasistole ventricolare è in
genere dovuta al fatto che il ventricolo che è stato attivato dall’extrasistole non è in grado di
rispondere subito alla stimolazione normale che segue. Le onde P’ nelle extrasistoli atriali hanno
forma diversa da quelle del NSA perché provengono da parti diverse degli atri. A volte, se
provengono dal basso (così come vale per le extrasistoli giunzionali) possono dare una
conduzione retrograda all’interno dell’atrio e pertanto dare un’onda P’ invertita (depolarizzazione
atriale dal basso all’alto).
Extrasistole giunzionale: è molto più facile che ci sia conduzione retrograda ed anche che ci sia
conduzione ventricolare aberrante, a causa della posizione più bassa del focolaio ectopico. Le
extrasistoli sopraventricolari possono presentarsi anche con uno schema che si ripete, alternandosi
con il ritmo sinusale. Il ciclo che contiene l’extrasistole assieme al ciclo a cui si associa viene detto
distico. In pratica quando un’extrasistole si associa alla fine di ciascun ciclo abbiamo bigeminismo
atriale, rapporto 1:2. Ogni tre cicli = trigeminismo atriale, etc. Clinica: quando tendono a
presentarsi in maniera sporadica le extrasistoli sopraventricolari hanno un significato benigno e
sono comuni nei soggetti sano. Se molteplici possono rischiare di causare aritmie sopraventricolari
come la fibrillazione atriale o la tachicardia sopraventricolare parossistica.
Terapia: extrasistoli sporadiche in giovani sani non richiedono terapia. Se insorgono in sindromi
da stimolazione adrenergica o in ipertiroidismo traggono notevole beneficio da beta-bloccanti.
In generale in soggetti sani le extrasistoli sopraventricolari non richiedono terapia. La richiedono
se causano tachicardia sopraventricolare parossistica o fibrillazione atriale.
• Extrasistoli ventricolari: o complessi prematuri ventricolari (PVC). Sono battiti ectopici a
provenienza ventricolare, contrazioni ventricolari premature. Sull’ECG appaiono come
complessi QRS di ampio voltaggio non preceduti da un’onda P, se provengono da destra
sono simili al BBS (negativi in V1), se provengono da sinistra sono simili al BBD (positivi in
V1). Sono più ampi dei QRS normali perché la conduzione è disordinata. Due CPV
successivi sono definiti paia o coppie. Si parla di tachicardia ventricolare quando ci sono
almeno tre CPV successivi ad una frequenza >100 bpm (se si fermano spontaneamente è
TV non sostenuta). In generale si distinguono quindi in ESV semplice (monomorfa o
polimorfa) ed ESV complessa (bigeminismo, trigeminismo, ESV precoci R/T).
Fenomeno R/T: se le ESV sono molto precoci vi è il pericolo che cadano sulla fase vulnerabile
dell’onda T causando una fibrillazione ventricolare. Si calcola l’IA, indice di anticipazione.
L’intervallo tra un battito ectopico e il battito normale è la pausa extrasistolica che comunemente è
compensatoria (anche se non compensa nulla) perché la somma della copula più la pausa è uguale
a 2 R-R normali. La pausa compensatoria è dovuta al fatto che normalmente il CPV non raggiunge
il NSA e non è in grado di farlo risincronizzare alla sua frequenza come fa un’extrasistole
sopraventricolare [in cui allora la pausa è soprattutto non compensatoria] pertanto il NSA genera
un impulso che viene condotto attraverso il NAV e raggiunge i ventricoli quando non sono ancora
in grado di rispondere, e pertanto il ritmo sinusale riparte dopo il secondo impulso del NSA (per
cui pausa + copula= 2 battiti). Se il CPV è in grado di risincronizzare l’NSA allora si ha una pausa
non compensatoria. Talvolta, più raramente, i CPV non sono affatto seguiti da una pausa e
pertanto si definiscono interpolati. Le extrasistoli ventricolari, comuni anche nelle persone sane,
sono provocate da molteplici cause quali acidosi e ipokaliemia, stress fisici e psichici, farmaci e
droghe, cardiopatie. Al polso appaiono come battiti prematuri meno forti (sistole ventricolare che
avviene quando il cuore non è del tutto riempito) seguiti una pausa a cui fa seguito un battito più
75
forte. Sono frequenti in pazienti (soprattutto donne, forse sindrome di Barlow) con prolasso della
mitrale oppure in caso di IM o cardiopatia ischemica e in questo caso hanno una prognosi
sfavorevole. Se sono dovute a stimolazione beta-adrenergica possono essere usati beta-bloccanti,
ma normalemente non richiedono terapia se presenti in soggetti sani e hanno prognosi benigna. In
caso di infarto acuto del miocardio si utilizza lidocaina (anche se ci sono studi controversi sul reale
beneficio alla sopravvivenza, infatti terapie che rallentano la conduzione miocardica o aumentano
la refrattarietà possono aumentare il rischio di aritmie fatali). Quando una PVC si associa con un
ciclo normale e lo schema si ripete per ogni ciclo successivo si parla di bigeminismo, se il rapporto
e 1:3 è trigeminismo. Diagnosi: ECG, Holter, ergometria.
Terapia: nei soggetti sani non richiedono trattamento. In presenza di malattie cardiache
organiche: a parte la terapia causale si può fare terapia sintomatica: controllo dei livelli di
potassio e magnesio e digitalemia (possibili intossicazione da digitale), terapia antiaritmica: in
caso di rischio di istaurazione di una fibrillazione ventricolare (Basso indice di anticipazione IA,
extrasistoli complesse in pazienti con grave cardiopatia di base). I beta-bloccanti sono i farmaci
di scelta perché riducono il rischio che le ESV provochino una fibrillazione ventricolare.
Prognosi: invariata in soggetti sani, indipendentemente dal tipo di ESV. Nei soggetti post-infarto
sono un indice prognostico sfavorevole, segno di possibile sviluppo di fibrillazione ventricolare.
2) Disturbi di conduzione dello stimolo:
a) Blocco seno atriale: blocco SA, ritardo della conduzione dello stimolo elettrico dal NSA
all’atrio destro, abbastanza raro. Viene anche detto: “blocco d’uscita del seno” e ne
vengono distinti tre tipi:
Blocco seno-atriale di I grado: semplice allungamento del tempo di conduzione seno-atriale che
può anche non essere evidente all’ECG (in genere non si vede).
Blocco seno-atriale di II grado: pause sinusali intermittenti con mancata conduzione di alcuni
impulsi e ritmo atriale “regolarmente irregolare”. Nel tipo I l’ECG mostra un progressivo
allungamento dell’intervallo P-R e accorciamento dell’R-R seguito da una pausa, nel tipo II
l’intervallo P-R non cambia e ci sono solo pause che comportano una bradicardia sinusale.
Blocco seno-atriale di III grado: assenza di onde P sinusali per periodi di durata varaibile. È
completo, nell’ECG non si evidenziano onde P (mancata depolarizzazione atriale). Dopo la pausa
la frequenza riprende in genere come prima del blocco. La pausa può dare origine ad un battito di
scappamento (se c’è mancato funzionamento a lungo, anche a ritmo di scappamento) dovuto a
focolai ectopici che escono dalla soppressione normale del NSA.
Eziologia: infarto, sindrome del nodo del seno malato, intossicazione digitalica, miocarditi.
Tutti i tipi di blocco seno-atriale possono essere associati a malattia del nodo del seno malato. In
questo caso nelle pause di attività elettrica può inserirsi un’attivazione di focus ectopici dando una
sindrome bradicardia-tachicardia. In genere i ritmi che insorgono come segnapassi secondari in
questo caso, anzicchè ritmi o battiti di scappamento, sono tachicardia sopraventricolare, flutter
atriale e fibrillazione atriale.
Clinica: se il blocco è prolungato possono aversi sintomi che vanno dalla vertigine alla sincope.
Terapia: causale, pacemaker se la condizione è grave (sindrome di Morgagni-Adams-Stokes).
b) Blocco atrioventricolare: BAV, Blocco atrio-ventricolare (BAV): disturbo di propagazione
degli impulsi atriali ai ventricoli. Ne vengono distinti tre tipi (gradi), e inoltre possono
essere distinte sulla base della localizzazione (NAV, fascio di His, branche di conduzione).
Eziologia: è varia, può essere funzionale o organica. Le eziologie funzionali (praticamente
estrinseche) sono principalmente l’ipersensibilità del seno carotideo, iperkaliemia, ipotiroidismo
(endocrino-metaboliche), beta-bloccanti, calcio antagonisti e digitale (farmacologiche). Le cause
organiche sono infettive (come endocardite, malattia di Lyme e di Chagas, Sifilide etc.),
ereditarie/congenite (distrofie miotoniche), infiammatorie (come LES e AR), infiltrative (come
amiloidosi, sarcoidosi, emocromatosi), degenerativa (con fibrosi progressiva idiopatica del sistema
di conduzione che può accompagnarsi all’invecchiamento). Anche la malattia coronarica, l’infarto
miocardico oltre che interventi cardiochirurgici, possono causare un blocco AV, per lo più
transitorio (in un 15-20% di pazienti). Il blocco può verificarsi a vari livelli nel sistema di
conduzione AV, a livello del NAV (tipica), ma anche del fascio di His o nel sistema His-Purkinje.
Blocco AV di I grado: aumento del tempo di conduzione nel NAV con rallentamento e quindi
prolungamento dell’intervallo PR che supera i 0,2 s (200ms corrispondono ad un quadrato grande)
e resta costante in ogni ciclo. Spesso è asintomatico, si riscontra in soggetti sani con aumentato
tono vagale, o può essere dovuto a farmaci (ad esempio digitalici, beta-bloccanti, calcio-
76
antagonisti) o anche ad alcune cardiopatie (ischemia ad esempio con ostruzione della coronaria
destra che di norma vascolarizza il NAV, spesso causando un blocco transitorio ad esempio per
edema).
Blocco AV di II grado: assenza intermittente della conduzione degli impulsi dall’atrio al
ventricolo. Alcuni impulsi atriali sono trasmessi, altri no, generando un ritmo irregolare con alcune
onde P che restano da sole, non associate ad un QRS. Se ne distinguono due tipi:
• Mobitz tipo 1: o Wenckebach, in genere tipico del nodo AV. Si hanno una serie di cicli in
cui l’impulso viene progressivamente ostacolato fino al punto in cui l’onda P non è seguita
da alcun complesso QRS. Si può avere un rapporto P:QRS uniforme del tipo 3:2; 4:3; 5:4. Si
ha un allungamento progressivo dell’intervallo P-R (periodismo di Luciani-Wenckebach,
fenomeno fisiologico ad alte frequenze, ma patologico in questo caso perché si presenta
anche a basse frequenze) e un accorciamento di quello R-R. Dei due è quello associato ad
una prognosi migliore, spesso dovuto ad un eccesso di parasimpatico che inibisce il NAV o
a medicinali che hanno effetto simile. Può anche essere causato da cardiopatia ischemica,
principalmente infarto miocardico della parete inferiore.
• Mobitz tipo 2: o Mobitz, in genere tipico di un blocco della conduzione distale o sottoHissiano, spesso associato a ritardi della conduzione ventricolare come blocchi di branca.
Ha maggiori probabilità di progredire verso un blocco AV di grado completo. Un certo
numero di depolarizzazioni atriali (onde P) vengono bloccate del tutto prima di essere
condotte al ventricolo. Pertanto si producono normali cicli P-QRS-T senza alterazione degli
intervalli P-R e R-R, ma preceduti da una serie di onde P che non producono complessi
QRS. Nella maggior parte dei casi è di tipo Mobitz 2:1 con due onde P per ogni QRS, ma
può essere anche 3:1 o anche con rapporti maggiori (che indicano un aggravamento e
blocchi come 4:1 e 5:1 sono indicati come Mobitz avanzati. Le onde P sono regolari e
puntuali, mai premature (questo per non confonderlo con extrasistoli atriali). Ha una
prognosi peggiore, ed è più frequentemente associato ad infarto miocardico della parete
anteriore. A volte il blocco di II grado può dare anche un blocco AV parossistico, ossia una
serie di onde P non condotte.
Blocco AV di III grado: o blocco AV completo, nessun impulso atriale viene condotto al sistema
ventricolare. Pertanto focolai ectopici ventricolari dovranno intervenire con il proprio
automatismo, un’attività di pacemaker che impone un ritmo idioventricolare, con frequenza tra 20
e 40 bpm. In realtà se il blocco colpisce solo la parte superiore del NAV può rimanere un focolaio
giunzionale. Se coinvolge tutto il NAV o è sotto il fascio di His allora funzionerà un focolaio
ventricolare. Pertanto più alto è il blocco (sopra anziché sotto-hissiano) maggiore e la frequenza e
migliore è la prognosi (inoltre il QRS sarà meno slargato). È indice di una patologia avanzata del
sistema di conduzione. Deve essersi verificato un blocco completo del sistema di conduzione.
Poiché il blocco è bidirezionale, la frequenza degli atri resta decisa dal NSA. Nel tracciato risulterà
quindi evidente una frequenza dei complessi QRS determinata dal pacemaker ventricolare non più
soppresso, ma contemporaneamente c’è un ritmo sinusale delle onde P. Si ha pertanto una
dissociazione AV. Non tutte le dissociazioni sono blocchi. È un blocco AV solo se la frequenza
atriale è maggiore di quella ventricolare (si ha infatti dissociazione anche nel ritmo si scappamento
ventricolare o nell’idioventricolare). Nel caso le frequenze di atrio e ventricolo siano uguali
(dissociazione AV isoritmica) può essere difficile porre diagnosi soprattutto se le onde P
precedono (per caso) i QRS.
Clinica: vi sono due pericoli in caso di blocco AV completo: A causa della notevole bradicardia che
viene a crearsi, sì può avere una riduzione della gittata cardiaca che può portare ischemia cerebrale
e sincope, una condizione definita sindrome di Morgagni-Stokes-Adams. In caso di forte
bradicardia può aversi insufficienza cardiaca.
Diagnosi: oltre all’ECG, ed alle eventuali manovre vagali o somministrazioni di farmaci che
influenzano il SNA vi sono valutazioni diagnostiche aggiuntive, che possono ad esempio essere
indicati in pazienti con sincope e sospetto blocco AV di alto grado. Registrazione
dell’elettrocardiogramma del fascio di His: tramite catetere si misurano attività atriale,
elettrogramma del fascio di His e attivazione ventricolare.
Si valutano: Intervallo PA: tempo tra onda P e deflessione atriale sul fascio di His= o < 50ms.
Intervallo AH: tempo tra deflessione atriale sul fascio di His ed elettrogramma di His (tempo di
conduzione attraverso il NAV)< o =130ms. Intervallo HV: tempo tra elettrogramma di His ed
esordio del QRS (tempo di conduzione attraverso il sistema HIs-Purkinje)< o =55ms. Anomalie in
questi tempi possono facilitare la diagnosi specie nelle D.D. tra Mobitz e Wenckeback. Un blocco
77
nell’His-Purkinje è associato ad un rischio maggiore di progressione verso gradi più elevati.
Terapia: oltre al trattamento causale vi è un trattamento sintomatico:
• BAV di I grado o II tipo Wenckebach: non serve terapia sintomatica. Eventualmente
atropina in caso di forte bradicardia.
• BAV di II grado tipo Mobitz: in genere è un blocco infraHis e pertanto con pericolo di
blocco totale. Da sospendere if farmaci che ritardano la conduzione, non serve l’atropina. In
caso di sintomi o possibile evoluzione terapia con pacemaker.
• BAV di III grado: impianto di pace-maker. Rianimazione ovviamente.
c) Blocchi di branca: sono alterazioni nella trasmissione di impulsi elettrici attraverso la
branca destra e sinistra del fascio di His. Gli stimoli giungono nai ventricoli tramite vie più
lente, ossia fibre del muscolo ventricolare. Il ventricolo non bloccato si depolarizza prima.
Si hanno così dei complessi QRS slargati perché non sincronizzati. Il QRS allargato è
>120ms nel blocco completo, tra 100-120 ms nel blocco incompleto.
Blocco di branca destra, BBD: 1) Aumento della durata del QRS 2) Onda S nella
derivazione D1 (ossia orizzontale con elettrodo positivo al braccio sinistro) e
profonde S nella derivazione V6. 3) In V1 c’è una forma RSR’e qRS in V6 (sempre
con netta onda S, forma a M) 4) Inversione secondaria dell’onda T da V1 a V6
(negativa nelle derivazioni in cui c’è RSR’). In realtà in generale nei blocchi l’onda T
ha andamento opposto all’ultima deflessione del QRS per alterazione della
ripolarizzazione dovuta ad alterazioni miocardiche 5) Aumento della deflessione
intrinsecoide ossia dell’intervallo tra l’inizio del QRS e il primo picco del QRS. Dal
punto di vista clinico il BBD non implica sempre una patologia cardiaca., c’è anche
in soggetti sani. È comune in caso di embolia polmonare a seguito del sovraccarico
del ventricolo destro. Non è indicato un intervento terapeutico.
Blocco di branca sinistra, BBS: 1) Aumento durata del QRS 2) Assenza di onde q in
D1 e in V4, V5 e V6 (si parte subito in alto, senza onda negativa. 3) In V1 il
complesso è QS (senza onda positiva R, quindi tutto negativo) con stessa forma del
complesso in D1 e V6 (che invece ha onde tutte positive, senza q). 4) Inversione
secondaria dell’onda T (negativa nelle deflessioni con ampia R e senza Q cioè D1 e
V6). Il BBS è riscontrato per lo più in cardiopatici per lo più con coronaropatie,
cardiopatia ipertensiva, patologie aortiche valvolari e miocardiopatie (qundi IM, SC,
miocarditi etc.). Non richiede interventi terapeutici speciali oltre alla risoluzione
della cardiopatia di base. Mobitz intermittente: blocco di branca permanente di un
lato e intermittente di un altro provoca un blocco AV intermittente con un QRS che
salta ad intervalli intermittenti.
Emiblocchi: La branca sinistra del fascio di His è costituita da due fascicoli:
anteriore e posteriore. Il blocco di uno di questi due fascicoli si definisce emiblocco.
Normalmente non comporta uno slargamento del QRS bensì una sua deviazione
assiale (modifica via di depolarizzazione del ventricolo) e un cambio di morfologia.
Emiblocco anteriore sinistro: il ventricolo sinistro viene attivato solo dal fascicolo
posteriore con impulsi che diffondono nella parte anteriore a partire dalla
posteriore. 1) Deviazione assiale sinistra maggiore di -40° 2) Complesso qR in D1 3)
rS in D2, D3, aVF 4) QRS normale o leggermente allargato. (in generale anche Q1S3
con onda Q in I e S larga e sottoslivellata in III). Tipici di cardiomiopatie e
cardiopatia ischemica.
Emiblocco posteriore sinistro: l’attivazione ventricolare sinistra si realizza solo
nella regione del fascicolo anteriore. 1) Marcata deviazione assiale destra 2) Piccole
onde q con alte onde R in D2, D3 e aVF. QRS è normale o leggermente allargato.
Aspetto S1Q3. È più raro del destro.
Gli emiblocchi avvengono spesso in concomitanza con infarti in quanto anche i fasci di conduzione
ventricolari sono normalmente irrorati dalle coronarie. La coronaria destra irrora NSA, NAV,
fascio di His e il ramo posteriore della branca sinistra. La branca sinistra è irrorata anche dalla
coronaria sinistra. Il ramo discendente anteriore della coronaria sinistra irrora anche lui parte del
ramo posteriore della branca sinistra, il ramo anteriore della branca sinistra e la branca destra.
Ostruzioni possono quindi causare un blocco di un solo fascio o di più fasci (bi fascicolari). Ad
esempio un’ostruzione del ramo discendente anteriore può causare BBD + emiblocco anteriore.
Da quanto detto si capisce pure perché l’emiblocco posteriore è più raro (è irrorato sia dalla
78
coronaria destra che dal ramo discendente della sinistra), ma anche più grave, soprattutto se
associato a BBD (forte tendenza a progredire in blocco AV). Inoltre si capisce che il BBS può essere
dovuto a emiblocco anteriore + posteriore e che il blocco AV può essere dovuto a 2 blocchi di
branca (o addirittura BBD + emiblocco anteriore + posteriore). Le combinazioni di blocchi bi
fascicolari sono spesso intermittenti, connun blocco fisso ed uno non sempre visibile. Esistono
anche blocchi trifascicolari i quali se continui costituiscono un blocco AV, se intermittenti danno
luogo ad un fenomeno di Mobitz intermittente.
Eziologia: cardiopatia ischemica, infarto, miocarditi e cardiomiopatie. Anche ipertrofia del
ventricolo sinistro (più BBS) e sovraccarico del cuore destro (emboli polmonare dà BBD).
Diagnosi: in caso di pericolo di blocco trifascicolare localizzazione esatta del blocco mediante ECG
del fascio di His. Diagnostica causale.
Terapia: eziologica della malattia di base. In caso di blocchi bi fascicolari pensare al pacemaker (in
genere indicato in caso di contemporaneo blocco AV o di sintomi (vertigini, sincopi). La terapia
del blocco trifascicolare è la stessa del blocco AV totale.
3) Forme speciali:
• Sick sinus syndrome, SSS, malattia del nodo del seno: SSS (sick-sinus syndrome), si
distingue in estrinseca ed intrinseca. Estrinseca: dovuta a cause extracardiache come
farmaci, SNA, ipotiroidismo, ipertensione endocranica, manovre vagali, apnea da sonno,
etc. (curare prima la patologia di base per evitare un inutile impianto di pacemaker).
Intrinseca: ha carattere degenerativo, spesso per sostituzione con tessuto fibroso. Può essere anche
associata a malattia coronarica, infiammazione (tipo pericarditi e miocarditi, ma anche da LES),
amiloidosi senile. Può raramente essere anche ereditaria (AD).
Clinica: dal punto di vista ECGgrafico si manifesta con bradicardia sinusale, arresto sinusale,
blocco seno-atriale d’uscita (già visti) oppure una tachicardia sopraventricolare alternata a
bradicardia (sindrome tachicardia-bradicardia, da 1/3 a ½ dei pazienti). I sintomi possono essere
associati in questo caso alla tachicardia (palpitazioni, angina pectoris, insufficienza cardiaca) o a
bradicardia (sincope per riduzione della gittata, astenia, affaticamento). La tachicardia si manifesta
il più delle volte come fibrillazione ( o anche flutter) atriale con associato rischio di
tromboembolia (anticoagulanti soprattuto per pazienti a rischio). Se associata ad altre patologie
cardiovascolari, la sintomatolagia e la mortalità sono aumentate.
Diagnosi: in genere con anamnesi ed ECG. Serve però spesso un ECG a lungo termine (monitor
ECGgrafici impiantabili) e assocazione con la sintomatologia per poter fare la diagnosi di
disfunzione del nodo seno-atriale. Anche ECG sotto-sforzo. Può servire alla diagnosi una
valutazione invasiva dell’attività del nodo del seno, oppure una valutazione della inadeguatezza
cronotropa (incapacità di aumentare la frequenza sotto sforzo).Test con atropina: dopo inieizione
di 1 mg di atropina la frequena cardiaca resta l di sotto di 80.
Terapia: non c’è terapia farmacologica particolarmente efficace, anzi bisogna sospendere eventuali
calcio-antagonisti e beta-bloccanti che possono causare la sindrome. La bradicardia sinusale snon
richiede terapia specifica e in generale la SSS non aumenta la mortalità. Nel caso sia sintomatica,
con sintomi ECG correlati, la terapia di prima scelta è l’impianto di un pacemaker permanente.
• Sindrome del seno carotideo: ipersensibilità dei barocettori della biforcazione carotidea
con disturbi clinici alla stimolazione della carotide. La stimolazione vagale può causare:
asistolia o forte bradicardia, oppure abbassamento della pressione arteriosa >50 mmHg,
oppure, nella forma mista, entrambe le cose. Quasi 1 anziano su 4. Il 90% è asintomatico.
Eziologia: quasi sempre di origine aterosclerotica. Clinica: vertigini, sincopi aseguito di
spostamenti della testa o costrizione del collo o dopo massaggio carotideo.
Diagnosi: massaggio carotideo: asistolia >3 secondi o abbassamento PA >50 mmHg.
Terapia: solo se ci sono disturbi anamnestici correlati a movimenti di testa e collo: pacemaker.
4) Tachicardie:
• Tachicardia da rientro nodale: detta in precedenza tachicardia parossistica
sopraventricolare: è un ritmo accelerato, tra i 150 e i 200 (e oltre)bpm, che genera da un
focolaio ectopico (o da un circuito di rientro) che ha origine negli atri (atriale) o nel nodo
AV (giunzionale). È definita parossistica perché si genera improvvisamente e non come
una risposta graduale (tipo tachicardia sinusale) all’esercizio fisico o ad altri stimoli.
Il NSA, poiché la frequenza di scarica è più alta, viene soppresso. Le onde P’ generate sono diverse
dalle onde P normali. Possono essere anche invertite, ancor più facilmente se provengono dal
basso atrio o dal NAV, questo perché l’attivazione atriale avviene per via retrograda. Ogni
79
impulso di depolarizzazione atriale viene condotto ai ventricoli. Le onde P’ anomale hanno un
rapporto fisso con i QRS. Avvengonoo in seguirto alle presenza di un circuito di rientro.
All’interno del NAV si può avere un rientro a causa della presenza di due vie di conduzione, una
più lenta e una più rapida (inoltre nel momento in cui si verifica un’extrasistole atriale (battito
ectopico) una via può essere ancora refrattaria e l’altra no, generando un rientro). Normalmente il
tutto è stimolato da un extrasistole atriale.
Clinica: l’esordio così come la fine dalla tachicardia è appunto improvviso e brusco. In genere
l’eziologia è benigna, ed è comune nei bambini (più femmine) e in giovani con cuore sano. Le crisi
posono anche essere scatenate da un grande pasto o da una forte emozione e la sensazione è come
di un forte cardiopalmo come un “frullio di ali sul petto”, ma sono in genere ben tollerate. In
pazienti con cardiopatia coronarica o insufficienza cardiaca possono invece causare riduzione della
gittata con sincope, angina o anche shock cardiogeno. Vi può essere concomitante poliuria.
Diagnosi: tachicardia regolare improvvisa + ECG (tachicardia regolare con QRS stretto).
Terapia: Spesso, soprattutto per le tachiaritmie da rientro del NAV, può bastare la manovra vagale
o la manovra di Valsalva (anche bere velocemente acqua fredda). Come terapia farmacologica, si
usano: Adenosina: 1° scelta, blocco a breve termine della via d conduzione AV nel nodo AV (8
secondi massimo). Può dare asistolia, dispnea, caduta della pressione, broncospasmo. Altro
farmaco che ha effetto è il Verapamil, che pure può avere effetto intropo negativo con asistolia, etc.
Elettroterapia: in caso di insuccesso della terapia farmacologica e in pazienti a rischio di shock
cardiogeno si può effettuare cardioversione elettrica.
• Tachicardia da rientro AV: seconda forma più frequente di tachicardia parossistica
sopraventricolare. Alla base c’è sempere una struttura accessoria di conduzione AV.
o Sindrome di Wolff-Parkinson-White: WPW. Detta anche sindrome da
preeccitazione ventricolare. È caratterizzata dalla presenza di una o più vie
accessorie che forniscono diretta connessione AV saltando il NAV.
Una via accessoria è detta fascio di Kent. Il ventricolo viene pertanto eccitato attraverso due vie,
questo fa sì che l’impulso atriale per la conduzione ventricolare scavalca il NAV e attiva
rapidamente i ventricoli dando luogo ad una sorta di preeccitazione ventricolare. Questo perché è
molto importante ricordare che la via accessoria è generalmente più rapida del NAV, mentre può
avere un periodo refrattario più lungo o più breve. In questo modo l’intervallo P-R è accorciato e
inoltre il complesso QRS risulta allargato e con un tratto iniziale ascendente (onda delta) dovuto al
fatto che la conduzione attraverso la via accessoria comincia prima (P-R più piccolo) ma è più lenta
(onda delta) e graduale ( poiché avviene a partire dalla via accessoria attraverso il muscolo) di
quella avvenuta tramite il fascio di His-Purkinje. La WPW è, dopo le alterazioni della conduzione
nel NAV, la seconda causa più comune di tachicardia parossistica sopraventricolare, sempre a
causa di un circuito di rientro. Nella maggior parte dei casi infatti la via accessoria ha un periodo
refrattario più lungo del NAV. Pertanto può accadere che un battito ectopico atriale (CPA) possa
essere condotto nel NAV e restare bloccato nella via accessoria ancora refrattaria, e poi percorrere
quest’ultima in modo retrogrado attivando gli atri (attivazione retrograda degli atri = echo beat,
battito eco). Se ciò si ripete si può sviluppare tachicardia.
Questa tachicardia circolare è detta ortodromica, ed è associata ad un complesso QRS normale
(perché la via accessoria conduce ora solo in senso retrogrado e quindi scompare l’onda delta). Più
raramente a via accessoria ha un periodo refrattario più breve e dunque attraverso i fasci di Kent si
avrà conduzione anterograda e si avrà andamento retrogrado lungo il NAV, generando una
tachicardia parossistica sopraventricolare antidromica. Questa è associata ad un QRS allargato
(perché ora è la via accessoria che conduce in senso anterogrado e l’onda delta dovuta alla lenta e
graduale conduzione attraverso il muscolo resta).
Clinica: si possono manifestare episodi aritmici già nell’infanzia oppure in età adulta. Si può
avere tachicardia parossistica sopraventricolare, flutter atriale o fibrillazione atriale. Più
comunemente tachicardia parossistica, al secondo posto FA ( 50% dei pazienti con vie accessorie è
a rischio per FA). Queste aritmie da rientro sono maggiormente sintomatiche nei pazienti con
WPW che in quelli con classiche aritmie da rientro nel NAV, si ha spesso lipotimia e sincopi.
Questo avviene perché, a causa della presenza anche della via accessoria, molto spesso si ha
conduzione rapida ai ventricoli, e quindi una risposta ventricolare alla fibrillazione atriale molto
maggiore di quella che si ha nei pazienti con aritmie da rientro del NAV. Si ha spesso una
tachicardia sopraventricolare parossistica con frequenze tra 150 e 250 bpm e QRS più spesso stretti
(via accessoria con periodo refrattario più lungo) che allargati. Lo stesso avviene per la
fibrillazione atriale, in cui la risposta ventricolare è persino maggiore (anche 1:1, con frequenze
80
pericolosamente elevate).
Diagnosi: anamnesi, all’ECG un ritmo irregolare ed una frequenza ventricolare media>200bpm
(QRS larghi o stretti) può far propendere per una WPW. Anche ECG Holter e event-recorder.
ECG intracardiaco: localizzazione delle vie accessorie. Importante individuare i pazienti con breve
periodo refrattario in quanto solitamente più a rischio di MCI.
Sono distinti due tipi di sindrome:
WPW di tipo A: via accessoria localizzata a sinistra, vicino la mitrale (si avrà onda delta e QRS
verso l’alto in V1 e V6)
WPW di tipo B: via accessoria localizzata a destra (QRS negativo in V1 e positivo in V6).
Terapia: come nelle aritmie da rientro la stimolazione vagale che rallenta il NAV può essere
sufficiente a porre fine alla tachicardia da rientro. In questo può servire anche l’adenosina così
come pura calcio-antagonisti (diltiazem o verapamil) o propranololo (beta-bloccante) o
procainamide. Nei casi di WPW con FA con conduzione anterograda per la via anomala i farmaci
d’elezione sono quelli che aumentano la refrattarietà e riducono la conduzione lungo la via
anomala, ossia quelli di classe I come procainamide (IA) chinidina, flecainide (Ic). Pazienti con
episodi frequenti di aritmie sintomatiche dovrebbero essere trattati con ablazione trans catetere
della via accessoria, sicura nel 95% dei casi, ma con rischi di arresto cardiaco che vanno soppesati
con i rischi emodinamici, con il rischio di fibrillazione ventricolare e con la gravità dei sintomi.
• Fibrillazione atriale: FA,
• Tachicardia ventricolare: TV, Tachicardia ventricolare: TV, tachicardia che ha origine al di
sotto del fascio di His in genere con frequenza > 100 bpm, fino a 200 e oltre (250). È
possibile avere anche una TV lenta, a frequenza tra 90 e 120, confondibile con RIPA.
In genere rappresenta un ampio circuito macrorientrante generatosi in un miocardio con patologia
cronica. La TV normale, ha come causa più frequente l’infarto miocardico acuto, ma può essere
causata anche da ipopotassiemia o da intossicazione digitalica. In effetti può essere di due tipi:
TV monomorfica: con complesso QRS uniforme. Riproducibile con pacing e stimolazione
ventricolare programmata, in genere avviene in assenza di cardiopatia strutturale, generata da un
focolaio ectopico (irritato da ipopotassiemia o digitale, etc).
TV polimorfica: con complesso QRS vario. Non riproducibile e causata da cardiopatia. Una TV si
definisce sostenuta quando dura più di 30 secondi.
La causa della tachicardia può essere quindi un rientro (cardiopatia) o un focolaio ectopico.
Clinica: Il pazienti si mostra con polso piccolo, ritmico e di ampiezza irregolare. Possono esserci
segni di scompenso dovuti alla cardiopatia di base. Sintomi comuni sono tachicardia, dispnea,
angina pectoris fino all’edema polmonare e allo shock cardiogeno.
Diagnosi: ECG: tachicardia regolare con deformazione tipo blocco di branca di almeno 3
complessi QRS consecutivi. Monomorfa o polimorfa cioè con complessi monomorfi o polimorfi. Si
definisce persistente se protratta per più di 30 secondi. Anche Holter e event-recorder.
Terapia: bisogna agire immediatamente, in quanto pericolosa per la vita. Terapia acuta:
antiaritmici: lidocaina (in Italia non si usa la Ajmalina), amiodarone (di prima scelta in pazienti
con insufficienza cardiaca). Cardioversione elettrica a 200 J: si fa in caso di insuccesso della terapia
farmacologica, funziona meglio se seguita da somministrazione di amiodarone.
Nei pazienti post-infarto ha ridotto la mortalità l’utilizzo di beta-bloccanti. No classe IC.
Torsione di punta: o torsades des pointes, è una forma di TV polimorfica caratterizzata da una
frequenza molto elevata (250-350 bpm) e da complessi QRS che variano progressivamente la loro
forma, da positivi a negativi e viceversa, dando l’impressione di una torsione, un capovolgimento,
un nastro attorcigliato. In genere si associa alla sindrome del QT lungo e tende a risolversi
spontaneamente. La terapia di scelta è l’infusione di magnesio.
• Flutter e fibrillazione ventricolare: FV. Flutter ventricolare: frequenza tra 250 e 350 bpm. I
QRS hanno aspetto sinusoidale con ampiezza simile tra loro. Evolve quasi invariabilmente
in una fibrillazione ventricolare. Il riempimento ventricolare è già insufficiente così come la
gittata cardiaca.
Fibrillazione ventricolare: FV, grave aritmia che comporta collasso emodinamico del paziente. Si
ha un’attivazione dei cardiomiociti totalmente alterata e con contrazioni irregolari e inefficaci, ECG
del tutto caotico con “frequenza” (se così si può ancora dire ) ventricolare anche >400 bpm. In
genere c’è progressione verso l’arresto cardiaco con ampiezza delle deflessioni che diminuisce
sempre più. Il paziente rischia la vita in pochi minuti se non si interviene con un defibrillatore
(cardioversione elettrica). Spesso è preceduta da extrasistoli ventricolari precoci, ossia CPV che
cadono nella fase di ripolarizzazione ventricolare, un periodo considerato di maggiore
81
vulnerabilità (tratto discendente dell’onda T). Questo è il fenomeno R/T.
Flutter atriale (di G. Fico)
Aritmia sopraventricolare caratterizzata da presenza di attivazione atriale sincronizzata
evidente all'ECG con una continua ondulazione della linea di base (onde F) con configurazione
A DENTE DI SEFA. La Frequenza atriale è compresa tra 240-340 bpm. La causa è un circuito di
rientro nell'atrio destro. E' di solito associato a BAV di grado variabile.
Cause: ipertiroidismo, valvulopatie, cardiopatia ischemica, IMA, embolia polmonare, BPCO.
All'ECG
•
non ci sono onde P
al posto delle onde P ci sono onde di Flutter (F) con conformazione a dente di sega
più facilmente distinguibili in II, III, aVF e V1.
•
La frequenza ventricolare è più bassa di quella atriale perché il nodo AV non è in
grado di condurre più di 150-200 impulsi al minuto ai ventricoli
•
il rapporto di conduzione onde F : QRS è normalmente un multiplo pari (2:1, 4:1,
6:1)
•
Se c'è blocco AV completo non si vedono i complessi QRS
•
i QRS sono normalmente stretti
•
All'approccio terapeutico
Nel paziente emodinamicamente instabile → cardioversione sincronizzata
Nel paziente emodinamicamente stabile:
•
SE POSSIAMO CON CERTEZZA ESCLUDERE UNA WOLF-PARKINSON WHITE →
digossina se ci sono segni di insufficienza cardiaca cronica; Calcioantagonisti o B-Bloccanti se
non ci sono segni di ICC
•
SE NON POSSIAMO ESCLUDERE UNA WOLF-PARKINSON-WHITE → amiodarone se
c'è ICC,
Propafenone o Sotalolo se non c'è ICC.
In tutti i casi → EPARINA A BASSO PESO MOLECOLARE.
5) Arresto cardio-circolatorio: esistono due forme di arresto cardiaco:
• Asistolia: o arresto ipodinamico non funziona NSA e nessun focolaio (nessun ritmo di
scappamento);
• Dissociazione elettromeccanica: come nella FV, il cuore produce segnali (sempre più
deboli) di attività elettrica, ma non vi è risposta meccanica. È detto arresto cardiaco
tachisistolico o iperdinamico.
Eziologia: cause cardiache, circolatorie (shock come nell’embolia polmonare), respiratorie
(ipossia), stadio terminale di diverse affezioni. Patogenesi: evolve spesso da tachicardie
ventricolari, fibrillazione ventricolare, bradicardie, torsades de pointes.
Diagnosi: presnza di incoscienza, arresto respiratorio e arresto circolatorio.
Terapia: è noto che la TV polimorfica, il flutter ventricolare e la FV portano sempre a collasso
emodinamico. In questi casi è indicato l’uso di un defibrillatore (scarica asincrona a 200J, se non
funziona scariche ritmiche). Se c’è TV monomorfica con compromissione emodinamica
defibrillatore sincrono all’onda R, se c’è TV monomorfica tollerata trattamento farmacologico con
lidocaina o amiodarone e se non funziona scarica sincrona sull’onda R. Si effettua rianimazione
cardio-polmonare (RCP).
Anomalie genetiche che predispongono alle aritmie ventricolari polimorfiche
82
Sindrome del QT lungo: SQTL, forma congenita è dovuta a mutazioni nei canali ionici che
comportano un’aumentata durata della ripolarizzazione. Le otto mutazioni identificate sono in
genere ai canali del K+ o del Na+. Le aritmie ventricolari potrebbero essere innescate da
postdepolarizzazioni precoci favorite da un accumulo intracellulare di calcio dovuto ad un
allungamento del plateau. C’è predisposizione pertanto ad aritmie ventricolari polimorfiche come
la torsades des pointes. L’intervallo QTc nei pazienti con SQTL pare essere da 400 a 460 uomini e
400-480 donne. Vi sono però condizioni, associate a rischio di aritmie molto alto, con QT>500ms.
Spesso il QT non è in grado di accorciarsi durante lo sforzo ed è quindi lungo a intermittenza.
Alcuni manifestano la sindrome solo se gli si dà il sotalolo (classe III, aumenta la durata del p.d.a.).
Il genotipo influenza la prognosi. Le mutazioni LQT 1-2-3 sono il 99% delle clinicamente rilevanti.
Terapia: nei pazienti con QT rilevata e sintomatici si impianta ICD, così come in quelli con LQT3 o
con QT>500 ms, considerati molto a rischio.
SQTL acquisita: per polimorfismi e/o mutazioni sporadiche ci sono soggetti predisposti
all’allungamento del QT in risposta ad alcuni farmaci e peggiorati da condizioni di ipokaliemia o
da bradicardia.
SQT breve: rara, associata a mutazioni che velocizzano la depolarizzazione, portano QT<320ms,
onde T alte e appuntite (che possono essere confuse con QRS e contate due volte dall’ICD). Rischio
di FA e FV, si impianta l’ICD.
Sindrome di Brugada: Importante causa di morte improvvisa nei giovani. Per un difetto del canale
del sodio (mutazione SCN5A) si ha minore entrata di sodio all’interno e p.d.a che dura di meno
nell’epicardio del tratto di efflusso del ventricolo destro. Si ha pertanto un’ampia differenza di
potenziale tra l’epicardio della zona di efflusso del VD e l’endocardio. Nell’ECG si ha
sopraslivellamento evidente del tratto ST in V1-V2-V3 e aspetto del QRS tipico del BBD. Si
impianta ICD nei sintomatici o con episodi aritmici. È più comune nei maschi asiatici.
Procainamide e fleicanide bloccano il canale del sodio e possono esacerbare la sindrome (e anche
renderla evidente, trovano utilizzo nei test diagnostici).
83
DISSECAZIONE AORTICA
Rientra nelle sindromi aortiche acute. E’ una severa emergenza medico-chirurgica. Diagnosi e
trattamento devono essere precoci dal momento che il T condiziona la prognosi. La patologia è
caratterizzata da lacerazione dell’intima (flap intimale), attraverso la quale il sangue penetra
scollando le pareti (falso lume). Il falso lume può riaprirsi nel vero lume attraverso una seconda
comunicazione (dissezione classica). Le dissezioni originano spesso a livello di placche
aterosclerotiche ulcerate. Le sedi più comuni sono per l’aorta ascendente: la porzione entro
5cm dalla valvola aortica;per la discendente: la porzione situata sotto l’arteria succlavia sx. In
alcuni casi la dissecazione si verifica senza Flap, per ematoma o emorragia (rottura dei vasa
vasorum). La dissecazione classica può determinare ostruzione dei rami arteriosi (coronarie,
tronco comune, carotide comune sx, succlavia sx) o anche sfiancamento dell’ostio valvolare con
comparsa di insufficienza aortica acuta. La causa più frequente di decesso fulmineo è la rottura
della parete aortica. Se il contenuto si riversa nel pericardio abbiamo tamponamento cardiaco.
Epidemiologia: fino a 3/100.000 all’anno. Mortalità 70% a 48 h
Classificazione di Barkey: I: Origina dalla aorta prossimale e si estende al di là dei tronchi
brachicefalici. II: origina dallo stesso punto ma è limitata all’aorta ascendente III: origina nell’aorta
discendente toracica sotto l’origine della succlavia. Classificazione della Stanford University:
dissezione tipoo A: comprende tutte le dissezioni coinvolgenti l’aorta ascendente. Dissezione
tipo B: Non coinvolge l’aorta ascendente. Ha una migliore prognosi.
Le dissezioni sono acute: datano meno di 2 settimane; subacute datano 2-3 settimana;
croniche:superano le sei settimane. Fattori che influenzano la cronicizzazione: trombosi del
falso lume, localizzazione distale della lacerazione intimale d’entrata, presenza di una lacerazione
di rientro. Eziologia: va ricondotta a fattori che indeboliscono la parete (lamina media) e
aumentano lo stress di parete. Abbiamo malattie ereditarie degenerative (Marfan, Ehlers
Danlos, dissecazione aortica familiare), malattie infiammatorie (Takayasu, malattia di Behcet,
arterite a cellule gigante), eventi traumatici (chirurgia aortica o atoracica, cateterismo cardiaco,
rianimazione cardiopolmonare), tossici (cocaina, anfetamine). L’HTA rappresenta il principale FR
perché determina stress parietale, sclerosi della parete dilatazione aneurismatica. Fattori
aggiuntivi: fumo, ipercolesterolemia. Clinica: Il dolore toracico è di tipo costrittivo (sensazione di
una lacerazione, strappo, pugnalata), improvviso, insopportabile che non risponde ai sedativi. La
sede iniziale è nella regione toracica anteriore (Tipo A), però tende progressivamente a diventare
un dolore posteriore o inter scapolare. L’origine posteriore è tipica degli aneurismi dell’aorta
discendente. Altre sedi di dolore sono: regione epigastrica, lombare, pelvica, mandibola. A volte il
dolore può migrare man mano che la dissezione si estende. Il dolore può progredire o regredire.
Laddove riappaia è un segno prognostico negativo. Altri segni sono : sincope ( associata
frequentemente a tamponamento cardiaco), raucedine (per compressione del nervo laringeo)
broncospasmo (compressione tracheo bronchiale). Possiamo avere ictus cerebrale (interrotto
apporto ematico) IMA, infarto renale, intestinale, emottisi ematemesi (con perforazione esofago).
Qualora ci sia ipotensione o shock (per d miocardico) la prognosi sarà negativa. Può esserci
insufficienza valvolare per la dilatazione dell’anulus con comparsa di soffio diastolico. Può
comparire il segno di Bernard Horner per comprssione ganglio cervicale (ptosi palpebrale, miosi,
enoftalmo). Diagnosi: l’iter è teso a confermare il Flap intimale, differenziale il vero e il falso lume,
quantificare versamenti associati, valutare sede estensione. Gold standard: TAC multistrato o eco
esofagea.
Laboratorio:leucocitosi, lieve o grave anemia. Valori di dimero D bassi escludono la diagnosi di
dissezione aortica. CPK-MB e troponina servono a escluydere infarto (sono alti in caso di
dissezione classica con occlusione coronarica). ECG: dd con IMA. Rx torace: slargamento
84
mediastinico, segni di versamento pleurico sx, segno del calcio ( separazione della calcificazione
dell’intima dalla porzione più esterna della aorta >5 mm) . ECO trans toracica: utile
nell’identificare la dilatazione alla radice dell’aorta, però incapace di visualizzare la metà posteriore
dell’arco e aorta discendente. ECO Trans esofagea: accuratezza superiore all’angiografia. C’è
notevole vicinanza del trasduttore. Il doppler utile nell’identificare la lacerazione di ingresso e di
rientro. TAC mdc: utile ma non si possono valutare le coronarie né la funzione ventricolare. TAC
multistrato: tecnica migliore costo-efficienza. RNM: molto utile, principale inconveniente è il tempo.
Angiografia: continua ad essere esame usato allo scopo di guidare terapia chirugica. Ha dei risci
procedurali per l’invasività e il mezzo di contrasto. Ultrasonografia intravascolare.
Approccio terapeutico in emergenza:
1)Terapia in attesa della diagnosi di imaging: Controllo del dolore con Morfina; monitoraggio
FC (se è elevata somministrare Labetalolo bolo o infusione, o propanololo; se <70bpm
somministrare agenti cronotropi come Atropina), Pressione Arteriosa (in presenza di severa
ipertensione abbassare la pressione non oltre il range di 110-100 mmHg usare Nitroprussiato
(vaso dilata e aumenta la forza di eiezione)spesso associato a b bloccanti come il propanololo o
l’atenololo (che riducono la F di eiezione e la PA)o alternativamente labetalolo a1 e b bloccante,
Verapamil e Diltiazem (calcio antagonisti) si usano quando ci sono controindicazioni ai beta
bloccanti; se ipoteso: valutare la reintegrazione di liquidi con 100-250ml di soluzione fisiologica,
se non c’è risposta alla fluido terapia noradrenalina e.v.), emodinamica (in presenza di instabilità
emodinamica, intubare e ventilare), diuresi, polsi, quadro neurologico. In caso di versamento
pericardico, la pericardio centesi potrebbe essere controindicata, causando sanguinamento
ricorrente.
2) terapia dopo diagnosi con Eco trans esofagea o trans toracica, TAC multistrato (se il paziente
è instabile); diagnosi con RMN e aortografia ( se paziente stabile). In ogni caso abbiamo due
opzioni terapeutiche:
Dissezione aortica tipo A ( I-II): dal momento che la mortalità con trattamento medico è alta, si
predilige una terapia chirurgica d’emergenza con impianto di un graft in aorta ascendente allo
scopo di prevenire la rottura aortica.
Dissezione aortica tipo B (III): la terapia medica ha risultati sovrapponibili alla chirurgia Pertanto
quest’ultima è riservata a pazienti che presentano: dolore incoercibile, progressiva espansione
del falso lume, ischemia viscerale o degli arti (puoi temporeggiare con bypass)o rottura
imminente.
La terapia interventistica si effettua con fenestrazione aortica con o senza impianto di stent,
generalmente in presenza di ipoperfusione di reni, arti. La terapia endovascolare (con impianto di
stent graft percutaneo per coprire la breccia e evitare il flusso nel falso lume), si usa in caso di
paziente anziano con precarie condizioni, in cui la terapia chirurgica sarebbe rischiosa(?).
La mortalità chirurgica è un po’ più alta nei pazienti con dissecazione distale. Complicanze:
recidiva della dissecazione, formazione di aneurismi nell’aorta indebolita, insufficienza valvolare
aortica progressiva. Sopravvivenza del 60% a 5 anni.
85
EMERGENZE IPERTENSIVE
Urgenza: va trattata in tempi rapidi (entro 24h), ma dal momento all’ipertensione non si associano
danni d’organo si considera che la vita del paziente non sia imminentemente a rischio.
Emergenza: la situazione può precipitare rapidamente; indispensabile che ci sia riduzione della
pressione entro un’h , segni di danno d’organo. Bisogna intervenire entro poche ore.
In relazione al danno clinico-anatomico:
Urgenze HT: PDA> 120 mmHg, cefalea lieve o sintomi aspecifici, edema papilla (ma senza
alterazione della coscienza), ematuria. Fra le urgenze si annoverano: HT accelerata maligna (
condizione con PA>130mmHG, abbiamo pertanto un’emorragia severa, essudati retinici bilaterali;
il papille dea caratterizza la forma maligna. Si associa a cefalea, compromissione visus, aumento
della creatinemia, insufficienza cardiaca. Il deterioramento renale avviene per necrosi fibrinoide
delle arteriole. E’ una manifestazione tipica delle pan arteriti. Bisogna ridurre la pressione a 100110 più lentamente possibile), HT da rimbalzo ( es. la clomidina che inibisce il rilascio di
catecolammine. Dà sonno e Sjogrem con secchezza delle fauci, se interrotto bruscamente)HT in
pre- chirurgico o post-chirurgico , HT dopo trapianto renale.
Emergenze HT: Encefalopatia, insufficienza renale acuta, insufficienza ventricolo sx, edema
polmonare, ischemia miocardica, aneurisma dissecante, preclampsia, feocromocitoma, anti iMAOtiramina.
Farmaci d’urgenza:
Nifedipina: si da x os. E.c: cefalea, tachicardia. Enalapril: ACEi che si da per os o e.v. EC IRA+
Angioedema. Clonidina: azione centrale, inibisce il rilascio di catecolammine determinando
xerostomia e secchezza fauci. Fentolamina , Prazosin: il prazosi e il doxazosin sono più usati. È
un a bloccante che dà ipotensione ortostatica, tachicardia e cefalea. Metil-Dopa: ha un effetto
centrale e dà ipotensione (metil noradrenalina)
Farmaci d’emergenza:
Nitroprussiato di Na: agisce nel giro di secondi e dura pochi minuti, genera abbassamento
pressorio post dilatazione artero venosa. Induce tachicardia riflessa. Nitroglicerina: agisce in
secondi- minuti. E’ un dilatatore venoso. Induce cefalea, bradicardia, ipotensione Labetalolo: a1 b
bloccante. E’ inotropo negativo e induce bradicardia. Diazossido x os: 15 min-12h è un
vasodilatatore arterioso. Si usa soprattutto con insulinomi, essendo iperglicemizzante.
Propanololo: b bloccante meno usato. Agisce 5min-4h. induce bradicardia, scompenso
congestizio e broncospasmo. Meno usato. Furosemide: diuretico d’ansa agisce tra 5 min-2h. Può
indurre iponatremia e ipocalemia.
Segni di urgenza:
Cefalea: può essere un segno di urgenza ipertensiva o può essere la causa della reazione HT per
il dolore. Retinopatia HT: caratterizzata da vasi arteriosi ristretti, con vasi venosi aumentati (
inversione rappiorto artero-venosso): se il paziente è al III stadio abbiamo essudati a fiocchi di
cotone (d.d. diabete) + emorragia a fiamma. IV stadio: papilledema, macchia biancastra,
edematosa. Indica un grave stadio di ipertensione (anche in emergenza).
86
Segni di emergenza ipertensiva: alterazione della P con coinvolgimento d’organo.
Encefalopatia: in un paziente normale il break-point è 60-150 mmHg; in un paz con HT cronica la
curva di flusso si sposta 75-180/190 mm Hg. Una rid pressoria che induca un abbassamento del
flusso pressorio genera danni da ipo perfusione. Altrimenti un incremento oltre i valori alti di break
point induce edema , encefalopatia (alterazioni stato mentale). Edema polmonare: conseguenza
del sovraccarico del venticolo sx, scompenso acuto. Si deve intervenire rapidamente. Rantoli e
rumori umidi all’ascultazione. Anche terzo e quarto tono. Pre eclampsia: donna incinta (vaso
costrizione vasi placentari?). Altri segni sono iperriflessia e edemi periferici. IRA. Aneurisma
dissecante: anisosfigmia <120 mmHg tra dx e sx, soffio da insufficienza aortica di nuovo
riscontro o triade di BacK ( ipotensione, rid toni cardiaci, distensione giugulare). Feocromocitoma:
spesso si riscontano macchie caffè latte e neurofibromatosi. Assunzione inibitori MAO- tiamina.
Come ci comportiamo davanti un’emergenza? Ricorda: se l’ambiente ospedaliero è
rapidamente raggiungibile, non fare nulla.
Ambiente non ospedaliero: PAD> 130mmHg+ coinv organi bersaglio (dolore toracico,
scompenso cardiaco, deficit neurologici focali). Diamo: Nifedipina x os (Ca antagonista che
induce calo brusco della pressione, deve stare steso per due h per evitare una crisi ipotensiva).
Nitroglicerina sublinguale solo se abbiamo dolore toracico o scompenso cardiaco. Furosemide:
diuretico d’ansa, solo in caso di edema polmonare. Nitroprussiato+ b bloccante ( in caso di
sospetta dissecazione aortica; generalmente anziani ipertesi con dolore interscapolare)Metil
DOPA ( pre-eclampsia sospetta PA>140790 mmHg) cefalea-vomito, annebbiamento visus,
iperriflessia e edema periferici)
Ambiente ospedaliero:
1) accesso venoso 2 )ECG per controllo continuo 3)Rx torace per escludere edema polmonare
4)esami laboratorio (creatinina, ematuria, enzimi) 5)Tac senza contrato: valuti presenza
emorragia intracranica; edema. La risposta ha implicazioni terapeutiche: in caso ICTUS
emorragico, non dare anti aggreganti. Il prof darebbe in caso di ICTUS ischemico ASA con una
dose inferiore a quella di attacco normale perché il riscio di infarcimento emorragico aumenta se
c’è edema peri lesionale.
L’obiettivo per un’emergenza ipertensiva è abbassare la pressione del 20-30% senza sconfinare
il break point cerebrale, entro la prima ora.Si effettua: a. Raccolta anamnestica : storia HTA e
farmaci; doghe farmaci (abuso cocaina, iMAO, antidepressivi triciclici); segni di danno d’organo
(dolore toracico, alterazione visus, dispnea); gravidanza. b. Esame fisico: pressione alle due
braccia, soffi addominali, neosoffio da insufficienza aortica, papilledema, rantoli a grandi bolle,
neurofibromatosi, macchie caffè latte, iperiflessia, edemi periferici.
c. Trattamenti specifici: 1) Encefalopatia ipertensiva: all’anamnesi vengono riferiti sintomi
progressivi da uno due giorni. Progressivamente cefalea, nausea, vomito, annebbiamento,
convulsione e deficit neurologici. Si fa TAC e si da ASA ( dose bassa per evitare infarcimento
emorragico). Bisogna trattarla per evitare la progressione verso il coma e la morte, senza
abbassargli troppo la pressione generando crisi ipotensiva. Si somministra pertanto
Nitroprussiato ( nitroderivato con tachicardia riflessa) + LABIDOLOLO ( inibitore a e b con effetto
inotropo negativo, bradicardia).2) Dissecazione aortica: si dà nitro prussiato e b bloccanti;
LABETALOLO 3) Ischemia: nitroglicerina 4) Scompenso cardiaco congestizio: Furosemidenitroglicerina5)Gravidanza: metil dopa- solfato di maghesio 6)Feocromocitoma: si danno alfa
bloccanti come Prazosin. Mai usare B bloccanti puri, indurremmo crisi HTA.
87
SINDROME DA DISTRESS RESPIRATORIO ACUTO (ARDS): EMERGENZA
L’ARDS è un quadro patologico caratterizzato da edema polmonare acuto non cariogeno e
grave insufficienza respiratori a con ipossemia refrattaria. Caratterizzata da infiammazione del
parenchima polmonare, danno dell’endotelio micro vascolare e dell’epitelio alveolare che
favorisce, pertanto, l’aumento della permeabilità della barriera alveolo-capillare con edema
polmonare e ipossemia refrattaria. Criteri secondo NAECC (North American-European Consensus
Comitee): 1)esordio acuto; 2) PaO2/FiO2<200 (normalmente superiore a 300) 3) all’Rx infiltrati
polmonari bilaterali 4)Pressione capillare polmonare PCWP<18mmHG o mancanza di ipertensione
atriale sx. Il Lung injury severity score, non lo riporto.
Epidemiologia: incidenza 13/100.000, in aumento.picco 60-70aa. La mortalità aumenta con l’età.
Eziologia: espressione di una grande varietà di processi. La causa più frequente di ARDS è la
sepsi , ma possono causarla tutte quelle condizioni che determinano il rilascio in circolo di
sostanze vasoattive che danneggiano l’endotelio capillare e l’epitelio alveolare. Altre cause sono
infezioni con rilascio di endotossine o esotossine, shock, annegamento, pancreatite,
politrauma,inalazione di sostanze tossiche o succhi gastrici. Si distingue un’ARDS
intrapolmonare (la patologia primitiva genera alterazioni polmonari tali per cui è inutile la PEEP.
Es in caso di polmonite con consolidamenti polmonari), e un’ARDS extrapolmonare o sistemica
(la PEEP, in questo caso, favorisce il recruitment alveolare favorendo gli scambi gassosi).
Fisiopatologia: A seguito dell’aumentata permeabilità si osserva il passaggio di H2O, ma anche
di proteine dal capillare verso lo spazio interstiziale. Le pressione oncotica risulta pertanto
aumentata e, entro le 24h dall’insulto acuto, si sviluppa edema. C’è così alterazione degli scambi
gassosi con comparsa di ipossemia. Tale ipossemia è legata all’alterazione del rapporto
ventilazione/ perfusione con comparsa di aree ad alto rapporto (spazio morto)e aree a basso
rapporto con comparsa di shunt intrapolmonare (aree perfuse ma non ventilate). L’ipossemia è di
tipo refrattaria, ovvero non risponde alla somministrazione di O2. L’ipossemia determina un
aumento della ventilazione con comparsa di tachipnea. Nel processo evolutivo dell’ARDS
riconosciamo una prima fase essudativa: l’edemainizialmente drenato dai l’infatici si accumula
prima nell’interstizio e poi negli alveoli, alterando gli scambi gassosi e la ventilazione con
alterazione della compliance. L’estesa infiltrazione dei neutrofili causa la distruzione dei
pneumociti I. Entro 72 h inizia la seconda fase di tipo fibrotico: In questa fase c’è accumulo di
detriti proteici e fibrina a livello della parete alveolare che determina la formazione delle
caratteristiche membrane ialine. I pneumociti di tipo II proliferano e rimpiazzano i pneumociti
di tipo I; c’è riduzione del surfattante. Nei giorni successivi abbiamo proliferazione dei fibroblasti
con fibrosi dei dotti alveolari, dei bronchioli e distruzione dei capillari. La trasformazione fibrotica
determina la comparsa di bolle pseudo enfisematose. Proprio della seconda è l’aumentato
spazio morto e la riduzione della diffusibilità di membrana. Pertanto compare ipercapnia.
Quadro clinico e radiologico: L’ARDS è dominato da tachipnea e ipossemia refrattaria.
Prime fasi: Entro le 48h. Abbiamo tachipnea con sviluppo di ipocapnia e alcalosi respiratoria Rx:
nulla Ultime fasi: C’è IRA. Abbiamo dispnea, tachipnea, rantoli diffusi, riduzione della compliance
polmonare. La progressione è verso lo scompenso cardiaco con acidosi metabolica e respiratoria
e edema diffuso. Altri sintomi sono la cute pallida, cianotica e umida, alla fine sopore e letargia.
Rx: diffusi infiltrati polmonari bilaterali (opacità diffuse), fenomeni di redistribuzione della
vascolarizzazione (strie di Kerly?).
Nel monitoraggio del paziente, pertanto, è utile
studiare il quadro clinico,Rx torace,emogasanalisi ,ECG, emocromo, saturimetria, PA, FC e
diuresi.
88
Trattamento: Il problema dell’ARDS è l’ipossemia conseguente a shunt intrapolmonari. Pertanto
bisogna trattarla garantendo il reclutamento e la stabilizzazione degli alveoli non ventilati.
L’applicazione di una PEEP migliora l’ossigenazione determinando il reclutamento degli spazi
aerei collassati (reclutamento aree atelettasiche), promuovendo il movimento di liquidi dagli
alveoli all’interstizio, aumentando CFR. Inoltre la PEEP evita il fenomeno di apertura/chiusura
degli alveoli. Però, a causa della variazione della compliance polmonare tra le diverse zone del
parenchima,il valore di PEEP da applicare sarà compreso fra i 5 e i 20 cmH2O, affinché sia
raggiunto un buon bilancio fra effetti positivi e negativi. IL paziente con ARDS viene ventilato
mantenendo una FiO2 < 0,6, Volume corrente 4 ml/kg, una PEEP 5-20 cm H2O, ipercapnia
permissiva ( si è visto che riduce il rilascio di TNF,IL8, NFkb, NOS) con una frequenza di
2inspirazione:1espirazione (favorisce la formazione di una PEEP intrinseca). Gli effetti
collaterali della PEEP: riduzione della gittata cardiaca, aumento spazio morto, edema
polmonare,aumento delle resistenze bronchiali, richio baro trauma.
Il paziente può essere ventilato con SIMV, bi PAP, anche con NPPV (PSV). Importante la
posizione prona (migliora gli scambi gassosi)e un’adeguata fluido terapia, evitando il sovraccarico
emodinamico.
Supporto ventilatorio nell’edema polmonare cariogenoL’edema cariogeno è uno stato
patologico rapidamente reversibile una volta controllati i fattori patogenetici e il circolo vizioso
ipossemia/scompenso/ipoperfusione. Questi pazienti beneficiano di un supporto ventilatorio NIV
che consente l’applicazione di una PEEP e di ridurre il lavoro respiratorio. Frequentemente è usata
la cPAP (aumenta rapidamente la PO2 , diminuisce la PCO2 e riduce il post-carico, ) con PEEP di
circa 10 cmH2O applicata tramite maschera. La NPPV deve essere considerata una tecnica
complementare rispetto all’invasiva.
89
Insufficienza respiratoria: condizione caratterizzata dalla riduzione rispetto ai valori fisiologici
della tensione parziale di ossigeno nel sangue arterioso. Può associarsi o meno ad un aumento
della pressione parziale di anidride carbonica. La funzione polmonare si riduce sino a causare un
ipossia con PaO2 <60 mmHg. Si distingue una insufficienza respiratoria parziale (ipossiemica)
caratterizzata dalla sola riduzione della PaO2, ed una insufficienza respiratoria globale
(ipossiemica e ipercapnica) con riduzione della PaO2 e aumento della PaCO2. L’insufficienza
respiratoria globale è compensata quando i valori di pH restano nei limiti fisiologici (per il
riassorbimento renale di bicarbonati), scompensata quando vi è acidosi respiratoria. Si distingue
una forma di insufficienza respiratoria acuta (IRA, che compare in soggetti peraltro sani) ed una
forma cronica (tipica di pazienti con BPCO).
Eziopatogenesi: in base all’eziologia, sono differenziabili due forme di IRA:
• IRA di tipo I, non ipoventilatoria (disturbi dello scambio gassoso): in genere è ipossiemica,
ma non ipercapnica. Le cause dei disturbi di scambio gassoso sono: ARDS, edema
polmonare cardiogeno, emorragia da contusione polmonare, ischemia da embolia
polmonare, pneumotorace (retrazione del polmone), emotorace, ostruzioni bronchiali.
• IRA di tipo II, ipoventilatoria (disturbi della pompa respiratoria): in genere è ipossiemica e
ipercapnica. Le cause dei disturbi di pompa sono: lesioni encefaliche o midollari,
ostruzioni delle vie aeree, traumi torace, alterazioni toraco-pleuriche (emo o pneumotorace)
I meccanismi che causano IR sono pertanto: turbe della ventilazione (vi è ipoventilazione con
riduzione della PaO2 ed aumento della PaCO2, come accade nelle riacutizzazioni della BPCO);
turbe della diffusione alveolo-capillare (ostacolo al passaggio dell’O2, ma minor compromissione
dello scambio di CO2, come accade nella fibrosi polmonare), alterazioni del rapporto
ventilazione-perfusione (ventilazione in eccesso rispetto alla perfusione ossia spazio morto o in
difetto rispetto alla perfusione ossia effetto shunt).
Clinica: vi sono manifestazioni specifiche dei quadri morbosi che causano l’insufficienza ed altre
che sono costanti. Queste ultime sono: cianosi centrale a livello di cute e mucose visibili, dispnea
(anche respiro di Cheynes-Stokes). Inoltre sono possibili manifestazioni cardiovascolari
(tachicardia, aritmia, segni di scompenso destro), manifestazioni neuro-psichiche (sonnolenza,
irritabilità, tremori). Segni acuti di acidosi sono invece: alterazioni neurologiche e coma, segni di
iperpotassemia (aritmie, ipereccitabilità, astenia, etc.). A lungo termine l’ipossia, l’ipercapnia e
l’acidosi possono causare: a livello polmonare: ipertensione arteriosa (c’è vasocostrizione di
compenso nella aeree di polmone poco ventilate e quindi aumento delle resistenze); a livello
cardiaco: possibile evoluzione a cuore polmonare; a livello renale: ipossiemia e ipercapnia
causano ischemia con aumento delle resistenze ed evoluzione verso l’insufficienza renale; a livello
cerebrale: incremento del flusso sanguigno (se si aggrava può dare edema cerebrale); sangue:
poliglobulia e macroglobulia con aumento della viscosità (produzione di EPO). Crollo della PA.
Diagnosi: anamnesi ed esame obiettivo possono far porre diagnosi e dare indizi sulla causa. Esami
strumentali: Emogasanalisi arteriosa: la si deve ripetere più volte (si preleva il sangue in genere
dall’arteria radiale e l’emoganalizzatore lo analizza). Valuta: PaCO2, pH, PaO2. Con la saturimetria
transcutanea si valuta la saturazione. Si possono eseguire: capnometria, Rx e TC torace.
Terapia IRA: vi è una terapia aspecifica, volta a risolvere l’ipossiemia e l’eventuale acidosi, ed una
terapia specifica volta a rimuovere le cause di IRA:
• Aspecifica: Ossigenoterapia con maschera Venturi: si indica in caso di PaO2 <60mmHg o
saturazione <90%. Terapia posturale: porre il paziente in ortostatismo o posizione seduta
in decubito ortopnoico. Correzione dell’acidosi: in caso di acidosi è necessaria la
ventilazione artificiale. Se non è possibile si usano sostanze tampone come trometamolum
(non tanto bicarbonato, che fa produrre altra CO2).
• Specifica: è volta a risolvere le possibili cause:
o Airway failure: ostruzione delle vie aeree: disostruzione meccanica (solo da lingua
o corpi estranei), disostruzione farmacologica (corticosteroidi, antistaminici, beta2stimolanti possono risolvere edema o broncospasmo), intubazione endotracheale.
o Pump failure: deficit di pompa: ventilazione meccanica (no CPAP).
o Gas eschange failure: deficit di scambio gassoso: Per aumentare la pressione e la
distensione alveolare: impiego di una pressione espiratoria positiva nelle vie aeree
(PEEP) associata o meno a ventilazione meccanica. Inoltre: Se vi è ostruzione
bronchiale: fibrobroncoscopiaSe vi è occupazione pleurica: toracentesi o drenaggio
pleurico. Se vi è danno alveolare o capillare: Terapia medica: antibiotici contro
infezioni, terapia edema polmonare cardiogeno, terapia ARDS, etc.
90
Ventilazione meccanica: può essere invasiva (protesizzazione) o non invasiva:
Ventilazione meccanica non invasiva (NIV)
La ventilazione meccanica è la ventilazione sostenuta da una pompa artificiale che viene connessa
alle vie aeree del paziente sostituendosi alla sua normale pompa (diaframmatica).
Protesi respiratorie non invasive: possono essere utilizzate varie protesi. Tra queste ci sono gli
occhialini nasali (garantiscono un flusso scarso, non utili in emergenza) e diversi tipi di maschere.
La maschera con reservoir è collegata ad un palloncino che funge da riserva di ossigeno, permette
l’espirazione al di fuori del palloncino e l’inspirazione della sola aria del palloncino garantendo
una somministrazione anche di FiO2=1 cioè O2 al 100%. La maschera di Venturi è una maschera
che attraverso un sistema di valvole permette una somministrazione accurata di percentuali di
ossigeno (massimo 50%). Altre tecniche sono la maschera oronasale, nasale, casco.
Queste protesi sono poi collegata ad un ventilatore che ventila attraverso diverse tecniche.
Rischi e complicanze:
• Generali della ventilazione artificiale (invasiva e non invasiva): causano un aumento
della pressione intratoracica con associata: riduzione del ritorno venoso, diminuzione
della gittata cardiaca (ridotta funzione ventricolare destra e sinistra), ipotensione
arteriosa, alterazione del rapporto V/P, ridotto flusso renale, barotrauma polmonare.
• Specifici della ventilazione non invasiva: insufficiente tenuta pneumatica (possibili fughe
di gas), discomfort, lesioni trofiche (da decubito) della maschera, distensione dello stomaco.
Vantaggi della NIV rispetto alla ventilazione invasiva: riduzione del lavoro respiratorio (il
passaggio di aria attraverso la protesi risulta più difficoltoso), assenza delle complicanze proprie
della protesizzazione (lesioni, infezioni, etc.), possibilità di evitare la sedazione, conservazione
delle funzioni glottiche (deglutizione, fonazione, tosse, riflesso glottico).
Indicazioni e controindicazioni alla NIV:
• Indicazioni: le principali sono la BPCO riacutizzata, EPA cardiogeno e crisi asmatica.
• Contronidicazioni: scarsa compliance del paziente, grave stato di agitazione, difficoltà nel
mantenere il decubito (almeno a 45°), alterazioni dello stato di coscienza.
Indicazioni all’intubazione tracheale: si preferisce in caso di ostruzioni delle vie aeree superiori,
rischio di ab ingestis, severo deficit di scambio gassoso (PaO2<60 a FiO2=1) e ventilatorio,
instabilità emodinamica o elettrocardiogragfica, barotraumatismo polmonare, alterazione dello
stato di coscienza, acidosi grave (<7,25), stato di shock.
La NIV cede il passo all’intubazione se dopo 30-60’ persistono ipssiemia, ipercapnia, acidosi o
instabilità emodinamica.
Tecniche di ventilazione polmonare non invasive: sono eseguite senza ausilio di una protesi
respiratoria endotracheale o extraglottica.
• Ventilazione non invasiva a pressione negativa: ventilazione a pressione negativa
esterna, come nel caso dell’ormai desueto polmone d’acciaio.
• Ventilazione non invasiva a pressione positiva: tramite ventilatori collegati ad una
maschera facciale, si induce una pressione positiva interna, PEEP. La tecnica della PEEP,
pressione espiratoria positiva è una tecnica che mantiene la pressione delle vie aeree,
durante l’espirazione, a livelli superiori alla pressione atmosferica. Può essere applicata a
tecniche di ventilazione spontanea, assistita o controllata. Impedisce il collasso degli
alveoli durante l’espirazione. Le tecniche di NIV sono:
1. CPAP: tecnica di ventilazione spontanea. È indotta una PEEP, pressione espiratoria
positiva, ma il paziente, seppur ad un livello di pressione più alto rispetto a quello
atmosferico, respira spontaneamente. Vi è un aumento della CFR.
2. BIPAP: tecnica simile alla CPAP, che permette la ventilazione spontanea del paziente. In
questo caso però il paziente ventila su due diversi livelli di PEEP che si alternano
ciclicamente. Il passaggio dal livello di pressione inspiratoria, IPAP (più alto) ed il livello di
pressione espiratoria EPAP (più basso) produce in pratica una espirazione meccanica
(erogata dal ventilatore), mentre il passaggio dal livello di EPAP all’IPAP produce una
inspirazione meccanica. La frequenza con cui si ripete il ciclo può essere regolata in modo
da permettere al paziente di compiere più atti respiratori spontanei tra un ciclo e l’altro.
91
3. PSV: tecnica di ventilazione assistita. In questo tipo di ventilazione gli atti non sono
erogati a intervalli predefiniti, bensì solo al momento dell’inspirazione dell’espirazione
volontaria del paziente. Vi è un meccanismo capace di captare il passaggio (trigger) del
paziente dall’espirazione all’inspirazione e viceversa, considerando che quando il paziente
inspira si produce un calo della pressione (rispetto a quella atmosferica o alla PEEP). Anche
questa tecnica può essere eseguita ponendo una PEEP più alta di quella atmosferica. Il
paziente verrà aiutato dal respiratore a compiere i suoi atti respiratori spontanei. La PS è
molto utile per le fasi di svezzamento dal ventilatore.
4. SIMV: si tratta di un tipo di ventilazione intermittente/controllata. Sono consentiti al
paziente atti respiratori spontanei tra gli atti imposti dal ventilatore, che vengono calibrati
sulla frequenza desiderata. Attualmente gli atti meccanici sono sincronizzati (SIMV
piuttosto che IMV) con il normale respiro del paziente. Anche la SIMV può essere usata per
lo svezzamento. Può richiedere un maggiore sforzo (fatica muscolare) da parte del
paziente. Può naturalmente essere associata a PEEP o anche a PSV (per gli atti spontanei).
5. Ventilazione controllata: il ventilatore eroga un volume di aria prestabilito ad intervalli di
tempo fissi. Bisognerà regolare la frequenza degli atti, il volume erogato al minuto, la
pressione di picco, il rapporto tra tempo di inspirazione ed espirazione, la PEEP. È indicata
per condizioni gravi o incapacità totale di controllare il respiro.
Monitoraggio:
• Strumentale: saturimetria, capnometria, emogasanalisi a 1h, 4h, 12h di ventilazione.
• Clinico: livello di coscienza, frequenza respiratoria, dispnea, impegno dei muscoli
accessori, respiro paradosso, frequenza cardiaca, pressione arteriosa.
• Monitoraggio del ventilatore: VT>5ml/kg, RR≈25/min; interazione pz/ventilatore.
Svezzamento: o weaning, manovra d’interruzione del supporto ventilatorio che viene iniziato al
termine del processo di guarigione dalla patologia che ha causato il bisogno del supporto.
Bisognerà valutare attentamente il paziente (condizioni emodinamiche, metaboliche, febbre,
shock). Il sistema più semplice di svezzamento consiste nella deconnessione del ventilatore e nella
connessione al tubo tracheale di un sistema di arricchimento con ossigeno dei gas inspirati.
Alternative sono l’utilizzo, gradualmente verso il basso, delle tecniche di ventilazione assistita
come BIPAP, PSV o anche la SIMV.
Ventilazione meccanica invasiva
Intubazione tracheale trans laringea: procedura d’emergenza volta ad inserire una protesi
respiratoria in trachea attraverso la rima della glottide.
Complicanze: intubazione endobronchiale o dell’esofago, lacerazione delle vie aeree superiori a
vari livelli, ostruzione del tubo o dislocazione o rottura dello stesso, inalazione tracheo bronchiale,
infezioni respiratorie, decubiti. Post-estubazione: spasomo o edema della glottide, laringite,
dolore, paresi. Tardive: stenosi, alterazioni deglutizione e corde vocali, ulcere e fistole.
Vie di accesso: può essere condotta per via orale o per via nasale (rinotracheale).
Tecnica standard di intubazione: la tecnica più comune è la laringoscopia diretta che richiede
l’utilizzo di un laringoscopio. Può essere necessaria anestesia e preossigenazione del paziente. Il
paziente è supino con capo esteso e sollevamento del mento. Sollevare l’epiglottide ed esporre
quindi la rima della glottide attraverso il laringoscopio. Si inserisce quindi il tubo in trachea e si
procede a gonfiare il cuff per evitare perdite di aria nel faringe durante la ventilazione. Si inizia
con la ventilazione pallone-tubo, poi, dopo aver valutato la corretta posizione della protesi e averla
ancorata alla cure (con cerotto) si procede all’auscultazione del torace e determinazione ad
esempio della CO2 espirata.
Cricotirotomia: tecnica utile a conseguire un accesso tracheale d’emergenza attraverso uno stomo
aperto a livello dello spazio intercricotiroideo.
Tracheotomia: è più complesso reperire la trachea. Consente di inserire tubi di diametro maggiore.
Inoltre la procedura è meno rapida, ed ha maggior complicanze.
92
Sbobbinatura prof De Robertis RIACUTIZZAZIONI DI BPCO
Esse sono causa comune di mortalità e morbilità in quanto si crea un equilibrio respiratorio molto precario che viene completamente sovvertito anche da piccoli stimoli nocivi che nell’individuo sano non provocherebbero nulla. Evento nella storia naturale della BPCO caratterizzato da modificazioni delle condizioni di base del paziente relativamente a DISPNEA, TOSSE e/o CARATTERISTICHE QUALITATIVE/QUANTITATIVE DELL’ESPETTORATO che vanno al di là delle variazioni quotidiane e che richiedono una modificazione del trattamento abituale. molte sono le cause di riacutizzazione ma le più frequenti sono: 1. Infezioni; 2. Inquinamento atmosferico: il calore, l’umidità dell’aria che respiriamo e le polveri sottili in essa presente ne peggiorano la qualità facilitando l’alterazione di quel sottile equilibrio presente nel pz BPCO; d’altronde, anche il pz asmatico risente fortemente di queste condizioni, ad esempio riferisce la comparsa di asma se fa jogging la mattina per la maggiore umidità dell’aria. 3. In un terzo dei casi, la causa della riacutizzazione non è definibile INDICAZIONI AL RICOVERO DEL PZ CON BPCO: •
Presenza di comorbidità ad alto rischio (polmonite, aritmie, scompenso cardiaco, diabete, insufficienza epatica o renale) •
Risposta inadeguata alla terapia ambulatoriale •
Marcato incremento della dispnea •
Compromissione delle normali attività di vita (alimentarsi, dormire) •
Peggioramento dell’ipossiemia •
Peggioramento dell’ipercapnia •
Alterazioni del sensorio •
Non autosufficienza (mancanza di supporto familiare) •
Dubbio diagnostico INDICAZIONI AL RICOVERO IN ICU DEL PZ CON BPCO: •
Dispnea grave che risponde in modo inadeguato alla terapia d’urgenza iniziale •
Confusione mentale, letargia, coma •
Ipossiemia persistente o ingravescente (PaO2<40 mm Hg) e/o ipercapnia grave/ingravescente (PaCO2>60 mm Hg), e/o acidosi respiratoria grave/ingravescente (pH< 7.25) nonostante l’incremento dell’ossigenocorrezione e NIPPV 93
TRATTAMENTO DELLE RIACUTIZZAZIONI DI LIVELLO I OVVERO PZ AMBUATORIALI: BRONCODILATATORI: SI CERCA DI SCEGLIERE SEMPRE LA MOLECOLA CON IL MINORE EFFETTO POSSIBILE SUL CUORE, ANCHE SE QUESTO è UN OBIETTIVO IRREALIZZABILE, DATO CHE TUTTE LE MOLECOLE SE PUR IN MISURA MINIMA AGISCONO SUI RECETTORI BETA CARDIACI •
b2agonisti short acting e/o ipratropium •
Considerare l’aggiunta di un broncodilatatore long acting se non già in uso •
Nella terapia cronica i broncodilatatori più usati sono: salbutamolo (short acting) salmeterolo e formeterolo (long acting), ipratropio/tiotropio (anticolinergici) e la teofillina(metilxantine‐da usare solo in fase acuta e sotto stretto controllo medico per la finestra terapeutica particolarmente ridotta e di conseguenza il rischio elevato di effetti collaterali a livello cardiovascolare e neurologico) CORTICOSTEROIDI •
Prednisone per os 30‐40 mg/dì per 10 giorni •
Considerare l’utilizzo di steroide inalatorio •
Per os si usa soprattutto il prednisone; per via inalatoria le molecole più impiegate sono: fluticasone e budesonide. È un’indicazione di massima perché ormai le molecole a disposizione sono numerosissime ANTIBIOTICI •
Possono essere utilizzati in pazienti con alterazioni quali/quantitative delle secrezioni bronchiali (scelta in base al pattern delle resistenze locali). In realtà, la maggior parte delle riacutizzazioni riconosce causa virale ciononostante si fa una terapia antibiotica di profilassi perché questi pz sono pieni di secrezioni in cui spesso ci può essere un focolaio batterico. TRATTAMENTO DELLE RIACUTIZZAZIONI DI LIVELLO II OVVERO PZ RICOVERATI: BRONCODILATATORI •
b2agonisti short acting (albuterolo, salbutamolo) e/o •
Ipratropium MDI OSSIGENOTERAPIA se saturazione < 90% CORTICOSTEROIDI •
Prednisone per os 30‐40 mg/dì per 10 giorni, oppure la dose equivalente per via ev sino ad un massimo di 14 giorni •
Considerare l’utilizzo di steroide inalatorio ANTIBIOTICI 94
•
Possono essere utilizzati in pazienti con alterazioni quali/quantitative delle secrezioni bronchiali (scelta in base al pattern delle resistenze locali) TRATTAMENTO DELLE RIACUTIZZAZIONI DI LIVELLO III OVVERO PZ RICOVERATI IN ICU OSSIGENOTERAPIA: oggi si evita soprattutto in questi pz di dare ossigeno al 100% perché questo potrebbe peggiorare ulteriormente la ventilazione, abolendo in parte lo stimolo principale al respiro spontaneo e favorendo una situazione di ipercapnia. Infatti gli obiettivi sono: mantenere una buona ossigenazione del sangue, con una saturazione>90% e scongiurare episodi di acidosi respiratoria e di ipercapnia. SUPPORTO VENTILATORIO: viene instaurato quando l’ossigenoterapia non è più sufficiente a garantire una buona ventilazione BRONCODILATATORI •
b2agonisti short acting (albuterolo, salbutamolo) e ipratropium MDI (2 puff / 2‐4 ore) (¹se pz ventilato). Considerare b2agonisti long‐acting CORTICOSTEROIDI •
Prednisone per os 30‐40 mg/dì per 10 giorni, oppure la dose equivalente per via ev sino ad un massimo di 14 giorni •
Considerare l’utilizzo di steroide inalatorio ANTIBIOTICI: la maggior parte di questi pazienti viene da un ambiente domestico, quindi i germi responsabili di un’eventuale infezione sono sicuramente comunitari. Tra i più frequenti gram negativi semplici e batteri acellulari. In questi casi, si possono usare molecole altrettanto semplici come macrolidi o amoxicillina acido clavulanico, in modo da riservarsi farmaci più potenti in caso di mancata risposta. Va da se che se il pz si presenta all’osservazione medica con una polmonite conclamata e gravi condizioni cliniche si dà subito un antibiotico più potente. In più il farmaco va scelto sulla base della conoscenza delle principali resistenze locali. NON INVASIVE VENTILATION (NIV) Consiste in una tecnica di ventilazione non invasiva ovvero senza intubare il paziente; risulta molto utile nei pz ipercapnici (come quelli con BPCO) che nonostante una terapia medica ottimale non riescono a migliorare il profilo dei gas ematici. La diffusione della niv oggi è attribuita anche all’aumento notevole delle interfacce disponibili per eseguirla, una delle tante è il casco, che comunque sono ben tollerate dal pz e che con un buon utilizzo e esperienza del personale permettono in realtà di trattare un numero di pz molto elevato, anche quelli più critici. È questo un dato molto importante, perché si riduce nettamente il numero delle intubazioni oro tracheali da fare, evitando tra l’altro tutte quelle situazioni di difficile tubazione dei pz, i quali si adattano molto bene alla IOT e per questo motivo sono difficili da riportare ad una ventilazione spontanea. 95
Emorragie digestive:
Le emorragie digestive possono essere acute e croniche. Quelle acute sono spesso gravi e
potenzialmente letali, si manifestano spesso con shock ipovolemico e oligo-anuria. Quelle
croniche, che possono manifestarsi con sangue occulto nelle feci (SOF) ed anemia, possono essere
sintomo di gravi patologie. Distinguiamo: ematemesi (emissione con il vomito di sangue rosso o
color posa di caffè per trasformazione nello stomaco dell’emoglobina in ematina), melena (feci
picee, bastano 50-100 cc di sangue), enterorragia (emissione di sangue rosso dal retto).
Valutazione della perdita di sangue e iniziale sospetto diagnostico: fondamentale, anche se sia
l’ematemesi che la melena possono verificarsi a vari livello del tubo digerente. In genere:
• Ematemesi senza melena: indica emorragia che origina prossimalmente al legamento di
Treitz; è un sintomo grave in genere associato a perdita ematica cospicua e acuta che
spesso richiede intervento chirurgico d’urgenza.
o Ematemesi con sangue rosso vivo: l’emorragia è di tale portata da causare vomito
prima della trasformazione in ematina da parte dello stomaco.
o Ematemesi con vomito caffeano: l’emorragia può anche essere abbondante, ma il
sanguinamento è lento, l’emoglobina è trasformata in ematina. Può esserci melena.
• Vomito di sangue deglutito: simile a ematemesi, ma dovuta a epistasi massiva o emottisi.
• Melena: può indicare una perdita in qualunque punto del tubo digerente però con tempo
adeguato da poter essere digerito e assumere il colore piceo. Nel 50% dei casi di emorragie
gastroduodenali ed esofagee vi è solo melena.
• Enterorragia: di solito è segno di un’emorragia distale rispetto al legamento di Treitz, in
genere oltre l’ileo terminale.
Clinica: dipende dal sangue perduto e dalla velocità con cui si verifica la perdita. Una perdita
inferiore a 500 ml raramente causa sintomi (a volte in anziani o anemici). Perdita rapida di sangue:
caduta volemia, riduzione quindi di ritorno venoso e gittata, vasocostrizione riflessa.
Perdita >20% della volemia: ipotensione ortostatica, sincope, nausea, confusione, sete.
Perdita >40%: marcata ipotensione, tachicardia, oligo-anuria, cute pallida, possibile coma.
Approccio iniziale al paziente con emorragia digestiva: la prima cosa da fare è valutare le
condizioni generali attraverso gli esami ematologici e quindi valutare i segni vitali, deficit di
coagulazione, funzione epatica e renale. Si valuta l’ematocrito (anche se immediatamente dopo
può non essere attendibile) per valutare se servono trasfusioni (ad ogni unità % di ematocrito
corrisponde perdita di circa 100 ml di sangue).
La terapia rianimatoria è fondamentale in caso di shock ipovolemico tramite infusione di plasma
expanders e sangue intero. Migliorare la diuresi e la respirazione. Valutare l’anamnesi patologica e
farmacologica. Stabilizzate le condizioni si può passare ad esami strumentali.
Terapia: Terapia medica: vasocostrittori (vasopressina), antiacidi e anti-H2, PPI, somatostatina.
Terapia endoscopica: l’endoscopia deve essere eseguita precocemente. Si può effettuare
elettrocoagulazione, laser terapia, terapia sclerosante. Chirurgica: dipende dalla patologia.
Approccio diagnostico-terapeutico:
Emorragie del primo tratto del tubo digerente
Eziologia: le cause più frequenti sono l’ulcera duodenale, ulcera gastrica, le varici esofagee, la
sindrome di Mallory-Weiss e cause oncologiche, diverticoli, ernia iatale. Anche vasculiti ed
emopatie. Se si sospetta un origine gastro-duodenale si deve posizionare un sondino nasogastrico, lasciato in situ per almeno 12 ore, al fine di segnalare la ripresa del sanguinamento. Se il
sondino indica emorragia in atto si procede a: lavaggi dello stomaco con soluzione fisiologica
fredda, instillazione di pro coagulanti ad azione topica (fino a che l’aspirato non è privo di
sangue). Se il sondino rileva solo modesta quantità di liquido caffeano, l’emorragia è cessata.
L’endoscopia è in ogni caso da effettua tra le 12-24 ore dall’inizio dell’emorragia.
Il sospetto di emorragia gastroduodenale deve venire anche in caso di melena senza ematemesi.
L’esame endoscopico consente di valutare il tipo di lesione e la sede e talvolta permette un
trattamento emostatico di coagulazione (elettrocoagulazione, sclerosi di varici esofagee, etc.).
Se l’endoscopia non identifica la lesione (sanguinamenti massivi) o le condizioni del paziente sono
critiche, è indicato l’intervento chirurgico d’urgenza. In caso di varici iniziare la terapia (vedi poi).
96
Classificazione dell’attività di sanguinamento, Forrest: IA: emorragia arteriosa in atto IB:
emorragia venosa in atto. II: coagulo alla base dell’ulcera o vaso visibile III: no segni di
sanguinamento recente.
Emorragie del tratto intermedio-distale
Sono emorragie del tenue e del colon-retto e possono avere eziologia assai varia. L’emorragia può
rendersi evidente con melena (in genere a livello del tenue prossimale) o enterorragia (in genere a
livello del colon distale), anemia ipocromica e SOF (sanguinamento cronico e modesto).
Eziologia: le cause più comuni sono malattia diverticolare, rettocolite ulcerosa, infarto
mesenterico, Crohnm enteriti gravi, diverticoli, emorroidi, ragade anale, etc. In caso di melena si
pone comunque il sondino naso-gastrico. Altrimenti la ricerca della sede va eseguita con la
pancolonscopia che permette biopsia e elettro/laser-coagulazione e non richiede preparazione del
paziente (solo assicurarsi che sia stabile). In caso di sanguinamenti non controllabili con terapia
medica si richiede l’intervento chirurgico.
97
Malattia peptica
Nello stomaco esiste una condizione fisiologica di equilibrio tra fattori aggressivi e difensivi che
regola la secrezione acida gastrica. La malattia peptica è una condizione in cui vi è un aumento
della secrezione di pepsina e HCL con iperacidità gastrica (indipendentemente dalla
presenza/assenza di erosioni o ulcere). Il paziente lamenterà bruciore, acidità, digestione lenta con
dispepsia. Questa condizione prende il nome di gastrite.
La gastrite, successivamente al sospetto clinico, si diagnostica istologicamente mediante
endoscopia e biopsia valutando vari parametri come infiltrato infiammatorio, perdita ghiandolare,
fibrosi, presenza/assenza di Helicobacter pylori. La presenza di H.Pylori può essere evidenziata
attraverso il test fecale e il breath test.
La gastrite acuta dura in media 1-2 settimane ed è autolimitante. Le cause più comuni sono: FANS,
alcol, stress, H.Pylori. L’infezione da H.Pylori è la causa principale di gastrite cronica, una gastrite
che dura invece mesi-anni e ha una sintomatologia molto sfumata.
La gastrite acuta da stress è una forma di gastrite tipica dei pazienti ricoverati in UTI o
rianimazione con erosioni e ulcere multiple del corpo gastrico e dell’antro per ischemia a livello
della mucosa dovuta a iperstimolazione del sistema adrenergico con liberazione di amine
vasoattive e cortisolo con riduzione dei bicarbonati.
Come già accennato, nel 95% dei casi di gastrite cronica l’eziologia è da ricondursi invece a
un’infezione di Pylori, che in genere tende a localizzarsi nell’antro ma che con il tempo può
progredire e interessare copro e fondo (pangastrite). L’infezione infatti richiama neutrofili e
linfociti con infiltrato infiammatorio che può condurre a una condizione di gastrite cronica
atrofica, una condizione precancerosa con perdita delle strutture ghiandolari. La liberazione di
HCl indotta dall’infezione causa danno al duodeno, predisponendo all’ulcera duodenale.
Per questo è fondamentale una diagnosi precoce per instaurare rapidamente una terapia medica di
eradicazione dell’infezione. La terapia più utilizzata per la gastrite è la cosiddetta Triplice terapia:
Amoxicillina/metronidazolo + claritromicina + PPI.
Ulcera peptica
Si tratta di una lesione di continuo della mucosa e della sottomucosa dello stomaco che si estende
fino alla muscolare ma che può, talvolta, perforare la sierosa. Va distinta dall’erosione che invece è
una lesione superficiale che non supera la muscolaris mucosae.
1) Ulcera gastrica: è più comune nei maschi, più tra 50-60 anni (l’età media è di 10 anni più alta
rispetto all’ulcera duodenale). Il muco gastrico, il rapido turnover delle cellule epiteliali e la buona
vascolarizzazione (che aiuta a eliminare l’eccesso di acidi) sono tutti fattori normalmente protettivi
la mucosa gastrica. Nello stomaco dei pazienti affetti vi sono infatti sempre alterazioni di tipo
gastritico. Nel 50-65% di pazienti con ulcera gastrica è riscontrabile a livello antrale H.Pylori. Altri
fattori lesivi sono i FANS (che riducono la concentrazione di bicarbonato e la sintesi di
prostaglandine), l’alcol, la caffeina (che aumenta la secrezione gastrica), il fumo. L’ulcera gastrica
insorge perciò in genere vicino al piloro, su mucosa iperemica e con segni di gastrite.
Clinica: è una patologia cronica con periodi di remissione e riacutizzazione. Alcuni pazienti
possono essere asintomatici. Il sintomo d’esordio è dolore epigastrico postprandiale precoce
(dopo 30 minuti circa). Il cibo può anche peggiorarlo. Periodicità stagionale con recrudescenze
primaverili e autunnali. Vi può essere anemia per stillicidio ematico e calo ponderale.
2) Ulcera duodenale: è 4-10 volte più frequente dell’ulcera gastrica, con incidenza massima intorno
ai 40 anni. L’eziologia non è certa, ma in ogni caso pare esserci una condizione di ipersecrezione
acida. FANS e cortisonici, caffeina e altre xantine, sono fattori di rischio. H.Pylori (che causa
gastrite e duodenite) si riscontra in più dell’85% dei casi. In genere l’ulcera si localizza vicino al
piloro, nel bulbo duodenale.
Clinica: associata a dolore epigastrico postprandiale tardivo (1-3 ore) con assunzione di cibo che
in genere risolve il dolore. È ricorrente, con periodicità stagionaleb e recrudescenze spesso in
primavera e autunno.
Diagnosi: oltre alla clinica, con dolore tipico e sintomatologia ricorrente e intermittente e un
anamnesi spesso di gastrite sono utili esami strumentali per la diagnosi di ulcera gastroduodenale. Endoscopia: sarebbe l’approccio di prima scelta, permettendo la visione diretta
dell’ulcera (valutarne la guarigione) e l’esecuzione di biopsie e ricerca di H.Pylori. Esame
radiologico con pasto baritato: nell’ulcera gastrica si nota la nicchia ulcerosa. Nell’ulcera
duodenale anche è visibile un cratere verso cui convergono le pliche mucose ispessite.
98
Complicanze: possono essere anche molto gravi. Possiamo avere:
• Perforazione: avviene in genere per erosione lenta della parete gastrica o duodenale, in
seguito a penetrazione dell’ulcera. La sede è in genere la piccola curvatura o la regione
antrale (gastrica), mentre per le duodenali la parete anteriore del duodeno. Vi può essere
aderenza dei tessuti contigui prima della perforazione (perforazione coperta).
Clinica: è un quadro di peritonite acuta. Diviene purulenta in 12-24h. Saccata se coperta.
L’esordio è acuto, con dolore intensissimo in epigastrio o ipocondrio destro, conati di
vomito. Il dolore si irradia a tutto l’addome. Febbre e leucocitosi. Paziente che appare
raggomitolato con segni di shock (cute fredda e pallida, polso frequente, ipotensione).
Si ha un quadro insomma di addome acuto peritonitico (addome ligneo, ileo paralitico,
scomparsa dell’area di ottusità epatica). Diagnosi: anamnesi e clinica. Si esegue un ECG
per escludere l’infarto cardiaco. Terapia: manovre rianimatorie, svuotamento stomaco con
sondino naso-gastrico, somministrazione di antibiotici e anti-H2-recettori. Si fa quindi
l’intervento, in genere semplice sutura dell’ulcera perforata (raffia). Si può fare exeresi
dell’ulcera con vagotomia e piloro plastica, rara la gastroresezione. La mortalità è 10%.
• Emorragia: nel 45% dei casi di sanguinamento alto la causa è un’ulcera peptica. È una
complicanza che avviene nel 15-20% dei casi, causa metà dei decessi. Il sanguinamento
spesso recidiva (soprattutto nei primi giorni, più con emoglobina bassa ed età avanzata).
L’ulcera gastrica recidiva più spesso della duodenale. La mortalità è di circa il 15%, 30% se
è una recidiva. A volte c’è solo stillicidio e sangue occulto nelle feci. Solo se l’emorragia è
copiosa si ha ematemesi. Diagnosi: si stabilizza il paziente e si esegue endoscopia. Si fa
lavaggio dello stomaco, rimozione di sangue e coaguli, monitoraggio con sondino nasogastrico e uso H2-RA. Possibili anche elettro o laser coagulazione e legatura dell’arteria.
• Stenosi: frequente se l’ulcera è iuxtapilorica. Si ha prima stenosi funzionale, poi proprio
organica con sclerosi del piloro. Se la stenosi è modesta causa solo un aumento del dolore e
dispepsia. Se è serrata è molto frequente il vomito alimentare, talvolta provocato. Si ha
rapido calo ponderale e malnutrizione. Terapia: correzione dei eventuali squilibri idroelettrolitici (alcalosi ipocloremica da vomito) e gastroresezione distale o bypass con gastroenterostomia a monte della stenosi.
• Cancerizzazione: è molto bassa la possibilità di una trasformazione maligna e comunque
riguarda solo le ulcere gastriche, ma non le duodenali.
Terapia: prima il ricorso alla chirurgia era sempre necessario, ora grazie alla terapia con H2bloccanti e IPP ed eradicazione di H.Pylori, è sempre più raro e riservato alle complicanze
maggiori (le 4 suddette) o sospetta natura maligna, scarsa compliance terapia medica. Gli
interveni mirano a: asportare l’ulcera resecando antro o bulbo duodenale e/o ridurre la secrezione
acida gastrica recidendo i rami gastrici del nervo vago. Abbiamo:
• Ulcorrafia laparoscopica: drenaggio del materiale presente in addome e chiusura della
perforazione (quindi in caso di perforazione).
• Vagotomia: ipersecrezione acida non rispondente alla terapia e fortemente sintomatica. La
vagotomia non risulta efficace nella sindrome di Zollinger Ellison e in altre condizioni di
ipergastrinemia. Viene eseguita sempre più raramente. La percentuale di recidive è elevata.
Esistono ora interventi di vagotomia sempre più distali e selettivi.
• Antrectomia con vagotomia: nei casi gravi di ipersecrezione acida. Si procede alla
resezione dell’antro gastrico, del piloro e del duodeno prossimale con riduzione del
volume dello stomaco del 30-50%; si procede anche a una contemporanea vagotomia. Il
ripristino della continuità del canale alimentare avviene di solito per gastro-duodenostomia
termino-terminale o termino-laterale (intervento secondo Bill-roth I) o gastrodigiunostomia (secondo Billroth II).
• Duodeno-gastroresezione: resezione dei 2/3 distali dello stomaco e della porzione
prossimale del duodeno con ricostruzione Billroth II. Bassa frequenza di recidive.
• Gastrectomia totale: necessaria talvolta in caso di ulcere sottocardiali associate a ZollingerEllison refrattarie alla terapia o in caso di gravi gastrite acute emorragiche. L’asportazione
dello stomaco è seguita da esofago-digiunostomia ricostruttiva.
99
Ipertensione portale
Anatomia della circolazione portale: La vena porta è formata dalla vena mesenterica superiore e
della vena splenica: la prima drena il sangue dell’intestino tenue e del colon destro, la seconda il
sangue della milza e di parte di stomaco e pancreas. La porta decorre nel legamento
epatoduodenale, dietro arteria epatica e via biliare. La vena mesenterica inferiore invece sbocca
direttamente nella vena splenica o più raramente nella mesenterica superiore. La gastrica sinistra
sbocca nel bordo sinistro della vena porta o più raramente nella vena splenica.
Fisiologia: si parla di ipertensione portale (IP) quando la pressione portale supera i valori normali
di 10-15 cmH2O, per portarsi al di sopra dei 22-25. Il flusso portale è di fatto il 75% di tutto il
sangue che giunge al parenchima e dipende dal gradiente pressorio tra la vena porta e le vene
sovraepatiche (dove la pressione è di 3-8cmH2O) e dalle resistenze epatiche interposte. In
condizioni normali il meccanismo di autoregolazione epatica mantiene la pressione costante
modificando proprio le resistenze intraepatiche (letto sinusoidale) in risposta al variare del flusso
splenico. Il meccanismo di base è il seguente: un aumento delle resistenze (patologie epatiche)
causa una diminuzione della perfusione del fegato. Il fenomeno di compensazione prevede:
aumento della gittata cardiaca, aumento volemia (meccanismo di renina-angiotensinaaldosterone), apertura shunt-arterovenosi con circolo splancnico (caduta delle resistenze
splancniche che causa aumentata pressione e arterializzazione cioè aumento del contenuto di
ossigeno del sangue venoso portale). Tutti questi fenomeni causano ipertensione portale che, fino
ad un certo punto è funzionale al mantenimento della perfusione epatica. Si instaura però un
circolo vizioso perché questi shunt arterovenosi causano aumento della gittata cardiaca con uno
stato iperdinamico della circolazione tipico dei cirrotici (che tra l’altro peggiora l’encefalopatia).
Nella cirrosi infatti sia le alterazioni funzionali, sia le anomalie dell’architettura (come fibrosi,
trombosi vascolare) portano all’aumento delle resistenze epatiche e quindi all’ipertensione portale
vasodilatazione splancnica ipovolemia con aumento del flusso portale rilascio del sistema
renina angiotensina.
In caso di ipertensione portale, le numerose connessioni tra vasi tributari della vena porta e della
cava vanno incontro a ipertrofia e sviluppo di un circolo collaterale: Anastomosi porto-cavali:
• Vena gastrica sinistra e vene del fondo gastrico sono in connessione con i plessi venosi
esofagei a livello intramurale e sovra cardiale dove ci sono numerose vene sottomucose a
palizzata che attraverso azygos ed emyazigos sono tributarie della cava. In caso di
ipertensione è da qui che si possono sviluppare le varici esofagee.
• Plesso emorroidario: mette in comunicazione, vene emorroidarie superiori (che vanno alla
mesenterica inferiore) e medie e inferiori (vanno alle ipogastriche che finiscono nella cava).
È da qui che possono svilupparsi le emorroidi.
• Vene paraombelicali e vena ombelicale (se pervia): connettono la porta con le vene
superficiali dell’addome, tributarie della cava. Possono far originare il caput medusae.
• Sistema del Retzius: miriade di piccole vene che drenano gli organi addominali della
parete posteriore che anastomizzano territorio mesenterico e vene peritoneali.
• Esistono infine anastomosi portocavali spontanee.
Ipersplenismo: di frequente riscontro nei pazienti con ipertensione portale. È una condizione di
trombocitopenia, leucopenia e raramente eritrocitopenia che si associa a splenomegalia. Più grave
in caso di blocchi preepatici. È fondamentalmente dovuto ad un aumento del sequestro, piuttosto
che alla distruzione di elementi figurati. Bisogna tuttavia sempre essere cauti a porre indicazione a
splenectomia perché se da un alto risolve la pancitopenia, da solo non è in grado di risolvere
l’ipertensione portale e comunque pone un elevato tasso di complicanze come emorragie, raccolte
sub freniche e anche trombosi secondarie dalle vena splenica. Migliora con interventi di shunt.
Varici esofagee (o esofago-gastriche)
Sono una delle più temute complicanze dell’ipertensione portale, sia perché sono indice di gravità
sia perché si accompagnano a un elevato tasso di mortalità. Il 70-80% dei cirrotici va incontro a
formazioni di varici esofagee entro 5 anni. Si tratta di varici (vaso venoso che per cedimento si
dilata e diventa tortuoso) a carico del plesso sotto-mucoso dell’esofago.
L’esofago ha una particolare funzione emodinamica. Infatti per la sua lunghezza è tributario di
entrambe le vene cave che di fatto mette in comunicazione. Il sangue refluo della porzione
cervicale va nelle vene tiroidee inferiori e quindi vena cava superiore; la porzione toracica nelle
vene azygos e emiazygos e quindi in cava superiore; la porzione addominale nella gastrica sinistra
100
e quindi in vena porta e poi cava inferiore. In condizione di ipertensione le vene del plesso
sottomucoso ipertrofizzano diventando varici.
Clinica: la principale complicanza delle varici è la rottura, associata a forte sanguinamento. Pare
che la causa della rottura siano “colpi” ipertensivi legati a tosse, sforzi fisici, etc. Il rischio di morte
al primo episodio emorragico è 30-50% e rimane all’incirca tale anche in caso di recidiva. Il rischio
di morte e risanguinamento è molto elevato durante le prime 3-5 settimane dall’episodio
emorragico e per questo è importante intervenire precocemente.
Diagnosi: in passato si face con radiografia con pasto baritato. Oggi si usa l’endoscopia digestiva
con video endoscopio che permette una buona visione delle varici. L’indagine, con le nuove
metodiche è eseguibile durante l’emorragia, e in tal caso è molto sensibile. L’aspetto delle varici è
quello di cordoni longitudinali serpiginosi che occupano da 1/3 a tutto l’esofago. Secondo Beppu,
caratteristiche importanti che ne aumentano il rischio di emorragia sono: colore bluastro, strie o
macchie rosse, nematocisti, iperemia diffusa, esofagite, tortuosità. Si associano questi criteri allo
stato funzionale epatico secondo Child-Pugh: Si dà un punteggio da 1 a 3 ad ognuno di 5
parametri: Ascite, Encefalopatia, Albumina (se è diminuita), Tempo di Quick (se è diminuito),
Bilirubinemia (se è aumentata), distinguendo così il rischio in A (5-6); B (7-9) e C(10-15).
Pertnato la Classificazione del rischio emorragico risulta in un punteggio che valuta la presenza
di strie rosse (piccole, medie o grandi) associata al grado di Child (A, B o C).
Serve anche diagnosi eziologica della patologia che ha portato all’ipertensione: cirrosi, BuddChiari, trombosi mesenterico-portale (da infezione). Ricordiamo tra i segni della cirrosi: subittero,
eritema palmare, angiomi a ragno, ascite, ginecomastia, flapping tremor.
Esami ematochimici: permettono la classificazione del grado di Child-Pugh. Inoltre si valuta
emocromo (possibile iperslenismo), iperammoniemia (che causa encefalopatia). Esami in grado di
valutare la funzione globale del fegato esistono: come il test clearance del galattosio dal sangue.
Ecografia: rapida e poco invasiva, è l’esame fondamentale. Permette di valutare il calibro dei vasi
spleno-porto-mesenterici, eventuali trombosi, colelitiasi, presenza di epatocarcinoma.
Tc-spirale, angio-TC e RMN: permettono un’ottima visualizzazione del territorio vascolare
epatico, tanto da poter sostituire l’angiografia. L’angiografia è molto più invasiva e rischiosa. Il
metodo oggi più utilizzato è l’arteriografia selettiva di tripode celiaco e arteria mesenterica
superiore. Si introduce un catetere nell’arteria femorale destra (attraverso una guida metallica), si
guida il catetere fino all’arteria interessata (si può notare l’aspetto a cavaturaccioli o ad albero
potato o assenza di visualizzazione della porta). Si può anche eseguire portografia (per via trans
ombelicale, oggi poco usata per problemi emorragici).
L’esame manometrico delle vene sovra epatiche può essere utile perché una pressione
differenziale di 12mmHg o più tra porta e arterie epatiche è associata a rischio emorragico.
Terapia delle varici: i trattamenti hanno diversi obiettivi, a seconda del momento:
1) Profilassi del primo sanguinamento: visto l’elevato rischio di mortalità si fa:
• Terapia medica farmacologica: in pazienti con varici, buona funzionalità epatica (Child A
o B), buna compliance ai farmaci, no controindicazioni si usano beta-bloccanti adrenergici
non selettivi (propanololo, le controindicazioni sono diabete, bronco pneumopatia). Si
deve cercare di ridurre il gradiente porto epatico a meno di 12. Si possono usare anche
nitrati (isosorbide-5monoitrato).
• Se la terapia medica non si può fare o non ha effetto si fa legatura endoscopica delle varici
2) Terapia dell’emergenza emorragica:
• Rianimazione: si devono predisporre accessi venosi per infusione di sangue e liquidi,
sondino naso-gastrico ampio per valutare la presenza di sangue, trattamento di eventuali
deficienze coagulative e infusione di sangue o plasma expanders. Prevenzione degli ab
ingestis, possibile intubazione, trattamento antibiotico, bilanciamento idro-elettrico.,
lattulosio per prevenire l’encefalopatia.
• Endoscopia d’urgenza e terapia endoscopica: è la diagnosi di certezza, si fa quando il
paziente è stabile. Si può eseguire contestualmente terapia con scleroterapia o legatura
endoscopica delle varici (emostasi immediata nel 90% dei casi).
• Farmaci: il trattamento può essere iniziato a casa o nel triage. Sono farmaci vasoattivi che
riducono la portata ematica delle varici come: gliopressina (spesso associata a
nitroglicerina che ne aumenta efficacia e tollerabilità), somatostatina, octreotide.
• Sonda di Sengstaken-Blakemore: sonda naso-gastrica con un pallone a pera nel tratto
terminale e un pallone cilindrico di 10-15 cm nel tratto prossimale. I due palloni si gonfiano
101
indipendentemente. Si inserisce la sonda e si gonfia il pallone distale nello stomaco. Poi si
tira la sonda fino al cardias e si gonfia anche il pallone prossimale che sta nell’esofago,
ottenendo un emostasi per compressione delle varici. Serve nelle varici esofagee, molto
poco in quelle gastriche. Non si può tenere più di 6-8 ore (ulcere, ab ingestis, etc.)
• TIPS o derivazione porto-cavale chirurgica: se la terapia endoscopica non è stata
sufficiente e il paziente continua a sanguinare e a richiedere trasfusioni si può effettuare:
chirurgia d’urgenza con derivazioni portocavali oppure si può posizionare, con metodica
radio interventistica una protesi trans epatica tra vena sovra epatica destra e il ramo
portale destro, ossia la TIPS (shunt porto-sistemico trans giugulare intraepatico), che
risolve l’emorragia e ha una mortalità inferiore rispetto alla chirurgia d’urgenza.
3) Profilassi della recidiva emorragica: rischio quasi del 70% entro l’anno
• Farmaci: beta-bloccanti associati o no ai nitrati long acting.
• Terapia endoscopica: gli interventi possibili sono essenzialmente due:
o Scleroterapia: si iniettano nel lume vasale e a livello perivascolare sostanze che
inducono tromboflebite e quindi sclerosi delle varici. Possono dare ulcerazioni e
quindi emorragie. Le complicanze dell’intervento (disfagia, febbre, possibile
perforazione dell’esofago) sono poco comuni. Per le varici gastriche si usa bucrilato,
un monomero che polimerizz all’interno della vena gastrica, trasformandosi in una
gomma che oblitera il lume del vaso. Può fuoriuscire dalla varice. La scleroterapia
endoscopica può essere eseguita anche in pazienti Child C e in corso di emorragia.
o Legatura endoscopica: si ottiene grazie ad un dispositivo legato all’endoscopio che
permette di aspirare la parete anteriore della varice e di rilasciare un piccolo elastico
di gomma che la strozza. È più semplice ed ha in pratica sostituito la scleroterapia.
Entrambe richiedono controlli endoscopici seriati (emorragie poco dopo).
• Interventi chirurgici non derivativi: intervento di Sugiura: si basa sulla detensione delle
varici e interruzione estesa delle connessioni venose esofagogastriche (deconnessione
azygos-portale) associata a resezione (esofagectomia longitudinale) e sutura delle varici.
Ormai poco usato per il gran numero di recidive e di emorragie.
• Interventi chirurgici derivativi: esistono interventi che creano shunt totali (che azzerano le
recidive, ma aumentano la mortalità da insufficienza epatica e l’encefalopatia e quindi
ormai abbandonati) e interventi che creano shunt selettivi. Tra questi ultimi: Intervento di
Inokuchi: si anastomizza alla cava la sola gastrica di sinistra (funziona poco); Shunt
splenorenale distale di Warren: si isola la vena splenica (si legano anche gastrica sinistra,
pilorica e gastroepiploica) e si anastomizza con la renale di sinistra. In questo modo si
abbassa la pressione detendendo le varici esofagee. Funziona bene, meno complicanze.
• TIPS e trapianto di fegato: mediante un ago-catetere introdotto per via giugulare si
anastomizza una vena sovra epatica con il ramo portale destro. È una tecnica semplice e
utile nelle emergenze, applicabile praticamente a tutti. Gravi complicanze: tasso di
encefalopatia alto simile agli shunt totali, trombosi dello shunt per stenosi della protesi. È
però molto utile nei pazienti in attesa di trapianto di fegato. Il trapianto ha il merito di
guarire la patologia di base e non solo l’ipertensione portale che ne è scaturita. Per
mancanza di organi, deve essere previsto in stadi avanzati o forme rapide e progressive.
Cirrosi epatica
Patologia caratterizzata dalla distruzione di lobuli e vasi epatici con fibrosi e formazione di setti di
connettivo e noduli di rigenerazione. È secondaria ad una necrosi e infiammazione, con
sostituzione di tessuto epatico con tessuto fibroso, capillarizzazione dei sinusoidi, formazione di
shunt porto-centrali e quindi formazione di noduli con sconvolgimento della struttura epatica. È
micronodulare (come in genere l’alcolica) o macronodulare (spesso la virale) se i noduli sono <o>
di 3 mm. Le immediate conseguenze della cirrosi sono l’insufficienza epatica e l’ipertensione
portale (inoltre la formazione di shunt porto-cavali riduce la perfusione epatica).
Epidemiologia: mortalità di 20/100000, più maschi, al nord più alcolica al sud più virale. 3060/100000 all’anno (26000). Può dare forti complicanze, anche epatocarcinoma.
Eziopatogenesi: è la conseguenza tardiva di molte affezioni epatiche. Le epatiti virali e l’abuso
alcolico sono alla base di circa il 90% delle cirrosi. Altre forme, più rare, sono: metaboliche,
iatrogene, autoimmuni, colestasiche, sindrome di Budd-Chiari, farmaci e tossici.
La causa di cirrosi è la progressiva fibrosi (setti attivi e passivi) e deposizione di collagene (I e III)
che comporta prima deposito nello spazio di Disse e capillarizzazione dei sinusoidi, poi
102
formazione di shunt vascolari dentro il tessuto fibroso residuato dopo necrosi porto-portale e
porto-centrale, con architettura sovvertita, epatociti che si ritrovano all’interno di noduli di
rigenerazione e che proliferano. Lo stravolgimento della struttura di parenchima e vasi intraepatici
aumenta di molto le resistenze e causa ipertensione portale. L’ aumento delle resistenze comporta
shear stress (attrito da flusso ematico) e stretching endoteliale e ciò causa liberazione di NO e
VEGF con conseguente vasodilatazione periferica, prima di tutto splancnica. La vasodilatazione e
l’aumentato sequestro di sangue causano attivazione dei barocettori e volocettori con attivazione
del sistema renina-angiotensina-aldosterone e aumnto di ritenzione di sodio e acqua, che causa
aumento dell’effettivo volume ematico del ritorno venoso al cuore oltre che ulteriore afflusso
portale che aggrava l’ipertensione.
Clinica: se compensata la cirrosi può non dare sintomi evidenti oltre quelli eventualmente dovuti
all’eziologia di base. La sintomatologia può essere sfumata o grave. Abbiamo:
• Sintomi generali: astenia, senso di peso epigastrico, anche nausea e calo ponderale.
• Segni cutanei: spider naevi (anche in gravidanza) su torace e volto, eritema palmare o
plantare, ragadi agli angoli della bocca, prurito, atrofia cutanea, etc.
• Disturbi ormonali: perdita di peli, impotenza, atrofia testicolare e ginecomastia nell’uomo.
Nella donna: disturbi mestruali, possibile amenorrea secondaria.
• Sintomi specifici dell’eziologia: emocromatosi, e Wilson ad esempio.
• Segni di cirrosi scompensata: ittero, diatesi emorragica, malnutrizione e cachessia,
ipertensione portale e sue conseguenze, encefalopatia epatica, epatocarcinoma.
Diagnosi: Anamnesi: sono indicativi abuso di alcol e pregresse infezioni epatiche, farmaci
epatotossici, dimagrimento, astenia, anoressia, prurito. Esame obiettivo: tutti i segni cutanei e
ormonali già visti, più subittero o ittero, petecchie, ecchimosi, lesioni da grattamento, ascite e
edemi, reticoli venosi, epatomegalia con superficie bozzoluta, stato di coscienza alterato,
splenomegalia, flapping tremor.
Laboratorio: Indici di ridotta capacità epatica di sintesi: diminuzione colinesterasi, fattori di
coagulazione (tempo di Quick allungato), antitrombina, ipoalbuminemia. Aumento di bilirubina.
Indici di necrosi: aumento transaminasi (anche LDH). Indici di colestasi: piuttosto incostanti,
ALP, gamma-GT, bilirubina. A volte anche: anemia, leucopenia e piastrinopenia,
ipergammaglobulinemia policlonale, iperammonienmia, markers virali, anticorpi, sideremia,
ferritina, cerulo plasmina, alpha1AT (dipendendo queste ultime dall’eziologia di base).
Ecografia: superficie epatica irregolare, parenchima epatico disomogeneo (noduli di
rigenerazione9, possibile riduzione dalla velocità di flusso nella porta (ipertensione portale), circoli
collaterali, ascite, splenomegalia- Con Fibroscan è possibile dimostrare il grado di fibrosi.
Iter diagnostico: anamnesi, clinica, laboratorio, morfologia epatica (ecografia e TC) e agobiopsia
epatica.
Complicanze: caratterizzano la cirrosi scompensata, il 10% di cirrosi compensate all’anno diventa
scompensata. Sono emorragia intestinale, ascite, sindrome epatorenale, trombosi portale,
encefalopatia epatica, epatocarcinoma.
Prognosi: dipende molto dall’eziologia di base, dalla presenza e dal tipo di complicanze e dallo
stadio della cirrosi epatica. Per definirne la gravità, si usa l’indice di Child Pugh che assegna un
punteggio da 1 a 3 ad encefalopatia, ascite, bilirubina, albumina, attività protrombinica (le ultime
due in negativo). Grado A tra 5 e 6, B tra 7 e 9, C tra 10 e 15. Per la mortalità nei pazienti in lista
trapianti si usa l’indice MELD. Bisogna aggiungere EGDS per valutare varici (ogni 1-3 anni),
ecografia per epatocarcinoma (ogni 6 mesi). Insomma follow-up. La sopravvivenza supera anche i
10 anni. A 5 anni: grado A 75%, B 40%, C 20%. Inoltre 2-3 epatocarcinoma/100 cirrotici all’anno.
Terapia: la fibrosi è irreversibile. Misure generali: dieta varia, adeguato apporto di calorie e
proteine (se c’è encefalopatia ridurre le proteine) senza eccessi e senza alcol. Trattare la patologia
di base ed eventuali complicanze.. Evitare farmaci a rischio epatotossico. Follow-up con ecografia
e dosaggio dell’alpha1-fetoproteina ogni 6 mesi. Infine trapianto di fegato.
Complicanze di ipertensione portale e cirrosi epatica:
Sindrome epatorenale: SER, grave insufficienza renale. Tipo 1 rapidamente progressiva (<2
settimane) e tipo 2 in pochi mesi. È dovuta all’intesa vasocostrizione renale in risposta alla
vasodilatazione periferica. Clinica: segni di cirrosi scompensata con ascite, edema, ittero ed
encefalopatia epatica. Fattori scatenanti possono essere la terapia diuretica, una pracentesi,
emorragia gastrointestinale. Diagnosi: cirrosi scompensa + peggioramento della funzione renale.
Terapia: eliminare fattori scatenanti, trapianto di fegato (se non è possibile si effettua TIPS) al fine
di ridurre la creatinina sierica. La prognosi è solitamente molto infausta.
103
Sindrome epatopolmonare: disfunzione polmonare con ipossemia nell’ambito di cirrosi epatica.
Ascite: presente in circa il 50% dei cirrotici, è dovuta principalemte all’ipertensione portale, però
anche all’eventuale ipoalbuminemia presente in corso di cirrosi. Nei casi lievi si può trattare con
restizione sodica, antagonisti dell’aldosterone (spironolattone). Se più grave si può somministrare
un diuretico d’ansa (furosemide) Regredisce in genere con paracentesi e terapia diuretica, ma può
divenire ascite refrattaria, resistente a terapia o anche associata a ipovolemia, ipertensione, crampi,
insufficienza renale. Può essere complicata dalla peritonite batterica spontanea (PBS), cioè
infezione del liquido ascitico da batteri enterici, alta mortalità. A volte con febbre e dolore, altre no.
Produce anche sintomi aspecifici e un generale peggioramento. Diagnosi con paracentesi e
neutrofili >250/mm3 e terapia antibiotica (magari dopo coltura e antibiogramma, cefalosporine).
Encefalopatia epatica: alterazione coscienza e funzione neuromuscolare, 20% dei cirrotici, 50% in
quelli con interventi di shunt porto-sistemico chirurgico (TIPS). Patogenesi: È un danno
neurologico dovuto alla maggiore quantità di sostanze tossiche (di natura azotata e che vengono
dall’intestino) che passano in maggior numero perché il fegato non le detossifica e perché si
aprono shunt porto-sistemici. La prima individuata è l’ammoniaca, che il fegato non trasforma più
in urea. Questa è tossica soprattutto per gli astrociti chi si rigonfiano (swelling).
Diagnosi: se non c’è manifestazione evidente si usano test psicometrici come il number
connection test. Può essere di vario grado: da leggero disorientamento, rallentamento, flapping
tremor (I), a sintomi più netti (II), profonda alterazione coscienza e confusione (III), a coma (IV).
Può essere episodica, cronica o ricorrente. A volte avviene a seguito di fattori precipitanti quali
stipsi, emorragie, infezioni, diete iperproteiche, eccesso diuretici.
Insufficienza epatica acuta: crollo della funzione epatica in soggetti precedentemente non affetti
da epatopatia cronica. Triade clinica: ittero, turbe della coagulazione, alterazioni della coscienza.
Si distinguono tre modalità di decorso: fulminante (< 7 giorni tra il crollo della funzione epatica e
l’insorgenza di encefalopatia), acuta (8-28 giorni), subacuta (>28 giorni).
Eziologia: Epatite virale (virus A, B, E, D, C), epatotossine (farmaci come il paracetamolo, alotano,
stupefacenti, amanita phalloides, sostanze chimiche), altro (Budd-chiari, shock, wilson, etc.).
Clinica: encefalopatia epatica con disturbi fino al coma, ittero, flapping tremor, diatesi emorragica
da mancanza dei fattori di coagulazione, ipotensione arteriosa, iperventilazione.
Complicanze: edema cerebrale, emorragie gastrointestinali, ipoglicemia, IRA, infezioni.
Laboratorio: transaminasi normali o aumentate, bilirubina alta, iperammoniemia, tempo di quick
diminuito, fattori di coagulazione bassi, frequente ipoglicemia, alcalosi.
Diagnosi: anamnesi, clinica e laboratorio, EEG, misurazione della pressione endocranica.
Terapia: Misure causali: se dovuta a gravidanza bisogna interromperla, se da intossicazioni dare
l’antidoto (paracetamoloacetilcisteina), terapia antivirale con lamivudina se dovuta a HBV,
siblinin e lavanda gastrica in caso di intossicazione da amanita.
Terapia di supporto: controllo e supporto elettroliti, glucosio e fattori di coagulazione (correggibili
con plasma fresco), nutrizione parenterale, apporto di antitrombina III.
Terapia delle complicanze:
• Terapia del distress respiratorio: è necessaria l’intubazione endotracheale e ventilazione
meccanica in caso di segni di distress respiratorio.
• Coagulopatia: plasma fresco in caso di sanguinamento, o anche emazie concentrate,
vitamina K, antitrombina III.
• Encefalopatia: eliminazione delle proteine dalla dieta, Lattulosio, Neomicina.
• Edema cerebrale: mantenere il paziente con capo sollevato di 30°, controllo glicemia,
intubazione tracheale e ventilazione meccanica, monitoraggio pressione endocranica. Se la
funzione renale è normale si può dare Mannitolo o Furosemide. Iperventilazione per breve
periodo di tempo per evitare l’insorgenza di eccessiva vasocostrizione.
• Insufficenza renale acuta: se la creatinina >5mg/dl si indica emodialisi.
• Gastroprotezione: Profilassi ulcera da stress con ranitidina (riduce pression endocranica)
• Instabilità emodinamica: in caso di ipotensione ipovolemia colloidi (albumina),
ipotensione nonostante euvolemia noradrenalina e dopamina.
• Altro: la terapia definitiva risulta essere il trapianto di fegato.
104
Diverticolo di Meckel e residui onfalo-mesenterici
Embriologia: fino alla VII-VIII settimana l’intestino primitivo ed il sacco vitellino sono in
comunicazione attraverso il canale onfalo-mesenterico. È interessata un’ansa intestinale erniata
che normalemente rientrando chiude il canale. Lateralmente decorrono due peduncoli vascolari
che costituiranno le arterie (mesenterica superiore) e le vene (sistema portale). L’arresto del
processo di involuzione del canale può dare: diverticolo di Meckel (da incompleta chiusura
dell’estremità intestinale del canale), fistola onfalo-mesenterica (comunicazione tra ileo e
ombelico), cisti ombelicale, cordone solido onfalo-ileale.
Diverticolo di Meckel: diverticolo vero, è un’estroflessione a fondo cieco del canale alimentare
rivestita da mucosa comunicante con il lume e comprendente tutti gli strati della parete intestinale,
si forma nell’ileo. Vascolarizzato dalla mesenteric superiore, può essere fisso all’ombelico. Può
contenere mucosa eterotopica pancreatica o gastrica (che può dare anche ulcere, questo perché le
cellule del sacco vitellino sono pluripotenti). È lungo circa 5cm, a circa 30-90cm dalla valvola
ileocecale e in genere sono sintomatici entro i due anni, sebbene possa restare asintomatico.
Clinica: i sintomi sono conseguenza di complicanze, che possono essere:
• Enterorragia: è la più frequente enterorragia pediatrica. Può essere dovuta ad ulcera
peptica sulla mucosa eterotopica o flogosi aspecifica. Può dare sanguinamento occulto o
essere massiva con shock ipovolemico.
• Occlusione intestinale: conseguenza di un volvolo attorno a un diverticolo fisso.
• Diverticolite: può dare un quadro molto simile all’appendicite acuta.
• Perforazione: conseguenza di un’ulcera o diverticolite o tumore, causa peritonite acuta.
• Localizzazione neoplastica: molto rara, in genere carcinoide.
• Ernia di Littré: erniazione del diverticolo in sede inguinale, ombelicale, crurale.
Diagnosi: è prepoperatoria solo nel 6% dei casi. Si può usare Rx addome (poco adatto), clisma
opaco del grosso intestino (diagnosi occasionale), Clisma del tenue e Rx (buon esame). Tc ed
ecografia: poco sensibili. Scintigrafia addominale con tecnezio: sensibilità elevata.
Il diverticolo appare come unico, impiantato sul bordo antimesenterico, di solito ad angolo retto,
nel terzo distale dell’ileo (anche se a volte è altrove).
Terapia:
La terapia è chirurgica, necessaria in presenza di complicanze. Si esegue la diverticulectomia,
associata al minor numero di complicanze post operatorie, oppure resezione ileale più o meno
allargata, indicata in caso di sospetto di mucosa gastrica ectopica. In caso di diverticolo
asintomatico può essere giustificato un atteggiamento conservatore con follow up, mentre per
alcuni autori la resezione eviterebbe poi un altro intervento in emergenza con maggiori
complicanze (in ogni caso solo in pazienti a rischio e <40 anni).
Ileo biliare
L’ileo biliare è l’occlusione meccanica del tratto intestinale a opera di un grosso calcolo biliare, in
genere a seguito della presenza di una fistola bilio-enterica che consente la migrazione spontanea
del calcolo dalla via biliare all’intestino. Nel 75% dei casi queste fistole si instaurano tra colecisti e
duodeno, più raramente con colon o stomaco oppure tra coledoco e duodeno.
La fistola bilio-enterica in genere si crea a seguito di un episodio di colecistite acuta con gangrena
della parete della colecisti e perforazione in un viscere vicino oppure dipende dalla presenza di un
calcolo incuneato che aumentando la pressione sulla parete della via biliare ne causa necrosi.
In genere avviene in età avanzata (>70anni). La presentazione clinica è quella dell’occlusione
intestinale con nausea vomito e dolore addominale.
La terapia non può prescindere inizialmente dalla terapia conservativa dell’occlusione intestinale,
ma il gesto terapeutico risolutivo consiste nella rimozione del calcolo mediante enterotomia. Sono
fondamentali poi l’aggressione della fistola con la sua riparazione e l’esecuzione della
colecistectomia per evitare colecistiti e colangiti ricorrenti, altrimenti comuni in presenza di fistola
bilio-enterica.
105
Malattia diverticolare del colon
Il colon è certamente il segmento del canale alimentare più predisposto alla formazione di
diverticoli. In assenza di complicanze si parla di diverticolosi, altrimenti malattia diverticolare.
Si definisce diverticolo l’estreflossione sacciforme della mucosa del colon attraverso un locus di
minore resistenza dello strato muscolare. Possono avere dimensioni variabili.
Epidemiologia: ha una frequenza elevata, specie dopo la VI decade. Fattori di rischio: alterata
motilità del colon, dieta a basso contenuto di fibre, indebolimento della parete del colon.
Anatomia patologica: sono in genere diverticoli acquisiti, da pulsione, pertanto costituiti solo da
mucosa e sierosa. È più colpito il sigma, meno retto e appendice. In genere inferiori al cm, ma
possono essere anche di diversi cm. Sono numerose estroflessioni sacculari, in genere posti nella
regione con minore resistenza, tra tenia mesenterica e quelle antimesenteriche.
Eziopatogenesi e clinica: distinguiamo, come detto, diverticolosi e diverticolite:
• Diverticolosi: il diverticolo è il risultato di un’erniazione della mucosa in punti deboli. È
spesso associata con disordini della motilità. Altro fattore è la segmentazione, fenomeno
di isolamento attraverso le onde peristaltiche non propulsive (circonferenziali) che si
accentua all’arrivo di un onda propulsiva. La dieta occidentale povera di fibre faciliterebbe
questa condizione. Spesso associata a riduzione della tensione della parete colica.
Clinica: in genere asintomatica. Talvolta dolori vaghi e mal localizzabili, flatulenza,
alterazioni dell’alvo con stipsi e feci dure, oppure diarrea.
• Diverticolite: pare dovuta a micro perforazione del diverticolo che causa infiammazione
dei tessuti pericolici. Questa può essere limitata o dare ascessi. È possibile anche che la
perforazione avvenga nella cavità peritoneale, dando peritonite fecale diffusa.
Clinica: il principale sintomo è il dolore addominale, spesso in fossa iliaca sinistra. In
genere è costante e non colico. Vi sono alterazioni dell’alvo come diarrea intermittente o
alternanza stipsi-diarrea. Può esserci febbricola, disturbi urinari (per compressione del
colon infiammato o infezione).
Diagnosi: serve anamnesi ed esame obiettivo, sufficienti in genere in caso di diverticolite.
Esami strumentali: Esame radiologico con clisma opaco: è l’esame più utilizzato e che permette la
visualizzazione diretta dei diverticoli, oltre che diagnosi di stenosi. La DD con carcinoma non è
facile, in genere la stenosi neoplastica è corta e con mucosa alterata, al contrario della normale
diverticolite (stenosi lunga con mucosa intatta). In fase acuta (crisi diverticolare acuta) non va mai
fatto né il clisma radio opaco né la colonscopia perché danno insufflazione di aria e c’è rischio di
perforazione. Inoltre il bario è irritante per il peritoneo e non sappiamo se ci sia una perforazione
in atto. L’indagine di scelta in fase acuta è la TC con mdc, molto utile insieme con l’ecografia per la
diagnosi delle complicanze (ascessi, emorragie). La TC può essere utilizzata per guidare il
drenaggio di un ascesso evitando l’intervento chirurgico.
Complicanze:
• Perforazione: evento grave, spontanea o iatrogena. Dà dolore acuto ai quadranti inferiori
(ma poi a tutto l’addome), pneumoperitoneo e contrattura parietale. Ileo paralitico. Un
semplice Rx addome può mostrare presenza di area libera in peritoneo o livello idroaereo.
• Ascesso: è la complicanza più frequente, anche conseguente a micro perforazione. Dolore
circoscritto, ai quadranti inferiori, spesso in fossa iliaca sinistra. C’è febbre, leucocitosi,
nausea e vomito. Ecografia e TC sono indicati per la diagnosi.
• Fistolizzazione: per drenaggio di un ascesso in organi circostanti o verso la cute. Le più
frequenti sono le fistole colo-vescicalo con piuria, ematuria, copruria. L’esame con clisma
opaco può evidenziarle.
• Occlusione intestinale: conseguente a stenosi infiammatoria. Visibile con clisma.
• Emorragia: comune, si presenta come una perdita per via rettale di sangue rosso scuro, in
genere autolimitata. L’emorragia massiva è rara. In tal caso si richiede colonscopia.
Terapia: è necessario l’intervento chirurgico in caso di emorragia massiva (di più di 1,5 L o per più
di 72 ore), nuova emorragia a breve distanza dalla precedente.
• Diverticolosi: se semplice e asintomatica può non richiedere terapia. Al massimo diete ad
alto contenuto di fibre vegetali. Nelle forme sintomatiche sono utili, riducendo la pressione
endoluminale del colon. Se sintomatica si possono dare antispastici, magari antibiotici.
106
Diverticolite: nel periodo acuto di diverticolite è necessario non assumere fibre per non
aumentare la massa fecale e somministrare liquidi, antibiotici non assorbibili
(paromomicina), antispastici e soluzioni glucosate. Negli stati flogistici lievi è sufficiente
digiuno ed antibiotici per via orale. Nel 10-20% dei casi può esserci recidiva. Alcuni
indicherebbero terapia chirurgica dopo episodi multipli di diverticolite.
La chirurgia è normalmente l’approccio per le complicanze:
Chirurgia di urgenza nelle forme acute (perforazioni, emorragie): si può eseguire:
• Intervento in 3 tempi: si fa colostomia di scarico e drenaggio della raccolta ascessuale, poi
resezione e anastomosi, poi chiusura della colostomia.
• Intervento in 2 tempi: di Hartmann, è il più usato. Si fa resezione del segmento
diverticolare, chiusura del moncone rettale e colostomia terminale sul colon discendente.
Poi, ingenere dopo 6 o più settimane si esegue chiusura della colostomia e rianastomosi tra
colon discendente e moncone rettale. La colostomia non si fa mai sul trasverso (ileostomia).
• Intervento in tempo unico: resezione-anastomosi senza colostomia.
•
107
Pancreatite acuta
È una malattia infiammatoria acuta, con distruzione del parenchima ghiandolare per fuoriuscita
dal sistema duttale degli enzimi pancreatici attivati. Può essere distinta in lieve (miniima
alterazione dell’organo e no complicanze) e severa (associata a insufficienza d’organo o
complicanze e alterazioni sistemiche e dello stato generale). Nella pancreatite acuta vi è la
possibilità di completa restitutio ad integrum dopo rimozione della causa scatenante.
Eziologia: vi sono diversi fattori in grado di scatenare una pancreatite acuta, anche idiopatica:
• Calcolosi biliare: associata al 60% dei casi di pancreatite acuta, forse dovuta ad ostruzione
del dotto di Wirsung e/o reflusso di bile e soprattutto di enzimi pancreatici.
• Alcolismo: forse responsabile di quasi il 30% dei casi. Pare sia dovuta a stimolazione
vagale, maggiore sensibilità dei recettori pancreatici alla secretina, aumento di gastrina. Si
ha aumentata contrattura dello sfintere di Oddi e maggiore concentrazione di proteine nel
secreto pancreatico che potrebbero creare aggregati (plug) e ostruire i dotti.
• Ipercalcemia: da iperparatiroidismo, mieloma, sarcoidosi, etc. L’eccessiva concentrazione
di calcio nel succo pancreatico ne favorirebbe la precipitazione e quindi ostruzione.
• Iperlipoprotineimie familiari: danno vascolare da acidi grassi scissi dalle lipasi.
• Interventi chirurgici recenti: che interessino il pancreas o le strutture circostanti. Anche
ERCP, interventi di gastroresezione e splenectomia, circolazione extracorporea.
• Malattie vascolari: aterosclerosi e vasculite possono causare pancreatite su base ischemica.
• Cause iatrogene: da estrogeni, corticosteroidi, tetracicline, mezzi di contrasto, CPRE.
Patogenesi: la pancreatite è dovuta all’azione degli enzimi pancreatici stessi sul parenchima. La
tripsina attiva i proenzimi in lipasi, proteasi, fosfolipasi ed elastasi. Inoltre attiva il complemento e
quindi l’infiammazione. Normalmente vi sono dei sistemi di inattivazione, cioè antiproteasi come
l’alpha1-antitripsina . La pancreatite si genera quando non vi è più equilibrio tra questi due
sistemi. Le teorie su come si liberino gli enzimi sono: teoria del dotto comune (ipertensione dovuta
all’ostruzione del dotto di Wirsung da parte di calcoli biliari), teoria della secrezione-ostruzione
(una secrezione eccessiva si succo pancreatico formerebbe micro calcoli e aggregati proteici con
rottura dei dotti pancreatici periferici), teoria del reflusso duodenale (la causa è il reflusso
duodenale, per incontinenza dello sfintere di Oddi, che genera la liberazione di enterochinasi).
Anatomia patologica: le lesioni sono: edema, emorragie endoparenchimali e necrosi.
Manifestazioni sistemiche: l’azione enzimatica tossica può diffondersi ed indurre effetti sistemici,
oltre che locali. Vi è spesso formazione di trasudato ed essudato nel retro peritoneo, ma anche in
regioni distanti dal pancreas (sottocutaneo, interstizio polmonare, cavità peritoneale). Vi può
essere ipotensione (per diminuzione delle resistenze periferiferiche, forse associata a liberazione di
sostanze vasoattive o a ipoalbuminemia che causerebbe anche i trasudati), ipocalcemia (perdita di
calcio per precipitazione o forse riduzione della sensiblità al paratormone nell’osso). Vi è in
sostanze un quadro talvolta settico e ipotensivo. Questo si associa nei casi gravi a insufficienza
renale e insufficienza respiratoria (quadro polmonare simile all’ARDS, dovuto forse alle
fosfolipasi circolanti che causerebbero lesioni delle membrane basali).
Clinica: una pancreatite lieve si associa in genere a dolore addominale lieve che recede in 2-3
giorni. La pancreatite severa è associata a dolore epigastrico intenso, costante e spesso con
distribuzione a barra (anche ipocondri) o a cintura (anche fianchi e dorso). Il quadro può essere
quello di un addome acuto. Vi è frequente distensione addominale, nausea e vomito, febbre, ileo,
contrattura di difesa (incostante), ipotensione. Il dolore è trafittivo e non risponde bene agli
analgesici (gli oppioidi aumentano il tono dello sfintere di Oddi e lo peggiorano, meglio salicilati).
Il paziente appare spesso con le cosce flesse sull’addome e piegato. Il dolore è comunque
improvviso e di grado molto alto, poco variabile e persistente per ore o giorni.
Esame obiettivo: possibili ecchimosi sui fianchi (segno di Gray-Turner) o periombelicali (di
Cullen) indicativi di stravaso ematico. A volte vi è ileo paralitico, distensione meterorica e
contrattura muscolare. È frequente l’ittero, franco o sclerale. Vi può essere inoltre un quadro
generale di shock con tachicardia, ipotensione, disidratazione, insufficienza respiratoria, oliguria e
insufficienza renale, iperglicemia, respiro di Kussmaul, tetania da ipocalcemia, etc. Possibile
comparsa di versamento pleurico, rialzo febbrile.
Complicanze: le più frequenti sono: formazione di ascessi o pseudo cisti, raccolta acuta di
liquidi, necrosi pancreatica. Altre complicanze sono: tetania (da ipocalcemia), diabete mellito
(per estensione alla componente endocrina), emorragie gastrointestinali, insufficienza renale
acuta, quadro di distress respiratorio (ARDS), encefalopatia pancratica (per azione degli enzimi
sulla mielina e la possibile insufficienza epatica), tromboflebiti, fistole e perforazioni intestinali.
108
Diagnosi: oltre ad anamnesi, clinica ed esame obiettivo, sono fondamentali:
Esami di laboratorio:
• Amilasemia: nei primi 2-3 giorni di sintomi vi è aumento dell’amilasi nel sangue che però
può regredire, soprattutto se vi è ampia distruzione della ghiandola. All’inizio aumenta di
3-5 volte. È poco specifica, ma importante, si riscontra anche in occlusioni intestinali o ad
esempio nell’ulcera gastroduodenale, carcinomi del pancreas e non solo, patologie delle
ghiandole salivari, insufficienza renale, malattie polmonari, ustioni. L’entità dell’elevazione
non è un indice di gravità.
• Amilasuria: si raccolgono urine nelle 2 o meglio 24 ore. Può restare elevata per più giorni.
• Altri valori alterati: transaminasi, LDH, lipasemia (più accurata e duratura
dell’amilasemia), bilirubina, gamma-GT, fosfatasi alcalina. Inoltre si ha leucocitosi
neutrofila, aumento VES, acidosi respiratoria. Anche ipocalcemia, ematocrito elevato,
aumento della glicemia, riduzione dei livelli di C3 e C4.
Poiché durante una pancreatite acuta la clearance renale dell’amilasi è superiore a quella della
creatinina si suole usare il rapporto: amilasuria/amilasemia x creatininemia/creatininuria x100. Se
questo è < 3 è improbabile la pancreatite. Possibile tra 3 e 5, probabile se è > 5.
Diagnosi strumentali: Rx addome: può evidenziare livelli idroaerei e dilatazione intestinale.
L’ansa sentinella è quando il livello idroaereo (segno di ileo paralitico) è in corrispondenza della
prima ansa digiunale (quadrante superiore sinistro). Anche possibile il segno del colon escluso
(distensione gassosa del colon ascendente, ma il discendente è vuoto). Rx torace: sempre utile, può
evidenziare un versamento pleurico. Ecografia addominale: è complessa per il pancreas, può
evidenziare edema, calcoli, dilatazione delle vie biliari, pseudo cisti.
Un indagine di secondo livello è la TC con mdc: indagine che fornisce più informazioni e consente
di valutare anche la gravità della pancreatite: grado A (pancreas normale), B (edema del pancreas),
C (edema anche del grasso peripancreatico), D(presenza di un flemmone), E (presenza di due o
più raccolte liquide o di aria nel tessuto pancreatico o peripancreatico). ERCP: è sconsigliata.
Diagnosi differenziale: distinguere da colica biliare, colecistite acuta, ulcera peptica perforata,
occlusione intestinale, infarto mesenterico, rottura di aneurisma aortico.
Valutazione della gravità: segni correlati a mortalità più elevata sono i criteri di Renson:
• Criteri iniziali: età>55 anni, leucociti>16000, glicemia>200, LDH>350, SGOT>250.
• Dopo 48 ore: riduzione dell’ematocrito, azotemia >50, calcemia <8, PO2 <60, deficit di basi e
sequestro di liquidi (>600 ml).
Segno prognostico sfavorevole è pure rilevazione di liquido peritoneale bruno alla paracentesi.
Per definire una pancreatite severa (e iniziare quindi i procedimenti terapeutici adatti) si usa però
il sistema prognostico di Glasgow: Comparsa di 3 o più alterazioni tra: glicemia >180,
leucociti>15000, LDH>600, azotemia >96, GOT>200, calcemia<8, albumina<3,2, PO2<60.
Il sistema APACHE II valuta invece lo stato generale del paziente.
Terapia medica: gli obiettivi della terapia sono ridurre la secrezione pancreatica, correggere lo
squilibrio elettrolitico e ripristinare l’equilibrio acido-base. Assistenza generale:
• Dolore: si utilizzano analgesici non oppiodi come Meperidina o FANS.
• Funzione respiratoria: si esegue un EGA ed eventuale ossigenoterapia se PaO2<60.
• Protezione pancreatica: si posiziona un sondino naso-gastrico (per aspirare le secrezione
acide gastriche) e il paziente deve stare a digiuno per 1-2 settimane. Si attua perciò
nutrizione parenterale totale (riduzione della stimolazione pancreatica). Si può fare
inibizione secrezione gastrica (PPI o anti-H2) e pancreatica (Somatostatina, Octreotide).
• Mantenimento della volemia e dell’equilibrio elettrolitico: frequenti alterazioni.
• Eventualemente associare: terapia antibiorica, farmaci antiproteasici (Aprotinina).
• Si può eseguire il lavaggio peritoneale allo scopo di rimuovere dal peritoneo i succhi
enzimatici pancreatici e le sostanze tossiche presenti.
Terapia chirurgico-interventistica: estrema discordanza sui tempi e le modalità di intervento:
• Intervento chirurgico precoce: può essere indicate la rimozione di un’ostruzione biliare
attraverso papillosfinterotomia con ERCP (si dovrà poi fare colicistectomia per le
complicanze). Se c’è pancreatite acuta severa può essere indicato un intervento rapido di
pancreasectomia parziale o torale (alta mortalità).
• Trattamento complicanze: le infezioni pancreatiche (ascessi, pseudo cisti) si risolvono con
drenaggio chirurgico e antibioticoterapia.
109
COMA: TRATTAMENTO IN EMERGENZA
Nel coma abbiamo perdita perdita prolungata e completa della coscienza, con assenza delle reazioni
di risveglio anche dopo stimolazione intensa (non risvegli abilità e incapacità a rispondere alle
stimolazioni). C’è relativa conservazione, almeno per un lasso di tempo, delle funzioni vegetative. Il
paziente comatoso si presenta costantemente con occhi chiusi.
Per coscienza intendiamo la consapevolezza di se e dell’ambiente. La coscienza si esplicita
attraverso un livello o stato di veglia (Ha sede in strutture fondamentali: nel diencefalo: talamo;
tronco encefalico: bulbo e ponte) e un contenuto o pensiero ( grazie ai due emisferi cerebrali
abbiamo espletamento delle funzioni mentali). Nel coma la perdita di coscienza è totale e prolungata
e riguarda sia il contenuto che il livello. SRAA(sostanza reticolare ascendente):Questa formazione
riceve input da tutto il corpo. A questo livello gli input vengono integrati con altre afferenze provenienti
dal cervelletto e dagli emisferi cerebrali. le formazioni ascendenti formano un network che viene
definito sistema reticolare attivante, che influenza la veglia e la coscienza. E’ responsabile della
vigilanza, laddove gli emisferi presiedono al contenuto della coscienza. Ne consegue che, affinché sia
integra la coscienza, sistema reticolare ascendente e corteccia debbano essere grossomodo intatti.
Il coma va distinto da disturbi o perdite parziali di coscienza:
Confusione: disorientamento spazio temporale, disturbi di fissazione mnesica
Delirium: analogo alla precedente con associata agitazione psicomotoria
Stupor: riduzione profonda dello stato di coscienza. E’ uno stato di non risposta dal quale il soggetto
può essere richiamato mediante stimoli energici e ripetuti.
Cause del coma:
1)Disfunzioni corticali bilaterali: sono dovute principalmente ad alterazione tossico metaboliche
(alcol, stupefacenti, farmaci come BDZ), sostanze tossiche endogene (ipercapnia, iperammonemia
iperglicemia, ipernatremia), alterazioni elettrolitiche (acidosi, alcalosi,ipoglicemia, ischemia),
infezioni (meningite,encefalite), traumi (lesioni craniche, lesione cerebrale diffusa,emorragia
extra durale e subdurale,embolia grassosa), ipotermia, febbre ecc.
2)Disfunzioni del SRAA: generalmente causata da una lesione encefalica strutturale.
Lesioni espansive sopratentoriali (aumento della pressione sulla membrana che divide il cervelletto
dal tronco encefalico)che invadono le strutture profonde, danneggiando i sistemi reticolari ascendenti.
Lesioni sottotentoriali espansive o distruttive che ledono direttamente o comprimono il tronco
encefalico( es. tumori cerebbellari o pontini, infarto cerebellare, ascessi). In generale un aumento di
pressione intracerebrale sia sovra che sottotentoriale può indurre erniazione e dislocazione di tessuto
cerebrale (molti dei segni nel coma sono attribuibili a questi sppostamenti).
Le lesioni sovratentoriali causano coma mediante uno slargamento e spostamento tissutale che
causa: compressione/disfunzione dell’emisfero opposto; compressione verso il basso delle strutture
diencefaliche etroncoencefaliche (SRAA). Le patologie che più frequentemente causano queste
lesioni sono: ematoma epidurale, subdurale, emorragia cerebrale, tumori, apoplessia ipofisaria.
L’erniazione sovratentoriale è distinta: 1) in trans falciale (giro del cingolo dislocato sotto la falce)
2) erniazione transtentoriale: distinta in uncale: il giro del temporale (uncus) è impegnato nella
parte anteriore del tentorio (segni:compressione del III n. cranico, dilatazione della pupilla
ipsilaterale); e transtentoriale centrale: la regione talamica subisce un movimento verso il basso
(sonnolenza, miosi) 3)Erniazione foraminale: inserimento forzato delle tonsille nel forame occipitale.
Fase pre ospedaliera: valutazione primaria:
Valutazione della sicurezza della scena; rapida e mirata raccolta anamnestica (diabetico,cirrotico
sintomatologia particolare riferita);
In ogni modo prima di ricercare l’eziologia del coma è fondamentale la valutazione dell’ABC
(airway, breathing,circulation): Valutare prioritariamente i parametri vitali : A: Airway assicurare la
pervietà delle vie aeree (rimuovere corpi estranei, protesi, vomito e assicurare la protezione del
rachide cervicale);B Breathing: monitorare frequenza del respiro e Sat. O2, somministrare O2 C
110
circolazione: monitorare la PA,monitorare l’attività cardiaca (Le riserve cerebrali di glucosio
forniscono energia per circa 2 minuti dopo l’interruzione del flusso sanguigno; la perdita di coscienza
avviene dopo 8 - 10 secondi dall’interruzione del flusso),trattare immediatamente ipotensione e aritmie
severe. D Disability: valutazione neurologica primaria volta a investigare lo stato di coscienza, la
funzione motoria e la funzionalità del tronco encefalico. Circa lo stato di coscienza esistono
versioni semplificate della scala di Glasgow che ci consentono in pochi secondi di inquadrare il
paziente. Un Glasgow <8 va immediatamente intubato sul posto (paziente non responsivo).
GLASGOW COMA SCALE
1
2
Apertura Nessuna Allo stimolo
occhi
doloroso
Risposta Nessun Suoni
verbale suono
incomprensibili
emesso
3
Allo stimolo
verbale
Parla e
pronuncia
parole, ma
incoerenti
Risposta Nessuna Estensione allo Anormale
motoria risposta stimolo doloroso flessione
allo stimolo
doloroso
4
Spontanea
Confusione,
frasi
sconnesse
5
N/A
Paziente
orientato,
conversazione
appropriata
Flessione /
Localizzazione
Ritrazione allo dello stimolo
stimolo
doloroso
doloroso
6
N/A
N/A
Obbedisce
ai comandi
[Ad ogni tipo di stimolo viene assegnato un punteggio e la somma dei tre punteggi costituisce l'indice
GCS; l'indice può andare da 3 a 15.Le lesioni cerebrali sono classificate come:Grave: con GCS !
8;Moderata:GCS 9-13; Lievee: GCS " 14 (vigilanza e percezione dell’ambiente esterno).
Nella valutazione delle alterazione della funzione motoria dobbiamo osservare la postura spontanea
assunta dal paziente. Prima vedi se ci sono movimenti spontanei, perché indicherebbero solo una
lieve riduzione dello stato di coscienza. Osservi altrimenti se ci sono posture caratteristiche: a canna
di fucile (meningite o emorragia subaracnoidea), rigidità decorticata (gambe estese e braccia
flesse, indica che il tronco è integro ma gli emisferi sono lesionati), rigidità decerebrata (collo,
braccia e gambe estesi. Indica lesione del tronco o lesioni emisferiche profonde). Poi valuti se c’è
risposta motoria alla stimolazione dolorifica (applicazione di una forte pressione sovra orbitaria) e
se sono presenti plegie ( solleva gli arti e lasciali cadere. Un arto indenne cade piuttosto lentamente.
Suggerisce lesione della via cortico-spinale ovvero lesione strutturale).
Per la valutazione del livello della lesione valutazione delle pupille (vedi dopo).
L’ultima tappa è la E Exposure: il paziente va svestito e valutato completamente. Si ricercano segni di
iniezioni (overdose) e si valuta scrupolosamente la cute per trarre quante più informazioni possibili
(cute secca da coma diabetico, cute umida da coma ipoglicemico, cute pallida da shock, cute
arrossata da ipertensione ecc.)
Terapia a livello pre-ospedaliero:
Monitoraggio: ECG, Emogas, plessimetria, glicemia.
Valutazione pervietà vie aeree: rimuovi manualmente o disostruisci meccanicamente o
farmacologicamente. Se GCS<8 intubazione oro tracheale e somministrazione di O2. Se fallisce o non
puoi cricotomia o tracheotomia. Fissaggio di un catetere vescicale,sondino naso gastrico (devi
prevenire gli ab ingestis), accesso vascolare venoso, somministrazione Coma Cocktail (contiene
Tiamina utile nella malnutrizione da alcolismo, glucosio al 33% per il coma ipoglicemico, Naloxone
per overdose da oppioidi, Flumatemil per coma farmacologicamente indotto da BDZ).
111
Fase intra ospedaliera:valutazione secondaria
L’obiettivo è quello di individuare la causa per porre trattamento specifico. Bisogna sempre assicurare
un accesso venoso valido, catetere vescicale e monitorare il paziente, come facciamo sempre.
E’ necessario raccogliere un’anamnesi dettagliata soffermandosi sulla modalità di esordio del coma:
se improvviso (traumi, emorragia, infarto), rapidamente progressiva (tossico metabolica),
lentamente progressivo. Si valutano i sintomi associati (cefalea, difetti di visione, vertigini, vomito) e i
segni vitali: valuti la pressione arteriosa(ipo o ipertensione), la temperatura (ipotermia per
intossicazione da alcol. Bisogna sempre misurare la temperatura ascellare e rettale. A volte,infatti, il
problema è proprio la temperatura, perché alcune reazioni biochimiche non avvengono in ipotermia.
Usare delle coperte termiche) e la frequenza respiratoria (la bradipnea depone per intossicazione da
oppiacei). In ogni modo il respiro del paziente è molto indicativo del sito della lesione:
Respiro di Cheyne-Stokes: In tale stato la persona alterna fasi di apnea anche lunga (fino anche a
20 secondi) a fasi in cui si passa gradatamente da una respirazione profonda, ad una sempre più
superficiale (cicli respiratori brevi e frequenti) e che termina nuovamente nella fase di apnea. Molto
indicativo di una lesione encefalica.
Iperventilazione neurogena centrale: respiro superficiale, velocissimo. Indica: lesione
mesencefalica Respirazione apneustica: caratterizzata da una fase inspiratoria prolungata (detta
crampo inspiratorio) e da una breve fase espiratoria. Anche in questo caso le cause principali sono
lesioni del tronco encefalico. Indica una lesione pontina.
Respirazione a grappolo: sequenza di atti respiratori irregolari per ampiezza seguiti da pause
irregolari. Indicativa di un interessamento ponte-bulbo.
Respirazione atassica: segue un pattern respiratorio molto irregolare, caratterizzato dall’alternanza
imprevedibile di iperventilazione e apnea. E’ associato a asincronia delle contrazioni dei muscoli
intercostali e del diaframma, che vengono a trovarsi in fase respiratoria opposta.Indicativa di una
lesione del bulbo.
Vanno ricercate tumefazioni e ferite (la fuoriuscita di sangue dal condotto
uditivo o liquorrea nasale sono segni di frattura della base cranica). L’olfatto gioca un ruolo nel caso
l’alito del paziente mantenga un odore alcolico, di frutta marcia (cheto acidosi diabetica), di
mandorle amare (intossica mento da cianuro), urinoso (coma uremico). Successivamente vanno
analizzati singolarmente e specificatamente 1)collo: la rigidità nucale suggerisce trauma, meningite 2)
torace: rantoli (I.cardiaca) sibili (crisi anafilattica) 3)addome: ematomi, tumefazioni, masse pulsatili 4)
retto e altro: sangue nelle feci, emorragie da qualsiasi orificio.
La fase successiva è l’indagine neurologica:
Si usa la Glasgow scale che prende in esame l’apertura degli occhi, la risposta verbale e la risposta
motoria.
Segni meningei: dovuti a meningite/ emorragia sub aracnoidea. Presenza di rigidità nucale(
resistenza del capo a flessione o estensione), segno Kering (l’esaminatore può estendere la coscia
solo se il ginocchio può piegarsi liberamente) e di Brudzinski (la flessione della testa determina
automaticamente la flessione delle ginocchia). Sistema motorio: sbadigli e deglutizione
suggeriscono che il tronco sia intatto; scosse mio cloniche suggeriscono una causa metabolicoanossica; emiplegia e iperriflessia con risposta plantare estensoria suggeriscono una lesione
strutturale, mentre una iporiflessia senza paralisi suggerisce causa farmacologica. Sistema
sensoriale: una lesione è sospettabile quando c’è un’evidente alterazione della risposta agli stimoli
nociocettivi.
Funzionalità del tronco encefalico: devi studiare la1) reattività pupillare: nel coma tossicometabolico ad es, le pupille sono normo reagenti alla luce e isocoriche (se manca il riflesso o è
asimmetrico bisogna ricercare una patologia strutturale). Midriasi: se è bilaterale con pupilla
iporeagente alla luce (danno mesencefalico, farmaci come atropina antidepressivi); se la midiriasi è
unilaterale con associata paralisi oculomotoria e non reattiva alla luce: probabile lesioni mesencefalo
e erniazione uncale. Miosi: se bilaterale con pupille puntiformi normo reagenti alla luce: overdose
oppiacei, lesioni pontine; se monolaterale non reattiva: patologia di Horner (dissezione e occlusione
aorta).
112
Posizione spontanea degli occhi: sguardo deviato verso la lesione (lesione encefalica), contro
lateralmente alla lesione o divergenza verticale dei bulbi (sofferenza del tronco).
Movimenti oculari spontanei: La presenza di movimenti spontanei lenti, oscillanti escludono una
lesione tronco encefalica. Bobbing: accessi di movimenti oculari intermittenti, usualmente coniugati,
bruschi, diretti verso il basso, cui segue il ritorno alla posizione iniziale “con una specie di inchino”.
Tipico delle gravi lesioni distruttive pontine caudali. Riflesso corneale: Stimolazione della cornea:
chiusura della palpebra e deviazione verso l’alto dell’occhio (fenomeno di Bell). Bisogna stare attenti a
causare l’infiammazione della cornea durante l’esecuzione del test;si raccomanda di usare sempre
pomate oftalmiche perché questi soggetti sono tendenti alla secchezza corneale.
Movimenti oculari riflessi: la presenza di questi due riflessi è tipica del soggetto lesionato.
1)Riflesso oculo-cefalico: ruoti la testa del paziente prima lentamente poi velocemente. In caso di
emisferi cerebrali danneggiati e tronco intatto gli occhi hanno una direzione opposta rispetto al
senso di rotazione del capo. In caso di tronco encefalico danneggiato: gli occhi seguono la
direzione della testa.
2)Riflesso oculo-vestibolare: evocato
iniettando acqua fredda nell’orecchio, si verifica, nel soggetto normale o in coma psicogeno,nistagmo
con fase lenta verso l’orecchio irrigato e la fase rapida contro laterale. Nelle lesioni sottotentoriali il
riflesso può mancare, mentre nelle sovratentoriali e metaboliche gli occhi deviano tonicamente vs la
sede di irrigazione ma manca la correzione corticale in senso opposto.
Caratteristiche del coma sovratentoiriale (corticale):
Inizio graduale del coma. Segni iniziali: afasia, emiparesi/emiplegia contro laterale con deviazione
oculare coniugata degli occhi lontano dagli arti paretici, crisi parziali motorie. Progressione in senso
rostro caudale, abbiamo:
-Sindrome diencefalica: coscienza: rallentamento pensiero e motorio; respiro: Cheyne Stokes;
pupille: miotiche e debolmente reagenti;riflessi oculo motore e oculo vestivolare: presenti ma la
componente rapida del nistagmo è ridotta/abolita; funzione motoria: tardivamente compare
decorticazione come risposta al dolore.
-Sindrome mesencefalica: coscienza:non responsivo,respiro:iperventilazione centrale neurogena,
pupille:non reagenti,riflessi oculo motore e oculo vestibolare:assenti, funzione motoria: risposta
in decerebrazione alla stimolazione nociocettiva o spontaneamente.
-Sindrome ponto-bulbare: coscienza:non responsivo,respiro:apneustico, atassico,pupille:non
reagenti,riflessi oculo motore e oculo vestibolare:assenti, funzione motoria: risposta in
decerebrazione alla stimolazione nociocettiva o spontaneamente.Questo stadio rappresenta la
modalità di presentazione delle patologie acute catastrofiche che si presentano in emergenza.
Coma da patologia sottotentoriale:
Inizio improvviso preceduto da nausea, vomito, cefalea diplpia e cefalea. I riflessi oculari assenti o
anormali, tetraplegia e respiro apneustico o bizzarro. Può esserci emi o tetraplegia.
Coma da patologia metabolica:
Inizio graduale, preceduto generalmente da delirio, sopore, stupore. Deficit motori simmetrici,
reazioni pupillari alla luce mantenute ma diametri ridotti.
Indagini di laboratorio: glicemia, elettroliti, anion Gap, creatinina, azotemia, transaminasi, bilirubina,
screening tossicologico e alcol. Ma anche Emocromo e elettroliti, test di gravidanza, emogasanalisi.
Fissare un catetere vescicale, effettuare una lavanda gastrica. Indagini strumentali: monitoraggio
ECG, saturi metrico. Rx del rachide e del cranio, Tac cranio.
113
Annegamento
Quadro evolutivo legato all’inalazione di liquidi. Si distingue:
• Annegamento umido: 80-90%, morte per asfissia da inalazione di liquidi nelle vie aeree e
talvolta anche nello stomaco.
• Annegamento secco: 10-20%, morte per asfissia da laringospasmo protratto.
In particolare, in base al meccanismo fisiopatologico coinvolto, si distingue:
• Anossia: asfissia reale. Annegamento secco. Per chiusura riflessa della glottide.
• Annegamento in acqua salata: ipertonica, si ha richiamo di liquidi dai capillari polmonari
agli alveoliedema polmonare acuto-alterazione surfactanteipovolemia ed
emoconcentrazioneasistolia dopo 6-7 minuti.
• Annegamento in acqua dolce: ipotonica, si ha richiamo di acqua ai capillari
polmonariipervolemia ed emodiluizione e riduzione osmolarità plasmatica emolisi ed
iperkaliemiaaritmie asistolia dopo 3-5 minuti. Si associa spesso atelettasia
(alterazione surfactante e colabimento alveolare) e edema polmonare acuto.
Cause: esaurimento di nuotatore capace, nuotatore incapace, sincope riflessa (da temperatura
dell’acqua, impatto violento dell’addome con l’acqua), perdita di conoscenza per uno stato
morboso critico, evento traumatico.
Fasi dell’annegamento: Sorpresa: unico atto inspiratorio riflesso compiuto all’entrare in acqua.
Resistenza: spasmo serrato della glottide, che dura circa 1 minuto. Dispnea: per ipercapnia non è
più possibile trattenere il respiro, si rilascia la glottide e si fanno respirazioni sott’acqua che
introducono molto liquido nei polmoni. Apnea: perdita di coscienza, coma profondo con arresto
del respiro. Terminale: boccheggia mento e arresto cardiaco. Più rapida in acqua dolce.
Clinica: Alterazioni respiratorie: tosse, tachipnea, ma anche dispnea ed apnea, edema polmonare
acuto, atelettasie. Rumori umidi ed espettorazione di sangue. Alterazioni cardiovascolari: pallore
e cianosi, aritmie, arresto cardiaco. Alterazioni neurologiche: confusione, ma anche convulsioni,
alterazioni della coscienza fino al coma. Possibile ipotermia.
Laboratorio: vi è ipossia ed ipercapnia, acidosi respiratoria, squilibri elettroliti, emolisi, etc.
Terapia: non mettere a repentaglio la propria vita. Gettare corde o altro per aiutare oppure
trasporta a riva con un braccio libero. Classificazione della vittima:
• Acquastress: non ha inalato, è tachipnoico e tachicardico. Riscaldare e controllare.
• Ipossia modesta: ha inalato, ma è vigile. Tosse consistente e tachicardia. Serve
ossigenoterapia e comunque ospedalizzazione obbligatoria.
• Ipossia severa: cianosi, dispnea, tachicardia, obnubilamento, coma. Servirà toilette delle vie
aeree, ventilazione artificiale, ricovero.
• Anossia: da asfissia. Cianosi, apnea, coma, assenza di polso. Serve BLS +ALS.
BLS annegamento: effettuare tutta la normale sequenza. Facile che vi sia vomito (collocare in
posizione laterale di sicurezza), difficile che vi siano traumi (inutile immobilizzare il rachide). Non
serve cercare di liberare le vie respiratorie dall’acqua.
In ospedale: servirà correggere ipossia e acidosi, volemia e osmolarità, eventuali squilibri
elettrolitici, edema cerebrale.
Ipotermia
Temperatura centrale inferiore a 35°. Assideramento: temperatura centrale inferiore a 34°. La
temperatura corporea centrale è misurata tramite sonde per basse temperature (timpanica,
esofagea, vescicale, rettale). Ipotermia: è un abbassamento in pratica di pochi gradi, ma in grado di
compromettere gli organi vitali. Congelamento: abbassamento della temperatura sotto gli 0°, ma
in aree limitate del corpo. Sotto i 35° le funzioni vitali sono compromesse. Sotto i 28° si arrestano.
Anche l’esposizione a 15° in immobilità può causare ipotermia.
Epidemiologia: in genere da droghe, etilismo, altre patologie. Più negli anziani.
I meccanismi di produzione e mantenimento di calore corporeo sono sopraffatti. Ciò accade
quando la temperatura esterna è bassa o vi sono patologie croniche. La velocità del vento influisce
dando una temperatura percepita più bassa di quella reale.
Cause: Primitive: esposizione prolungata al freddo. Secondarie: patologie che coinvolgono
ipotalamo e SNC: traumi, tumori, encefalopatia di Wernicke, anoressia, ictus. Cause metaboliche:
insufficienza ipofisaria, tiroidea, surrenalica. Tossiche: alcol, barbiturici, CO, uremia. Altro:
malnutrizione, sepsi, digiuno.
Classificazione REGA: Grado I: 35°-32°. Piena coscienza, brividi intensi, polso frequente, respiro
rapido. Grado II: 32°-28°: sonnolenza o confusione, non ha più brividi e respira lentamente.
114
Grado III: <28°: incoscienza, segni vitali poco percettibili. Grado IV: morte apparente, assenza di
segni vitali (arresto cardiaco).
Nel primo stadio l’organismo mette in moto meccanismi di compenso. Dal secondo stadio in poi il
paziente muore senza intervento. Nel terzo e nel quarto può sembrare morto ma se si interviene
subito può ancora esserci guarigione.
Gestione: valutazione iniziale, anche eziologica, dell’ipoetermia. Valutare approccio e trattamento.
Anamnesi: fonti di esposizione, patologie, tossici, valutazione dei sintomi. Esame obiettivo:
misurare la temperatura interna, valutare presenza di brivido, frequenza respiratoria, segni di
scompenso cardiaco, alterazioni neurologiche. Esami di laboratorio: funzione renale, elettroliti,
emocromo, tossicologico, EGA, urine. Strumentale: ECG, Rx torace, eventuale TC.
Laboratorio: aumento ematocrito, ipopotassemia, iperglicemia, ipoproteinemia, aumento amilasi e
CPK e transaminasi, acidosi mista. Strumentali: Rx torace: polmonite o focolai di ab ingestis.
Ecografia addome: lesioni truaumatiche e pancreatiche. ECG: aumento dell’intervallo P-R, QRS
allargato, onde T invertite, Onda J (di Osborne), aritmie pericolose.
Terapia: valutare polso e respiro, se necessario BLS. Rimuovere panni bagnati, se possibile
somministrare bevande calde, no alcool e caffeina, coperte. Coprire la testa. Non utilizzare fonti di
irradiazione di calore esterne, no esercizio muscolare strenuo.
In ospedale: eventuale intubazione, se in coma somministrare tiamina nel sospetto di alcolismo e
glicemia se ipoglicemico. Monitoraggio cardiaco, profilassi aritmie ipercinetiche con bretilio.
Sondino naso-gastrico e catetere vescicale. Accesso venoso per soluzione fisiologica riscaldata a
45°. Ossigeno riscaldato a 45°. Trattare la malattia di base se ipotermia secondaria.
Tipi di riscaldamento: Lento: 0,3-1,2°/h. Moderato: 3°C. Rapido: 6-18°.
Collasso da riscaldamento: si può verificare eccessiva vasodilatazione, ipotensione e shock.
Evitare di riscaldare il paziente troppo velocemente.
After drop: ulteriore decremento della temperatura interna dopo manovre intese a ripristinare la
temperatura. Può essere dovuto al riscaldamento delle estremità con immissione di sangue freddo
e acidi in circolo. O riequilibrio tra temperatura periferica e centrale.
Folgorazione
Fenomeno che si verifica al contatto del corpo con un conduttore elettrico. Spesso per incidenti sul
lavoro e domestici, raro per fulmini. Se la tensione è alta: caso di arco fotovoltaico, può avvenire
la scossa anche senza contatto diretto con la sorgente elettrica. La corrente può causare effetti a più
livelli: Ustioni (in genere da correnti ad alto voltaggio, situazione simile alla crush sindrome);
Contratture muscolari 8da correnti alternate). Neurologici: perdita di coscienza, alterazione dei
centri del respiro. Cardiaci: fibrillazione ventricolare ed asistolia.
• Alta tensione: >1000 Volt: la vittima è scagliata lontano. Ustioni estese e gravissime.
• Bassa tensione: <1000 Volt: il rischio maggiore sono danni al cuore: arresto cardiaco.
Terapia: staccare subito la corrente, altrimenti allontanare l’infortunato usando materiale isolante,
toccando solo cose asciutte e stando su di una superficie asciutta. Ogni secondo in più di contatto
con l’elettricità riduce la sopravvivenza del folgorato. Manovre rianimatorie.
Ustioni
Lesioni tissutali causate dall’eccessiva esposizione della cute ad agenti di natura termica, elettrica o
radiante. Se estese o gravi possono causare un coinvolgimento multi sistemico. La gravità
dell’ustione dipende dall’estensione superficiale (in percentuale) e dalla profondità:
1. Ustioni di 1° grado: dolente ipertermia cutanea. Alterazione strati superficiali epidermide.
2. Ustioni di 2° grado: cute rossa, edema, essudato, flittene. Necrosi epidermica e del derma
papillare. A volte necrosi. La riparazione avviene in settimane, anche con esiti cicatriziali.
3. Ustioni di 3° grado: tessuto necrotico da volere bianco al marrone. Interessa tutta la cute e
spesso il connettivo, trombosi di vasi sanguigni. Spesso va incontro a sepsi.
4. Ustioni di 4° grado: distruzione di tessuto osseo, carbonizzazione dei tessuti.
Altri fattori prognostici sono: età, stato generale, traumi, interessamento di zone critiche.
Ustione grave: I grado>75%, II grado>25%, III grado>10%, interessamento di aree critiche, fasce
estreme di età, soggetti con gravi patologie preesistenti, elettriche o chimiche (causano altri effetti).
Clinica: si distinguono 2 fasi: Fase I: quadro di shock, proporzionale all’ustione. Può esserci
ipovolemia per eccessiva vasodilatazione e permeabilità capillare con perdite di acqua elettroliti e
proteine. Si ha in genere insufficienza respiratoria dovuta a varie cause (traumi, minore
espansione del torace dovuta alle escare, inalazioni, etc. Fase II: serie di risposte dovute a vari
115
mediatori. Si possono avere alterazioni cardiovascolari, immunodepressione (facile lo sviluppo di
infezione locale, ma anche di uno stato settico generale), ipercatabolismo (che ritarda la guarigione
e peggiora il quadro generale). Possono verificarsi CID e ARDS.
Terapia fase I: allontanamento dalla fonte ustionante, anamnesi, trattamento dell’insufficienza
respiratoria con ossigeno (anche fino all’intubazione). Misure di supporto cardiocircolatorio:
compensare le perdite di proteine, acqua ed elettroliti. Non si usano colloidi, più che altro
soluzioni ipertoniche. Si possono dare inotropi positivi (dopamina, o meglio dobutamina). Tenere
sotto controllo le costanti ematochimici, emocromo, EGA, etc. Analgesici come meperidina o
morgina. Prevenzione ulcere da stress con anti-H2. Sondino naso gastrico per ustioni del volto.
Possibile terapia iperbarica per accelerare la guarigione.
Terapia fase II: fondamentale la prevenzione, controllo e rimozione dei focolai settici. Trattamento
topico con creme antibiotiche, escarectomia, copertura con cute autologa da siti donatori (da fare
entro la prima settimana, prima del acme infiammatorio e infettivo). Le ustioni di II grado e quelle
di III a spessore parziali spesso in asetticità riepitelizzano spontaneamente. In quelle di III grado a
tutto spessore bisogna rimuovere l’escara rapidamente. Supporto nutrizionale, possibilmente
enterale. Ambiente asettico. Evitare l’uso indiscriminato di antibiotici, basarsi su colture e
antibiogrammi. In caso di intervento chirurgico dare vancomicina o gentamicina o amikacina. Se vi
è ipercoagulazione si dà eparina. Se c’è CID plasma fresco e antitrombina III.
Tetano
Eziologia: malattia infettiva, non contagiosa, dovuta a clostridium tetanii, bacillo Gram+. Questo
produce spore in grado di sopravvivere anni. Queste causano infezione se vengono a contatto con
zone emorragiche o necrotiche, ferite, presenza di corpi estranei (terra, schegge). Il bacillo produce
una tossina solubile e diffusibile con affinità per il tessuto nervoso.
Patogenesi: la tossina induce abnorme attività dei motoneuroni somatici. Probabilmente la tossina
raggiunge i tronchi nervosi inizialmente per via ematica.
Clinica: Incubazione: silente, da 5 a 15 giorni. Più è breve più è grave. Esordisce con disfagia,
trisma (per contrattura del massetere) e risus sardonico (contrattura muscolatura facciale).
Interessa i gruppi muscolari in modo discendente. Alla fine interessa muscoli intercostali,
diaframma e laringei causando insufficienza respiratoria. Vi è poi alterazione vago simpatica con
sudorazione, iperpiressia, tachicardia e ipertensione. Successivamente ipotensione bradicardia con
bassa gittata che spesso termina con la morte. Può esservi tetano localizzato: forma rara in cui le
manifestazioni sono solo nel sito delle ferite, oppure generalizzato: sistemico.
Diagnosi: la clinica è fondamentalmente l’unico modo.
Terapia: medicare la ferita allontanando zone necrotiche e corpi estranei, acqua ossigenata.
Terapia antibiotica con penicilline (o eritromicina). Somministrazione di gammaglobuline (siero
antitetanico) per via intrarachidea. Sedativi come il diazepam possono limitare gli spasmi. Possono
essere necessari beta-bloccanti nella fase di stimolazione simpatica. A causa dell’ipercatabolismo
spesso presente, è importante una buona nutrizione con sondino naso-gastrico.
Ossigenoterapia iperbarica:
La somministrazione di ossigeno iperbarico ha alcuni effetti fisiologici positivi: Ristabilisce
funzioni depresse dall’ipossia: funzione fagocitaria dei leucociti, funzione osteociti e fibrociti,
neoformazione micro vascolare, aumento deposizione di collagene, aumento deposizione e
riassorbimento di tessuto osseo. Pertanto ha azione battericida e batterio astatica,
iperproliferazione fibroblasti e funzione maggiore del tessuto osseo. Nei casi di intossicazione
da cianuri o monossido di carbonio facilita la dissociazione dei tossici dall’emoglobina. Inoltre
aumenta la tensione arteriosa di O2 e il riassorbimento degli edemi.
Effetti negativi: può dare danno polmonare e atelettasia, danno retinico, tossicità cellulare,, effetto
tossico su enzimi e cellule del SNC (fascicolazioni, convulsioni, distruzione di neuroni).
Indicazioni: è fondamentale in caso di: embolia gassosa arteriosa, malattia da decompressione,
gangrena gassosa da clostridi, gangrena acuta nei diabetici, crush syndrome, intossicazione da CO,
osteoradionecrosi.
È comunque utile in caso di: innesti cutanei, insufficienza arteriosa periferica, osteomielite,
intossicazioni da cianuro, osteoporosi, fratture.
Altre situazioni sono: edema cerebrale postanossico, mielite da radiazioni, retiniti, etc.
116
Ipertermia maligna
Disordine genetico AD, caratterizzato da una risposta ipermetabolica agli anestetici inalatori ed ai
miorilassanti depolarizzanti. È una forma di iperpiressia progressiva spesso causante morte.
È fondamentale la precocità di intervento.
Epidemiologia: circa 1/100000 nella popolazione adulta. La mortalità è scesa intorno al 7%. La
sindrome è più comune in età pediatrica è nei giovani maschi tra 10 e 20 anni.
Fisiopatologia: vi sono alcune sostanze trigger, scatenanti: anestetici alogenati o miorilassanti
depolarizzanti: fenotiazine, I-MAO, antidepressivi triciclici, inibitori fosfodiesterasi, metilxantine.
Nei pazienti in cui vi è un’alterazione genica dei canali del calcio RyR1, oppure alterazione dell
proteine del meccanismo eccitazione-contrazione, alterazione della pompa del calcio ATP
dipendente o alterazioni del secondo messaggero, vi è un aumento del calcio libero
citoplasmatico. Il recettore della rianodina, gene MHS1 pare essere l’alterazione più comune.
Diagnosi: non esistono segni clinici specifici per l’ipertermia maligna. È importante identificare i
soggetti suscettibili prima dell’esposizione a sostanze scatenanti. Si valutano: familiarità, eventi
avversi in corso di anestesia, CPK sierico elevato, episodi di ipertermia o urine ipercromiche dopo
sforzi fisici intensi, facile stancabilità e crampi, malformazioni muscolo-scheletriche. Bisogna così
valutare i soggetti candidati alla biopsia muscolare. Il CPK è aspecifico, in quanto aumentato in
ipotiroidismo, esercizio fisico, miopatie, infarto del miocardio, rabdomiolisi.
Test diagnostici: si può effettuare il test della contrattura in vitro all’alotano ed alla caffeina.
Molto sensibile e piuttosto specifico. Per aumentare la specificità si fa test anche con cloro-cresolo.
Test diagnostici non invasivi: il test della contrattura in vitro IVTC è invasivo e costoso. Altri test
sono quelli di valutazione del flusso di calcio nei linfociti B con cloro-cresolo, ed altri.
Prevenzione: identificazione del paziente a rischio, preparazione sala operatoria, anestesia sicura.
Segni clinici e strumentali:
• Precoci: rigidità massetere, tachipnea, aumento CO2, tachicardia, rigidità localizzata. Lo
spasmo del massetere, presente anche in miopatie, può complicare l’intubazione.
• Intermedi: ipertermia, urine ipercromiche, discesa saturazione di O2, aritmie, cianosi.
• Tardivi: rigidità muscolare generalizzata, ipertermia >40°C, acidosi mista, aumento della
produzione di CO2, aritmie.
In generale abbiamo: PaCO2 alta e K alti, PO2, pH e saturazione di ossigeno bassi. Segni biochimici
tardivi sono: mioglobine mia/mioglobinuria, acidosi mista e iperlattacidemia, iperCPKemia, CID.
Coinvolgimento organi e apparati:
• Cardiovascolre: diminuita gittata e pressione, aritmie arresto cardiaco. La pressione è
diminuita per la vasodilatazione periferica. L’acidosi mista causa tachicardia.
• SNC: convulsioni e alterazione della coscienza, associate ad alterazioni EEG.
Si distinguono diverse forme: Fulminante: acidosi, ipertermia >38°, rigidità muscolare
generalizzata, marcato incremento enzimi muscolari. Potenzialmente fatale. Moderata: segni
muscolari e metabolici, più generici, regredisce dopo sospensione trigger e Dantrolene. Forma
frusta o abortiva: segni sfumati di stimolazione metabolica: spasmo massetere, etc. Forma tardiva:
da tenere in osservazione per 4-6 ore dopo chirurgia minore e 24 per chirurgia maggiore.
Terapia acuta: Sospendere immediatamente l’anestetico trigger. Sostituire tubi, raccordi e
reservoir del paziente con un circuito non contaminato da alogenati. Iperventilare con O2 al 100%
e aumentare frequenza. Somministrare Dantrolene. Corregere l’acidosi con bicarbonato.
Correggere l’iperpotassiemia: Glucosio/Insulina. (no calcio-antagonisti + dantrolene). Si può
utilizzare lidocaina per controllare le aritmie, anche beta-bloccanti.
Trattamento ipertermia: somministrare soluzioni fredde (4-5°C) per via ev. ed endocavitaria.
Raffreddamento di superficie fin quando la temperatura scende a 38°C, per evitare
vasocostrizione. Mantenere la diuresi con furosemide. Se necessari idrocortisone o desametasone.
Preparazione di anestesia sicura: dopo aver valutato i fattori di rischio del paziente ed effettuato il
test IVCT. Preparazione psicologica (rassicurazione) e farmacologica: premedicazione con BZP.
Non è indicata la profilassi con Dantrolene. Predisporre apparecchio di anestesia e vaprozzatore
non contaminati con alogenati. Monitoraggio: CO2 espirata, ECG, PA, temperatura, saturazione,
ma anche potassio e CPK. Vi deve essere adeguata scorta di Dantrolene e soluzioni glucosate a 4-5°
oltre che mezzi di raffreddamento di superficie. Anestesia sicura: BZP, propofol, oppioidi,
protossido di azoto, miorilassanti competitivi. Oltre ad alogenati e succinil colina sono considerti
trigger anche I-MAO e antidepressivi triciclici.
Predizione dell’ipertermia maligna: si valuta con un punteggio da 1 a 80 (e più): rigidità, danno
muscolare, acidosi respiratoria, temperatura, coinvolgimento cardiaco.
117
Intossicazioni
Paziente intossicato: Esame obiettivo e primo soccorso: si deve dare la precedenza alla
valutazione delle funzioni vitali:
• Valutazione neurologica: con glasgow ed esame dei riflessi pupillari.
• Valutazione respiratoria: valutare pervietà vie aeree, alterazioni del respiro, può essere
necessaria la ventilazione artificiale, anche con intubazione. Si fa pertanto emogasanalisi,
che permette anche la valutazione di acidosi o alcalosi. Esame obiettivo torace.
• Valutazione cardiocircolatoria: valutazione polso e pressione arteriosa, ECG. Accesso
venoso, ottnere campioni di sangue per lo screening tossicologico. Somministrare
glucosata al 5%. Fluidoterapia se c’è ipotensione. Si può già iniziare senza provarla la
terapia con Naloxone come antidoto, nel paziente in coma. Tutto in 5-10 minuti.
Anamnesi tossicologica: anamnesi patologica e tossici, anche suicidi e droghe.
Misure atte ad impedire l’assorbimento del tossico:
• Lavanda gastrica: il valore terapeutico della procedura resta controverso. Si deve fare se vi
è sospetto di ingestione di sostanze ad alta tossicità (cianuro, antidepressivi triciclici,
colchicina). Il tossico dopo 2-4 ore cessa di essere nello stomaco (tranne sedativi, oppioidi,
anticolinergici che rallentano lo svuotamento gastrico), pertanto risulta utile solo se fatta in
questo lasso di tempo. Alcune sostanze come aspirina e ferro possono comunque rimanere
a lungo nello stomaco. Se vi è stato vomito importante prima del ricovero probabilmente
sarà inutile. La lavanda o gastrolusi ha però anche complicanze come: perforazioni
esofagee, traumatismi, ab ingestis, emorragie. In pratica la lavanda non è da utilizzare
routinariamente e pare efficace solo se fatta entro un’ora. Tecnica: sonda di calibro
maggiore rispetto ad un sondino (deve permette passaggio anche di compresse intere). Si fa
per via orale. Una volta nello stomaco posizionare il paziente in decubito laterale sinistro.
Si collega il cilindro di una siringa all’estremità della sonda, più in alto del paziente.
Immettere 150-200 ml di salina, abbassare il cilindro sotto il paziente e lasciare drenare il
liquido del lavaggio dello stomaco per gravità. Quando la soluzione è limpida si termina.
• Sciroppo di ipecacuana e altri emetici: l’ipecacuana è l’emetico di prima scelta. Contiene
alcaloidi in grado di stimolare il vomito per via centrale e periferica entro 25-30 minuti
dalla somministrazione. 30ml di sciroppo e molti bicchieri d’acqua. Anche una seconda
dose dopo altri 30 minuti. Se non si ottiene l’effetto: gastrolusi e carbone attivato. Altri
modi per indurre il vomito (manuale, apomorfina che è più rapida) sono sconsigliati.
Controindicazioni: coma in atto, età<6 mesi, convulsioni in atto, ingestione di acidi forti o
alcali (possono danneggiare le mucose alla fuoriuscita), necessità di dare antidoti per os,
diatesi emorragiche (varici, cirrosi), ingestione di materiale tagliente, vomito già avvenuto.
• Carbone attivato: efficace nell’assorbire una grande varietà di sostanze, tranne piccoli ioni
(magnesio, etanolo, ferro, litio). Rapporto carbone/tossico deve essere di 10/1. Si
aggiungono 4-8 parti di acqua alla polvere. Controindicazione: ingestione di acidi o alcali
(inefficace), occlusione intestinale. Da evitare nei pazienti che non possono vomitare (può
provocare vomito). Indicato a tutti i pazienti che giungano in emergenza entro un’ora.
Per evitare il vomito potrebbe essere utilizzato un antiemetico.
• Catartici: poco utili. Possono essere usati con il carbone attivo poiché questo non assorbe i
purganti. Tra questi solfato di magnesio e sorbitolo. Da evitare in caso di ileo, ostruzione
intestinale, insufficienza renale (rischio di ipermagnesemia).
• Irrigazione intestinale totale: serve ad accelerare il transito di tossico attraverso l’intestino
durante l’assorbimento. Soluzioni elettrolitiche di glicole polietilenico permettono che non
vi sia grande assorbimento do liquidi. Indicazioni: utile nei pazienti che hanno assunto
ferro, litio o altri farmaci poco assorbiti dal carbone o ingestione di compresse a lento
rilascio (o anche ovetti di cocaina e simili). Tecnica: si posizione un tubo gastrico attraverso
cui si fa passare glicole polietilenico sino a quando i liquido effluente non sia limpido.
• Altro: dipendendo dal tipo di somministrazione del tossico, può servire decontaminazione
oculare (irrigazione di quantità abbondanti di soluzione acquosa), cutanea (rimozione
degli abiti e lavaggio delle zone venute a contatto), respiratoria (ventilazione e ossigeno).
Misure per l’eliminazione del tossico già assorbito: l’utilità dei metodi di depurazione dipende
molto dalle caratteristiche del tossico assorbito. Funzionano in genere se il tossico ha: emivita
lunga e lenta metabolizzazione per fenomeni di riassorbimento (circolo entero-epatico o tubulare),
basso volume apparente di distribuzione, bassa frazione di legame protidico, bassa liposolubilità,
eliminazione prevalente per via renale.
118
Indicazioni alla depurazione: è da effettuarsi quando vi sono: segni di grave intossicazione con
deterioramento delle funzioni vitali (ipotensione, aritmie, depressione SNC), deterioramento
progressivo e prolungato della coscienza (nonostante la terapia intensiva), quantità o pericolosità
del tossico elevate, compromissione della normale via di eliminazione del tossico (per patologie
o compromissione del paziente dovuta al tossico stesso, per esempio nel caso del paracqua che ha
eliminazione renale, ma causa necrosi tubulare acuta), altri fattori di rischio (età, comorbidità).
Metodi non invasivi: iperventilazione, camera iperbarica, diuresi forzata:
• Diuresi forzata e manipolazione del pH urinario: la diuresi forzata può essere effettata
con carico di liquidi e Mannitolo o diuretici d’ansa (rischi di edema polmonare e
cerebrale). Il pH viene invece manipolata perché in soluzione acida una base debole risulta
più ionizzata e viceversa. La membrane cellulari sono relativamente impermeabili alle
molecole ionizzate, per cui la sostanza ionizzata non verrà riassorbita. Alcalinizzazione:
mediante biacarbonato di sodio (porta il pH urinario a 7-8). Bisogna monitorare con
attenzione potassio e pH urinario. Utile in caso di salicilati o barbiturici (fenobarbital).
Metodi invasivi: sono metodi che comportano in genere dei rischi più o meno gravi. L’efficacia
dipende molto dal volume di distribuzione apparente e dalla concentrazione ematica, dalla
velocità di mobilizzazione dai tessuti al sangue, dal legame con proteine e dalla liposolubilità. Si
devono effettuare in intossicazioni gravi, con rischio di ingestione di una dose letale. Abbiamo:
• Dialisi peritoneale: in caso di intossicazione da barbiturici, etanolo, glicole etilenico,
mercurio, bromuri, litio, chinidina, salicilati, teofillina. La clearance dipenderà dal flusso
del dialisato e dal tossico. L’ipotensione riduce l’efficacia. È semplice, ma di efficacia
minore rispetto all’emodialisi. Utile in assenza di questa o in caso di trasporto.
• Emodialisi: difficile in caso di ipotensione e riduzione gittata. Efficace di più per sostanze
con peso molecolare <500 Da, idrosolubili, basso volume di distribuzione, scarso legame
proteico. Intossicazioni da tricoloroetano, etanolo, metanolo, glicole, litio, salicilati. Può
inoltre servire a trattare acidosi metabolica, iperpotassemia, sovraccarico di liquidi. Può
dare trombosi nel sito venoso di accesso, infezioni, embolia, etc.
• Emoperfusione: con cartucce di carbone attivato o resine assorbenti. Utile in caso ad
esempio di barbiturici, carbamazepina, metotrexate, teofillina. Il passaggio attraverso il
filtro può dare leucopenia, trombocitopenia, piccole embolie di carbone.
• Emofiltrazione: processo attraverso il quale liquidi, elettroliti e sostanze a basso peso
molecolare vengono rimosse mediante un filtro. È di seconda scelta. Ma può essere
continua. Utile nelle intossicazioni da teofillina e paraquat.
Esempi di intossicazioni:
Benzodiazepine: molto comuni, ma scarsa tossicità acuta in genere. Si ha depressione del SNC.
L’antidoto è il flumazenil, antagonista del recettore. Da evitare se anche antidepressivi triciclici.
Antidepressivi triciclici: al secondo posto per frequenza, hanno notevole tossicità acuta. Hanno
azione anticolinergica e quindi eccitante a livello del SNC con rischio di convulsioni, ma anche
aritmie ipercinetiche. Non vi è antidoto specifico. Da effettuare tecniche di decontaminazione
gastrointestinale: lavanda gastrica subito (causano comunque ritardato svuotamento), carbone
attivato, anche somministrazione ripetuta (ogni 6 ore). Inutile la depurazione dato l’elevato
volume di distribuzione. Monitoraggio e sostegno delle funzioni vitali.
Barbiturici: sono stati ormai sostituiti dalle benzodiazepine come sedanti. Inducono depressio del
SNC con significativa depressione respiratoria e cardiocircolatoria. Alta mortalità. Si giova della
alcalinizzazione delle urine attraverso bicarbonato di sodio ev.
Droghe d’abuso: Oppiacei: da dosi massicce di eroina, morfina, metadone o derivati come la
meperidina e idromorfone. Nei casi gravi: miosi, bradipnea o apnea, assenza di risposta al
dolore, coma profondo. Solo con la meperidina non c’è miosi. Serve mantenere le vie aeree pervie
e ventilazione. Infusione di soluzioni saline non in quantità elevate. Naloxone. Il naloxone è un
antagonista degli oppioidi. Può causare una sindrome da astinenza: agitazione, dolori
addominali,sudorazione, vomito. È grave nei neonati, meno negli adulti.
Cocaina: causa simolazione del SNC, agitazione psicomotoria, possibile,psicosi. Può dare infarto
del miocardio, anche in giovani per effetto vasocostrittore. Serve sostegno delle funzioni vitali,
glucosio al 20%, nifedipina, nitro prussiato per l’ipertensione. Diazepam per la sedazione.
Altro: Sostanze caustiche: somministrare latte, no lavaggio gastrico. Terapia chirurgica.
CO: insufficienza respiratoria trattabile con ossigenoterapia al 100%. Trae beneficio dalla camer
iperbarica. Morso di vipera: possibile shock. Bende per limitare la diffusione. Siero antiofidico.
Funghi: l’amanita phalloides dà vomito e diarrea., poi grave. Solo fluido terapia.
119
Cause: mutazione del gene che codifica il cotrasportatore del sodio e del cloruro a livello
del tubulo distale del nefrone.
Terapia: in tutte queste 4 forme è necessario l’apporto di calcio (gli inibitori della sintesi
delle prostaglandine hanno solo un’efficacia transitoria); somministrare inoltre spironolattone oppure triamterene (senza tiazidico).
PSEUDO-SINDROME DI BARTTER
Epidemiologia: spesso giovani donne che esercitano attività sanitarie, anoressia nervosa.
Eziologia
— abuso di lassativi
— abuso di diuretici.
Clinica: il quadro è analogo a quello della sindrome di Bartter.
Diagnosi: anamnesi, clinica, evtl. presenza di tracce di diuretici nell’urina.
Terapia: sostegno psico-somatico, sospensione dei farmaci scatenanti.
INSUFFICIENZA RENALE
INSUFFICIENZA RENALE ACUTA (IRA)
Definizione
Insufficienza renale ad esordio acuto, abitualmente reversibile.
Sintomo tipico: riduzione della produzione di urina ! oligoanuria con aumento di azotemia e creatininemia.
Oliguria: < 500 ml urina/die
Anuria: < 200 ml urina/die.
Il 15% dei casi presenta diuresi normale o poliuria. In questi casi l’unico sintomo è rappresentato dall’aumento nel plasma delle sostanze normalmente eliminate con le urine.
In assenza della dialisi, l’IRA ha un decorso verso l’uremia e l’exitus.
Eziologia
1. IRA prerenale (70-80% dei casi)
— danno renale circolatorio-ischemico da ipotensione, ipovolemia, shock di varia
genesi.
Nota: non è sempre possibile accertare anamnesticamente lo shock. Spesso la
sintomatologia dello shock è transitoria oppure viene mascherata (ad es. non
viene notata la caduta della PA durante la narcosi).
— danno renale tossico (alcuni autori lo considerano tra le cause renali di IRA);
principali fattori scatenanti:
• farmaci: antiinfiammatori non steroidei = FANS (inibitori della sintesi di prostaglandine); ACE-inibitori; antibiotici: aminoglicosidi, cefalosporine, inibitori
della girasi, amfotericina B, ecc.; citostatici: cisplatino, metotrexate, ciclosporina, ecc.; sali d’oro
697
120
• mezzi di contrasto iodati (in particolare nei pazienti con reni già danneggiati
e/o trattati con farmaci potenzialmente nefrotossici e/o affetti da plasmocitoma
o da malattia di Waldeström).
Nota: nei pazienti con funzionalità renale ridotta, è tassativa la necessità di
adottare adeguate misure. Ricorrere, se possibile, ad altre indagini diagnostiche d’immagine. In caso di somministrazione di mezzo di contrasto, impiegare sostanze non ioniche a bassa osmolarità e attuare alcune misure preventive:
adeguata idratazione, sospensione di farmaci potenzialmente nefrotossici
• sostanze chimiche, ad es. glicole
• emolisi (incidente trasfusionale)
• rabdomiolisi: traumi («crush-syndrome»), abuso di farmaci, delirio da astinenza alcoolica, eccessivo sforzo fisico, ipolipemizzanti (ad es. inibitori della
HMG-CoA-reduttasi, fibrati).
2. IRA renale:
affezioni renali da cause diverse:
— nefropatie infiammatorie: sindrome di Goodpasture, nefrite interstiziale acuta da
farmaci, infezione da Hantavirus, ecc.
— nefropatie vascolari: occlusione dell’arteria o vena renale, vasculiti, ecc.
— sindrome emolitico-uremica (SEU) = sindrome di Gasser: è la causa più frequente di IRA in età infantile. 2 forme:
• SEU enteropatica, causata da E. coli enteroemorragica = E. coli produttrice di
verotossina, appartenente al sierogruppo 0 157.
• SEU non enteropatica, causata da pneumococchi produttori di neuraminidasi,
o da causa sconosciuta
— ostruzione tubulare da precipitazione di catene leggere (in caso di plasmocitoma), urato (in caso di iperuricemia), ossalato (ad es. in caso di intossicazione da
glicole).
3. IRA postrenale:
ostacoli al flusso urinario (localizzati dal bacinetto renale fino all’uretra = blocco
urinario).
Clinica
All’esordio l’IRA non presenta sintomi significativi: successivamente compaiono rapidamente astenia, nausea, torpore, ev. labilità neuropsichica. Poiché in taluni casi può
mancare il sintomo principale (oliguria) conviene sempre controllare accuratamente la
funzione renale nelle affezioni predisponenti all’IRA (bilancio idrico, azotemia e creatininemia, esame delle urine).
4 Stadi dell’IRA:
1. lesioni renali (ad es. shock, nefrotossine)
2. oligo-anuria: pericoli principali:
— ipervolemia (insufficienza cardiaca sinistra, edema cerebrale, edema polmonare)
— iperpotassiemia (acidosi metabolica, uremia)
3. poliuria: pericolo principale: perdita di acqua, sodio e potassio
4. guarigione con normalizzazione della diuresi.
Complicanze
1. Polmone:
— polmone da shock (ARDS) nell’ambito di uno shock che ha portato all’IRA
— fluid lung, edema polmonare da ipervolemia
— polmonite (ad es. dovuta a respirazione artificiale).
698
121
2. Sistema cardio-circolatorio:
— ipertensione (ad es. dovuta ad ipervolemia)
— insufficienza cardiaca, pericardite (evtl. con versamento)
— disturbi del ritmo cardiaco da alterazioni del potassio.
3. Apparato gastro-intestinale:
— ulcera da stress, evtl. con emorragia
— gastroenterite uremica, peritonite.
4. SNC:
edema cerebrale.
5. Sistema ematopoietico:
anemia, piastrinopenia e alterazioni funzionali delle piastrine, evtl. leucocitosi.
6. Sistema immunitario:
indebolimento delle difese con pericolo di infezioni, polmoniti, sepsi (specialmente
dopo manovre strumentali o cateterizzazione delle vie urinarie, cateterizzazione venosa, respirazione artificiale).
Diagnosi differenziale dell’oligo-anuria
1. Oliguria funzionale (ad es. da mancato apporto di liquidi).
Sia nell’oliguria funzionale, sia nella IRA, l’azotemia è aumentata (nell’oliguria
funzionale la creatininemia subisce un aumento minore). L’esame delle urine evidenzia quanto segue:
parametro urinario
peso specifico (g/l)
osmolalità (mosm/kg)
urea (mg/dl)
sodio (mmol/l)
rapporto urea urinaria/urea sierica
2.
3.
4.
5.
oliguria funzionale
IRA
> 1.025
> 1.000
> 1.000
<
30
>
10
< 1.015
< 600
< 1.000
>
35
<
5
Nota: se l’oliguria funzionale non viene trattata con adeguato apporto di liquidi,
può instaurarsi una IRA.
IRA prerenale
Anamnesi: shock? narcosi? emolisi? miolisi? aborto? insufficiente apporto di liquidi in caso di febbre? sudorazione abbondante? diarrea? ecc.
IRA renale
GN iperacuta? (infezione preesistente? edema? ipertensione? nefromegalia riscontrata all’ecografia?). In caso di oliguria associata a tosse con espettorato ematico, pensare alla sindrome di Goodpasture. Esclusione di una infezione da Hantavirus mediante test sierologici (IgM aumentate).
Anuria postrenale
Blocco meccanico al flusso di urina dal rene o dalla vescica in caso di preesistente
affezione urologica, ginecologica, interventi in prossimità della vescica.
Ecografia: bacinetto renale dilatato e ripieno di liquido. Vescica vuota in caso di
occlusione localizzata all’uretere. Vescica piena in caso di ostacolo localizzato distalmente alla vescica (uretra, prostata). Valuzione del riempimento vescicale con
percussione/palpazione, event. puntura vescicale qualora non sia possibile eseguire
una ecografia.
Insufficienza renale cronica
nefropatie pregresse? anemia renale? ipertensione prolungata? (ecograficamente:
piccoli reni grinzi - IRA: reni grandi).
699
122
Diagnosi
1. anamnesi + clinica
2. quantità della diuresi
3. esami ematochimici: iperazotemia (evtl. stick rapido in caso di emergenza), ipercreatininemia, disturbi elettrolitici, emogasanalisi
4. esami urinari: sedimento, proteinuria, peso specifico e osmolalità, urea, sodio
5. ecografia color-doppler: IRA: nefromegalia; IRC: piccoli reni grinzi; stasi nel bacinetto renale? calcoli? mancato riempimento vescicale?
6. inoltre:
— radiografia del torace (fluid lung?)
— sospetto di trombosi dei vasi renali ! ecografia color-doppler, angiografia
— sospetto di IRA postrenale ! parere dell’urologo
— esclusione di una GN rapidamente progressiva (diagnostica immunologica: ANCA, ecc.)
— esclusione di una infezione da Hantavirus; in età infantile esclusione di una infezione da E. coli enteroemorragica.
Terapia della IRA
1. Trattamento della patologia di base:
— trattamento dello shock
— misure di rivascolarizzazione in caso di malattia occlusiva reno-vascolare
— trattamento urologico in caso di ostruzione delle vie urinarie.
2. Trattamento sintomatico dell’IRA da causa renale o prerenale: somministrazione di
un diuretico dell’ansa, ad es. furosemide. Il trattamento diuretico determina l’aumento della diuresi (ma non del filtrato glomerulare). Ciò rappresenta il presupposto per l’apporto per via parenterale di:
— calorie
— farmaci.
3. Bilancio idroelettrolitico
— in caso di iperpotassiemia, somministrare resine a scambio ionico, ecc. (vedi
cap. Iperpotassiemia)
— in caso di acidosi metabolica bicarbonato di sodio (secondo il base-excess)
— apporto di liquidi per bilanciarne la perdita:
• perspiratio insensibilis (1 l/die o più; in caso di febbre, 500 ml o più per ogni
°C sopra i 37°C)
• perdita renale
• perdita extrarenale di liquidi (vomito, diarrea, sudorazione, sondino naso-gastrico, secrezione da ferite, ecc.).
In aggiunta alle perdite, l’introduzione quotidiana di liquidi in caso di anuria dovrebbe ammontare a circa 600 ml (1 l perspiratio insensibilis meno 400 ml di
acqua di ossidazione e acqua endogena libera). La perdita ponderale giornaliera
di 200-300 g (catabolismo) corrisponde ad un bilancio equilibrato.
4. Alimentazione
Apporto calorico sufficientemente elevato (ca. 40 kcal/kg).
5. In caso di evtl. somministrazione di farmaci (ad es. antibiotici, digitalici), se ne devono adeguatamente ridurre le dosi. Per il controllo ottimale della terapia, misurare
la concentrazione ematica dei farmaci.
6. Trattamento dialitico
Con il cosiddetto test alla furosemide è possibile valutare preventivamente se la dialisi può essere indicata: se, dopo l’infusione di 500-1000 mg di furosemide in 250 ml
di fisiologica in 1 ora, la diuresi non supera 50 ml/h, l’IRA va trattata con la dialisi.
700
123
Indicazioni per la dialisi:
— azotemia > 150 mg/dl, oligoanuria < 300 ml urina/24 h
— insufficienza renale acuta ipercatabolica (aumento giornaliero dell’azotemia > 60
mg/dl)
— iperpotassiemia non controllabile con terapia conservativa
— acidosi metabolica non controllabile con terapia conservativa
— ipervolemia ingravescente, con pericolo di «fluid lung», edema cerebrale, edema
polmonare
— pericardite uremica.
Alla ripresa della diuresi, in fase poliurica, i pazienti sono esposti al pericolo di perdita di acqua ed elettroliti (in quanto la funzione tubulare recupera più tardivamente rispetto a quella glomerulare).
Prognosi
Dipende da:
1. superamento della patologia di base che ha condotto all’insufficienza renale acuta
(con tutte le complicanze che questa comporta)
2. superamento dell’oligo/anuria:
in assenza di affezioni renali preesistenti, l’IRA prerenale ha una prognosi favorevole se si supera con la dialisi la fase dell’IRA (restitutio dopo circa 3 settimane).
Prevenzione
Trattamento adeguato e tempestivo dello shock + apporto di volume; cauta somministrazione di farmaci potenzialmente nefrotossici.
INSUFFICIENZA RENALE CRONICA E UREMIA
Definizione
È la conseguenza della perdita irreversibile delle funzioni glomerulare, tubulare ed endocrina di entrambi i reni (vedi Fisiopatologia).
Epidemiologia
Incidenza in Europa occidentale: 10/100.000/anno; negli USA: 60/100.000/anno.
Eziologia
— nefropatia diabetica (circa 35% dei casi)
— danni renali da ipertensione (circa 25%)
— glomerulonefrite cronica (circa 10%)
— nefrite interstiziale, compresa la pielonefrite cronica (circa 5%)
— nefropatia policistica (circa 3%)
— nefropatia da analgesici (circa 1%)
— altre cause (6%): malattie del collagene (in particolare LES) e vasculiti, amiloidosi,
mieloma multiplo, ecc.
— eziologia non chiara (circa 15%).
Stadiazione dell’insufficienza renale:
I. Stadio iniziale di compenso:
lieve riduzione della clearance della creatinina e della capacità di concentrazione
con valori di azotemia e creatininemia ancora normali.
II. Stadio della ipercreatininemia compensata:
aumento dei valori di creatininemia sino a 6 mg/dl (530 µmol/l), senza sintomi clinici di uremia.
701
124
Equilibrio elettrolitico
Distribuzione dei liquidi corporei: il contenuto di acqua rappresenta una frazione equivalente
circa al 60% del peso corporeo. L’acqua è distribuita in due compartimenti: extracellulare (circa
1/3) ed intracellulare (circa 2/3). Nell’ipotesi di un contenuto totale di liquidi di 42 litri, 28
sarebbero intracellulari e 14 extracellulari (tra compartimento intravascolare, interstiziale e “terzo
spazio” meno quantificabili costituito da tubo gastro-intestinale, cavità peritoneale, pleurica, etc.).
La quantità di liquido corporeo dipende da un equilibrio tra fluido extracellulare ECF e fluido
intracellulare ICF. Quando vi sono variazioni importanti avvengono ridistribuzioni di fluidi.
Perdite di fluido: una perdita di 2L di fluido isotonico (sangue, fistola intestinale) viene ad essere
a carico del ECF, senza variazione della sodiemia, senza ridistribuzione di fluidi. Una perdita di
3L di fluido ipotonico (perdite insensibili) causa: aumento sodiemia e osmolarità ECF,
redistribuzione dei fluidi tra ICF e ECF, perdita maggiore per ICF che ECF.
Incremento di fluido: un incremento di 2L viene ad essere (infusione salina) a carico dell’ECF,
senza variazione della sodiemia, senza redistribuzione di fluidi. Un incremento di 3L di fluido
ipotonico (glucosio o infusione salina ipotonica) causa: diminuzione sodiemia e osmolatirà ECF,
redistribuzione di fluidi tra ICF e ECF, incremento maggiore per ICF che ECF.
Eccesso di sodio e acqua: causa edema. Eccesso di sola acqua: edema assente.
Deficit di sodio e acqua: ipotensione ortostatica. Deficit di solo acqua: asintomatico.
Deplezione di volume: perdita combinata di acqua e di sodio, con riduzione del volume
extracellulare. Vi è pertanto ipovolemia.
Eziologia: le cause possono essere: Perdite renali: nefropatia cronica, uso protratto di diuretici,
poliuria, diuresi osmotica (diabete), deficit di mineralcorticoidi (Addison). Perdite extrarenali:
gastro-intestinali (vomito, diarrea, drenaggi), cutanee (sudorazione profusa in caso di febbre,
ustioni). Sequestro di liquidi nel “terzo spazio” (meno comune, ascite, emorragie interne, etc.).
Clinica: alterazioni dello stato di coscienza (obnubilamento del sensorio, letargia), secchezza di
cute e mucose, ipotensione ortostatica, tachicardia, oliguria/anuria, a volte anche ipotensione a
riposo fino ad uno stato di shock. Laboratorio: aumento ematocrito, azotemia e creatinemia.
Bisogna però sempre considerare anche calcemia, potassiemia e glicemia, oltre alla natremia, che
può essere alta, normale o bassa. La disidratazione può essere lieve (perdita di liquidi <5% del
peso corporeo), moderata (circa 10%), grave (>15%).
Terapia: apporto di liquidi: almeno 2-3 l di acqua per infusione ev. di NaCl 0,9%.
In generale reintegrare almeno il 50% della perdita entro le prime 12 ore. Ma ridurre la velocità se
si teme l’insorgenza di scompenso cardiaco.
1) Alterazioni della sodiemia: la sodiemia è determinata per lo più dall’equilibrio idrico totale:
A) Iponatriemia: Na<135 mEq/L. In genere da apporto o ritenzione idrica eccessiva. Può essere
• Ipervolemica: scompenso cardiaco, cirrosi epatica, sindrome nefrosica, eccessiva
somministrazione di liquidi.
• Ipovolemica: perdite extra-renali (vomito, diarrea, ustioni) o renali (abuso di diuretici,
nefropatie con perdita di sale, insufficienza surrenalica).
• Euvolemica: insufficienza tiroidea, sindrome da inappropriata secrezione di ADH.
Clinica: dipende dall’entità e dalla rapidità di instaurazione. 130-135: riduzione del gusto; 130-125:
nausea, vomito, sete, anoressia, crampi; 120-125: astenia, sopore, agitazione, confusione; <120: crisi
epilettiche, coma. Se ipovolemia: riduzione diuresi, cute e mucose disidratate, ipotensione. Se
ipervolemia: edemi declivi e/o ascite.
Terapia:
• Ipervolemica: restrizione idrica + eventuali diuretici (furosemide), mentre la soluzione
salina ipertonica non è utile e può essere dannosa.
• Ipovolemia: correzione volemia con soluzione fisiologica (10-15ml/kg per h). In presenza
di sintomi neurologici valutare l’infusione di soluzione ipertonica (1,5-3%).
• Euvolemica: Se lieve ridurre l’apporto idrico fino alla normalizzazione. Se Na <130 o
sintomi neurologici: furosemide + soluzione salina. Nella sindrome da inappropriata
secrezione di ADH: Tolvaptam (antagonista ADH).
125
B) Ipernatriemia: Na>145 mEq/L. In genere da deficit idrico (disidratazione), ma può essere:
• Da diminuito apporto idrico: incoscienza, incapacità a bere, minor senso della sete.
• Da perdita idrica: vomito, diarrea, sudorazione/febbre, iperventilazione, diabete insipido,
diuresi osmotica, tireotossicosi, ustioni.
• Da aumento di sodio: da maggiore apporto (infusione salina ipertonica) oppure da
ritenzione salina (minor perfusione renale, iperaldosteronismo).
Clinica: dipende dall’entità e dalla rapidità d’instaurazione. La sintomatologia è prevalentemente
neurologica: astenia muscolare, confusione mentale, depressine del livello di coscienza di grado
variabile, tachicardia, secchezza di cure e mucose.
Terapia: Soluzione salina ipotonica (0,5%), o glucosata (5%). Se si è instaurata rapidamente
corregere alla velocità di 1 mEq/l per h, se lentamente non superare gli 0,5mEq/l per h.
Se vi è ipovolemia: si può utilizzare inizialmente fisiologica allo 0,9%.
2) Alterazioni della potassiemia: bisogna ricordare che le condizioni di acidosi favoriscono la
fuoriuscita di K dalle cellule, così come gli alfa-adrenergici e la digitale. I beta-adrenergici, insulina
e aldosterone favoriscono l’ingresso di K nelle cellule.
A) Iperpotassiemia: K>5,5 mEq/L. Eziologia:
• Da ridotta escrezione renale: insufficienza renale acuta e cronica, uropatia ostruttiva,
eccesso di risparmiatori di potassio (spironolattone), eccesso di ACE-inibitori,
ipoaldosteronismo primitivo.
• Da eccessiva assunzione: anche in caso di trasfusioni.
• Da shift cellulare: acidosi, ustioni, rabdomiolisi, eccesso di farmaci (come digitale).
Clinica: Gastroenterica: anoressia, nausea, vomito. Neuromuscolare: parestesie, astenia, paralisi
flaccida. Cardiovascolare: ECG con onde T a tenda, aumento intervallo PR, aumento QRS,
appiattimento o scomparsa onda P, giunzione QRS+T (onda sinusoidale). Può giungere fino alla
fibrillazione ventricolare e arresto cardiaco.
Terapia: Resina a scambio cationico Kayexalate: con sorbitolo, ripetibile ogni 4-6 ore.
In caso sia acuta e grave, in ordine di urgenza: Calcio gluconato (ev in 5 min), bicarbonato di
sodio, glucosio + insulina. Anche beta2-stimolanti (salbutamolo), furosemide (d’ansa).
B) Ipopotassiemia: K<3,5mEq/L. Eziologia:
• Da perdita: Renale (iperaldosteronismo, eccesso di diuretici, Cushing, steroidi);
Gastrointestinale: vomito o diarrea.
• Da scarso apporto: anoressia mentale, alcolismo cronico.
• Da shift cellulare: alcalosi, somministrazione di glucosio/insulina.
Clinica: Cardiaca: ECG con onde T piatte, depressione tratto ST, comparsa onda U, allungamento
del QT e PR, extrasistoli atriali e ventricolari, blocco AV. Neuromuscolari: astenia, rabdomiolisi.
Terapia: rimozione delle cause. Casi cronici: terapia orale con cloruro di potassio in caso di
alcalosi e citrato di potassio in caso di acidosi. Casi gravi: cloruro di potassio ev.
3) Alterazioni della calcemia:
A) Ipocalcemia: Ca<2mEq/L o 1mmol/L. Eziologia:
• Da ridotto assorbimento: deficit vitamina D, malassorbimento, insufficienza renale cronica.
• Endocrinopatie: ipoparatiroidismo, pseudo-ipoparatiroidismo, carcinoma tiroide
calcitonina secernente.
• Da aumentata eliminazione: terapia diuretica protratta.
• Altro: ipoprotidemia, alcalosi, iperfosforemia, ipomagnesemia, pancreatite acuta.
Clinica: sono pericolosi valori inferiori a 1,5 mEq/l. La gravità dei sintomi dipende anche dalla
rapidità della diminuzione. Neuromuscolare: segni di Chvostek e Trousseau, laringospasmo,
convulsioni, psicosi. Cardiovascolare: ridotta contrattilità miocardica e gittata, allungamento QT.
Terapia: Asintomatici: calcio per os. Sintomi acuti: calcio glunocato 10%.
Nei pazienti digitalizzati l’aumento della calcemia può causare aritmie ventricolari.
B) Ipercalcemia: Ca>2,7mEq/L o 1,35mmol/L. Eziologia:
Iperparatiroidismo, mieloma multiplo, Addison, Paget, cancro, sarcoidosi, ipertiroidismo,
immobilizzazione, ipervitaminosi D, Milk-alkali syndrome, uso protratto di diuretici tiazidici.
126
Clinica: Cardiovascolare: crisi ipertensive, alterazione ECG (QT accorciato, aumentata tossicità
digitalica). Neurologica: cefalea, letargia, allucinazioni, confusione, astenia muscolare.
Gastrointestinale: anoressia, nausea, vomito, ileo paralitico. Urinaria: poliuria, urolitiasi.
Terapia: la calcemia è importante quando vi è aumento di calcio >12 mg/dL (normale 9-10
mg/dl), se sintomatica, se la funzione renale è alterata.
Reidratazione: soluzione fisiologica. Diuresi forzata: fisiologica + furosemide.
Glucocorticoidi: efficaci in mieloma, neoplasie, milk alcali, sarcoidosi, eccesso di vitamina D.
Calcitonina: ogni 12 ore. Mitramicina: farmaco citotossico che inibisce gli osteoclasti.
Emergenze endocrino-metaboliche
Ipoglicemia: quadro di riduzione dei livelli di glucosio al di sotto di 60-50 mg/dl. È comune in
pazienti diabetici in terapia insulinica o con ipoglicemizzanti orali.
Eziologia: eccesso di insulina (o ipoglicemizzanti), deficit alimentare, esercizio muscolare massivo,
condizioni morbose (insulinoma, ipotiroidismo), traumi.
Clinica: l’esordio è abbastanza rapido. La maggior parte dei sintomi precoci sono dati dalla
risposta adrenergica: cefalea, fame, irrequietezza. Questi sintomi possono mancare in pazienti
diabetici in età avanzata e con polifarmacoterapia. Con glicemia <50-70: allucinazioni,
atteggiamenti ostili, sudorazione fredda, tremori, tachicardia. Con glicemia <20-50: convulsioni,
perdita di coscienza. Con ulteriore calo glicemico può sopraggiungere come.
Questi sintomi sono per lo più dovuti a neuroglicopenia (sofferenza dei neuroni).
Terapia: Ossigenoterapia, Accesso venoso, misurazione glicemia. Se la glicemia è <60-70
somministrare glucosata al 20-50%. Attenzione alla pervietà della via venosa perché la soluzione
fortemente ipertonica può causare necrosi in caso di stravaso. In alternativa anche glucagone.
Sindromi iperglicemiche: distinguiamo essenzialmente due forme: cheto acidosi sistemica (per lo
più diabetica), sindrome iperglicemico/iperosmolare.
A) Chetoacidosi diabetica: spesso associata a sospensione della terapia insulinica nel diabete di
tipo II, ma può anche essere l’esordio di un diabeti di tipo I. La condizione è associata ad un deficit
insulinico ed un eccesso di ormoni contro regolatori (glucagone ma anche cortisolo e catecolamine)
Ne consegue un aumentata lipolisi che causa massivo trasporto al fegato di acidi grassi liberi.
Questi vengono convertiti in corpi chetonici. Questi sono chetoacidi che si neutralizzano con i
bicarbonati. Se in eccesso causano acidosi metabolica con gap anionico aumentato. A questa
acidosi si associa dunque chetonemia/chetonuria e iperglicemia.
Clinica: all’inizio poliuria, polidipsia, deplezione di volume. Possono esserci nausea, vomito e
dolori addominali. Si ha tachicardia e ipotensione. L’alito ha il classico odore di acetone, si può
avere tachipnea (anche respiro di Kussmaul) per l’acidosi e alterazioni della coscienza sino al
coma. Si deve monitorare il pH e il gap anionico e non i corpi chetonici.
Terapia: è necessario valutare eventuali, comuni, alterazioni elettrolitiche (soprattutto potassio,
ma anche fosfati e sodio). Garantire il bilancio elettrolitico e risolvere eventuale riduzione della
volemia. Pertanto Reidratazione con soluzione salina, somministrazione di insulina (in bolo poi,
infusione) fino alla risoluzione dell’acidosi. Se il glucosio è <250mg/dl bisogna aggiungere
glucosio all’infusione. In seguito trattare le alterazioni elettrolitiche: somministrazione di
potassio, mentre raramente è necessario dare bicarbonato di sodio per l’acidosi.
B) Sindrome iperosmolare iperglicemica non chetosica: caratterizzata da iperglicemia,
iperosmolarità, grave disidratazione senza cheto acidosi. Spesso in corso di diabete di tipo II,
specie in età avanzata e in caso di fattori precipitanti (traumi, ustioni, pancreatiti, infezioni, etc).
Si ha pertanto iperglicemia, diuresi osmotica e disidratazione con perdita di liquidi. Non è ancora
chairo il perché non si costituiscano corpi chetonici (no tanti ormoni contro regolatori, attività
epatica alterata, inibizione della lipolisi da parte della condizione iperosmolare, boh).
Clinica: disidratazione, alterazioni della coscienza (dalla confusione al coma), ipotensione,
oliguria (in genere associata a mancanza della capacità di assumere liquidi autonomamente).
Anche in questo caso si ha acidosi metabolica con elevato gap anionico.
Terapia: Reidratazione con soluzione salina, somministrazione di insulina. Trattare le
alterazioni elettrolitiche: somministrazione di potassio. Bisogna in ogni caso prevenire
l’ipopotassiemia che diviene più evidente con l’aumentare della volemia.
127
Alterazioni tiroidee:
A) Tireotossicosi: sindrome da aumentato rilascio di ormoni tiroidei. È una condizione pericolosa
per la vita. Clinica: iperpiressia (febbre oltre i 39-40), confusione mentale, tachicardia,
fibrillazione atriale, collasso cardiocircolatorio. Dolore addominale e diarrea. Possibile diagnosi di
malattia di Graves (ma anche altre situazioni). Terapia: sostegno al circolo e misure specifiche:
propiltiuracile, propranololo (betabloccante adrenergico), ioduro di potassio, desametasone.
B) Mixedema: sindrome da diminuito rilascio di ormoni tiroidei, ipotiroidismo severo. Clinica:
bradicardia, alterazioni respiratorie, confusione, ipotermia. Terapia: misure di sostegno (pervietà
vie aeree, fluidi, glucosio, riscaldamento). Idrocortisone e L-tiroxina.
Insufficienza surrenalica acuta: la crisi surrenalica è una condizione pericolosa per la vita. Può
essere scatenata da fattori come traumi, interventi chirurgici, parto, ustioni, malattia febbrile.
Insufficienza surrenalica primitiva: deficit nella sintesi di glucorticoidi (risposta alla stress) e
mineralcorticoidi (omeostasi idroelettrolitica e pressoria). Le cause possono essere neoplasie,
emorragie, sepsi (con emorragia surrenalica bilaterale è sindrome di Waterhouse-Friderichsen),
etc. La causa più comune è la malattia di Addison (più femminile).
Insufficienza surrenalica secondaria: deficit selettivo di glucocorticoidi: (deficit ACTH) da
somministrazione prolungata di glucorticoidi esogeni, tumori ipofisari, apoplessia ipofisaria.
Il deficit di glucorticoidi causa anoressia, vomito, letargia, ipoglicemia. Nell’Addison c’è mancata
soppressione di ACTH e quindi MSH con associata iperpigmentazione. Il deficit di
mineralcorticoidi causa perdita renale di sodio e acqua, shock ipovolemico ed iperkaliemia.
Clinica: la sintomatologia è soprattutto associata al deficit di cortisolo: febbre, dolore addominale,
astenia, vertigini posturali, ipotensione ortostatica refrattaria al trattamento (ipotensione severa
nelle forme gravi), tachicardia, polso piccolo, cute pallida, possibile shock ipovolemico.
Possono esserci segni di prolungata assunzione di corticosteroidi oppure iperpigmentazione.
Il paziente è in genere ipoglicemico durante la crisi.
Diagnosi: oltre all’anamnesi ed alla clinica, può aiutare il laboratorio (ipoglicemia, iperazotemia in
caso di shock ipovolemico, iponatriemia e iperkaliemia). Il cortisolo può essere dosato, per quanto
poco sensibile, e sarà basso. L’ACTH è elevato nell’Addison. Si può effettuare un test di stimolo
con ACTH (dopo somministrazione di ACTH nei pazienti normali c’è un picco di cortisolo).
Terapia: garantire la pervietà vie aeree, ossigenoterapia al 100% in caso di shock, accesso venoso,
monitorare ritmo cardiaco e pressione, oltre che saturazione e glicemia.
Reidratazione con infusione salina per ripristinare la volemia. Infusione di glucosio. Il farmaco di
scelta è l’idrocortisone (sia attività mineralcorticoide che glucocorticoide). Eseguire se necessario,
un test di stimolo con ACTH. Secondo alcuni è meglio dare desametasone (solo glucorticoide) ed
eseguire subito il test con ACTH. Trattare eventuali condizioni precipitanti.
Feocromocitoma: neoformazione a partenza dalle cellule cromaffini che secernono catecolamine.
Più frequentemente origina dalla midollare del surrene, ma può svilupparsi anche dai neuroni
simpatici postgangliari o in altre sedi (10% dei casi è extrasurrenale). Nell’80% dei casi è unilaterale
(più a destra), nelle MEN è più spesso bilaterale.
Clinica: la sintomatologia è legata all eccessiva produzione soprattutto di adrenalina (ADR) e
noradrenalina (NA) che possono determinare l ́insorgenza di crisi ipertensive arteriose in genere
improvvise e imprevedibili o uno stato di ipertensione continua. Il feocromocitoma è in genere <10
cm, produce NA e ADR (e altro) o sol NA (extrasurrenali)
Clinica tipica: ipertensione arteriosa (70% parossistica e 30% stabile) a volte scatenata da traumi o
stress di vario genere. Si ha cefalea, pallore, tachicardia, vomito, flushing al viso, tremori, ansia.
Anche ipertermia e catabolismo aumentato.
Clinica atipica: può presentarsi con morte cardiaca improvvisa, intolleranza al glucosio,
insufficienza miocardica, disturbi vagali, stato settico, ipertiroidismo.
Complicanze: può causare angina, IMA, emorragia cerebrale, edema polmonare.
Diagnosi: una volta posto il sospetto clinico, la diagnosi va confermata con indagini di laboratorio
e strumentali (TC con mdc). Si può effettuare dosaggio delle catecolamine libere in urine o loro
cataboliti (metanefrine).
Terapia: in emergenza si deve trattare con antipertensivi, evitando i beta-bloccanti (tranne in caso
di sviluppo di tachiaritmie) In sede pre-ospedaliere nitroglicerina. In pronto soccorso usare
Labetalolo (alfa e beta-bloccante) o meglio farmaci solo alfa bloccanti (come Prazosina).
Terapia chirugica: asportazione non facile (alto rischio di crisi ipertensive anche fatali).
128
Equilibrio acido base
Nell’interpretazione dell’emogasanalisi è utile ricordare che se il disturbo è causato
dall’apparato respiratorio si osserverà un incremento o decremento primitivo della pCO2,
mentre il bicarbonato subirà una variazione compensatoria nello stesso senso della pCO2.
Allo stesso modo nei disturbi metabolici si osserverà un decremento o incremento
primitivo del bicarbonato, mentre la pCO2 subirà una variazione compensatoria nello
stesso senso.
Il GAP anionico ( (Na++ K+)-(Cl—HCO3)= 16mEq/L ) è particolarmente importante nella
d.d. tra le due forme.
* [N.B pCO2 arterioso =40; pCO2 venoso =46; HCO3 a=24; v=26]
• Acidosi metabolica: [pH diminuito, HCO3 diminuiti, pCO2 diminuita per compenso]
A.M. ad elevato gap anionico o normocloremica (da iperproduzione di acidi): Il
gap anionico è aumentato. I bicarbonati si consumano per tamponare l’eccesso di
acidi mentre il Cl rimane pressoché invariato. Possono essere indotte da un
eccessivo apporto di ioni H+ , o un’eccessiva produzione metabolica di H+ (acidosi
lattica, cheto acidosi diabetica) o insufficiente eliminazione (acidosi uremica).
• A.M. a normale Gap anionico (ipercloremiche): il Gap anionico è invariato perché
gli ioni cloro sono trattenuti in scambio con il bicarbonato, che viene invece perso. Il
Cl è pertanto aumentato mentre i bicarbonati sono ridotti. Può essere indotta da
un’eccessiva eliminazione di bicarbonati ( diarrea, inibitori dell’anidrasi carbonica,
diluizione o idratazione rapida), malattie tubulari renali (acidosi tubulari o
malattie interstiziali).
L’acidosi metabolica produce una diminuzione di HCO3 e pertanto un abbassamento del
pH. L’equilibrio è riportato attraverso il compenso respiratorio (la pCO2 decresce 1 mmHg
per ogni mEq/l di decremento di HCO3 , se non ci troviamo, implica che abbiamo anche un disordine
respiratorio).
Terapia: Volta alla malattia sottostante. La correzione deve essere proporzionale alla
rapidità con cui si è instaurata. La somministrazione di HCO3 induce l’ingresso di potassio
nella cellula con secondaria ipopotassemia. La somministrazione di HCO3 può indurre
iper natremia e sovraccarico di volume. In presenza di I respiratoria grave, la
somministrazione di HCO3 aumenta la CO2. Il trattamento con bicarbonato va riservato in
pazienti con pH <7,2.
Alcalosi metabolica: [pH aumentato, HCO3 aumentato, pCO2 aumentata per compenso]
Il disturbo primitivo è dovuto a un aumento di HCO3 plasmatici di origine esogena o a
una perdita di acidi con aumento relativo dei HCO3 Le cause sono distinte in base alla
responsività alla terapia con Cl in:
• Cloro responsive: da perdita massiva di ioni H+ per vomito o abuso di diuretici. Gli
H+ scendono, HCO3 aumenta. Nelle forme Cl responsive si somministra NaCl allo
0,9% che viene riassorbito come anione assieme al Na+ mentre i HCO3 vengono
eliminati con le urine.
• Cloro resistenti: da iperaldosteronismo, primitivo e secondario Cushing, abuso di
liquirizia, deplezione potassica grave, sd di Bartter. Il rene non funziona bene per
consentire lo scambio con il Cl. L’alcalosi va corretta con soluzioni di K+ (se gli dai
K+ il rene smette di cedere H+ e cede K+).
• Iatrogene: somministrazione di alkali, Milk alkali syndrome, abuso CCS . Se
interrompi, recede.
Terapia: in generale nei pazienti con edemi evitare la somministrazione di ClNa. In caso di
alcalosi grave somministrare acetazolamide (inibitore dell’anidrasi carbonica).
129
Acidosi respiratoria: Il disturbo primitivo è dovuto ad un aumento di pCO2 per difetti di
ventilazione. La correzione avviene lentamente in (5-7g) grazie al compenso renale. Le
cause sono generalmente: insufficienza respiratoria acuta (per laringospasmo,edema
glottide,asma bronchiale, ONX, corpo estraneo ecc) e insufficienza respiratoria cronica
(BPCO, fibrosi polmonare) encefalopatie, mieliti.
Terapia: consta nel miglioramento della ventilazione e rimozione della causa scatenante.
Va sempre preferita la NIV.
Alcalosi respiratoria: [pH aumentata, pCO2 diminuita, HCO3 diminuita per compenso]
Aumento della ventilazione polmonare. Le cause dell’alcalosi respiratoria acuta possono
essere la stimolazione anormale dei centri respiratori (ansia , malattie SNC come Ictus,
infezioni) ma anche ipossemia (embolia polmonare, scompenso cardiaco congestizio,
anemia, polmoniti).
Terapia: Volta a risolvere la causa. Bisogna spesso sedare il paziente con BDZ per os. Per
ridurre il circolo vizioso iperventilazione-alcalosi, far respirare il paziente in un sacchetto
(aumenta cos’ la CO2 nell’aria inspirata) Se si verifica grave ipertonia muscolare
somministrare Calcio gluconato 10%.
130