Corso di Chimica
Numeri quantici e tavola periodica MC
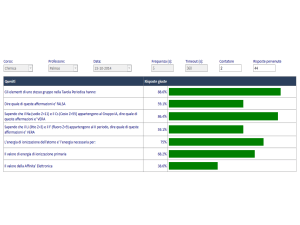
1. Sapendo che i numeri atomici di Cl (cloro), Ar (argon), e K (potassio) sono rispettivamente 17, 18 e 19, dire se i due ioni
Cl- e K+ e l'atomo di Ar hanno:
1.
le stesse dimensioni;
2.
lo stesso numero di elettroni
3.
lo stesso numero di protoni
4.
lo stesso numero di neutroni
2. Nel livello corrispondente a n=4 sono presenti complessivamente:
1.
4 orbitali
2.
9 orbitali
3.
12 orbitali
4.
16 orbitali
3. Secondo il principio di esclusione di Pauli un orbitale puo' contenere al massimo:
1.
un elettrone
2.
due elettroni con spin parallelo
3.
tre elettroni con spin opposto
4.
due elettroni con spin antiparallelo
4. Il principio di esclusione di Pauli dice che in un atomo non ci possono essere due elettroni caratterizzati:
1.
dalla stessa quaterna di numeri quantici
2.
dallo stesso valore del numero quantico principale
3.
dallo stesso valore del numero quantico magnetico
4.
dalla stessa terna di numeri quantici s, l ed m
5. Nel livello corrispondente a n=3 sono presenti complessivamente:
1.
4 orbitali
2.
18 elettroni
3.
12 elettroni
4.
6 orbitali
6. Per un atomo con la configurazione elettronica esterna 4s2 4p5, quale delle seguenti affermazioni e FALSA:
1.
si trova nel VII gruppo
2.
può formare un anione monovalente
3.
può formare un catione monovalente
4.
la sua configurazione elettronica esterna presenta 3 doppietti e un elettrone spaiato
risposta giusta
1/2
Corso di Chimica
Numeri quantici e tavola periodica MC
7. Sapendo che il Na (sodio Z=11) e il Cs (Cesio Z=55) appartengono al Gruppo IA, dire quale di queste affermazioni e' VERA
1.
Il Na appartiene ad un periodo caratterizzato da un valore di n maggiore di quello del Cs
2.
Avendo numero atomico maggiore, il Cs ha un numero di elettroni esterni maggiore rispetto a quello del Na
3.
Avendo numero atomico maggiore, il Cs ha un raggio atomico maggiore del Na
4.
Essendo dello stesso gruppo il numero di elettroni totali e' lo stesso
8. Sapendo che il Li (litio Z=3) e il F (fluoro Z=9) appartengono al II periodo, dire quale di queste affermazioni e' VERA
1.
Il Li appartiene ad un gruppo caratterizzato da un numero maggiore di elettroni esterni
2.
Avendo numero atomico maggiore, il F si trovera' a sinistra del Li nella Tavola periodica
3.
Entrambe gli atomi, se ionizzati, tenderanno alla configurazione del gas nobile Neon (Z=10)
4.
Essendo dello stesso periodo entrambi gli atomi hanno gli elettroni piu' esterni nel 2 livello
9. Dire quale di queste affermazioni e' FALSA
1.
la configurazione elettronica di un atomo e' deducibile dal suo numero atomico
2.
la configurazione elettronica di atomi dello stesso periodo e' la stessa
3.
la configurazione elettronica esterna di atomi dello stesso gruppo e' la stessa
4.
la configurazione elettronica esterna dei gas nobili ha sempre 8 elettroni
10. Gli elementi di uno stesso gruppo nella Tavola Periodica hanno:
1.
lo stesso numero atomico
2.
numero atomico che cresce di una unita' andando dall'alto verso il basso
3.
numero atomico che cresce di una unita' andando dal basso verso l'alto
4.
lo stesso numero di elettroni esterni
11. L'energia di ionizzazione dell'atomo e' l'energia necessaria per:
1.
portare un elettrone da un livello ad un altro
2.
togliere un neutrone dall'atomo allo stato gassoso
3.
tenere vincolato un elettrone al nucleo
4.
togliere un elettrone dall'atomo allo stato gassoso
12. Il valore di energia di ionizzazione primaria
1.
per gli elementi di uno stesso periodo aumenta all'aumentare del numero atomico.
2.
per gli elementi di uno stesso gruppo aumenta all'aumentare del numero atomico.
3.
è molto bassa per gli elementi del VII gruppo
4.
e' molto alto per gli elementi del I Gruppo, perche' questi hanno carattere metallico
risposta giusta
2/2