Per conoscere lo stato di un sistema dobbiamo tener conto di 3 grandezze: la
pressione (P), il volume (V), la temperatura (T). La pressione è il rapporto tra
forza F esercitata e area S sulla quale viene esercitata tale forza (F/S) e la sua
unità di misura è il pascal.
Le trasformazioni termodinamiche possono essere:
• A pressione costante (V/T = k): isobara
• A volume costante (P/T = k): isocora
• A temperatura costante (PV = k): isoterma
Mettendo in relazione queste 3 espressioni siamo giunti a:
PV/T = k.
Nel caso di un gas perfetto l’equazione che coinvolge le 3 grandezze (P, V, T) è:
P V = n R T, in cui n è il numero di moli ed R la costante universale dei gas.
Se durante la trasformazione il sistema non scambia calore con l’esterno si
parlerà di trasformazione adiabatica (Q = 0).
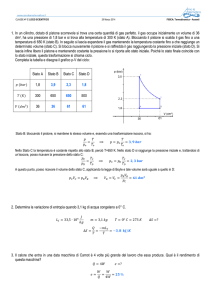
Per rappresentare le trasformazioni termodinamiche utiliazziamo il piano
di Clapeyron.
Nell’immagine abbiamo rispettivamente: un’isoterma, un’isobara e
un’isocora.
In questa equazione compare U che
rappresenta l’energia interna del sistema.
Per energia interna del sistema si intende
la somma delle energie cinetica e
potenziale associate alle particelle di cui
detto sistema è costituito.
ΔU = Uf – Ui è la variazione dell’energia
interna del sistema, Q è il calore assorbito
e L è il lavoro compiuto dal sistema. Il
calore è positivo quando viene assorbito
dal sistema e negativo quando viene
ceduto. Il lavoro è positivo quando viene
compiuto dal sistema (quando comporta
un’espansione del gas) e negativo quando
viene compiuto sul sistema (quando
viene compresso).
L’energia interna è una funzione di stato in quanto la sua
variazione ΔU per il passaggio del sistema dallo stato iniziale (1)
allo stato finale (2) è sempre la stessa indipendentemente da come
il sistema sia passato dallo stato iniziale a quello finale. Durante
una trasformazione, infatti, la variazione di una funzione di stato
dipende solo dallo stato iniziale e finale del sistema e non dal
percorso.
Per una trasformazione ciclica, la variazione di energia interna è
uguale a zero in quanto lo stato iniziale coincide con quello finale.
Prendendo in considerazione l’equazione Q-L = ΔU, possiamo
formulare il primo principio della termodinamica detto anche
principio di conservazione dell’energia: L’energia totale di un
sistema e dell’ambiente esterno si conserva anche se essa può
essere convertita da una forma all’altra di energia. In altre parole
l’energia non può essere né creata né distrutta.
L’energia interna di un gas dipende solamente dalla
temperatura. Possiamo infatti variare l’energia interna
di un gas (e quindi la sua temperatura) riscaldando il
sistema o comprimendolo.
L’energia interna di un corpo non è mai 0, poiché un gas,
essendo costituito da molecole in movimento, non può
mai avere volume e pressione uguali a 0.
Se l’energia interna è legata alla temperatura, la
temperatura è a sua volta legata all’energia cinetica
media delle molecole.
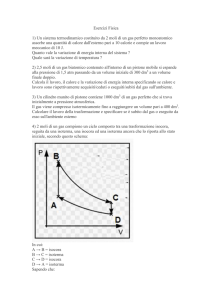
Prendiamo un recipiente con al suo
interno un gas. Un pistone consentirà di
regolare la pressione P esercitata dal gas
sulle pareti. Se fornisco calore con il
fornellino aumenterà la temperatura, se
abbasso il pistone aumenterà la pressione
e se alzo il pistone aumenterà il volume.
Riscaldamento a volume costante: in
questo caso il pistone viene tenuto fermo
in modo che non aumenti il volume
mentre viene fornito calore. Il lavoro L è
uguale a 0, pertanto, considerando il
primo principio (Q – L = ΔU) avremo
che ΔU = Q. Mettendolo in relazione con
l’equazione Q = c m ΔT, avremo:
ΔU = Q = c m ΔT. In questo caso c
diventerà cv, cioè calore specifico a volume
costante ed m diventerà n, cioè il numero
di moli, quindi:
ΔU = Q = cv n ΔT. Nei gas
monoatomici cv è 3/2 R, per i gas
biatomici è 5/2 R.