Primo principio della termodinamica
Gas ideale/perfetto: definizione
Gas: insieme di particelle privo di forma e volume
proprio. Si dice perfetto o ideale se i suoi parametri
termodinamici P,V,T sono legati tra loro
dall'equazione di stato:
PV =n R T
n
numero di moli
R
8, 314 J
K mole
Costante universale dei gas
Date due variabili (P,V,T) che definiscono lo stato del
sistema, la terza può essere calcolata tramite
l'equazione di stato.
P
P0 , V 0
T
P V
0
0
0
nR
Stato del sistema
Piano
di Clapeyron
P9 Primo Principio
V
1
Condizioni fisiche perché un gas possa essere
considerato ideale:
Le molecole possono essere considerate
puntiformi (bassa densità).
Interagiscono tra loro e con le pareti del
recipiente con urti perfettamente elastici
(nessuna dispersione di energia cinetica).
Le forze di interazione molecolare a distanza
sono trascurabili (bassa densità, alta
temperatura e quindi agitazione termica)
Le molecole del gas sono identiche tra loro
P9 Primo Principio
2
Derivazione equazione dei gas perfetti da
leggi sperimentali di Boyle & Gay-Lussac
Legge di Boyle:
PV =const
A temperatura constante
Legge di GayLussac:
V T =V 0 (1+α T )
PT =P0 (1+βT )
e costanti e T misurata in gradi Celsius.
Per un gas ideale:
1
−1
α=β=
C
273.15
1
V T =V 0 (1+α T )=V 0 α ( α +T )
1
P T = P0 (1+β T )=P 0 α( α +T )
P9 Primo Principio
3
Se
T =273.15+T C
V T =V 0 α T
PT =P0 α T
allora
con T misurato in gradi Kelvin
Alcune definizioni:
Una mole contiene un numero di atomi (o
molecole) pare a NA = 6.02 x 1023 (numero
di Avogadro)
Il peso molare M è pari al peso di una
mole del gas
Data una massa Mgas di un gas, il numero di
moli è
M gas
m=
ma N A
dove ma è la massa dell'atomo (o molecola) di
cui è costituito il gas.
Volume molare: volume occupato da una
mole di gas
P9 Primo Principio
4
Condizioni standard
P0 =101325 Pa
o
T 0 =273.15 K =0 C
3
V m =0.022414 m =22.424 l(volume molare)
Date n moli a P0 e T0, V0 = n Vm, se si aumenta T
PT =P0 α T
V 0 PT =P0 V 0 α T = P0 V T
Ma per legge di Boyle, trattandosi sempre dello
stesso sistema:
V 0 PT =P0 V T =P V
Con P e V coordinate dello
stato di equilibrio alla
temperatura T
PV =P 0 V 0 α T =n (P0 V m α)T =n R T
P9 Primo Principio
5
Barotrauma:
Scendendo in profondità la P aumenta. Il
respiratore fornisce quindi aria ad una
pressione pari a quella esterna. Se si risale
troppo velocemente senza respirare, i polmoni
si gonfiano perchè la pressione interna è
maggiore di quella esterna.
PV =const
P9 Primo Principio
6
Teoria cinetica dei gas
Il gas è un insieme di molecole in movimento che
urtano tra loro e con le pareti che le confinano.
La pressione P è l'effetto macroscopico
degli urti molecolari contro le pareti.
P9 Primo Principio
7
Recipiente cubico
di lato L
(vista laterale)
v
v
L
Momento trasferito (1D)
Δ p= pf − p i=−mv−(−mv)=−2 mv
2L
Tempo tra 2 collisioni
Δt=
v
Modulo della forza esercitata da una
singola molecola su una parete
v mv
F=2m v =
2L L
2
P9 Primo Principio
8
Numero totale di molecole
1
mv
FT = n N A
3
L
1 2
⟨v ⟩= ⟨v ⟩
3
2
x
3 possibili direzioni nello spazio:
n NA
NA numero di Avogadro
2
Pressione sulla parete:
2
2
FT 1
mv 1
mv 2 n N A
P= 2 = n N A 3 = n N A
=
EK
V 3 V
L 3
L 3
1 2
EK = m v
2
energia cinetica della singola molecola
2 nN A
T
P=
E K =n R
3 V
V
3 R
3
EK =
T= k T
2 NA
2
k
R
NA
8, 314
6,02 10
J K
23
­1
K costante di Boltzmann
mole
­1
P9 Primo Principio 1, 38
mole
­1
10
23
J/K
9
Energia interna di un gas= somma
dell'energia cinetica di tutte le molecole.
Funzione SOLO della temperatura
L'energia interna può variare solo grazie
a scambi di energia (calore o lavoro)
dQ
0
dQ
0
dL
0
Sistema
dL
0
Lavoro ottenuto
dal sistema
Lavoro
fatto
P9 Primo Principio
sul sistema
10
Espressione generale del lavoro
Per una espansione infinitesima
P
A
Vf
V
dx
A
i
gas
dL
Fdx
P Adx
V
f
V
P V f Vi
PdV
i
Per una espansione finita
V
f
L
P V dV
V
i
P9 Primo Principio
11
Conferma sperimentale che l'energia interna
dipende solo dalla Temperatura: esperimento
dell'espansione libera.
Durante l'espansione sia P che V
cambiano ma l'energia interna U resta
costante (nessun lavoro fatto dalle forze
di pressione perche' il V non cambia,
nessuno scambio di calore perché le
pareti sono adiabatiche). Quindi, U può
dipendere solo da T
P9 Primo Principio
12
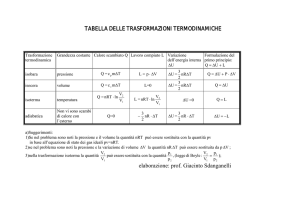
Trasformazioni termodinamiche
1) ISOBARA: a pressione costante
P
P0
P0 , V i
P0 , V f
Vi
Vf
V
L=P 0 (V f −V i)=P0 ΔV
Calore può essere scambiato e si ha:
dQ=nc P dT
Dove cP è il calore specifico a pressione
costante
P9 Primo Principio
13
2) ISOCORA: a volume costante
P
Pi
Pi , V 0
Pf
P f ,V0
V0
V
L=P Δ V =0
ΔU =Δ Q=nc V dT
Valida perché dU dipende solo da dT.
cV calore specifico a volume costante.
P9 Primo Principio
14
Relazione di Mayer tra calori specifici
In una trasformazione isobara:
dU =nc V dT =dQ−dL=nc P dT−P dV
Dall'equazione di stato dei gas si ha
P dV =n R dT
Perché P costante da cui
dU =nc V dT =nc P dT−n R d T
c P−c V =R
3
cV = R J /mole K
2
5
c P= R J /mole K
2
Per gas monoatomico.
P9 Primo Principio
15
3) ISOTERMA: a temperatura costante
Per un gas perfetto dall’ equazione di stato
PV
nRT
0
cos t .
Legge di Boyle
P
Isoterma a T0 = cost.
V
V
V
f
f
L = ∫ PdV = nRT 0 ∫
Vi
Vi
nRT 0 ln
Î ”
U
Vf
Vi
U T0
dV
= nRT 0 ( ln V f −ln V i )
V
Q
perché
U T0
Q
P9 Primo Principio
L
0
16
4) ADIABATICA: senza scambio di calore
dU =−dL
L'energia interna varia a causa del lavoro e
quindi T cambia.
Condizione adiabatica
PV =n R T ⇒ P dV +V dp=n R dT
Q=0 ⇒ dU =−P dV lavoro fatto sul sistema
1 dU
1 dV
P
=− P
⇒ − dV =n dT
n dT
n dT
cV
Si ricorda che
cV 0
1 dU
n dT
P9 Primo Principio
17
P dV +V dp=n R dT ⇒
P dV +V dp
=n dT
R
R=c P −cV
Ma
P dV +V dp
−P
=n dT =
dV
c P −cV
cV
n R dT ⇒
c V dV +V dP c v =−P dV c P + P dV c V
Dividendo ambo i membri per PV
V dP c v
P dV c P
=−
PV
PV
si ottiene alla fine
cP
γ=
cV
definendo
dP dV c P
+
=0
P V cV
γ
log P+ γ log V =const ⇒ log(P V )=const
Vf
Vf
i
i
1− γ
1− γ
(V
−V
)
1
i
L=∫ P dV =K ∫ γ =K f
1−γ
V
V V
dove K =PV γ
P9 Primo Principio
18
Secondo principio della termodinamica
Clausius: E' impossibile realizzare una
trasformazione il cui UNICO risultato è il
traferimento di calore da un corpo più freddo a
uno più caldo (senza lavoro esterno)
Kelvin-Plank: E' impossibile realizzare
una trasformazione il cui UNICO risultato è
la trasformazione di tutto il calore assorbito
da una sorgente omogenea in lavoro.
SONO EQUIVALENTI
P9 Primo Principio
19
Supponiamo sia FALSA la formulazione di Clausis
e realizziamo una macchina termica che scambia
calore Q estraendolo da una sorgente fredda Tf e
cedendolo ad una sorgente calda Tc,
Q'
Possimao ora
aggiungere una
seconda macchina che
assorbe dalla sorgente
calda il calore Q' e
cede il calore Q a
quella più fredda. Il
risultato finale è la
produzione di un
lavoro L = Q' – Q con
calore estratto SOLO
dalla sorgente Tc. Ma
Q
questo nega la
formulazione di
Kelvin-Planck!
Tc
Q
Tf
Tc
L
Q
Tf
P9 Primo Principio
20
Ciclo di Carnot
Il sistema torna nella condizione iniziale quindi
dU = 0 e
d U=dQ−dL=0
Q è il calore assorbito quindi Q = Q1 - Q2
P9 Primo Principio
21
Il rendimento è definito come
L
η=
Q
L= Lavoro compiuto Q=Calore assorbito
Q1−Q 2 T 1−T 2
η=
=
Q1
T1
La funzione di stato ENTROPIA è definita
come:
Q
Δ S=
T
dQ
Δ S=∫
T
In una trasformazione
isoterma
In una
trasformazione
P9 Primo
Principio
generica
22
Ciclo di Carnot nel piano T,S
P9 Primo Principio
23
Un recipiente con volume fissato e con pareti adiabatiche è diviso
in due parti da un setto NON adiabatico. Inizialmente, una parte
contiene m1 = 10 kg di acqua a temperatura T1 = 20o C, l'altra
contiene invece m2 = 2.5 kg di acqua a T2 = 80o C. Calcolare la
temperatura finale del sistema una volta raggiunto l'equilibrio.
Il volume non cambia, quindi non viene fatto lavoro. Allora, per il
primo principio
Q1=Δ U 1=−Q 2=−Δ U 2
Q=m c Δ T
m1 c(T f −T 1)=−m2 c(T f −T 2)
m1 T 1+m2 T 2
Tf=
=32 o
m1 +m2
P9 Primo Principio
24
Un cilindro con un pistone mobile esegue un'espansione durante
la quale scambia 40 kJ di lavoro con l'ambiente. Sapendo che la
variazione di U è 660 KJ, calcolare il calore scambiato dal
sistema.
Il lavoro è POSITIVO perché FATTO dal sistema.
Δ U =Q−L=Q−40=660 kJ
Q=700 Kj
P9 Primo Principio
25
Un contenitore termicamente isolato contiene inizialmente 130 g
di acqua a T = 80o C e un cubetto di ghiaccio di massa m = 13 g a
temperatura T = -10o C. Si calcoli la temperatura finale
all'equilibrio (Ca = 4.186 kJ/(kg K), cg = 2.220 kJ/(kg K), calore
latente di fusione hl = 333 kJ/kg).
Il calore assorbito dal ghiaccio per sciogliersi viene assorbito
dall'acqua. Questo calore viene assorbito in 3 stadi: 1) Qg1 =
calore assorbito per arrivare a T=0o C 2) Qg2 = calore assorbito
per fondere il ghiaccio, 3) Qg3 = calore per riscaldare l'acqua fusa
prodotta a T=0o.
Per il ghiaccio
Qg 1=m g c g (T 0 −T g )=0.012∗2.220∗(0−(−10))=0.0266 kJ
Q g2 =mg∗h l=333∗0.012=3.996 kJ
Q g3=mg c a (T f −T 0)
Per l'acqua inizialmente presente
Qa =ma c a (T f −T 1 )
Qa =Q g1+Qg2 +Q g3
ma c a T 1 −Qg 1 −Qg 2
o
Tf=
=66
P9 Primo Principio
(mg+ma )c a
26
3 moli di gas perfetto alla temperatura iniziale TA = 400 K e alla
pressione PA = 2.5 Atm sono espanse in modo isotermo dallo stato
A allo stato finale B in cui il volume del gas è doppio (V B = 2VA).
Il gas viene successivamente compresso isobaricamente fino a
tornare al volume iniziale VA. Calcolare il valore delle variabili
termodinamiche nello stato finale.
nR T A
T A=400 K P A =2.5 Atm V A =
PA
Isoterma:
1
V B =2V A T B =T A P B = P A =1.25 Atm
2
Isobara:
PC V C
V C =V A P C=P B =1.25 Atm T C =
=200 K
nR
A
P
C
B
P9 Primo Principio
V
27