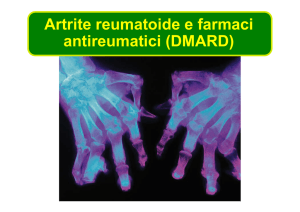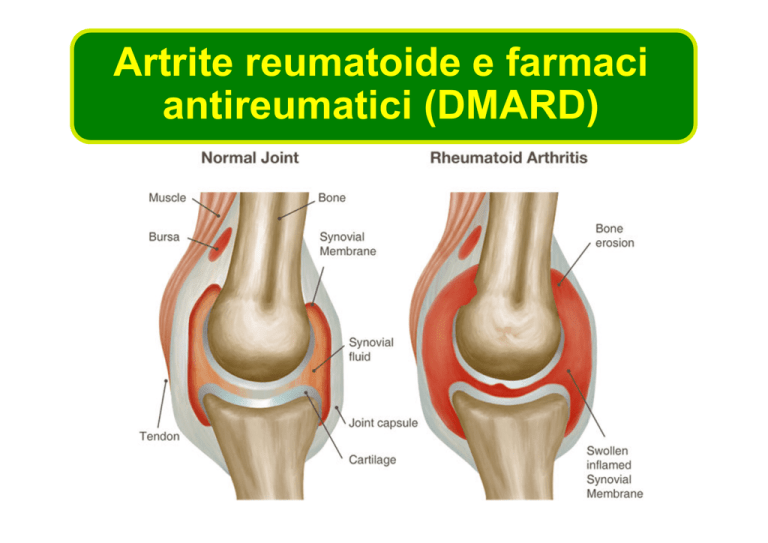
Artrite reumatoide e farmaci
antireumatici (DMARD)
Famous people with RA
• Dorothy Hodgkin: Nobel prize winning scientist,
developed severe RA at age 28. Developed X-ray
crystallography, discovered the structure of insulin,
penicillin, vitamin B12 .
• Christiaan Barnard: performed first heart
transplant in 1967; He retired after developing RA.
Wrote a book on arthritis (“Arthritis Handbook:
How to Live With Arthritis”)
• Pierre-Auguste Renior: French, impressionist
Pierre-Auguste Renior
(1841-1919)
Pierre-Auguste Renior
(1841-1919)
Artrite reumatoide
Condizione cronica infiammatoria che colpisce alcuni individui
geneticamente predisposti
Processi autoimmuni contribuiscono al mantenimento
dell’AR, ma non e’ del tutto chiaro se patologia origina
da processo autoimmune o da un antigene esogeno
Sintomi graduali, molto spesso colpite articolazioni
interfalangee prossimali delle dita, quelle metacarpofalangee e
i polsi – anca e caviglia coinvolte successivamente
Articolazioni colpite sono calde, tumefatte e dolenti
Rigidita’ da aumento del liquido extracellulare intorno e all’interno dell’articolazione
Comuni manifestazioni sistemiche: malessere, affaticamento generale
Manifestazioni extra-articolari (neuropatia e vasculite) meno comuni
Black= joints most commonly affected
Grey= joints often affected
White= joints usually not affected
RA is Not a Benign Disease
In Europe and the USA about one percent of the population suffers from
this autoimmune disease; women are three times more commonly affected
than men and often develop their first symptoms while still middle-aged
We can be certain that the disease process had already been present for
many months, or perhaps even years before symptoms appear. People
have looked at blood samples from blood donors for anticitrulline
antibodies, which are typical of RA, and there are many people who have
these antibodies ten years before diagnosis
Once the first symptoms appear, the disease often progresses rapidly: the
inflammation of the joints fails to subside, but in stead becomes selfperpetuating and spreads to other organs
Without proper treatment rheumatoid arthritis is very progressive. There is
a severe shortening of life expectancy of anything up to 15 years
RA is Not a Benign Disease
If not controlled, RA inflammation leads to:
• joint damage and joint deformities
• progressive loss of physical function
• work disability (32-50% after 10 years of RA)
• premature mortality, mainly from cardiovascular disease (50% increase
in risk of death from CVD)
Artrite reumatoide
Fase iniziale
Importante attivazione TLR su cellule dendridiche e macrofagi,
stimolazione che inizia una risposta del sistema dell’immunita’ innata
Risposta primaria caratterizzata da infiltrazione di cellule linfoidi nella
sinovia periarticolare, neoangiogenesi e proliferazione delle membrane
sinoviali
La sinovia diventa invasiva (panno) e gli osteoclasti distruggono cartilagine
articolare e tessuto osseo
Artrite reumatoide
Fase cronica
Il processo infiammatorio cronico e’ avviato da linfociti T-helper 1 (Th1),
che migrano nell’articolazione infiammata (sfuggono alla soppressione da
parte delle cellule regolatorie)
I linfociti T attivati producono varie citochine pro-infiammatorie (es.
TNFalpha, IL-1) – stimolazione dei linfociti B, macrofagi, fibroblasti,
condrociti e osteoclasti
Artrite reumatoide
Fase cronica
Il processo infiammatorio cronico e’ avviato da linfociti T-helper 1 (Th1),
che migrano nell’articolazione infiammata (sfuggono alla soppressione da
parte delle cellule regolatorie)
I linfociti T attivati producono varie citochine pro-infiammatorie (es.
TNFalpha, IL-1) – stimolazione dei linfociti B, macrofagi, fibroblasti,
condrociti e osteoclasti
Ruolo predominante nel coordinare la produzione di altri mediatori
infiammatori e nel reclutare altre cellule del sistema immunitario/
infiammatorio nell’articolazione (con IL-1 promuove espressione di
molecole di adesione su cellule endoteliali vascolari)
Con la IL-1, pruomuove rilascio cellulare (fibroblasti sinoviali, osteoclasti e
condrociti) di metalloproteasi che distruggono tessuti
Artrite reumatoide
Fase cronica
Il processo infiammatorio cronico e’ avviato da linfociti T-helper 1 (Th1),
che migrano nell’articolazione infiammata (sfuggono alla soppressione da
parte delle cellule regolatorie)
I linfociti T attivati producono varie citochine pro-infiammatorie (es.
TNFalpha, IL-1) – stimolazione dei linfociti B, macrofagi, fibroblasti,
condrociti e osteoclasti
Co-stimolano le cellule T
Producono citochine infiammatorie (TNFalpha)
Producono Ab anti-fattore reumatoide (FR, IgM autoaunticorpo che si lega
con le IgG; presente in molti soggetti con AR)
Forma complessi con il collagene, attivando il complemento
Pathophysiology of RA
Normal Joint
Capsule
Synovial
membrane
Synoviocytes Cartilage
Established RA
Early RA
Angiogenesis Neutrophils
T cells
B cells
Synoviocyte Dendritic cell
accumulation
(enlarged synovium)
Plasma
cell
Neutrophils
Bone
erosion Pannus
Adapted with permission from Choy and Panayi. N Engl J Med. 2001;344:907. Copyright © 2001 Massachusetts
Medical Society. All rights reserved.
The Immune Cascade in RA
RF
Autoantibodies
B
Self-antigens
Activates
T
T
PC
T
T
T
FLS
Inflammation
Joint damage
FLS
APC/DC
T
FLS= Fibroblast-like synoviocyte
PC= Plasma Cell
Activates
MΦ
Cytokines
MMPs
Prostaglandins
Nitric oxide
MΦ
T-Cell Activation
DC
DC
DC
MHC class II
Antigen
CD80/86
CTLA4
TCR
CD28
T
T
T
Activated
T cell
Downregulated
T cells
TNF And Joint Damage
IFNγ
IL-12
IL-18
TNFα
MΦ
PGE, MMP
Nitric oxide
IL-6
IL-8
Other cytokines
Growth factors
TNF
IL-1
C
FLS
C
OC
MMP, PGE
Cartilage Destruction
MMP, PGE
Decrease repair
Bone Destruction
Choy and Panayi. N Engl J Med. 2001;344:907.
Silverman and Carson. Arthritis Res Ther. 2003;5(suppl 4):S1.
Cartilage Destruction
TNF And Joint Damage
TNFalpha and Il-1 also stimulate Integrin
expression on vascular endothelial cells
B
IL-6, TNFα
T
APC
TNFα
α
MΦ
TNFα
α, IL-1, IL-6
OC
Articular
cartilage
1.
2.
3.
FLS
C
Production of metalloproteinases and other effector molecules
Migration of polymorphonuclear cells
Erosion of bone and cartilage
EARLY Treatment of RA with
DMARDs
E EARLY DIAGNOSIS AND TREATMENT OF RA
A AGGRESSIVE USE OF DMARDS ALTERS THE COURSE OF RA
R REMISSION IS THE NEW TARGET OF RA TREATMENT
L LONG TERM USE OF DMARDS
Y YES, DMARDS ARE SAFE WHEN MONITORED REGULARLY
Treatment of RA
the standard of care has changed
DMARDs
NSAIDS
Go low, go slow
Inverting the pyramid
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
AR: farmacoterapia
FANS
Possono modificare la sintomatologia, ma non la distruzione
progressiva cronica delle articolazioni
La scelta del FANS e’ arbitraria, con una notevole variabilita’ nella risposta
individuale alle differenti molecole
COXIB di norma prescritti a pazienti intolleranti a FANS non selettivi
AR: farmacoterapia
DMARD
Possono ridurre la velocita’ di prog. dell’erosione e distruzione
articolare, determinando anche un miglioramento sia dei
sintomi che dei marker clinici e sierologici della patologia
Uso precoce di DMARD determina miglioramenti nel lungo periodo
Spesso utilizzati con FANS per le prime settimane di trattamento, dato che:
•Hanno pochi effetti antinfiamnatori diretti (anche se producono una
riduzione cronica della risposta infiammatoria)
•Possono richiedere anche 2-3 mesi prima che efficacia sia evidente
MTX e’ uno dei DMARD piu’ utilizzato (in caso di intolleranza, leflunomide)
Terapia d’associazione sempre + applicata (generalm. piu’ efficace). Es.:
Se singolo DMARD non controlla patologia, dove non e’ stato provato il
MTX, si deve introdurlo
Consigliati altri DMARD se dopo 3 mesi di trattamento MTX non raggiunti
risultati attesi
AR: farmacoterapia
DMARD
Possono ridurre la velocita’ di prog. dell’erosione e distruzione
articolare, determinando anche un miglioramento sia dei
sintomi che dei marker clinici e sierologici della patologia
Ruolo di corticosteroidi nell’AR e’ controverso
Iniezioni intra-articolari per infiammazione di singole articolazioni (es.
ginocchia e spalle)
Nelle fasi attive della patologia, registrati miglioramenti con brevi cicli di
prednisolone orale o s.e. intermittenti di alte dosi di metilprednisolone prima
della piena efficacia DMARD
Farmaci anti-TNFα (i piu’ utilizzati tra i “biologici”) in genere riservati a
pazienti che non rispondono o che mostrano intolleranza ad alcuni
DMARD; spesso usati in associazione con MTX
ACR score
A number indicating how much a person’s rheumatoid arthritis (RA) has improved,
based on guidelines set forth by the American College of Rheumatology (ACR).
The ACR score represents a percentage. An ACR20 score means that a person’s
RA has improved by 20%, an ACR50 score means it has improved by 50%, and
an ACR70 score means it has improved by 70%.
To qualify for an ACR20 score, a person with RA must have at least 20% fewer
tender joints and at least 20% fewer swollen joints. As well, he or she must show
a 20% improvement in at least three of the following five areas:
the person’s overall (global) assessment of his or her own RA
the physician’s global assessment of the person’s RA
the person’s assessment of his or her own pain
the person’s assessment of his or her own physical functioning
the results of an erythrocyte sedimentation rate or C-reactive protein blood test
(both of which test for inflammation).
ACR50 and ACR70 scores use the same criteria but require 50% and 70%
improvement, respectively
Efficacy results from the phase 3 Trial of Etanercept and Methotrexate with
Radiographic Patient Outcomes (TEMPO) in active RA (adapted from Klareskog et al.
(The Lancet, 2004;363:675-681)
Efficacy results from the phase 3 Anti-TNF Therapy in RA with Concomitant
Therapy (ATTRACT) trial of infliximab plus methotrexate (MTX) in active RA
Efficacy results from a randomized, placebo-controlled phase 3 trial of
adalimumab plus MTX in active RA (Adapted from Keystone et al )
AR: farmacoterapia
DMARD
Possono ridurre la velocita’ di prog. dell’erosione e distruzione
articolare, determinando anche un miglioramento sia dei
sintomi che dei marker clinici e sierologici della patologia
Ruolo di corticosteroidi nell’AR e’ controverso
Iniezioni intra-articolari per infiammazione di singole articolazioni (es.
ginocchia e spalle)
Nelle fasi attive della patologia, registrati miglioramenti con brevi cicli di
prednisolone orale o s.e. intermittenti di alte dosi di metilprednisolone prima
della piena efficacia DMARD
Farmaci anti-TNFα (i piu’ utilizzati tra i “biologici”) in genere riservati a
pazienti che non rispondono o che mostrano intolleranza ad alcuni
DMARD; spesso usati in associazione con MTX
Anakinra meno efficace di anti-TNFα, mentre abatacept e rituximab sono
efficaci in pazienti che non rispondono o tollerano anti-TNFα
DMARD are safe
when monitored regularly
Benefits of early DMARDs outweigh their risks
AR: farmacoterapia
it would be all too easy to conclude that all patients should be treated with
methotrexate plus a biologic as first-line therapy ; however, it should be recognized
that the superiority in different trials for the combination was demonstrated at the
group level only
in addition, each of these trials also documented the good efficacy of methotrexate as
monotherapy in some patients (which did achieve disease remission, nonprogression of radiographic changes, and functional stability). Thus, a sizeable
subset of patients (range 15–40% in these studies) would be over-treated if they were
given combination therapy from the start.
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
AR: farmacoterapia
In actual practice, 40% of patients with established RA achieve low disease activity,
but only 24% achieve remission. It would seem somewhat foolhardy to pursue a
treatment objective that is not realistic for more than three-quarters of patients
If one were to adjust therapy every 3 months because of not having achieved
remission, it would take only 2 years to exhaust all biologic options; seen against the
average disease course of 25 years, that is a serious limitation
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
AR: farmacoterapia
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
Available DMARDs
•
•
•
•
•
•
Methotrexate
Sulfasalazine
Hydroxychloroquine
Leflunomide
Gold
Others
–
–
–
Cyclosporine
Azathioprine
Cyclophosphamide
Biologics
• Specially designed to treat inflammatory
types of arthritis such as rheumatoid and
psoriatic arthritis.
• Work by different mechanisms.
• Like DMARDs, biologics are used to
suppress inflammation and help prevent
damage to the joint.
Current Available Biologics
Tumor Necrosis InhibitorsAdalimumab - anti-TNF mab
Certolizumab pegol - anti-TNF Fab’
Etanercept - soluble TNF receptor
Golimumab - anti-TNF mab
Infliximab - anti-TNF mab
T cell inhibitor- Abatacept
IL-1 Inhibitors- Anakinra
anti-B cell antibody- Rituximab
anti-IL-6 antibody- Tocilizumab
Sulfasalazina
Usata per AR prec. e lieve, con idrossiclorochina e MTX; 1-3 mesi x eff. ter.
Parzialmente assorbita immodificata attraverso mucosa intestinale, mentre
la maggior parte raggiunge il colon dove e’ ridotta e trasformata in 5-ASA e
sulfapiridina
Sulfapiridina e ≈ 20 % di 5-ASA sono assorbiti dal colon (ma simili
concentrazioni nel l. sinoviale); metab. epatico; t½ plasmatica di circa 5-10 h
Sulfasalazina
Usata per AR prec. e lieve, con idrossiclorochina e MTX; 1-3 mesi x eff. ter.
Parzialmente assorbita immodificata attraverso mucosa intestinale, mentre
la maggior parte raggiunge il colon dove e’ ridotta e trasformata in 5-ASA e
sulfapiridina
Azioni
Puo’ inibire vie coinvolte nella sintesi di citochine proinfiammatorie mediate da NF-kB
Sulfapiridina sembra agire riducendo assorbimento di antigeni
in grado di promuovere infiammazione articolare
Effetti collaterali
•
•
•
•
•
Nausea, vomito, diarrea, dolore addominale
Anoressia
Discrasie ematiche (spec. agranulocitosi
trombocitopenia)
Rash
Oligospermia
Per AR necessari dos. elevati – dist. intestinali (si possono minimizzare
aum. gradualmente dosaggio e usando preparazioni gastroresistenti)
e
Antimalarici
Clorochina, idrossiclorochina (per AR prec. e lieve, con MTX)
L’azione di questi farmaci e’ legata alla riduzione della trasformazione e
della chemiotassi dei linfociti T
La loro natura leggermente basica ne permette l’ingresso e l’accumulo
all’interno dei lisosomi
Nei macrofagi, la processazione lisosomiale di proteine fagocitate dipende
da proteasi acide
Questi farmaci, aumentando il pH luminale lisosomiale, alterano la
processazione di antigeni peptidici, riducendo cosi’ la loro successiva
presentazione sulla membrana cellulare – ridotta interazione (e attivazione)
tra macrofagi e linfociti T
Questi farmaci possono ridurre la produzione di citochine infiammatorie,
hanno potere antiossidante e possono inibire PLA2
Antimalarici
Clorochina, idrossiclorochina (per AR prec. e lieve, con MTX)
L’azione di questi farmaci e’ legata alla riduzione della trasformazione e
della chemiotassi dei linfociti T
Farmacocinetica
Clorochina assorbita completamente per os
Ha un Vd elevato (si concentra nei tessuti che
contengono melanina – es. retina – e nella milza,
fegato, rene)
Metabolismo epatico (50% in metaboliti attivi) ed
eliminazione renale (50% immodificato)
Emivita lunga, tende a crescere nel trattamento
cronico (iniziale 6 giorni, seguita da lenta fase di
eliminazione dai tessuti con emivita > di 1 mese)
Antimalarici
Clorochina, idrossiclorochina (per AR prec. e lieve, con MTX)
L’azione di questi farmaci e’ legata alla riduzione della trasformazione e
della chemiotassi dei linfociti T
Effetti collaterali
Nausea, vomito, diarrea, dolore addominale
(possono essere causati da un’attivita’ anti-AChE
della clorochina)
Retinopatia (pigmentazione e difetti del campo
visivo; meno frequente con idroclorochina) – e.
collaterale piu’ significativo; controllare vista
periodicamente,
soprattutto
se
trattamento
continua per > 5 anni
Leflunomide
Inibisce la sintesi de novo di UMP – i linfociti attivati
richiedono una quantita’ di pirimidine 8 volte
maggiore per la proliferazione
Apporto inadeguato di UMP aumenta espressione di
p53 (oncosoppressore) che trasloca nel nucleo e
provoca arresto in fase G1
Cio’ diminuisce l’espansione clonale di linfociti
autoimmuni T e B attivati e determina la
soppressione di produzione di Ab e dei processi
immuni cellulo-mediati
Descritte
anche
una
inibizione delle TK e una
ridotta
produzione
di
citochine pro-infiammatorie
– importanza minore
Leflunomide
Farmacocinetic
a
Profarmaco, ben assorbito per os
Legame all’albumina >90%
Convertito
non-enzimaticamente
(mucosa
intestinale e plasma) nel suo metabolita attivo
(lunga emivita di 14-18 gg)
Escrezione renale e biliare (ricircolo enteroepatico)
Nota: sono necessarie dosi di carico a causa della
sua lunga emivita
Utilizzata da sola o in associazione
Leflunomide
Effetti indesiderati
Disturbi GI, specialmente diarrea e nausea Durante trattamento controllare
regolarmente
funzionalita’
Aumento pressione arteriosa
epatica e numero di cellule
Cefalea, vertigini, letargia
ematiche (soprattutto leucociti)
Rash cutanei
Leucopenia
Alopecia
Se effetti collaterali seri, l’eliminazione del farmaco puo’
essere favorita da colestiramina (lega metabolita attivo e
ne contrasta riassorbimento per circolo enteroepatico)
Alterazioni reversibili funzionalita’ epatica
Teratogeno: si raccomanda alla donna di evitare
concepimento
per
i
2
anni
successivi
all’interruzione del farmaco (all’uomo per 3 mesi)
MTX
O
OH
O
COOH
N
H
NH2
COOH
N
N
H2N
N
N
Acido folico folato
N
N
N
H
H2 N
N
N
COOH
N
H
N
CH3
COOH
MTX
Uno dei DMARD piu’ utilizzati, da solo o in associazione (dosi sono molto
piu’ basse di quelle necessarie per chemioterapia antineoplastica;
1/settimana p.o, s.c.; anche i.m. se irritazione GI o ridotto assorbimento
intestinale)
La combinazione di MTX e anti-TNFα ha un duplice vantaggio:
• Si raggiungono risultati clinici e radiologici migliori di monoterapia
• Si riduce l’immunogenicita’ degli anti-TNFα (specialmente Infliximab)
MTX
O
OH
O
COOH
N
H
NH2
COOH
N
N
H2N
N
N
Acido folico folato
N
N
N
H
H2 N
N
N
COOH
N
H
N
CH3
COOH
MTX
Uno dei DMARD piu’ utilizzati, da solo o in associazione (dosi sono molto
piu’ basse di quelle necessarie per chemioterapia antineoplastica;
1/settimana p.o, s.c.; anche i.m. se irritazione GI o ridotto assorbimento
intestinale)
La risposta al MTX avviene entro 3-6 settimane
Con la somministrazione cronica si possono presentare citopenie (in
particolare leucopenie), cirrosi epatica e sindrome acuta simile a
polmonite – contrastati da leucovorina
MTX
Anche se il suo meccanismo d’azione principale e’ l’antagonismo dei
folati, la somministrazione di folato (per prevenire tox mucose orali e GI)
non ne riduce effetto immunosoppressore
MTX
Anche se il suo meccanismo d’azione principale e’ l’antagonismo dei
folati, la somministrazione di folato (per prevenire tox mucose orali e GI)
non ne riduce effetto immunosoppressore
Probabilmente coinvolto anche accumulo di adenosina (intermedio nella
biosintesi delle purine) – MTX inibisce deaminazione di adenosina
Potente antinfiammatorio (riduce adesione dei neutrofili, produzione di
citochine, attivita’ macrofagica, espressione molecole di adesione)
Methotrexate (MTX)
Several potential mechanisms for MTX activity in RA have
been proposed. These include antiproliferative, antiinflammatory, and immunosuppressive effects.
MTX can affect these mechanisms through inhibiting
purine/pyrimidine synthesis or proinflammatory cytokine
production, promoting adenosine release or activated T cell
apototosis, suppressing lymphocyte proliferation, neutrophil
chemotaxis, or neutrophil adherence, and reducing serum Ig
levels
Methotrexate (MTX)
Methotrexate toxicities
Abortifacient
Alopecia
Bone Marrow suppression
Cirrhosis
Mucositis
Nausea
Pneumonitis
Teratogenesis
? Infection
? Malignancy
Tests Prior to Beginning Methotrexate
Complete blood cell count (CBC)
Hepatitis B and C virus serologic tests
Serum albumin and either an AST or ALT
Serum creatinine (estimate of creat clearance)
Chest radiograph
Pulmonary function tests in patients with
respiratory symptoms
MTX is contraindicated in patients with
excessive ETOH intake, or
hepatitis C or active hepatitis B, or
pregnancy or
significant lung disease.
MTX Dosing and Monitoring for Toxicity
Dosing
5- 25 mg PO, SC or IM weekly with
Folic acid > 5 mg/week
Monitoring for Toxicity
Every 4-8 weeks laboratory studies:
CBC,
either AST or ALT,
serum albumin,
serum creatinine
Sali d’oro
Auranofin (s. per os; effetti piu’ lenti), sodio aurotiosolfato (s. i.m. profonda)
– poco usati
Effetti benefici possono manifestarsi in 3-6 mesi
Azioni
Assorbiti da macrofagi, ne inibiscono funzioni fagocitiche
(ridotta liberazione di mediatori infiammatori e proliferazione di
altre cellule immunocompetenti)
Farmacocinetica
Si legano a albumina e proteine tissutali (accumulo
nel fegato, rene, mdollo osseo, linfonodi, milza)
Accumulo anche nella sinovia infiammata
Eliminazione renale (in parte biliare)
Emivita di alcune settimane (a causa di accumulo)
Sali d’oro
Auranofin (s. per os; effetti piu’ lenti), sodio aurotiosolfato (s. i.m. profonda)
– poco usati
Effetti benefici possono manifestarsi in 3-6 mesi
Effetti collaterali
Possono essere gravi e ogni sintomo di tossicita’
impone l’immediata interruzione della terapia
Ulcerazioni orali
Proteinuria da glomerulonefrite membranosa (puo’ comparire dopo alcune
settimane di terapia e, a volte, progredire in sindrome nefrotica; la
regressione puo’ richiedere fino a 2 anni da interruzione terapia)
Disturbi ematici (trombocitopenia, agranulocitosi e anemia aplastica)
Rash
Fibrosi polmonare
Diarrea (comune con formulazioni orali)
Sali d’oro
Auranofin (s. per os; effetti piu’ lenti), sodio aurotiosolfato (s. i.m. profonda)
– poco usati
Effetti benefici possono manifestarsi in 3-6 mesi
Prevenzione e gestione degli effetti indesiderati
Costi elevati
Monitoraggio delle urine per diagnosticare eventuale proteinuria
Controllo ematocrito prima di ogni nuova iniezione (con regolarita’ in corso
di terapia orale)
Complicanze severe possono richiedere trattamento con dimercaprolo o
penicillamina (chelano oro e ne aumentano eliminazione)
I composti a base d’oro non devono essere utilizzati in pazienti con
anamnesi positiva di patologie renali o epatiche, discrasie ematiche o gravi
rash
Biologic Therapies: Targeting Cytokines
B
IL-6, TNFα
T
APC
TNFα
α
-
-
MΦ
Cytokine
inhibitors
-
TNFα
α, IL-1, IL-6
OC
Articular
cartilage
1.
2.
3.
FLS
C
Production of metalloproteinases and other effector molecules
Migration of polymorphonuclear cells
Erosion of bone and cartilage
TNF Inhibitors
mAb or Fab’
Adalimumab
Certolizumab pegol
Golimumab
Infliximab
Soluble receptor
Etanercept
No signal
Choy and Panayi. N Engl J Med. 2001;344:907.
Anti-TNFα
α
Adalimumab
Anticorpo monoclonale umanizzato
S. iniezione sottocutanea ogni 1 o 2 settimane (lunga emivita di 12 gg),
degradato per proteolisi
Etanercept
Proteina di fusione, costituita da due porzioni
extracellulari solubili del recettore p75 per il TNF, fuse
con il dominio Fc delle IgG1 umane. Riconosce sia TNFa
che TNFβ (linfotossina α; non chiara la rilevanza clinica)
S. iniezione sottocutanea 2 volte a settimana (assorbimento lento; emivita
di 5 gg), degradato per proteolisi
Infliximab Anticorpo chimerico monoclonale composto dalla regione
variabile dell’anticorpo murino (TNFα), unito alla regione
costante di Ig umane. Non lega linfotossina α (TNFβ)
S. infusione endovenosa (almeno 2 h), inizialmente a intervalli di 2 o 4
settimane, poi ogni 2 mesi (lunga emivita di 9 gg), eliminazione ?
Anti-TNFα
α
Golimumab
Anticorpo monoclonale umanizzato
S. iniezione sottocutanea ogni mese in combinazione con MTX o DMARD
non biologici
Certolizumab pegol Bloccante PEGilato del TNFa contenente un
frammento Fab di un anticorpo umanizzato. Non
contiene porzione Fc (non attiva complemento
ne’ causa citotossicita’ cellulo-mediata)
S. iniezione sottocutanea ogni 2 settimane in combinazione con MTX
Side Effects of TNF Inhibition
• Infusion Reactions with Infliximab, Injection Site
Reactions with Adalimumab and Etanercept
• Infection
– Tuberculosis
– Serious resulting in death
• Malignancy
– Increased risk of lymphoma – early data
– Solid tumors?
• Neurologic
– Multiple Sclerosis, seizures, inflammation of the ocular nerve
• Autoimmune
– Antibody formation – SLE like illness
• Worsening of Congestive Heart Failure
Cumulative incidence of tuberculosis (TB) following first exposure to anti-tumour necrosis
factor (anti-TNF) therapy (most recent drug model, with person-years censored at death, last
returned follow-up form, or date of switching to second anti-TNF).
Dixon W G et al. Ann Rheum Dis 2010;69:522-528
©2010 by BMJ Publishing Group Ltd and European League Against Rheumatism
TNF Antagonists: Contraindications
• Current active infection
• Chronic or recurrent infections
• History of TB
•
•
•
•
Congestive heart failure
Recent malignancy
Systemic lupus erythematosus
Multiple sclerosis, optic neuritis
Biologic Therapies: Targeting T Cells
Abatacept
IL-4
IL-6
IL-10
B
-
IL-6, TNFα,
IFNγ, IL-10, lymphotoxin
T
APC
IL-2
IFNγ
TNFα
α
MΦ
IL-17
RANKL
TNFα
α, IL-1, IL-6,
metalloproteinases
Pannus
Articular
cartilage
OC
1.
2.
3.
FLS
C
Production of metalloproteinases and other effector molecules
Migration of polymorphonuclear cells
Erosion of bone and cartilage
T-Cell Co-Stimulatory Blockade (Abatacept)
T-Cell Activation
• T-cell activation requires 2 signals:
• 1st signal: The antigen presented by the MHC
is recognized by the T-cell receptor
• 2nd signal: Co-stimulatory molecules CD80
and CD86 on APCs bind to CD28, an autoregulatory protein, on the T-cell surface
• T-cells have an intrinsic mechanism to
terminate T-cell activation, which regulates
immune activation
66
Regulating T-cell Activation
• T-cell regulation occurs via the Cytotoxic TLymphocyte Associated Antigen-4 (CTLA4) molecule
• CTLA-4 acts as a negative regulator of
CD28-mediated T-cell stimulation
• Antagonizes the CD80/CD86:CD28 binding
pathway by binding CD80/CD86
• Greater affinity for CD80/CD86 than CD28
• Leads to the down-regulation of T-cell
activation
67
T-Cell Activation
DC
DC
DC
MHC class II
Antigen
CD80/86
CTLA4
TCR
CD28
T
T
T
Activated
T cell
Downregulated
T cells
Abatacept
• Consists of the extracellular domain of CTLA4 and a modified Fc fragment of IgG1 to
prevent antibody dependent cell-mediated
cytotoxicity
• Has a novel mechanism of action that mimics
CTLA-4’s action
69
22
Targeting T Cells: Abatacept—a Human
Immunoglobulin Receptor Fusion Protein
Without Abatacept
With Abatacept
T
DC
T
DC
CD80/86 CD28
Activated
T cell
Abatacept
(CTLA4Ig)
Abatacept competes with CD28 to
bind to CD80/86, downregulating
T-cell activation
T-Cell Co-Stimulatory Blockade (Abatacept)
Abatacept (CTLA4-Ig) is a novel fusion protein with a mechanism of action that is
mechanistically distinct from other biologic DMARDs.
Abatacept consists of the extracellular domain of the CTLA4 molecule complexed
to the Fc domain of human IgG1.
The CTLA4 domain is similar to the naturally occurring protein and avidly
binds to CD80/CD86 on antigen-presenting cells.
The IgG1 domain functions to solubilize the molecule.
The putative mechanism of action of abatacept is based on its ability to block the
costimulatory signal required for activation of T cells. Absence of the second
costimulatory signal results in T-cell anergy, a state where T cells remain
functionally inactivated.
In contrast to the natural molecule CTLA4, abatacept does not bind to the
membrane of T cells.
Farmacocinetica
Dose raccomandata e’ basata su peso paziente,
somministrata per infusione endovenosa di 30
minuti (dopo la prima, ogni due settimane; dopo
la terza, ogni 4 settimane)
Effetti indesiderati
Aumento rischio infezioni delle
superiori, nasofaringite e nausea
vie
aeree
Cefalea
Indicato per pazienti adulti con AR moderata-severa che hanno risposto in
maniera inadeguata a DMARD come MTX o anti-TNFa
Puo’ essere usato da solo o in associazione con altri DMARD (non
raccomandati anti-TNF e anakinra a causa dell’aumento del rischio di
infezioni gravi)
Anakinra
Antagonista per il recettore umano della IL-1 ricombinante
Produce modesta riduzione dei segni e sintomi della AR di grado
moderato-severo in fase attiva nei pazienti adulti refrattari ad uno o piu’
DMARD
Puo’ essere utilizzato da solo o in associazione ad altri DMARD (non
raccomandati anti-TNF o abatacept)
Farmacocinetica
S. Iniezione sottocutanea giornaliera (a giorni
alterni in pazienti con disfunzione renale), emivita
di 4-6 h, eliminazione renale
Effetti indesiderati Rezioni al sito di iniezione
Aumento rischio infezioni gravi, soprattutto in
soggetti asmatici
Neutropenia
Anakinra
Antagonista per il recettore umano della IL-1 ricombinante
A causa dei risultati inferiori degli anti-TNF e dello schema di
somministrazione, e’ usato poco per RA.
Maggiore successo come farmaco di nicchia per alcune rare (ma
devastanti) malattie caratterizzate da elevata produzione di IL-1
NOMID – Neonatal-Onset Multisystem Inflammatory Disease; conosciuta
anche come sindrome CINCA (Chronic Infantile Neurological, Cutaneus
and Articular)
Sindrome di Muckle-Wells
B-Cell Depletion
(Rituximab)
Rituximab is a mouse-human chimeric monoclonal antibody
that targets the CD20 B cell antigen.
Biologic Therapies: Targeting B Cells
Rituximab
-
IL-4
IL-6
IL-10
RF, anti-CCP
B
IL-6, TNFα,
IFNγ, IL-10, lymphotoxin
T
PC
APC
IL-2
IFNγ
TNFα
α
MΦ
IL-17
RANKL
TNFα
α, IL-1, IL-6,
metalloproteinases
Pannus
OC
FLS
Immune complexes
Complement fixation
Attract inflammatory
cell infiltrates
C
Articular 1. Production of metalloproteinases and other effector molecules
cartilage 2. Migration of polymorphonuclear cells
3.
Erosion of bone and cartilage
B-Cell Depletion Therapy in RA
• How does B-Cell Depletion work?
– B-Cells cannot act as antigen presenting cells
to activate T-Cells
– B-Cells cannot produce Rheumatoid Factor
– B-Cells cannot release cytokines
Rituximab
Rituximab
CD20 is a cell-surface antigen that is not present on stem cells.
CD20 is lost before differentiation of B cells into plasma cells.
Rituximab results in a rapid and transient depletion of pre-B and mature B cells
only without affecting progenitor or plasma cells.
Several mechanisms have been proposed for the depletion of B cells by
rituximab:
Antibody-dependent cellular cytotoxicity (ADCC)
Complement-dependent cytotoxicity (CDC)
Induction of apoptosis
Complement-dependent
cytotoxicity
Rituximab
Indicato per l’uso in combinazione con MTX in pazienti adulti con RA
moderata-severa che non hanno risposto in maniera adeguata ad uno o
piu’ anti-TNFα
Farmacocinetica
S. tramite due infusioni endovenose di 1000 mg a
distanza di 2 settimane una dall’altra
Per ridurre intensita’ di reazioni da infusione
(orticaria,
ipotensione,
angioedema)
somministrare 30 min prima metilprednisolone
Effetti indesiderati Rezioni da infusione (trattare pazienti con
vasopressori, antistaminici e fluidi)
Se infusione deve essere ripresa, la sua velocita’
va ridotta del 50% dopo risoluzione completa dei
sintomi
Tocilizumab
• Anti-IL-6 receptor bloker
• Clinical efficacy in patients who had previously failed to
respond to DMARDs or anti-TNF agents, or both
• Given intravenously every 4 weeks
• Adverse Effects Include:
infusion-related adverse events, increased rate of
common infections, reduced platelet and neutrophil
levels in blood, risk of hypertension
Increase LDL and HDL
Tocilizumab Mode of Action
• Drug binds IL-6 receptors and prevents IL-6 from binding
• Inhibits production of more T and B cells and aids to decrease inflammation at the
joints
Tocilizumab Mode of Action
Figure 1 A schematic showing simplified pathophysiologic pathways in RA and
their main clinical consequences
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
Figure 2 A schematic showing simplified pathophysiologic pathways in RA, and where
these processes can be interfered with by currently available biologic agents
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
Table 1 The current armamentarium of DMARDs
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
Table 2 The current armamentarium of biologic agents
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
anti-Rank Ligand antibody- Denosumab
Denosumab--a novel strategy to prevent structural joint damage in patients with
RA?
Schett G, David JP.
Nat Clin Pract Rheumatol. 2008 Dec;4(12):634-5.
anti-Rank Ligand antibody- Denosumab
1.
Denosumab treatment effects on structural damage, bone mineral density, and
bone turnover in rheumatoid arthritis: a twelve-month, multicenter, randomized,
double-blind, placebo-controlled, phase II clinical trial.
Cohen SB, Dore RK, Lane NE, Ory PA, Peterfy CG, Sharp JT, van der Heijde D,
Zhou L, Tsuji W, Newmark R; Denosumab Rheumatoid Arthritis Study Group.
Arthritis Rheum. 2008 May;58(5):1299-309.
2.
Denosumab prevents metacarpal shaft cortical bone loss in patients with erosive
rheumatoid arthritis.
Sharp JT, Tsuji W, Ory P, Harper-Barek C, Wang H, Newmark R.
Arthritis Care Res (Hoboken). 2010 Apr;62(4):537-44.
3.
Denosumab-mediated increase in hand bone mineral density associated with
decreased progression of bone erosion in rheumatoid arthritis patients.
Deodhar A, Dore RK, Mandel D, Schechtman J, Shergy W, Trapp R, Ory PA,
Peterfy CG, Fuerst T, Wang H, Zhou L, Tsuji W, Newmark R.
Arthritis Care Res (Hoboken). 2010 Apr;62(4):569-74
Components of the
RANKL/RANK/OPG Pathway
RANK Ligand (RANKL)
Protein expressed by osteoblasts/bone lining cells
Binds to RANK and activation of RANK promotes
osteoclast formation, function, and survival
RANK
Expressed by osteoclasts and their precursors
Activated by RANKL binding
Osteoprotegerin (OPG)
Protein secreted by osteoblasts/bone lining cells
Natural inhibitor of RANKL
Blocks RANKL-mediated activation of RANK to
balance bone remodeling
Kostenuik PJ. Curr Opin Pharmacol. 2005;5:618-625.
Boyle WJ, et al. Nature. 2003;423:337-342.
Kostenuik PJ, et al. Curr Pharm Des. 2001;7:613-635.
RANKL in the Regulation of
Osteoclast Activity
RANKL expression is increased
by:
PTH
Cytokines (TNF- , IL-1, IL-11)
Glucocorticoids
RANKL expression is decreased
by:
Estrogen
Cytokines (TGF- , IL-4)
Osteoblasts
TNF- =tumor necrosis factor-alpha; PTH=parathyroid hormone;
IL-1, IL-11, IL-4=interleukins-1, -11, and -4; TGF- =transforming growth factor beta.
Adapted from: Boyle WJ, et al. Nature. 2003;423:337-342.
Kostenuik PJ. Curr Opin Pharmacol. 2005;5:618-625.
Hofbauer LC and Schoppet M. JAMA. 2004;292:490-495.
Osteoclast
Precursors
Differentiated
Osteoclast
Activated
Osteoclast
Janus Kinase Inhibitors (JAKs)
• New molecular approach to treating RA
• Inhibit the activity of the janus kinase (JAK)
family to down regulate inflammatory
reactions
• JAK inhibitors include:
• Tofacitinib
• VX-509
• Baricitinib
94
JAK Family
• Tyrosine kinase proteins
• Family includes:
•
•
•
•
JAK1
JAK2
JAK3
TYK2
• Plays an important role in mediating the
intracellular signal transduction of cytokines
95
JAK Proteins
• Acting in pairs, JAK proteins facilitate the
phosphorylation of intracellular proteins
• Phosphorylation of the signal transducer and
activator of transcription (STAT) leads to altered
gene transcription
• STAT controls autoimmune and inflammatory
responses
96
26
Tofacitinib
• Small, non-biologic DMARD with
demonstrated efficacy in treating RA
• Interferes with the signalling pathways of
JAK1 and JAK3
• JAK3 associates with the Ŵ-chain of common
cytokine receptors
• These receptors are used by interleukins to
regulate lymphocyte activation and production
• Inhibition leads to anti-inflammatory and
immunosuppressive effects
97
Tofacitinib: Inhibiting JAKDependent STAT Pathways
98
Summary
Summary of RA Treatment
• RA is an auto-immune disease with upstream mechanisms of activated
macrophages, activated B cells and activated T cells; resulting in
downstream cytokine production and destruction signaling pathways.
• Activated macrophages secrete (downstream) inflammatory cytokines
TNF-α, and IL-6 and IL-1.
• TNF-α inhibitors etanercept, infliximab, adalimumab
• IL-6 receptor antagonist tocilizumab
• IL-1 receptor antagonist anakinra
• Activated B cells contribute to inflammation and destruction by
producing autoantibodies (RF) and cytokine IL-6
• Bind to CD20 antigen on B Cell and depletes B cells rituximab
• Activated (CD4+) T cells activate macrophages and B cells
• Upstream regulation of T Cell activation pathway abatacept
• Downstream signaling pathways (RANK, MMPs)
• JAK inhibitors to down regulate inflammatory responses
tofacitinib
100