Artrite reumatoide e farmaci
antireumatici (DMARD)
Artrite reumatoide e farmaci
antireumatici (DMARD)
Famous people with RA
• Dorothy Hodgkin: Nobel prize winning scientist,
developed severe RA at age 28. Developed X-ray
crystallography, discovered the structure of insulin,
penicillin, vitamin B12 .
• Christiaan Barnard: performed first heart
transplant in 1967; He retired after developing RA.
Wrote a book on arthritis (“Arthritis Handbook:
How to Live With Arthritis”)
• Pierre-Auguste Renior: French, impressionist
Pierre-Auguste Renior
(1841-1919)
Pierre-Auguste Renior
(1841-1919)
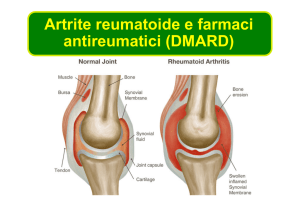
Artrite reumatoide
Condizione cronica infiammatoria che colpisce alcuni individui
geneticamente predisposti
Processi autoimmuni contribuiscono al mantenimento
dell’AR, ma non e’ del tutto chiaro se patologia origina
da processo autoimmune o da un antigene esogeno
Sintomi graduali, molto spesso colpite articolazioni
interfalangee prossimali delle dita, quelle metacarpofalangee e
i polsi – anca e caviglia coinvolte successivamente
Black= joints most commonly affected
Grey= joints often affected
White= joints usually not affected
Artrite reumatoide
Condizione cronica infiammatoria che colpisce alcuni individui
geneticamente predisposti
Processi autoimmuni contribuiscono al mantenimento
dell’AR, ma non e’ del tutto chiaro se patologia origina
da processo autoimmune o da un antigene esogeno
Sintomi graduali, molto spesso colpite articolazioni
interfalangee prossimali delle dita, quelle metacarpofalangee e
i polsi – anca e caviglia coinvolte successivamente
Articolazioni colpite sono calde, tumefatte e dolenti
Rigidita’ da aumento del liquido extracellulare intorno e all’interno dell’articolazione
Comuni manifestazioni sistemiche: malessere, affaticamento generale
Manifestazioni extra-articolari (neuropatia e vasculite) meno comuni
RA is Not a Benign Disease
The disease affects about 1% of the population (all age, but it is most
common from the ages of 40-70 years); women are three times more
commonly affected than men and often develop their first symptoms while
still middle-aged
We can be certain that the disease process had already been present for
many months, or perhaps even years before symptoms appear. People
have looked at blood samples from blood donors for anticitrulline
antibodies, which are typical of RA, and there are many people who have
these antibodies ten years before diagnosis
Once the first symptoms appear, the disease often progresses rapidly: the
inflammation of the joints fails to subside, but in stead becomes selfperpetuating and spreads to other organs
Without proper treatment rheumatoid arthritis is very progressive. There is
a severe shortening of life expectancy of anything up to 15 years
RA is Not a Benign Disease
If not controlled, RA inflammation leads to:
• joint damage and joint deformities
• progressive loss of physical function
• work disability (32-50% after 10 years of RA)
• premature mortality, mainly from cardiovascular disease (50% increase
in risk of death from CVD)
RA is Not a Benign Disease
The diagnosis of RA is a clinical diagnosis that combines
•
the patient history of joint pain and stiffness
•
the physical examination documentation of symmetric polyarticular joint
swelling (synovitis)
•
the laboratory tests including radiographs, inflammatory markers
(erythrocyte sedimentation rate [ESR] and C-reactive protein [CRP]),
and autoantibodies (rheumatoid factor [RF] and anti-cyclic citrullinated
peptide antibodies [anti-CCP])
J Manag Care Pharm. 2011;17(9-b):S3-S8
A joint working group of American
College of Rheumatology (ACR)
and the European League Against
Rheumatism (EULAR) was formed
to develop new classification criteria
for RA
Patients are considered to have RA
if they have a score of at least 6.
J Manag Care Pharm. 2011;17(9-b):S3-S8
The new criteria are an important step forward to assist in the diagnosis of RA early in
the disease course, thereby facilitating early intervention. However, it should be noted
that these criteria are not intended to be a primary care screening or referral tool.
Artrite reumatoide
Nella fase iniziale e’ importante attivazione TLR su cellule dendritiche e
macrofagi, stimolazione che inizia una risposta del sistema dell’immunita’
innata
J Immunol Res. 2015;2015:527696.
Artrite reumatoide
Nella fase iniziale e’ importante attivazione TLR su cellule dendritiche e
macrofagi, stimolazione che inizia una risposta del sistema dell’immunita’
innata
Risposta primaria caratterizzata da infiltrazione di cellule linfoidi nella
sinovia periarticolare, neoangiogenesi e proliferazione delle membrane
sinoviali
La sinovia diventa invasiva (panno) e gli osteoclasti distruggono cartilagine
articolare e tessuto osseo
Il processo infiammatorio cronico e’ avviato da linfociti T-helper 1 (Th1),
che migrano nell’articolazione infiammata (sfuggono alla soppressione da
parte delle cellule regolatorie)
I linfociti T attivati producono varie citochine pro-infiammatorie (es.
TNFalpha, IL-1) che stimolano i linfociti B, macrofagi, fibroblasti, condrociti
e osteoclasti
Artrite reumatoide
Nella fase iniziale e’ importante attivazione TLR su cellule dendritiche e
macrofagi, stimolazione che inizia una risposta del sistema dell’immunita’
innata
• Pruomuovono reclutamento di leucociti
Risposta
primaria
caratterizzata
da infiltrazione
cellule linfoidi
nella
• Aumentano
espressione
di molecole
di adesione di(integrine)
su endotelio
vascolare
sinovia
periarticolare, neoangiogenesi e proliferazione delle membrane
sinoviali
• Stimolano fibroblasti sinoviali, osteoclasti e condrociti a esprime recettori per
a rilasciare
metalloproteasi
Lacitochine
sinoviaediventa
invasiva
(panno) eche
glidistruggono
osteoclastitessuti
distruggono cartilagine
articolare e tessuto osseo
TNFalpha ha un ruolo preminente nel coordinare la produzione di altri mediatori
nel reclutare altre
cellulee’
delavviato
sistema da
immunitario
nell’articolazione
Ilinfiammatori
processo einfiammatorio
cronico
linfociti T-helper
1 (Th1),
che migrano nell’articolazione infiammata (sfuggono alla soppressione da
parte delle cellule regolatorie)
I linfociti T attivati producono varie citochine pro-infiammatorie (es.
TNFalpha, IL-1) che stimolano i linfociti B, macrofagi, fibroblasti, condrociti
e osteoclasti
Artrite reumatoide
B lymphocytes play several critical roles in the pathogenesis of RA:
Nella fase iniziale e’ importante attivazione TLR su cellule dendritiche e
They are thestimolazione
source of the
rheumatoid
factors
(RF)del
andsistema
anticitrullinated
protein
macrofagi,
che
inizia una
risposta
dell’immunita’
antibodies (ACPA), which contribute to immune complex formation and complement
innata
activation in the joints (their presence provides the physician with prognostic
information);
Risposta primaria caratterizzata da infiltrazione di cellule linfoidi nella
sinovia
periarticolare,
neoangiogenesi
e proliferazione
delle membrane
B cells are
also very efficient
antigen-presenting
cells, and can contribute
to T cell
sinoviali
activation through expression of costimulatory molecules;
B cells both respond to and produce the chemokines and cytokines that promote
La
sinovia diventa invasiva (panno) e gli osteoclasti distruggono cartilagine
leukocyte infiltration into the joints, formation of ectopic lymphoid structures,
articolare
e tessuto osseo
angiogenesis, and synovial hyperplasia.
Res Ther. 2003; 5(Suppl 4): S1–S6.
Il processo infiammatorio cronico e’ avviato daArthritis
linfociti
T-helper 1 (Th1),
RF, autoantibodies
(of any isotype) specific
for the constant
regions alla
of IgG;
detectable in upda
to
che
migrano nell’articolazione
infiammata
(sfuggono
soppressione
>80% of
RA patients,
may also be present in a 'hidden' or complexed form in the synovial
parte
delle
cellule and
regolatorie)
fluids of some seronegative patients; RF efficiently fix and activate complement in vitro by the
classic pathway; not a diagnostic marker; less specific for RA than ACPA
I linfociti T attivati producono varie citochine pro-infiammatorie (es.
ACPA, autoaintibodies against citrulline-containing proteins; highly specific for RA (95-98%)
TNFalpha,
IL-1) che stimolano i linfociti B, macrofagi, fibroblasti, condrociti
e osteoclasti
Arthritis Res Ther. 2003; 5(Suppl 4): S1–S6.; J Manag Care Pharm. 2011 Nov-Dec;17(9 Suppl B):S09-13.
Biomed Res Int. 2014;2014:681678.
Artrite reumatoide
Nella fase iniziale e’ importante attivazione TLR su cellule dendritiche e
macrofagi, stimolazione che inizia una risposta del sistema dell’immunita’
innata
Risposta primaria caratterizzata da infiltrazione di cellule linfoidi nella
sinovia periarticolare, neoangiogenesi e proliferazione delle membrane
sinoviali
La sinovia diventa invasiva (panno) e gli osteoclasti distruggono cartilagine
articolare e tessuto osseo
Il processo infiammatorio cronico e’ avviato da linfociti T-helper 1 (Th1),
che migrano nell’articolazione infiammata (sfuggono alla soppressione da
parte delle cellule regolatorie)
I linfociti T attivati producono varie citochine pro-infiammatorie (es.
TNFalpha, IL-1) Attivati
che stimolano
i linfociti
fibroblasti,
condrociti
direttamente
ancheB,damacrofagi,
ACPAs; Aumento
riassorbimento
e osteoclasti osseo
Pathophysiology of RA
Normal Joint
Capsule
Synovial
membrane
Synoviocytes Cartilage
Established RA
Early RA
Angiogenesis Neutrophils
T cells
B cells
Synoviocyte Dendritic cell
accumulation
(enlarged synovium)
Plasma
cell
Neutrophils
Bone
erosion Pannus
Adapted with permission from Choy and Panayi. N Engl J Med. 2001;344:907. Copyright © 2001 Massachusetts
Medical Society. All rights reserved.
The Immune Cascade in RA
RF
Autoantibodies
B
Self-antigens
Activates
T
T
PC
T
T
T
FLS
Inflammation
Joint damage
FLS
APC/DC
T
FLS= Fibroblast-like synoviocyte
PC= Plasma Cell
Activates
MΦ
Cytokines
MMPs
Prostaglandins
Nitric oxide
MΦ
T-Cell Activation
DC
DC
DC
MHC class II
Antigen
CD80/86
CTLA4
TCR
CD28
T
T
T
Activated
T cell
Downregulated
T cells
IL-2
TNF And Joint Damage
IFNγ
IL-12
IL-18
TNFα
MΦ
PGE, MMP
Nitric oxide
IL-6
IL-8
Other cytokines
Growth factors
TNF
IL-1
C
FLS
C
OC
MMP, PGE
Cartilage Destruction
MMP, PGE
Decrease repair
Bone Destruction
Choy and Panayi. N Engl J Med. 2001;344:907.
Silverman and Carson. Arthritis Res Ther. 2003;5(suppl 4):S1.
Cartilage Destruction
EARLY Treatment of RA with
DMARDs
E EARLY DIAGNOSIS AND TREATMENT OF RA
A AGGRESSIVE USE OF DMARDS ALTERS THE COURSE OF RA
R REMISSION IS THE NEW TARGET OF RA TREATMENT
L LONG TERM USE OF DMARDS
Y YES, DMARDS ARE SAFE WHEN MONITORED REGULARLY
Treatment of RA
the standard of care has changed
DMARDs
NSAIDS
Go low, go slow
Inverting the pyramid
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
AR: farmacoterapia
FANS
Possono modificare la sintomatologia (dolore e gonfiore
articolare), ma non il decorso – NON utilizzare da soli
La scelta del FANS e’ arbitraria, con una notevole variabilita’ nella risposta
individuale alle differenti molecole
COXIB di norma prescritti a pazienti intolleranti a FANS non selettivi
(attenzione agli effetti cardiovascolari)
AR: farmacoterapia
Glucocorticoidi (GC)
Uso dei GC nell’AR e’ ancora oggi controverso
(rischi vs benefici)
Possono essere presi in considerazione come terapia aggiuntiva, ma non sono
trattamenti primari (non sembrano modificare progressione RA; effetti collaterali)
Il 34-93% di tutti i pazienti reclutati in recenti trial clinici dei biologici (quindi con una
patologia attiva) ricevevano GC
GC sopprimono efficacemente e rapidamente (come i FANS) sinovite e sintomi RA
Dovrebbero essere utilizzati al piu’ basso dosaggio e per il piu’ breve tempo
possibili (EULAR Task Force raccomanda di aderire allo “standard care”)
Dovrebbero essere somministrati di mattino presto (influenza efficacia visto che
sintomi e livelli sierici di citochine mostrano ritmo circadiano)
Le linee guida ACR raccomandano che i pazienti in trattamento con GC assumano
1.5 g di calcio e 400-800 IU di vitamina D
AR: farmacoterapia
Glucocorticoidi (GC)
Uso dei GC nell’AR e’ ancora oggi controverso
(rischi vs benefici)
Nelle fasi iniziali, associazione DMARD (sulfasalazina, MTX) con glucocorticoidi
orali (es. prednisolone) a bassi dosaggi e per 6 mesi ritarda danno osseo e
diminuisce progressione
Nelle fasi attive della patologia, GC sistemici (per os, vie parenterali; cicli brevi o
somministrazione
intermittente)
possono
produrre
miglioramenti
della
sintomatologia prima della piena efficacia dei DMARD – “bridging therapy”
Iniezioni intra-articolari possono essere utili contro infiammazione di singole
articolazioni (es. ginocchia e spalle) – effetti temporanei. Prima di iniziare,
escludere diagnosi di artrite settica
La sospensione della terapia con CG (specie se alti dosaggi/uso prolungato)
dovrebbe essere fatta lentamente (un mese o piu’)
AR: farmacoterapia
DMARD
Termine utilizzato dalla fine degli anni ’80 per indicare un
eterogeneo gruppo di farmaci con specifiche proprieta’
antireumatiche
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
AR: farmacoterapia
DMARD
Possono ridurre la velocita’ di prog. dell’erosione e distruzione
articolare, determinando anche un miglioramento sia dei
sintomi che dei marker clinici e sierologici della patologia
Uso precoce di DMARD determina miglioramenti nel lungo periodo
Spesso utilizzati con FANS per le prime settimane di trattamento, dato che:
• Hanno pochi effetti antinfiamnatori diretti (anche se producono una
riduzione cronica della risposta infiammatoria)
• Possono richiedere anche 2-3 mesi prima della loro piena efficacia
MTX e’ uno dei DMARD piu’ utilizzato (in caso di intolleranza, leflunomide)
Terapia d’associazione sempre + applicata (generalm. piu’ efficace). Es.:
Se singolo DMARD non controlla patologia, dove non e’ stato provato il
MTX, si deve introdurlo
Consigliati altri DMARD se dopo 3 mesi di trattamento MTX non raggiunti
risultati attesi
AR: farmacoterapia
DMARD
Possono ridurre la velocita’ di prog. dell’erosione e distruzione
articolare, determinando anche un miglioramento sia dei
sintomi che dei marker clinici e sierologici della patologia
Farmaci anti-TNFα (i piu’ utilizzati tra i “biologici”) in genere riservati a
pazienti che non rispondono alle terapie orali o che mostrano intolleranza
ad alcuni DMARD; spesso usati in associazione con MTX
Anakinra meno efficace di anti-TNFα, mentre abatacept, rituximab e
tocilizumab sono efficaci in pazienti che non rispondono o non tollerano
anti-TNFα
Agenti citotossici (es. ciclofosfamide) sono di particolare importanza per
terapia delle forme extra-articolari di artrite reumatoide, quali vasculiti,
pericarditi e pleuriti
Measuring disease activity
It is important to know how to measure disease activity in RA as most
clinical trials employ these as outcome measures.
This can be measured by a number of indices including the disease
activity score (DAS), DAS28, simplified disease activity index, clinical
disease activity index, rheumatoid arthritis disease activity index, patient
activity scale and routine assessment patient index data
Each assesses a various combination of factors including number of
tender joints, number of swollen joints, acute phase reactants [erythrocyte
sedimentation rate, C-reactive protein (CRP)], patient global assessment
and physician global assessment. Each of these has varying definitions of
remission, low disease activity, moderate disease activity and high
disease activity.
World J Orthop. Mar 18, 2015; 6(2): 278-283
Rheumatology
Di Marc C. Hochberg,Alan J. Silman,Josef S.
Smolen,Michael E. Weinblatt,Michael H. Weisman
ACR score
A number indicating how much a person’s rheumatoid arthritis (RA) has improved,
based on guidelines set forth by the American College of Rheumatology (ACR).
The ACR score represents a percentage. An ACR20 score means that a person’s
RA has improved by 20%, an ACR50 score means it has improved by 50%, and
an ACR70 score means it has improved by 70%.
To qualify for an ACR20 score, a person with RA must have at least 20% fewer
tender joints and at least 20% fewer swollen joints. As well, he or she must show
a 20% improvement in at least three of the following five areas:
the person’s overall (global) assessment of his or her own RA
the physician’s global assessment of the person’s RA
the person’s assessment of his or her own pain
the person’s assessment of his or her own physical functioning
the results of an erythrocyte sedimentation rate or C-reactive protein blood test
(both of which test for inflammation).
ACR50 and ACR70 scores use the same criteria but require 50% and 70%
improvement, respectively
Efficacy results from the phase 3 Trial of Etanercept and Methotrexate with
Radiographic Patient Outcomes (TEMPO) in active RA (adapted from Klareskog et al.
(The Lancet, 2004;363:675-681)
Efficacy results from the phase 3 Anti-TNF Therapy in RA with Concomitant
Therapy (ATTRACT) trial of infliximab plus methotrexate (MTX) in active RA
Efficacy results from a randomized, placebo-controlled phase 3 trial of
adalimumab plus MTX in active RA (Adapted from Keystone et al )
ACR score
A number indicating how much a person’s rheumatoid arthritis (RA) has improved,
based on guidelines set forth by the American College of Rheumatology (ACR).
The ACR score represents a percentage. An ACR20 score means that a person’s
RA has improved by 20%, an ACR50 score means it has improved by 50%, and
an ACR70 score means it has improved by 70%.
To qualify
an ACR20
score,
a personresponse
with RAmeasurement
must have at
least 20% arthritis
fewer
Although
usefor
of the
ACR20 has
standardized
in rheumatoid
(RA)
trials,
the and
ACR20
has been
as less joints.
sensitive
change
than
continuous
tender
joints
at least
20%criticized
fewer swollen
Astowell,
he or
sheare
must
show
measures
of response, and
threshold
(>20%)
is thought
a 20% improvement
in atitsleast
threeforofresponse
the following
five
areas: to be low.
Athe
newperson’s
hybrid measure
RA response
… maximizes
to change,
correlates well with
overall of
(global)
assessment
of his sensitivity
or her own
RA
rheumatologists’ impressions of improvement, and preserves the ACR20
the physician’s global assessment of the person’s RA
Arthritis Rheum. 2007 Mar 15;57(2):193-202.
the person’s assessment of his or her own pain
the person’s assessment of his or her own physical functioning
The hybrid ACR response measure is intended for use as an outcome measure in clinical
trials.
Its use enables
modest treatment
differencesrate
to be
as statistically
significant
the results
of an erythrocyte
sedimentation
or detected
C-reactive
protein blood
test
and allows trials to be carried out with fewer subjects than are required using current outcome
(both of which test for inflammation).
measures.
Arthritis Rheum. 2007 Mar 15;57(2):193-202.
ACR50 and ACR70 scores use the same criteria but require 50% and 70%
improvement, respectively
DMARD are safe
when monitored regularly
Benefits of early DMARDs outweigh their risks
AR: farmacoterapia
it would be all too easy to conclude that all patients should be treated with
methotrexate plus a biologic as first-line therapy ; however, it should be recognized
that the superiority in different trials for the combination was demonstrated at the
group level only
in addition, each of these trials also documented the good efficacy of methotrexate as
monotherapy in some patients (which did achieve disease remission, nonprogression of radiographic changes, and functional stability). Thus, a sizeable
subset of patients (range 15–40% in these studies) would be over-treated if they were
given combination therapy from the start.
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
AR: farmacoterapia
In actual practice, 40% of patients with established RA achieve low disease activity,
but only 24% achieve remission with biologic treatment. It would seem somewhat
foolhardy to pursue a treatment objective that is not realistic for more than threequarters of patients
If one were to adjust therapy every 3 months because of not having achieved
remission, it would take only 2 years to exhaust all biologic options; seen against the
average disease course of 25 years, that is a serious limitation
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
AR: farmacoterapia
Although biologic agents as a group clearly have favorable efficacy and safety
profiles, unique risks with specific agents have emerged, and the possibility of such
events must always be considered in the medical decision to use them
The cost of biologic agents is so much higher than conventional therapies that the
appraisal of these drugs in health-economic terms has emerged as a major issue. It
should be emphasized, however, that the cost of not adequately treating RA is also
enormous, especially in the longer term
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
AR: farmacoterapia
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
Available DMARDs
•
•
•
•
•
•
Methotrexate
Sulfasalazine
Hydroxychloroquine
Leflunomide
Gold
Others
–
–
–
Cyclosporine
Azathioprine
Cyclophosphamide
Biologics
• Specially designed to treat inflammatory
types of arthritis such as rheumatoid and
psoriatic arthritis.
• Work by different mechanisms.
• Like DMARDs, biologics are used to
suppress inflammation and help prevent
damage to the joint.
Current Available Biologics
Tumor Necrosis InhibitorsAdalimumab - anti-TNF mab
Certolizumab pegol - anti-TNF Fab’
Etanercept - soluble TNF receptor
Golimumab - anti-TNF mab
Infliximab - anti-TNF mab
T cell inhibitor- Abatacept
IL-1 Inhibitors- Anakinra
anti-B cell antibody- Rituximab
anti-IL-6 antibody- Tocilizumab
Sulfasalazina
Usata per AR prec. e lieve, con idrossiclorochina e MTX; 1-3 mesi x eff. ter.
Parzialmente assorbita immodificata attraverso mucosa intestinale, mentre
la maggior parte raggiunge il colon dove e’ ridotta e trasformata in 5-ASA e
sulfapiridina
Sulfapiridina e ≈ 20 % di 5-ASA sono assorbiti dal colon (ma simili
concentrazioni nel l. sinoviale); metab. epatico; t½ plasmatica di circa 5-10 h
Sulfasalazina
Usata per AR prec. e lieve, con idrossiclorochina e MTX; 1-3 mesi x eff. ter.
Parzialmente assorbita immodificata attraverso mucosa intestinale, mentre
la maggior parte raggiunge il colon dove e’ ridotta e trasformata in 5-ASA e
sulfapiridina
Azioni
Puo’ inibire vie coinvolte nella sintesi di citochine proinfiammatorie mediate da NF-kB
Sulfapiridina sembra agire riducendo assorbimento di antigeni
in grado di promuovere infiammazione articolare
Effetti collaterali • Nausea, vomito, diarrea, dolore addominale
•
•
•
•
Anoressia
Discrasie emat. (agranulocitosi e trombocitopenia)
Rash
Oligospermia (reversibile; sconsigliata in soggetti
maschi che desiderino procreare)
Per AR necessari dos. elevati – dist. intestinali (si possono minimizzare
aum. gradualmente dosaggio e usando preparazioni gastroresistenti)
Antimalarici
Clorochina, idrossiclorochina (per AR prec. e lieve, con MTX)
L’azione di questi farmaci e’ legata alla riduzione della trasformazione e
della chemiotassi dei linfociti T
La loro natura leggermente basica ne permette l’ingresso e l’accumulo
all’interno dei lisosomi
Nei macrofagi, la processazione lisosomiale di proteine fagocitate dipende
da proteasi acide
Questi farmaci, aumentando il pH luminale lisosomiale, alterano la
processazione di antigeni peptidici, riducendo cosi’ la loro successiva
presentazione sulla membrana cellulare – ridotta interazione (e attivazione)
tra macrofagi e linfociti T
Questi farmaci possono ridurre la produzione di citochine infiammatorie,
hanno potere antiossidante e possono inibire PLA2
Antimalarici
Clorochina, idrossiclorochina (per AR prec. e lieve, con MTX)
L’azione di questi farmaci e’ legata alla riduzione della trasformazione e
della chemiotassi dei linfociti T
Farmacocinetica
Clorochina assorbita completamente per os
Ha un Vd elevato (si concentra nei tessuti che
contengono melanina – es. retina – e nella milza,
fegato, rene)
Metabolismo epatico (50% in metaboliti attivi) ed
eliminazione renale (50% immodificato)
Emivita lunga, tende a crescere nel trattamento
cronico (iniziale 6 giorni, seguita da lenta fase di
eliminazione dai tessuti con emivita > di 1 mese)
Antimalarici
Clorochina, idrossiclorochina (per AR prec. e lieve, con MTX)
L’azione di questi farmaci e’ legata alla riduzione della trasformazione e
della chemiotassi dei linfociti T
Effetti collaterali
Nausea, vomito, diarrea, dolore addominale
(possono essere causati da un’attivita’ anti-AChE
della clorochina)
Retinopatia (pigmentazione e difetti del campo
visivo; meno frequente con idroclorochina) – e.
collaterale piu’ significativo; controllare vista
periodicamente,
soprattutto
se
trattamento
continua per > 5 anni
Leflunomide
Inibisce la sintesi de novo del ribonucleotide
pirimidinico UMP – i linfociti attivati richiedono una
quantita’ di pirimidine 8 volte maggiore per la
proliferazione
Apporto inadeguato di UMP aumenta espressione di
p53 (oncosoppressore) che trasloca nel nucleo e
provoca arresto in fase G1
Descritte anche una
inibizione delle TKs e
una ridotta produzione di
citochine
proinfiammatorie
–
importanza minore
Cio’ diminuisce l’espansione clonale di linfociti
autoimmuni T e B attivati e determina la
soppressione di produzione di Ab e dei processi
immuni cellulo-mediati
Leflunomide
Farmacocinetic
a
Profarmaco, ben assorbito per os
Legame all’albumina >90%
Convertito
non-enzimaticamente
(mucosa
intestinale e plasma) nel suo metabolita attivo
(lunga emivita di 14-18 gg)
Escrezione renale e biliare (ricircolo enteroepatico)
Nota: sono necessarie dosi di carico a causa della
sua lunga emivita
Utilizzata da sola o in associazione
Leflunomide
Effetti indesiderati
Disturbi GI, specialmente diarrea e nausea Durante trattamento controllare
regolarmente
funzionalita’
Aumento pressione arteriosa
epatica e numero di cellule
Cefalea, vertigini, letargia
ematiche (soprattutto leucociti)
Rash cutanei
Leucopenia
Alopecia
Se effetti collaterali seri, l’eliminazione del farmaco puo’
essere favorita da colestiramina (lega metabolita attivo e
ne contrasta riassorbimento per circolo enteroepatico)
Alterazioni reversibili funzionalita’ epatica
Teratogeno: si raccomanda alla donna di evitare
concepimento
per
i
2
anni
successivi
all’interruzione del farmaco (all’uomo per 3 mesi)
Leflunomide
Effetti indesiderati
Disturbi GI, specialmente diarrea e nausea
Aumento pressione
arteriosa (come anche il MTX e gli agenti biologici) non
Leflunomide
Cefalea, vertigini,dovrebbe
letargia essere usata in pazienti con infezioni batteriche
attive, infezioni da herpes zoster attive, infezioni fungine
Rash cutanei potenzialmente letali
Leucopenia
Leflunomide (come anche il MTX) e’ controindicata in
Alopecia
pazienti con conta leucocitaria < 3000/mm3 o storia di
tumori
del sangueepatica
nei precedenti 5 anni
Alterazioni reversibili
funzionalita’
Teratogeno: si raccomanda alla donna di evitare
concepimento
per
i
2
anni
successivi
all’interruzione del farmaco (all’uomo per 3 mesi)
Leflunomide
Effetti indesiderati
Disturbi GI, specialmente diarrea e nausea
Aumento pressione arteriosa
Cefalea, vertigini, letargia
Rash cutanei
Leucopenia
Pazienti con malattie epatiche non dovrebbero ricevere
leflunomide (o sulfasalazina o MTX)
Alopecia
Alterazioni reversibili funzionalita’ epatica
Teratogeno: si raccomanda alla donna di evitare
concepimento
per
i
2
anni
successivi
all’interruzione del farmaco (all’uomo per 3 mesi)
Leflunomide (come MTX) non dovrebbe essere usata
in pazienti con infezione acute/croniche da HBV o HCV
MTX
O
OH
O
COOH
N
H
NH2
COOH
N
N
H2N
N
N
Acido folico folato
N
N
N
H
H2 N
N
N
COOH
N
H
N
CH3
COOH
MTX
Uno dei DMARD piu’ utilizzati, da solo o in associazione (per questa
indicazione, dosi sono molto piu’ basse di quelle necessarie per
chemioterapia antineoplastica; 7.5-25 mg/settimana p.o, s.c.; anche i.m.
se irritazione GI o ridotto assorbimento intestinale)
MTX
O
OH
O
COOH
N
H
NH2
COOH
N
N
H2N
N
N
Acido folico folato
N
N
N
H
H2 N
N
N
COOH
N
H
N
CH3
COOH
MTX
Uno dei DMARD piu’ utilizzati, da solo o in associazione (per questa
indicazione dosi sono molto piu’ basse di quelle necessarie per
chemioterapia antineoplastica; 7.5-25 mg/settimana p.o, s.c.; anche i.m.
se irritazione GI o ridotto assorbimento intestinale)
La combinazione di MTX e anti-TNFα ha un duplice vantaggio:
•Si raggiungono risultati clinici e radiologici migliori di monoterapia
•Si riduce l’immunogenicita’ degli anti-TNFα (specialmente Infliximab)
MTX
O
OH
O
COOH
N
H
NH2
COOH
N
N
H2N
N
N
Acido folico folato
N
N
N
H
H2 N
N
N
COOH
N
H
N
CH3
COOH
MTX
Uno dei DMARD piu’ utilizzati, da solo o in associazione (per questa
indicazione, dosi sono molto piu’ basse di quelle necessarie per
chemioterapia antineoplastica; 7.5-25 mg/settimana p.o, s.c.; anche i.m.
se irritazione GI o ridotto assorbimento intestinale)
La risposta al MTX avviene entro 3-6 settimane
Con la somministrazione cronica si possono presentare citopenie (in
particolare leucopenie), cirrosi epatica e sindrome acuta simile a
polmonite – contrastati da leucovorina
Raccomandati: monitoraggio periodico con ricerca di eventuali infezioni,
emocromo completo, test per gli enzimi epatici (sopr. Terapia cronica)
MTX
O
OH
O
COOH
N
H
NH2
COOH
N
N
H2N
N
N
Acido folico folato
N
N
N
H
H2 N
N
N
COOH
N
H
N
CH3
COOH
MTX
Uno dei DMARD piu’ utilizzati, da solo o in associazione (per questa
indicazione, dosi sono molto piu’ basse di quelle necessarie per
chemioterapia antineoplastica; 7.5-25 mg/settimana p.o, s.c.; anche i.m.
se irritazione GI o ridotto assorbimento intestinale)
La risposta al MTX avviene entro 3-6 settimane
In presenza di alterata funzionalità renale, MTX deve essere assunto con
estrema cautela e a dosaggio ridotto, perché una ridotta funzionalità
renale ne determina una ritardata eliminazione. Monitorare funzionalita’
renale prima e durante la terapia
MTX
O
OH
O
COOH
N
H
NH2
COOH
N
N
H2N
N
N
Acido folico folato
N
N
N
H
H2 N
N
N
COOH
N
H
N
CH3
COOH
MTX
PK
Una volta assorbito, MTX legato a proteine plasmatiche (albumina),
distribuzione in tutti I compartimenti corporei.
Derivati idrossilati di MTX hanno minore attivita’; emivita 6-9 ore (tuttavia,
MTX trasportato all’interno delle cellule via carrier dei folati ridotti, dove
viene trattenuto molto piu’ a lungo – cio’ consente somministrazione
settimanale) – derivati poliglutammati hanno emivita di 3-4 giorni
MTX eliminato prevalentemente per via urinaria (30% per via biliare) –
risultato di filtrazione glomerulare e secrezione tubulare attiva (attenzione
se uso agenti nefrotossici o inibitori secrezione)
MTX
Anche se il suo meccanismo d’azione principale e’ l’antagonismo dei
folati, la somministrazione di folato (per prevenire tox mucose orali e GI)
non ne riduce effetto immunosoppressore
Note:
AICAR:
5-Aminoimidazole-4carbossamide ribonucleotide
GAR: glicinamide ribonucleotide
PRPP: 5-fosforibosil-1-pirofosfato
MTX
Anche se il suo meccanismo d’azione principale e’ l’antagonismo dei
folati, la somministrazione di folato (per prevenire tox mucose orali e GI)
non ne riduce effetto immunosoppressore
Probabilmente coinvolto anche accumulo di adenosina (intermedio nella
biosintesi delle purine) – MTX inibisce deaminazione di adenosina e
promuove suo rilascio
MTX
Anche se il suo meccanismo d’azione principale e’ l’antagonismo dei
folati, la somministrazione di folato (per prevenire tox mucose orali e GI)
non ne riduce effetto immunosoppressore
Probabilmente coinvolto anche accumulo di adenosina (intermedio nella
biosintesi delle purine) – MTX inibisce deaminazione di adenosina e
promuove suo rilascio
Potente antinfiammatorio (riduce adesione dei neutrofili, produzione di
citochine, attivita’ macrofagica, espressione molecole di adesione)
Methotrexate (MTX)
Several potential mechanisms for MTX activity in RA have
been proposed. These include antiproliferative, antiinflammatory, and immunosuppressive effects.
MTX can affect these mechanisms through inhibiting
purine/pyrimidine synthesis or proinflammatory cytokine
production, promoting adenosine release or activated T cell
apototosis, suppressing lymphocyte proliferation, neutrophil
chemotaxis, or neutrophil adherence, and reducing serum Ig
levels
Methotrexate (MTX)
MTX
These effects occur mainly in the first 5 years of treatment and lead to drug
suspension in ~5% of rheumatologic patients
Before starting MTX therapy, any evidence of severe liver, lung, or kidney disease
must be determined, and patients with these diseases should be excluded
Clinical Therapeutics/Volume 36, Number 3, 2014
Tests Prior to Beginning Methotrexate
Complete blood cell count (CBC)
Hepatitis B and C virus serologic tests
Serum albumin and either an AST or ALT
Serum creatinine (estimate of creat clearance)
Chest radiograph
Pulmonary function tests in patients with
respiratory symptoms
MTX is contraindicated in patients with
excessive ETOH intake, or
hepatitis C or active hepatitis B, or
pregnancy or
significant lung disease.
Sali d’oro
Auranofin (s. per os giornaliera; effetti piu’ lenti), sodio aurotiosolfato (s. i.m.
profonda 1/settimana – standard per ~ 50 anni) – poco usati
Effetti benefici possono manifestarsi in 3-6 mesi
Azioni
Assorbiti da macrofagi, ne inibiscono funzioni fagocitiche
(ridotta liberazione di mediatori infiammatori e proliferazione di
altre cellule immunocompetenti); probabile inibizione NF-kB
Farmacocinetica
Si legano a albumina e proteine tissutali (accumulo
nel fegato, rene, midollo osseo, linfonodi, milza)
Accumulo anche nella sinovia infiammata
Eliminazione renale (in parte biliare)
Emivita di alcune settimane (a causa di accumulo)
Sali d’oro
Auranofin (s. per os giornaliera; effetti piu’ lenti), sodio aurotiosolfato (s. i.m.
profonda 1/settimana – standard per ~ 50 anni) – poco usati
Effetti benefici possono manifestarsi in 3-6 mesi
Effetti collaterali
Possono essere gravi e ogni sintomo di tossicita’
impone l’immediata interruzione della terapia
Ulcerazioni orali
Proteinuria da glomerulonefrite membranosa (puo’ comparire dopo alcune
settimane di terapia e, a volte, progredire in sindrome nefrotica; la
regressione puo’ richiedere fino a 2 anni da interruzione terapia)
Disturbi ematici (trombocitopenia, agranulocitosi e anemia aplastica)
Rash
Fibrosi polmonare
Diarrea (comune con formulazioni orali)
Sali d’oro
Auranofin (s. per os giornaliera; effetti piu’ lenti), sodio aurotiosolfato (s. i.m.
profonda 1/settimana – standard per ~ 50 anni) – poco usati
Effetti benefici possono manifestarsi in 3-6 mesi
Prevenzione e gestione degli effetti indesiderati
Costi elevati
Monitoraggio delle urine per diagnosticare eventuale proteinuria
Controllo ematocrito prima di ogni nuova iniezione (con regolarita’ in corso
di terapia orale)
Complicanze severe possono richiedere trattamento con dimercaprolo o
penicillamina (chelano oro e ne aumentano eliminazione)
I composti a base d’oro non devono essere utilizzati in pazienti con
anamnesi positiva di patologie renali o epatiche, discrasie ematiche o gravi
rash
Biologic Therapies: Targeting Cytokines
Biologic Therapies: Targeting Cytokines
B
IL-6, TNFα
T
APC
TNFα
α
-
-
MΦ
Cytokine
inhibitors
-
TNFα
α, IL-1, IL-6
OC
Articular
cartilage
1.
2.
3.
FLS
C
Production of metalloproteinases and other effector molecules
Migration of polymorphonuclear cells
Erosion of bone and cartilage
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
Agenti biologici non dovrebbero essere usati in pazienti con infezioni
batteriche attive, infezioni da herpes zoster attive, infezioni fungine
potenzialmente letali
Tutti i pazienti candidati per il trattamento con agenti biologici dovrebbero
essere esaminati (prima e, a cadenza annuale, dopo) per la tubercolosi
Anti TNF-alpha sono controindicati in pazienti con HBV, sclerosi multipla,
disordini demielinizzanti, insufficienza cardiaca congestizia
Tutti i pazienti in trattamento dovrebbero sottoporsi alla vaccinazione antiinfluenzale annuale, antipneumococco, anti HBV
Dovrebbero essere evitate vaccinazioni con virus vivi attenuati (es. per
varicella zoster, poliomelite, rabbia)
Biologici somministrati per via endovenosa possono dare reazioni da
infusione – lievi o potenzialmente letali
Anti TNF-alpha (forse) associati ad un aumento rischio di linfoma e altri
tumori
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
Fab region
Light chain
• Unique for each Ab
• Determines ligand
specificity
Heavy chain
Carbohydrate → effector functions
Fc region
• Identical for each Ab isotype
• Biological activity
• Pharmacokinetic properties
C1q binding site → CDC; lysis of target cell
FcRn binding site → transport across membranes
FcγγR binding site
CDRs, complementarity-determining regions
FcγγRs, Fc receptors for IgG
FcγγR receptor on
effector cells
→ ADCC; lysis or phagocytosis of target
cell
(cellule natural killer, monociti,
macrofagi, polimorfonucleati)
FcRns, neonatal Fc receptors for IgG
CDC, Complement-dependent cytotoxicity
ADCC, Antibody-dependent cell-mediated cytotoxicity
Hansel TT et al. (2010) Nat Revi Drug Disc 9:325-38
Tecniche avanzate di ingegneria genetica
(tecnologia degli ibridomi, tecniche di innesto, topi
transgenici, phage display technique) hanno
permesso la generazione di vari tipi di MAb
(anticorpi monoclonali)
La nomenclatura dei MAb riflette il tipo di MAb
MAb murini = omab/onab
(es. muromonab)
MAb chimerici = ximab
(es. infliximab, rituximab)
100% murine protein
25% murine protein
5-10% murine protein
no murine protein
MAb umanizzati = zumab
(es. tocilizumab)
MAb umani = mumab
(es. adalimumab, golimumab)
TNF Inhibitors
mAb or Fab’
Adalimumab
Certolizumab pegol
Golimumab
Infliximab
Soluble receptor
Etanercept
No signal
Choy and Panayi. N Engl J Med. 2001;344:907.
Anti-TNFα
α
In base a risultati ottenuti da vari trials clinici, tutti questi agenti hanno
mostrato efficacia nel ridurre segni clinici di infiammazione in pazienti con
RA dopo fallimento con DMARD; in alcuni casi anche remissione
Inibitori del TNF-alfa sono piu’ efficaci quando combinati con MTX – se
possibile, una precoce terapia associata a migliori risultati
La risposta clinica puo’ manifestarsi entro 2 settimane
Structure of Etanercept
Human TNF Receptors
Human Antibody
Etanercept - Mode of Action
sTNFR:Fc
Activated
macrophage
TNF
sTNFR:Fc
Target
cell
sT
NF
TNFR
R
Signal
Proprietà degli agenti anti-TNF-α
sTNF-α
α
mTNF-α
α
Ligandi
sTNF-α
α
mTNF-α
α
Certolizumab
Infliximab
Inibitor
pegol (Cimzia)
(Remicade)
i
Struttura e massa Frammento Fab PEGhilato di mAb chimerico
mAb umanizzato
150
molecolare (kDa)
∼95
sTNF-α
α
mTNF-α
α
sTNF-α
α
mTNF-α
α
sTNF-α
α
(mTNF-α
α)
TNF-β
β
Adalimumab
(Humira)
Golimumab
(Simponi)
Etanercept
(Enbrel)
mAb umano
(phage display)
150
mAb umano
Proteina di fusione
(in topo transgenico)
2 p75-Fc
150
150
∼14 giorni
8-10 giorni
10-20 giorni
14-20 giorni
4-6 giorni
Dose da carico
400 mg
poi 200 mg s.c.
ogni 2 settimane
3–5 mg/kg per
infusione e.v.
settimane 0, 2, 6;
poi ogni 8 sett.
40 mg s.c.
ogni 2
settimane
50 mg s.c.
1 volta al mese
25 mg s.c. 2
volte/settimana o 50
mg 1 volta/settimana
Potenza neutralizzante
per sTNF-α
α
+++
+++
+++
+++
+++
Legame a mTNF-α
α
+++
+++
+++
+++
+/-
-
+++
+++
+++
+++
? (presunto +++)
? (presunto +++)
++/++/-
∼8%
14-68%
1-87%
∼16%
0-18%
Emivita
plasmatica
Somministrazione
CDC
ADCC
Ab neutralizzanti antifarmaco in pazienti con AR
Toussirot E et al. (2007) Recent Pat Inflamm Allergy Drug Discov 1: 39-47
Taylor P.C. (2010) Curr Op Pharmacol 10:308–15; Shealy D et al. (2010) mAbs 2(4):428-39
Agenti anti-TNF-α
Alcune differenze nell’interazione con TNF-α
Etanercept lega il TNF-α
α solubile e la linfotossina-α
α
Tutti gli altri agenti legano sia il TNF-α
α solubile sia quello legato
alla membrana, ma non legano la linfotossina-α
Etanercept e certolizumab pegol legano solo una molecola di
TNF-α
α (monovalenti) ⇒ formazione di complessi monomerici
Tutti gli altri agenti sono bivalenti ⇒ formazione di complessi
polimerici → ↑ clearance (fagocitosi); ↑ immunogenicità; ↑ effetti
Fc-mediati
Infliximab
Adalimumab
Golimumab
s- or m-TNF-α
α
Etanercept
Complessi polimerici con sTNFα
(600-5000 kDa)
Certolizumab
Legame del TNF-α
αe
formazione di complessi
monomerici
Legame bivalente del TNF-α
αe
formazione di
immunocomplessi con mAbs
anti-TNF-α
α
Taylor P.C. (2010) Curr Op Pharmacol 10:308–15; Mewar D & Wilson AG (2011) Br J Pharmacol 162:785-91
Agenti anti-TNF-α
Alcune differenze in struttura ed effetti Fc-mediati
Tutti, eccetto certolizumab pegol, contengono la regione FcIgG1
→ Interazione del farmaco con i recettori Fcγγ sulle cellule effettrici
→ Citotossicità complemento-dipendente (CDC)
→ Citotossicità Ab-dipendente cellulo-mediata (ADCC)
Etanercept: CDC e ADCC (in vitro) < altri agenti;
Certolizumab pegol, essendo un frammento Fab, manca della
regione Fc e, quindi, non attiva CDC e ADCC
Inoltre, certolizumab è legato covalentemente ad una molecola di
glicole polietilenico (PEG; polimero idrosolubile, inerte)
Fab fragment
of a humanized
IgG1
40-kDa PEG
moiety
Conseguenze della peghilazione:
↑ Stabilità e solubilità
↑ Emivita plasmatica; ↓ clearance (↑ ingombro sterico; ↓ proteolisi)
↓ Attività biologica (mascheramento di determinanti antigenici)
↓ Immunogenicità (mascheramento di determinanti antigenici)
→ ↓ sviluppo di Ab neutralizzanti anti-farmaco
→ ↓ frequenza di somministrazione
Taylor P.C. (2010) Curr Op Pharmacol 10:308–15
Agenti anti-TNF-α
Alcune differenze in efficacia e sicurezza
Tutti dimostrano efficacia equivalente nella AR
Il 30% dei pazienti non risponde, ma i pazienti che non rispondono ad
un agente possono rispondere ad un altro
Rischio di riattivazione della TBC: etanercept < altri agenti
Immunogenicità: prevalenza di Ab neutralizzanti anti-farmaco in
pazienti con AR
Infliximab:
↑ clearance e ↓ efficacia
dosaggio o frequenza di somministrazione
avverse
necessità di ↑
↑ rischio di reazioni
Etanercept: gli Ab anti-etanercept non sono neutralizzanti e non
influenzano la risposta clinica al farmaco
Alessandri C et al. (2007) Ann N Y Acad Sci 1110: 319-29
Harding FA et al. (2010) mAbs 2:256-65
Mewar D & Wilson AG (2011) Br J Pharmacol 162:785-91
Anti-TNFα
α
Adalimumab
Anticorpo monoclonale umano
S. iniezione sottocutanea (40 mg) ogni 2 settimane – ogni settimana se
usato da solo (lunga emivita di 12 gg), degradato per proteolisi
Etanercept
Proteina di fusione, costituita da due porzioni
extracellulari solubili del recettore p75 per il TNF, fuse
con il dominio Fc delle IgG1 umane. Riconosce sia TNFa
che TNFβ (linfotossina α; non chiara la rilevanza clinica)
S. iniezione sottocutanea una (50 mg) o due (25 mg) volte a settimana
(assorbimento lento; emivita di 5 gg), degradato per proteolisi
Infliximab Anticorpo chimerico monoclonale composto dalla regione
variabile dell’anticorpo murino (TNFα), unito alla regione
costante di Ig umane. Non lega linfotossina α (TNFβ)
S. infusione endovenosa – 3 – 6 mg/Kg alla settimana 0, 2 e 6, poi ogni 2
mesi; in alcuni casi 10 mg/Kg al mese (emivita di 9 gg), eliminazione ?
Anti-TNFα
α
Golimumab
Anticorpo monoclonale umano
S. iniezione sottocutanea (50 mg) ogni mese in combinazione con MTX o
DMARD non biologici
Certolizumab pegol Bloccante PEGilato del TNFa contenente un
frammento Fab di un anticorpo umanizzato. Non
contiene porzione Fc (non attiva complemento
ne’ causa citotossicita’ cellulo-mediata)
S. iniezione sottocutanea (400 mg all’inizio, poi 200 mg ogni 2 settimane;
anche 400 mg/mese per mantenimento) in combinazione con MTX
Side Effects of TNF Inhibition
• Infusion Reactions with Infliximab, Injection Site
Reactions with Adalimumab and Etanercept
• Infection
– Tuberculosis
– Serious resulting in death
• Malignancy
– Increased risk of lymphoma – early data
– Solid tumors?
• Neurologic
– Multiple Sclerosis, seizures, inflammation of the ocular nerve
• Autoimmune
– Antibody formation – SLE like illness
• Worsening of Congestive Heart Failure
Cumulative incidence of tuberculosis (TB) following first exposure to anti-tumour necrosis
factor (anti-TNF) therapy (most recent drug model, with person-years censored at death, last
returned follow-up form, or date of switching to second anti-TNF).
Dixon W G et al. Ann Rheum Dis 2010;69:522-528
©2010 by BMJ Publishing Group Ltd and European League Against Rheumatism
TNF Antagonists: Contraindications
• Current active infection
• Chronic or recurrent infections
• History of TB
•
•
•
•
Congestive heart failure
Recent malignancy
Systemic lupus erythematosus
Multiple sclerosis, optic neuritis
Trends Mol Med. 2016 Mar;22(3):214-29.
Trends Mol Med. 2016 Mar;22(3):214-29.
Biologic Therapies: Targeting T Cells
Abatacept
IL-4
IL-6
IL-10
B
-
IL-6, TNFα,
IFNγ, IL-10, lymphotoxin
T
APC
IL-2
IFNγ
TNFα
α
IL-17
RANKL
Pannus
Articular
cartilage
MΦ
TNFα
α, IL-1, IL-6,
metalloproteinases
OC
1.
2.
3.
FLS
C
Production of metalloproteinases and other effector molecules
Migration of polymorphonuclear cells
Erosion of bone and cartilage
T-Cell Co-Stimulatory Blockade (Abatacept)
T-Cell Activation
• T-cell activation requires 2 signals:
• 1st signal: The antigen presented by the MHC
is recognized by the T-cell receptor
• 2nd signal: Co-stimulatory molecules CD80
and CD86 on APCs bind to CD28, an autoregulatory protein, on the T-cell surface
• T-cells have an intrinsic mechanism to
terminate T-cell activation, which regulates
immune activation
101
Regulating T-cell Activation
• T-cell regulation occurs via the Cytotoxic TLymphocyte Associated Antigen-4 (CTLA4) molecule
• CTLA-4 acts as a negative regulator of
CD28-mediated T-cell stimulation
• Antagonizes the CD80/CD86:CD28 binding
pathway by binding CD80/CD86
• Greater affinity for CD80/CD86 than CD28
• Leads to the down-regulation of T-cell
activation
102
T-Cell Activation
DC
DC
DC
MHC class II
Antigen
CD80/86
CTLA4
TCR
CD28
T
T
T
Activated
T cell
Downregulated
T cells
Abatacept
• Consists of the extracellular domain of CTLA-4 and a modified Fc
fragment of IgG1 to prevent antibody dependent cell-mediated
cytotoxicity
• Has a novel mechanism of action that mimics CTLA-4’s action
Targeting T Cells: Abatacept—a Human
Immunoglobulin Receptor Fusion Protein
Without Abatacept
With Abatacept
T
DC
T
DC
CD80/86 CD28
Activated
T cell
Abatacept
(CTLA4Ig)
Abatacept competes with CD28 to
bind to CD80/86, downregulating
T-cell activation
Reumatol Clin.2012;8:78-83
T-Cell Co-Stimulatory Blockade (Abatacept)
Abatacept (CTLA4-Ig) is a novel fusion protein with a mechanism of action that is
mechanistically distinct from other biologic DMARDs.
Abatacept consists of the extracellular domain of the CTLA4 molecule complexed
to the Fc domain of human IgG1.
The CTLA4 domain is similar to the naturally occurring protein and avidly
binds to CD80/CD86 on antigen-presenting cells.
The IgG1 domain functions to solubilize the molecule.
The putative mechanism of action of abatacept is based on its ability to block the
costimulatory signal required for activation of T cells. Absence of the second
costimulatory signal results in T-cell anergy, a state where T cells remain
functionally inactivated.
In contrast to the natural molecule CTLA4, abatacept does not bind to the
membrane of T cells.
Farmacocinetica
Dose raccomandata e’ basata su peso paziente,
somministrata per infusione endovenosa di 30
minuti (dopo la prima, ogni due settimane; dopo
la terza, ogni 4 settimane)
Effetti indesiderati
Aumento rischio infezioni delle vie aeree
superiori,
nasofaringite,
infezioni
urinarie,
cellulite, nausea
Cefalea
Indicato per pazienti adulti con AR moderata-severa che hanno risposto in
maniera inadeguata a DMARD come MTX o anti-TNFa
Puo’ essere usato da solo o in associazione con altri DMARD (non
raccomandati anti-TNF e anakinra a causa dell’aumento del rischio di
infezioni gravi)
Anakinra
Antagonista per il recettore umano della IL-1 ricombinante
Anakinra:
recombinant form of the naturally occurring IL-1 antagonist IL-1RA
Anakinra
Antagonista per il recettore umano della IL-1 ricombinante
Produce modesta riduzione dei segni e sintomi della AR di grado
moderato-severo in fase attiva nei pazienti adulti refrattari ad uno o piu’
DMARD
Puo’ essere utilizzato da solo o in associazione ad altri DMARD (non
raccomandati anti-TNF o abatacept)
Farmacocinetica
Iniezione s.c. (100 mg) giornaliera (se disfunzione
renale moderata, giorni alterni; non deve essere
usato in pazienti con compromissione renale
grave), emivita di 4-6 h, eliminazione renale
Effetti indesiderati Rezioni al sito di iniezione
Aumento rischio infezioni gravi, soprattutto in
soggetti asmatici
Neutropenia
Anakinra
Antagonista per il recettore umano della IL-1 ricombinante
A causa dei risultati inferiori degli anti-TNF e dello schema di
somministrazione, e’ usato poco per RA.
Maggiore successo come farmaco di nicchia per alcune rare (ma
devastanti) malattie caratterizzate da elevata produzione di IL-1
Cryopyrin associated periodic syndrome (CAPS) is the term for three syndromes that were
previously known under separate names: familial cold autoinflammatory syndrome, Muckle–
Wells syndrome and Neonatal-Onset Multisystem Inflammatory Disease (NOMID; aslo
known as CINCA). Each is linked to mutations in the NLRP3 inflammasome, which activates
caspase-1 and results in increased release of IL-1β
The CAPS phenotype can vary from discrete inflammatory episodes of fever, myalgia and
skin rash, lasting a few days, to almost continuous systemic inflammation with neurological
involvement, including aseptic meningitis, raised intracranial pressure, deafness and growth
retardation.
Seminars in Immunology 25 (2013) 469–484
Puo’ essere utilizzato nelle forme di gotta cronica recidivante per risolvere
attacchi subentranti e cronici
Anakinra
Quando [urato]p supera 0.25-0.4 mM, cristalli di MSU si
depositano nei tessuti formando tofi; il rilascio di cristalli di
urato da formazioni tofacee e il loro deposito nella
membrana sinoviale o cartilagine di un’articolazione causa
artite dolorosa (manifestazione clinica della gotta)
Se a. urico in eccesso, puo’ depositarsi anche a livello renale
– danneggiamento progressivo
Iperuricemia puo’ essere indotta da:
• Eccessiva produzione di a. urico da
esagerata distruzione cellulare (es. nei disturbi
mieloproliferativi o linfoproliferativi, specialmente in
corso di terapia antineoplastica)
Incremento della sintesi purinica (alterazioni ereditarie)
Elevata assunzione (es. carne)
Obesita’
A. urico e’ un prodotto, poco
solubile,
del catabolismo di
guanina e adenina
• Ridotta escrezione renale di a. urico (TP) – 80% dei casi
Insufficienza renale, farmaci (diuretici, ASA basse dosi,
lattato da abuso di alcol)
Model of the
inflammation.
role
of
IL-1
in
gouty
MSU crystals internalized by monocytes
activate the NALP3 inflammasome (Phase 1,
lower left). NALP3 protein activation leads to
the recruitment and activation of the adaptor
ASC and caspase-1 via PYD-PYD and CARDCARD homotypic interactions, resulting in the
processing and maturation of pro–IL-1 into its
biologically active form, IL-1 . IL-1 (mainly
acting on nonl eukocytic cell types, possibly
synoviocytes) will then activate the IL-1R
complex, leading to recruitment of MyD88 via
TIR-TIR homotypic interactions. This results in
the activation of NF-κB, which will turn on the
transcription
of
neutrophil-recruiting
chemokines, such as IL-8, S100, or
macrophage inflammatory protein 2 (MIP-2)
(Phase 2, lower right). ASC, apoptosisassociated speck-like protein containing a
CARD; CARD, caspase-recruitment domain;
DD, death domain; PYD, pyrin domain.
J Clin Invest. 2006;116(8):2073-2075.
A magic bullet for gout?
Multiple steps in the inflammatory cascade
initiated by monosodium urate (MSU) crystals.
(1) MSU crystals are detected by the pattern
recognition molecules of the innate immune
system, such as the Toll-like receptors. (2) MSU
crystals are phagocytosed by macrophages. (3)
Intracellular MSU crystals activate the NALP3
inflammasome,
a
multi-protein
complex
composed of the NALP3 sensor, the ASC
adaptor protein and the procaspase-1. This
induces cleavage of procaspase-1 to its active
form, caspase-1. Caspase-1 in turn cleaves
inactive pro-IL1 to generate IL1 . 4) Active
IL1 is then released into extracellular fluids
(synovial fluid, plasma…).
(5) IL1 activates IL1 receptors on the endothelium, resulting in signal transduction and gene activation. (6) An
array of proinflammatory cytokines and chemokines, including IL8, is secreted by endothelial cells, which
increase cell adhesion molecules on the endothelium. (7) Neutrophils are recruited leading to accumulation of
these cells within the joint. (8) Amplification of the inflammatory cascade by neutrophil release of more IL1
and other proinflammatory cytokines.
Ann Rheum Dis 2009;68:1517-1519
Iperuricemia e gotta
Il trattamento della gotta si basa su tre principali punti:
Terapia dell’attacco acuto
Profilassi delle ricadute
Terapia dell’iperuricemia
Iperuricemia e gotta
Il trattamento della gotta si basa su tre principali punti:
Terapia dell’attacco acuto
Profilassi delle ricadute
Terapia dell’iperuricemia
FANS (no ASA; es. naprossene 500 mg BID;
indometacina 50 mg TID), steroidi, colchicina
(spesso necessaria combinazione)
Come misure terapeutiche complementari
vanno considerate l’applicazione locale di
ghiaccio e l’immobilizzazione dell’articolazione
La risoluzione dell’attacco acuto e’ da preferire prima di iniziare terapia
ipouricemizzante
Nella scelta dei farmaci importante valutare presenza di comorbidita’
Iperuricemia e gotta
Iperuricemia e gotta
Il trattamento della gotta si basa su tre principali punti:
Terapia dell’attacco acuto
Profilassi delle ricadute
Terapia dell’iperuricemia
I FANS vanno somministrati alla dose piu’ alta e poi diminuiti in rapporto a
tollerabilita’, comorbidita’ e compliance.
Se FANS/colchicina controindicati o accessi gottosi resistenti, possibile
somministrare steroidi per os/via parenterale (nelle forme monoarticolari
anche l'infiltrazione intraarticolare di cortisonici in formulazione depot)
Gli effetti terapeutici dei cortisonici sono analoghi a quelli ottenuti con i FANS, ma le
riacutizzazioni dopo sospensione del trattamento sono più frequenti. Le dosi abitualmente
efficaci sono 25-50 mg di prednisone al giorno (o dosi equivalenti di altre molecole) per uno o
due giorni. Successivamente si riduce progressivamente il dosaggio fino a sospendere il
trattamento nell’arco di 7-10 giorni
Iperuricemia e gotta
Il trattamento della gotta si basa su tre principali punti:
Terapia dell’attacco acuto
Profilassi delle ricadute
Terapia dell’iperuricemia
Colchicina
Interferisce con vari processi della cascata infiammatoria (es: inibizione
reclutamento e azioni dei neutrofili nell’articolazione colpita da gotta,
inibizione rilascio TNFα da parte dei macrofagi, riduzione espressione
recettori per TNFα su macrofagi ed endotelio, inibizione rilascio sostanze
chemiotattiche LTB4 e IL-8)
Disorganizza microtubuli (riduzione adesione neutrofili, riduzione
fagocitosi cristalli di urato e/o liberazione di enzimi/radicali dannosi) – non
efficace in altre forme di artrite infiammatoria
Molto efficace se sommin. precocemente (dolore migliora entro 18 h; effetto max dopo 48 h) riservata di solito a soggetti intolleranti a FANS - basso indice terapeutico
Colchicina, effetti indesiderati:
Tossicita’ GI
Miopatia, neuropatia, tossicita’ midollare
Danni epatici e renali
Nature Reviews Rheumatology 10, 271–283 (2014)
Iperuricemia e gotta
Il trattamento della gotta si basa su tre principali punti:
Terapia dell’attacco acuto Abbassare uricemia a livelli < 6 mg/dl per
prevenire formazione di nuovi cristalli
Profilassi delle ricadute
Terapia dell’iperuricemia
Inibitori
xantina-ossidasi
(allopurinolo,
febuxostat), uricosurici (sulfinpirazone), uricasi
(rasburicase; uso riservato alle situazioni
emato-oncologiche)
L’intervento di asportazione dei tofi (depositi di cristalli di urato) solo in casi
selezionati, per effetti da compressione o infezioni
La terapia ipouricemizzante (promuovere dissoluzione e prevenire
formazione cristalli MSU) è indicata nei pazienti con attacchi acuti
ricorrenti, artropatia uratica cronica, depositi tofacei o alterazioni
radiografiche tipiche della gotta
Nella profilassi dell’attacco acuto nei primi mesi della terapia ipouricemizzante
possono essere utilizzati colchicina a basso dosaggio (0.5-1 mg/die) e/o FANS (con
gastroprotezione se indicata).
Nature Reviews Rheumatology 6, 30-38 (January 2010)
Iperuricemia e gotta
Il trattamento della gotta si basa su tre principali punti:
Terapia dell’attacco acuto
Profilassi delle ricadute
Terapia dell’iperuricemia
Nei casi resistenti alle terapie convenzionali, possibile utilizzare biologici
anti IL-1 come anakinra (100 mg/die s.c.) e canakinumab (Ab anti IL-1beta;
150 mg singola somministrazione)
Anti-Interleukin-1 Therapy in the Management of Gout
Anti-Interleukin-1 Therapy in the Management of Gout
http://www.ema.europa.eu/docs/en_GB/document_library/Public_statement/2012/10/WC500134461.pdf
The most common mechanisms of therapeutic anti-inflammatory action of gouty arthritis drugs. Colchicine,
NSAIDs, and glucocorticoids act on many different molecular targets; the mechanisms displayed herein are the
most likely targets for reduction of MSU crystal–induced inflammation when these drugs are administered at the
recommended therapeutic doses. Anti–IL-1, IL1-RA, and IL1-TRAP therapies act specifically to block IL-1
B-Cell Depletion
(Rituximab)
Rituximab is a mouse-human chimeric monoclonal antibody
that targets the CD20 B cell antigen.
Biologic Therapies: Targeting B Cells
Rituximab
-
IL-4
IL-6
IL-10
RF, anti-CCP
B
IL-6, TNFα,
IFNγ, IL-10, lymphotoxin
T
PC
APC
IL-2
IFNγ
TNFα
α
IL-17
RANKL
MΦ
TNFα
α, IL-1, IL-6,
metalloproteinases
Pannus
OC
FLS
Immune complexes
Complement fixation
Attract inflammatory
cell infiltrates
C
Articular 1. Production of metalloproteinases and other effector molecules
cartilage 2. Migration of polymorphonuclear cells
3.
Erosion of bone and cartilage
Targeting B Cells: Rituximab—
A Chimeric Anti-CD20 Monoclonal Antibody
Rituximab
Antibodies
CD20
Transiently depletes pre-B
and mature B cells only
Progenitor and plasma cells
are not affected
B
Antigen
Edwards and Cambridge. Rheumatology (Oxford). 2001;40:205; Edwards et al. N Engl J Med. 2004;350:2572;
Johnson and Glennie. Semin Oncol. 2003;30(suppl 2):3; Shanahan et al. Curr Opin Rheumatol. 2003;15:226;
Silverman and Weisman. Arthritis Rheum. 2003;48:1484.
Rituximab
Rituximab
CD20 is a cell-surface antigen that is not present on stem cells.
CD20 is lost before differentiation of B cells into plasma cells.
Rituximab results in a rapid and transient depletion of pre-B and mature B cells
only without affecting progenitor or plasma cells.
Several mechanisms have been proposed for the depletion of B cells by
rituximab:
Antibody-dependent cellular cytotoxicity (ADCC)
Complement-dependent cytotoxicity (CDC)
Induction of apoptosis
Complement-dependent
cytotoxicity
Rituximab
Indicato per l’uso in combinazione con MTX (se intolleranza anche da
solo) in pazienti adulti con RA moderata-severa che non hanno risposto in
maniera adeguata ad uno o piu’ anti-TNFα
Farmacocinetica
S. tramite due infusioni endovenose di 1000 mg a
distanza di 2 settimane una dall’altra
Per ridurre intensita’ di reazioni da infusione
(orticaria, ipotensione, angioedema) somm. 30
min prima metilprednisolone o equivalente
Effetti indesiderati Rezioni da infusione (trattare pazienti con
vasopressori, antistaminici e fluidi)
Se infusione deve essere ripresa, la sua velocita’
va ridotta del 50% dopo risoluzione completa dei
sintomi
In pazienti con patologie cardiovascolari, puo’
aggravare angina, aritmia, scompenso cardiaco
Rituximab
Indicato per l’uso in combinazione con MTX (se intolleranza anche da
solo) in pazienti adulti con RA moderata-severa che non hanno risposto in
maniera adeguata ad uno o piu’ anti-TNFα
Nota:
Pazienti sieronegativi per FR e ACPA sono meno responsivi a rituximab,
suggerendo che in questi casi la malattia proceda secondo meccanismi
non mediati da cellule B – differente terapia
Nota:
Prima di iniziare terapia, dovrebbe essere valutata la sieropositivita’ per
HBV e testata la funzionalita’ epatica
Tocilizumab
• Anticorpo monoclonale umanizzato
che neutralizza selettivamente sia la
forma di membrana (mIL-6R) che la
forma solubile (sIL-6R) di IL-6R,
abolendo in questo modo l’azione
biologica di IL-6
Tocilizumab
• Anticorpo monoclonale umanizzato
che neutralizza selettivamente sia la
forma di membrana (mIL-6R) che la
forma solubile (sIL-6R) di IL-6R,
abolendo in questo modo l’azione
biologica di IL-6
Tocilizumab
• Anticorpo monoclonale umanizzato
che neutralizza selettivamente sia la
forma di membrana (mIL-6R) che la
forma solubile (sIL-6R) di IL-6R,
abolendo in questo modo l’azione
biologica di IL-6
• In associazione con MTX e’ indicato
per trattamento AR attiva di grado
moderato/grave in pazienti adulti che
che
non
abbiano
risposto
adeguatamente o siano intolleranti a
DMARD o anti-TNF; anche in
monoterapia se intolleranza a MTX
• 8 mg/Kg per infusione endov. ogni 4
settimane (se paziente > 100 Kg, non
sono raccomandate dosi > 800 mg)
IL-6 e AR
IL-6 promuove reazioni della fase acuta:
Attivazione dei neutrofili, espressione molecole di adesione endoteliale, migrazione
leucociti, produzione proteine fase acuta a livello epatico (proteina C reattiva,
amiloide A sierica, ferritina etc.)
IL-6 guida il passaggio dalla risposta immunitaria innata verso quella acquisita,
inducendo differenziazione e inibendo apoptosi dei linfociti B e T
IL-6 blocca differenziazione dei linfociti T reg (antinfiammatori) e seleziona linfociti
Th17 (particolarmente autoaggressivi)
IL-6 induce neoangiogenesi, differenziazione e attivazione osteoclasti
IL-6 aumenta sensibilita’ fibre nocicettive
Eccesso di IL-6 e’ causa maggiore dell’anemia in corso di AR – riduzione ferro per
eritropoiesi perche’ IL-6:
•Aumenta produzione di epcidina (blocca il riassorbimento del ferro intestinale)
•Aumenta produzione
reticoloendoteliale)
di
ferritina
(dispersione
del
ferro
nel
sistema
Tocilizumab: meccanismo d’azione
Tocilizumab: valutazione clinica
pretrattamento
Anamnesi di infezioni severe, croniche o ricorrenti
Anamnesi di tubercolosi personale e familiare
Anamnesi di neoplasie maligne
Anamnesi di diverticolite
Anamnesi di epatopatia
Anamnesi di sclerosi multipla e altre malattie demielinizzanti
Anamnesi di fattori di rischio e malattie cardiovascolari
Gravidanza presunta o in atto
Tra le indagini preliminari consigliate ricordiamo: esami generali (es. emocromo,
VES, PCR, AST, ALT, creatinina, esame urine), esami metabolici (es. colesterolo
totale, HDL, LDL, TG, glicemia), esami immunologici (RA, anti-citrullina), radiografia
torace, test tubercolina, sierologie per HBV, HCV, HIV
Tocilizumab: valutazione clinica
pretrattamento
Anamnesi di infezioni severe, croniche o ricorrenti
Anamnesi di tubercolosi personale e familiare
Nota: se infezione batterica,
tocilizumab va sospeso e
intrapresa terapia antibiotica
Vaccini inattivi
vanno
somministrati 2 settimane prima e quelli attenuati
Anamnesi
di neoplasie
maligne
almento 4 settimane prima di iniziare terapia con tocilizumab
Anamnesi di diverticolite
Si raccomanda vaccinazione per pneumococco, HBV e influenza
Anamnesi
di epatopatia
Considerare
l’eventuale necessita’ di una profilassi antitubercolare o
antivirale; se sospetta TBC latente o infezione HBV senza epatite attiva,
iniziare terapia appropriata 4 settimane prima di tocilizumab
Anamnesi di sclerosi multipla e altre malattie demielinizzanti
Anamnesi
di fattori
di rischio
e malattie
In caso di
epatite
B attiva,
uso dicardiovascolari
antivirali specifici fino all’annullamento
degli indici di replicazione virale prima di iniziare tocilizumab (continuare
terapia antivirale anche durante tocilizumab e 6 medi oltre la sua
sospensione)
Gravidanza presunta o in atto
In pazienti con HIV terapia con tocilizumab e’ ragionevole se malattia virale
e’ ben controllata
Tocilizumab: valutazione clinica
pretrattamento
Anamnesi di infezioni severe, croniche o ricorrenti
Anamnesi di tubercolosi personale e familiare
Anamnesi di neoplasie maligne
Anamnesi di diverticolite
Anamnesi di epatopatia
Valutare rapporto rischi/benefici perche’ diverticolite e’ una (rara)
complicanza infettiva riscontrata durante terapia con tocilizumab
Anamnesi di sclerosi multipla e altre malattie demielinizzanti
Rischio perforazioni da tocilizumab aumentato in caso di concomitante
uso di corticosteroidi o FANS
Anamnesi di fattori di rischio e malattie cardiovascolari
Gravidanza presunta o in atto
Somministrare consenso informato al paziente
Tocilizumab: valutazione clinica
pretrattamento
Anamnesi di infezioni severe, croniche o ricorrenti
Anamnesi di tubercolosi personale e familiare
Anamnesi di neoplasie maligne
Anamnesi di diverticolite
Anamnesi di epatopatia
Pazienti
con multipla
epatopatie
valutare con epatologo la
Anamnesi
di sclerosi
e altre preesistenti,
malattie demielinizzanti
necessita’ di intraprendere terapia con tocilizumab; controlli vanno
Anamnesi
di fattori
e malattie
eseguiti
ognidi2 rischio
settimane
per i cardiovascolari
primi 3 mesi di terapia, dopo ad intervalli
non superiori ai 3 mesi
Gravidanza presunta o in atto
Tocilizumab: valutazione clinica
pretrattamento
Anamnesi di infezioni severe, croniche o ricorrenti
Anamnesi di tubercolosi personale e familiare
Anamnesi di neoplasie maligne
Tocilizumab non ha causato un aumento di incidenza di eventi
cardiovascolari
Anamnesi
di diverticolite seri: ciononostante, si consiglia di sospendere
tocilizumab nelle fasi acute di infarto miocardico (anche dell’ictus
ischemico)
fino a stabilizzazione parametri cardiovascolari
Anamnesi
di epatopatia
Anamnesi
di sclerosi
multipla regolare
e altre malattie
demielinizzanti
Consigliato
follow-up
con un
cardiologo
Anamnesi di fattori di rischio e malattie cardiovascolari
Gravidanza presunta o in atto
Tocilizumab: valutazione clinica
pretrattamento
Anamnesi di infezioni severe, croniche o ricorrenti
Anamnesi di tubercolosi personale e familiare
Anamnesi di neoplasie maligne
Anamnesi di diverticolite
Anamnesi di epatopatia
Anamnesi di sclerosi multipla e altre malattie demielinizzanti
Anamnesi di fattori di rischio e malattie cardiovascolari
Gravidanza presunta o in atto
Terapica con tocilizumab non deve essere intrapresa
Consigliata contraccezione durante terapia con tocilizumab, da
estendere a 3 mesi dopo fine trattamento
Tocilizumab: reazioni avverse
Infezioni
• In linea con le raccomandazioni stilate per altri biologici e
per i DMARD, le seguenti strategie sono raccomandate
per minimizzare il rischio di infezioni nei pazienti che
ricevono tocilizumab
• Il trattamento non dovrebbe essere iniziato in pazienti con infezione attiva
• Il trattamento dovrebbe essere interrotto in pazienti che sviluppano infezioni
gravi fino ad adeguato controllo
• I pazienti devono essere sottoposti a screening per tubercolosi latente prima e
durante terapia: in caso di positivita’ profilassi con isoniazide o altro
antitubercolare
• I vaccini con virus vivi attenuati non dovrebbero essere somministrati in
concomitanza della terapia con toclizumab
Tocilizumab: reazioni avverse
Complicanze della diverticolite
• Negli studi randomizzati e controllati, le complicanze
della diverticolite sono state la peritonite purulenta, le
perforazioni del basso intestino, le fistole e gli ascessi.
• Toclizumab da usare con cautela in pazienti con pregressa anamnesi positiva
per ulcerazioni e perforazioni intestinali
Tocilizumab: reazioni avverse
Forme maligne
• I pazienti con AR possono presentare un più alto rischio
di sviluppare forme neoplastiche, come il linfoma e il
carcinoma polmonare, rispetto alla popolazione
generale.
• Al momento tuttavia i dati clinici sono insufficienti e
sicuramente non possono considerarsi conclusivi per la
valutazione dell’uso del tocilizumab sull’incidenza di
patologie neoplastiche
Tocilizumab: reazioni avverse
Reazioni da infusione
• La struttura dove viene somministrata terapia e.v. di
tocilizumab deve disporre di farmaci per intervento
immediato
• Reazioni acute:
Eventi avversi associati a infusione (es. ipertensione arteriosa) o riscontrati
nelle 24 ore successive (es. cefalea, rash, orticaria)
Uso di corticosteroidi consente di prevenire fase tardiva delle reazioni
allergiche
• Nel caso di reazione all’infusione lieve, quando sintomatologia si e’ risolta
completamente e’ possibile riprendere l’infusione a velocita’ ridotta (50%) e poi
aumentarla con accurato monitoraggio parametri vitali
• I pazienti con reazioni severe devono sospendere terapia
Figure 1 A schematic showing simplified pathophysiologic pathways in RA and
their main clinical consequences
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
Figure 2 A schematic showing simplified pathophysiologic pathways in RA, and where
these processes can be interfered with by currently available biologic agents
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
Table 1 The current armamentarium of DMARDs
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
Table 2 The current armamentarium of biologic agents
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
van Vollenhoven, R. F. (2009) Treatment of rheumatoid arthritis: state of the art 2009
Nat. Rev. Rheumatol. doi:10.1038/nrrheum.2009.182
The endocannabinoid system (ECS) and
its therapeutic implications in RA
Increasing evidence suggests that ECS, especially cannabinoid receptor 2 (CB2), has an
important role in the pathophysiology of RA. Many members of the ECS are reported to inhibit
synovial inflammation, hyperplasia, and cartilage destruction in RA
In particular, specific activation of CB2 may relieve
RA by inhibiting not only the production of
autoantibodies, proinflammatory cytokines, and
metalloproteinases (MMPs), but also bone erosion,
immune response mediated by T cells, and the
proliferation of fibroblastlike synoviocytes (FLSs).
However, the development of cannabinoid systembased drugs still requires further investigation […]
Clearly, a final conclusion requires more than just
cellular and animal studies. […] the ECS mainly
exerts negative regulation in the processes of
inflammation and immune responses in RA. Thus,
long-term use of drugs of this class may lead to
other adverse effects (eg, decreased resistance to
infection, inhibition of marrow and blood, and
increased possibility of malignancies), which will
need more attention and clarification.
International Immunopharmacology 26 (2015) 86–91
The endocannabinoid system (ECS) and
its therapeutic implications in RA
International Immunopharmacology 26 (2015) 86–91
Janus Kinase (JAK) Inhibitors:
Jakinibs
• New molecular approach to treating RA
• Inhibit the activity of the janus kinase (JAK)
family to down regulate inflammatory
reactions
• JAK inhibitors include:
• Tofacitinib
• Decernotinib
• Baricitinib
Tofacitinib: Inhibiting JAKDependent STAT Pathways
161
JAK Family
• Tyrosine kinase proteins
• Family includes:
•
•
•
•
JAK1
JAK2
JAK3 (leukocyte-specific)
TYK2
• Plays an important role in mediating the
intracellular signal transduction of cytokines
JAK Proteins
• Acting in pairs, JAK proteins facilitate the
phosphorylation of intracellular proteins
• Phosphorylation of the signal transducer and
activator of transcription (STAT) leads to altered
gene transcription
• STAT controls autoimmune and inflammatory
responses
Tofacitinib
• Small, non-biologic DMARD with demonstrated
efficacy in treating RA
• Interferes preferentially with the signalling
pathways of JAK1 and JAK3
• Affects the activity of human DCs by decreasing
CD80/CD86 expression and T cell stimulatory
cabability through suppression of type I IFN
signaling
• Inhibition leads to anti-inflammatory and
immunosuppressive effects Koenders & van den Berg, 2015
Tofacitinib: clinical data
• Tofacitinib showed comparable efficacy to TNF
inhibitor treatment in RA patients who were also
using MTX
• Tofacitinib + MTX was also an effective
treatment for patients who were not responsive
to TNF inhibitors
• Tofacitinib has even been suggested as new
first-line monotherapy, having superior efficacy
over MTX in the treatment of RA
Koenders & van den Berg, 2015
Tofacitinib
However, tofacitinib was not approved by European regulatory
agencies in 2013 because its overall safety profile:
Increased risk of serious infections, malignancy, and lymphoma
Increase in both LDL and HDL
Reductions in neutrophil counts
However, these side effects are not unique to JAK inhibitors
New safety data claim that the overall risk of infections and
mortality rate in RA patients treated with tofacitinib or with
biologic agents are similar
Koenders & van den Berg, 2015
Successes and failures of chemokine-pathway
targeting in rheumatoid arthritis
Chemokines and chemokine receptors are involved in leukocyte recruitment and
angiogenesis underlying the pathogenesis of rheumatoid arthritis (RA) and other
inflammatory rheumatic diseases. Numerous chemokines, along with both
conventional and atypical cell-surface chemokine receptors, are found in inflamed
synovia. Preclinical studies carried out in animal models of arthritis involving agents
targeting chemokines and chemokine receptors have yielded promising results.
However, most human trials of treatment of RA with antibodies and synthetic
compounds targeting chemokine signalling have failed to show clinical
improvements. Chemokines can have overlapping actions, and their activities can be
altered by chemical modification or proteolytic degradation. Effective targeting of
chemokine pathways must take acount of these properties, and can also require
high levels of receptor occupancy by therapeutic agents to prevent signalling. CCR1
is a promising target for chemokine-receptor blockade.
Nature Reviews Rheumatology 12, 5–13 (2016)
Successes and failures of chemokine-pathway
targeting in rheumatoid arthritis
Chemokines (chemotactic cytokynes) are small (8-10 kDa) signalling proteins that
can be classified according to the location of cysteine (C) residues near the N
terminus of the primary sequence. These residues form intramolecular disulfide
bridge with other C residues.
XC-chemokines contain a single N-terminal cysteine
CC-chemockines have two adjacent residues
CXC-chemokines have two cysteines separated by one other amino acid
CX3C-chemokines have three amino acids between the C residues
Many chemokines also have nonsystematic names that are often still in use
Chemokines receptors are proteins with seven transmembrane domains, generally
coupled to G proteins and expressed on the surface of target cells
“conventional” receptors: mediate cell migration
“atypical” receptors: influence chemokine bioavailability
Nature Reviews Rheumatology 12, 5–13 (2016)
Successes and failures of chemokine-pathway
targeting in rheumatoid arthritis
Nature Reviews Rheumatology 12, 5–13 (2016)
Successes and failures of chemokine-pathway
targeting in rheumatoid arthritis
Nature Reviews Rheumatology 12, 5–13 (2016)
Successes and failures of chemokine-pathway
targeting in rheumatoid arthritis
Nature Reviews Rheumatology 12, 5–13 (2016)
Summary
Summary of RA Treatment
• RA is an auto-immune disease with upstream mechanisms of activated
macrophages, activated B cells and activated T cells; resulting in
downstream cytokine production and destruction signaling pathways.
• Activated macrophages secrete (downstream) inflammatory cytokines
TNF-α, and IL-6 and IL-1.
• TNF-α inhibitors etanercept, infliximab, adalimumab
• IL-6 receptor antagonist tocilizumab
• IL-1 receptor antagonist anakinra
• Activated B cells contribute to inflammation and destruction by
producing autoantibodies (RF) and cytokine IL-6
• Bind to CD20 antigen on B Cell and depletes B cells rituximab
• Activated (CD4+) T cells activate macrophages and B cells
• Upstream regulation of T Cell activation pathway abatacept
• Downstream signaling pathways (RANK, MMPs)
• JAK inhibitors to down regulate inflammatory responses
tofacitinib
Trends Mol Med. 2016 Mar;22(3):214-29.
anti-Rank Ligand antibody- Denosumab
Recent studies have demonstrated that osteoclasts, the primary cells responsible for
bone resorption, are mainly involved in bone and joint destruction in rheumatoid
arthritis (RA) patients.
Recent progress in bone cell biology has revealed the molecular mechanism of
osteoclast differentiation and bone resorption by mature osteoclasts.
Anti-RANKL therapy in combination with the anti-inflammatory therapy is a promising
strategy for RA treatment, and safe and effective therapies against RA may be
expected in the near future
World J Orthop. 2013 January 18; 4(1): 1-6.
anti-Rank Ligand antibody- Denosumab
1.
Denosumab treatment effects on structural damage, bone mineral density, and
bone turnover in rheumatoid arthritis: a twelve-month, multicenter, randomized,
double-blind, placebo-controlled, phase II clinical trial.
Cohen SB, Dore RK, Lane NE, Ory PA, Peterfy CG, Sharp JT, van der Heijde D,
Zhou L, Tsuji W, Newmark R; Denosumab Rheumatoid Arthritis Study Group.
Arthritis Rheum. 2008 May;58(5):1299-309.
2.
Denosumab prevents metacarpal shaft cortical bone loss in patients with erosive
rheumatoid arthritis.
Sharp JT, Tsuji W, Ory P, Harper-Barek C, Wang H, Newmark R.
Arthritis Care Res (Hoboken). 2010 Apr;62(4):537-44.
3.
Denosumab-mediated increase in hand bone mineral density associated with
decreased progression of bone erosion in rheumatoid arthritis patients.
Deodhar A, Dore RK, Mandel D, Schechtman J, Shergy W, Trapp R, Ory PA,
Peterfy CG, Fuerst T, Wang H, Zhou L, Tsuji W, Newmark R.
Arthritis Care Res (Hoboken). 2010 Apr;62(4):569-74
Components of the
RANKL/RANK/OPG Pathway
RANK Ligand (RANKL)
Protein expressed by osteoblasts/bone lining cells
Binds to RANK and activation of RANK promotes
osteoclast formation, function, and survival
RANK
Expressed by osteoclasts and their precursors
Activated by RANKL binding
Osteoprotegerin (OPG)
Protein secreted by osteoblasts/bone lining cells
Natural inhibitor of RANKL
Blocks RANKL-mediated activation of RANK to
balance bone remodeling
Kostenuik PJ. Curr Opin Pharmacol. 2005;5:618-625.
Boyle WJ, et al. Nature. 2003;423:337-342.
Kostenuik PJ, et al. Curr Pharm Des. 2001;7:613-635.
RANKL in the Regulation of
Osteoclast Activity
RANKL expression is increased
by:
PTH
Cytokines (TNF- , IL-1, IL-11)
Glucocorticoids
RANKL expression is decreased
by:
Estrogen
Cytokines (TGF- , IL-4)
Osteoblasts
TNF- =tumor necrosis factor-alpha; PTH=parathyroid hormone;
IL-1, IL-11, IL-4=interleukins-1, -11, and -4; TGF- =transforming growth factor beta.
Adapted from: Boyle WJ, et al. Nature. 2003;423:337-342.
Kostenuik PJ. Curr Opin Pharmacol. 2005;5:618-625.
Hofbauer LC and Schoppet M. JAMA. 2004;292:490-495.
Osteoclast
Precursors
Differentiated
Osteoclast
Activated
Osteoclast
RANKL in the Regulation of
Osteoclast Activity
Estrogen limits the expression of RANKL
Increased RANKL in postmenopausal women
leads to excessive bone resorption