70
Parte Seconda - Conoscenze teoriche
monomeri ad entrambe le estremità, ma l’estremità (+) si allunga con una velocità
da 5 a 10 volte maggiore dell’estremità (–). I microfilamenti formano un reticolo che
conferisce supporto strutturale all’intera cellula, determinandone anche la forma e,
inoltre, permettono il movimento delle cellule che così possono migrare, inglobare
particelle e dividersi. All’interno delle cellule eucariotiche esistono diverse proteine
che legano l’actina e regolano l’assemblaggio e il disassemblaggio dei microfilamenti. Tali proteine possono agire sia legando e sequestrando monomeri di actina, al
fine di impedire la loro incorporazione nei microfilamenti, sia legandosi alle estremità dei microfilamenti, bloccandone l’ulteriore allungamento. Tra le proteine che
legano l’actina ricordiamo la timosina E4, la profilina, l’ADF/cofilina, la proteina
cappuccio (capZ) e la gelsolina. Nelle cellule i microfilamenti entrano a far parte di
diverse strutture, quali i microvilli, proiezioni della membrana plasmatica tipiche
delle cellule che costituiscono la mucosa intestinale. Essi sono formati da fasci di circa 20-30 filamenti di actina allineati in parallelo e con le estremità (+) adiacenti alla
membrana plasmatica. Le proteine che regolano la formazione dei microvilli sono la
fimbrina e la villina. Un’altra struttura formata da microfilamenti è l’anello contrattile, il quale divide le due cellule figlie alla fine della mitosi. Esso contiene la proteina
D-actinina che permette ai microfilamenti di essere più distanziati e di interagire con
altre proteine. Infine, ricordiamo i reticoli tridimensionali lassi, disposti al di sotto
della membrana plasmatica, che permettono di sostenere la superficie cellulare. In
essi i microfilamenti sono disposti perpendicolarmente tra di loro, formando legami
crociati. Contengono la proteina filamina.
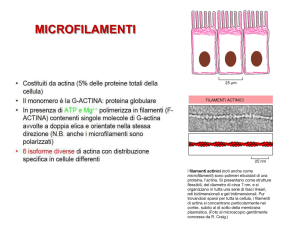
I microfilamenti sono responsabili di molti tipi di movimenti cellulari fra i quali ricordiamo la contrazione muscolare e la locomozione cellulare. La contrazione
muscolare è una specializzazione strutturale e funzionale della cellula muscolare e si
basa sull’interazione fra i filamenti di actina e di miosina. Si conoscono almeno 18
classi di miosine; la miosina di tipo II, presente nel muscolo, è una proteina composta da 4 catene leggere e 2 catene pesanti, queste ultime caratterizzate da una testa
globulare, una regione cerniera e da una lunga coda bastoncellare. La testa globulare
lega l’actina e idrolizza l’ATP, che fornisce l’energia per scivolamento del filamento
di actina. La locomozione cellulare è impiegata da diversi tipi di cellule, come le
amebe, le cellule embrionali, i globuli bianchi e le cellule cancerose; è permessa
dalla formazione di strutture transitorie come pseudopodi, lamellipodi e filopodi. La
formazione e la retrazione di queste strutture si basa sull’assemblaggio e disassemblaggio di filamenti di actina.
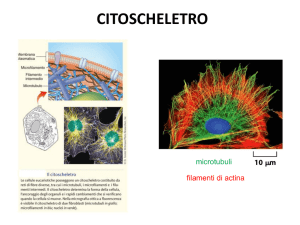
Il secondo tipo di filamenti proteici che fanno parte del citoscheletro è rappresentato dai filamenti intermedi, che hanno un diametro di circa 10 nm e fungono
da supporto per l’intero complesso citoscheletrico essendo le strutture più stabili e meno solubili del citoscheletro. Sono stati classificati oltre 50 tipi di diverse
proteine dei filamenti intermedi con caratteristiche comuni, ma che differiscono
per dimensioni e proprietà chimiche. Tutte queste proteine contengono un dominio centrale a bastoncello, costituito da circa 310-318 aminoacidi, conservato
in dimensioni e sequenza, fiancheggiato da domini amino- e carbossi-terminali,
che variano nelle diverse proteine, per dimensioni, sequenza e struttura secondaria.
Le estremità determinano la specificità delle diverse proteine, mentre il dominio