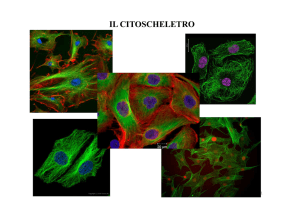
Capitolo 3 - Citologia e istologia
71
centrale è importante per l’assemblaggio dei filamenti. La struttura di base dei filamenti intermedi consiste di due polipeptidi avvolti tra loro con una struttura coiled-coil. I domini centrali dei due polipeptidi presentano una struttura ad D-elica e
sono allineati, mentre i domini N- e C-terminale formano delle strutture globulari
alle due estremità. Durante l’assemblaggio dei filamenti intermedi, i due dimeri si
associano lateralmente, ma in modo antiparallelo sfalsato, a formare un tetramero
che prende il nome di protofilamento. A loro volta, i protofilamenti interagiscono
fra di loro associandosi per sovrapposizione sia laterale che longitudinale a costituire una struttura filamentosa. Il filamento intermedio completamente assemblato
è costituito da 8 protofilamenti connessi coda-coda. I filamenti intermedi possono essere raggruppati in 6 diverse classi. Le cheratine costituiscono le prime due
classi, ciascuna comprendente circa 15 proteine diverse, formano i tonofilamenti
caratteristici delle cellule epiteliali e sono coinvolte nella produzione di strutture
come capelli, unghie e corna. La classe III comprende la vimentina e la desmina.
La classe IV è formata dai neurofilamenti tipici dei neuroni. La classe V è costituita dalle lamìne nucleari. La nestina, proteina presente nelle cellule staminali del
sistema nervoso centrale, costituisce la classe VI. Così come per i microfilamenti,
esistono diverse proteine associate ai filamenti intermedi. Tra di esse ricordiamo la
filaggrina, la paranemina e la sinemina che hanno la funzione principale di interconnettere i singoli filamenti, oltre che inibirne l’ulteriore polimerizzazione. Inoltre, l’interazione meccanica di filamenti intermedi, microfilamenti e microtubuli è
resa possibile da specifiche proteine di connessione che contengono siti di legami
per tutte e tre le componenti del citoscheletro. Tali proteine sono dette plachine e
tra di esse troviamo la plectina.
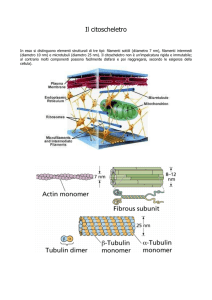
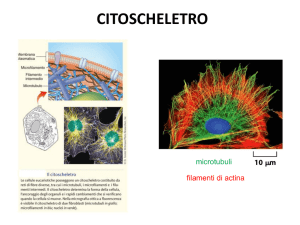
L’ultima classe di strutture appartenenti al citoscheletro è costituita dai microtubuli, cilindri con un diametro di circa 25 nm e lunghezza variabile (200 nm fino ad
alcuni µm). La loro parete è formata da proteine globulari disposte in file longitudinali, dette protofilamenti, allineate parallelamente all’asse longitudinale del tubulo.
Un microtubulo è formato generalmente da 13 protofilamenti accostati fianco a
fianco intorno ad una cavità centrale detta lume. L’unità di base di un protofilamento
è un eterodimero di D- e E-tubulina largo circa 4 nm e lungo 8 nm. Gli eterodimeri
si allineano testa-coda, longitudinalmente al microtubulo. Le molecole di tubulina
sono formate da 3 domini: uno amino-terminale che lega il GTP, uno centrale e uno
carbossi-terminale che interagisce con le proteine che legano i microtubuli (MAP,
Microtubule Associated Proteins).
Le MAP svolgono un ruolo importante nello stabilire la distribuzione e la struttura del reticolo endoplasmatico nella formazione del complesso di Golgi, nel movimento dei lisosomi e dei granuli di secrezione e nell’internalizzazione delle vescicole
della membrana cellulare.
La polimerizzazione dei microtubuli avviene a 37°C, in presenza di dimeri di
tubulina, GTP, ioni Mg2+ e in assenza di ioni Ca2+. Una tappa critica nella formazione dei microtubuli è la nucleazione, cioè l’aggregazione dei dimeri di tubulina in
gruppi detti oligomeri. Successivamente, vengono aggiunte subunità ad un’estremità, processo definito allungamento. L’estremità (+) è quella ad accrescimento rapido,
mentre quella (–) ad accrescimento lento. I microtubuli sono importanti in quanto





![[ XI ] INDICE GENERALE Riconoscimento e interazioni tra cellule](http://s1.studylibit.com/store/data/001175494_1-9062ea75af318561914dbe68aa0e27ca-300x300.png)