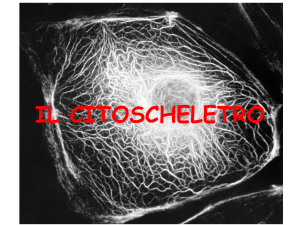
Il CITOSCHELETRO
Principi di Citologia e Istologia. Prof. Pucci, 2003
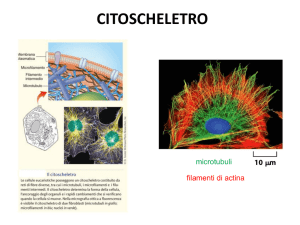
Il CITOSCHELETRO
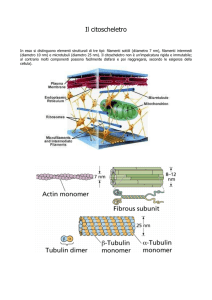
Microtubuli, Microfilamenti, Filamenti Intermedi
E’ formato da una complessa rete di filamenti proteici di diversa natura, che si
estendono lungo tutto il citoplasma. Al citoscheletro fu inizialmente attribuita la
funzione di “scheletro” cellulare; oggi gli si riconoscono una serie di funzioni
addizionali, come sintetizzato nello schema.
Partecipazione alla
regolazione
di attività cellulari
Mantenimento della
forma cellulare
FUNZIONI:
Ancoraggio di organelli
e altre strutture cellulari
Movimento di organuli
Motilità cellulare
endo- ed eso-citosi
Forza tensile
Polarità
cellulare
Movimenti
cromosomici
I tre tipi di filamenti e la loro localizzazione nella cellula epiteliale
8-10 nm
Filamenti intermedi
25 nm
Microtubuli
7 nm
Filamenti di Actina
MICROTUBULI
Diametro
MICROFILAMENTI FILAMENTI
INTERMEDI
25 nm
7 nm
10 nm
Apparenza
Tubuli cavi
composti da
13 protofilamenti
Filamenti
elicoidali
Filamenti a cordoni
composti da
8 protofilamenti
Componente
monomerico
tubulina
dimero globulare
(alfa e beta)
actina
globulare
monomero
I: keratine
II: vimentina
desmina
GFAPs
III: neurofilamenti
IV: lamine nucleari
50 kDa
43 kDa
40 - 130 kDa
GTP
(due per Dimero)
ATP (1:1)
Nessuno
MW
Nucleotide
di legame
I microfilamenti di actina
Le actine sono proteine globulari di circa 43 kDa, altamente conservate,
coinvolte nella motilità di cellule muscolari e non muscolari.
Esistono tre isoforme principali di actina:
alfa: presente nel tessuto muscolare
beta:citoplasmatica
gamma:più rara
L’actina monomerica si definisce G-actina, la forma polimerica f-actina
monomeri
dimeri
trimeri
Polimero a doppio avvolgimento
Micrografia elettronica di actina
polimermerizzata “in vitro”
La polimerizzazione dell’actina
Struttura dell’actina
Estremità -
depolimerizzazione
polimerizzazione
Estremità +
“treadmilling”
Esempi di proteine che interagiscono con l’actina
alfa-actinina
filamina
timosina
profilina
Cap Z
gelsolina
tropomiosina
cofilina
Inositolo trifosfato (InsP3)
e polifosfoinositidi competono
con il legame tra CapZ e actnin
Proteine che mediano la polimerizzazione:Rho, Rac,Cdc42
appartenenti alla famiglia delle proteine G monomeriche (Ras)
Miosina 1
calmodulina
Fimbrina
Villina
Microvilli intestinali
I microtubuli e le loro specializzazioni
MTOC
Ciglia
Centro di organizzazione microtubuli
Cellule migranti
Corpuscoli
basali
Cellule in divisione
Centrioli
Flusso assonico
Alfa-tubulina
Beta-tubulina
GTP /GDP
GTP
Modello “treadmilling”
GDP
Assemblaggio
dei protofilamenti
Assemblaggio
dei foglietti
Allungamento
dei tubuli
Proteine motrici: trasduttori meccano-chimici
A
B
Kinesina
tetramero
-
Dineina
nonamero
+
-
+
ATP
C
Modelli di trasporto vescicolare
attraverso i microtubuli (A,B)
ed il citoscheletro actinico (C)
Struttura della Kinesina
Catena pesante
Testa globulare
Catena leggera
Idrolisi dell’ATP e
legame ai microtubuli
Legame alle vescicole
Struttura interna delle ciglia
ponte
Assonema: 9+2
membrana pl
dineina
b.i.
coppia
centrale
dineina
b.e.
guaina
interna
raggio
testa
tubulo A
13 sub
tubulo B
1O/11 sub
ME di sez.trasversale di un ciglio
battito
flessione
recupero
scorrimento
Proteine dei
filamenti
interedi
Proteine IF
Distribuzione
Tipo I
Keratine acidiche
Epiteli
Tipo II
keratine basiche
Epiteli
Tipo III
Vimentine
Desmine
Fibrillare acida gliale
Periferina
Mesenchima
Muscolo
Cellule Gliali
Tipo IV
NF-L
NF-M
NF-H
Internexina
Neuroni maturi
Neuroni maturi
Neuroni maturi
Sistema nervoso embrionale
Tipo IV speciali
Filensina
Phakinina
fibrocellule della lente
fibrocellule della lente
Tipo V
Lamina A
Lamina B
Lamina C
Nucleo
Nucleo
Nucleo
Filamenti intermedi
Modalità di aggregazione
Esempio di organizzazione del citoscheletro del globulo rosso