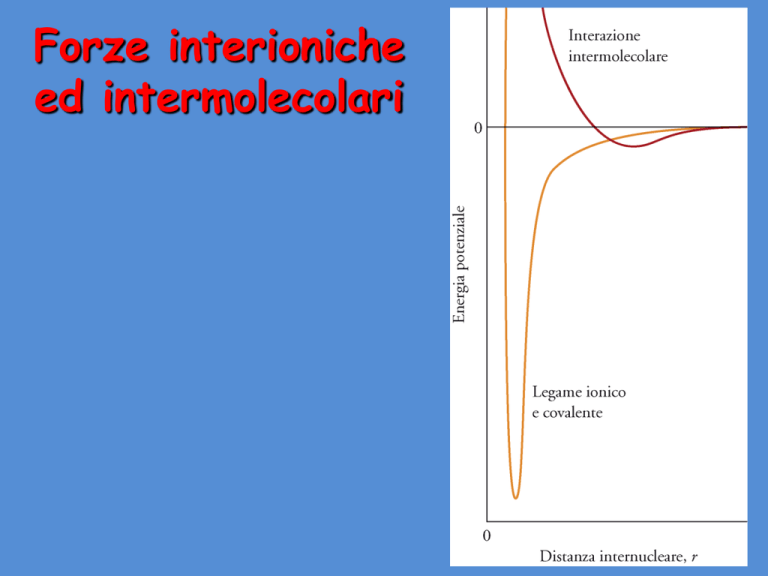
Forze interioniche
ed intermolecolari
Forze interioniche ed
intermolecolari
• Le interazioni ione-dipolo sono forti nel caso di ioni piccoli e di
carica elevata. Una conseguenza è che i cationi piccoli e molto
carichi risultano spesso idrati anche nei composti
• Le interazioni dipolo-dipolo sono più deboli delle forze agenti tra
ioni e declinano rapidamente con la distanza, specialmente nelle
fasi liquida e gassosa, in cui le molecole ruotano
• L’interazione di London è dovuta all’attrazione tra dipoli elettrici
istantanei in molecole adiacenti e agisce tra tutti i tipi di
molecole; la sua intensità aumenta con il numero di elettroni
della molecola considerata e si aggiunge a qualsiasi interazione
dipolo-dipolo. Le molecole polari attraggono anch’esse quelle
apolari per effetto di deboli interazioni dipolo-dipolo indotto
dipolo -dipolo indotto
dipolo istantaneo-dipolo istantaneo
Interazioni intermolecolari
L'efficacia delle forze di London aumenta all'aumentare della
massa molecolare: nuvole elettroniche più voluminose si
deformano più facilmente (più polarizzabili), avendo un moto più
"libero".
Lo stato fisico degli alogeni: F2 gas, Cl2 gas, Br2 liquido, I2 solido
Le interazioni tra molecole sferiche sono più deboli delle interazioni tra molecole lineari!!
Il legame idrogeno
Si forma quando un atomo di idrogeno
ad un elemento molto elettronegativo
l'interazione tra le altre molecole e
risulta sostanzialmente maggiore
interazioni dipolo-dipolo.
si trova legato
X (X= N, O, F)
il legame H-X
delle normali
I dipoli di legame possono interagire con la coppia
elettronica non condivisa dell'atomo di azoto,
ossigeno o fluoro di una molecola vicina.
Le piccolissime dimensioni dell’atomo di H, la presenza in esso di un solo
elettrone e quindi l’assenza di elettroni di schermo, rendono particolarmente
intenso il campo elettrico intorno al protone. Questo comportamento è
caratteristico del solo atomo H.
L’Acqua
Il momento di dipolo permanente nella
molecola di H2O, generato dalla grande
differenza di elettronegatività tra gli
elementi O ed H, permette l’esplicazione
di significative forze intermolecolari
dipolo-dipolo (ca. 15 Kcal/mol).
La forza di queste interazioni
permette alla piccola molecola
(18
u.m.a.)
di
esistere
termodinamicamente stabile in
forma liquida alle ordinarie
condizioni
standard
di
temperatura e pressione.
L’acqua bolle a 100 °C e fonde a °0 C
In assenza del legame ad idrogeno si calcola che tali
temperature sarebbero rispettivamente ~ -80 °C e ~ -100 °C.
La lunghezza del legame O-H è 101 pm, la distanza OH (nel
ghiaccio) è 175 pm
Il solfuro di diidrogeno H2S bolle a -61.8 °C e fonde a –
85.5°C, poiché la minore elettronegatività dell’atomo di zolfo
non consente la formazione di sensibili legami ad idrogeno
LEGAMI A IDROGENO NELLA MOLECOLA DI
FLUORURO DI IDROGENO (FCl)
L’attrazione elettrostatica si stabilisce fra l’atomo di idrogeno di una
molecola e l’atomo di fluoro di un’altra molecola. Si formano così
catene di molecole di fluoruro di idrogeno (o acido fluoridrico).
d+
d-
d+
d-
d+
d-
d+
d-
d+
d-
H
F
H
F
H
F
H
F
H
F
legame a
idrogeno
Struttura del ghiaccio
Acido acetico
Vi sono diverse proteine nell’uovo, e ognuna coagula a temperature diverse.
L’ovotransferrina, nell’albume, comincia a coagulare a 62 °C e diventa un solido morbido a
65 °C. Poiché l’ovotransferrina costituisce solo il 12 per cento delle proteine dell’albume,
questo rimane morbidissimo. A 85 °C anche l’ovalbumina, che costituisce il 54 per cento
delle proteine dell’albume, coagula, e il bianco diventa più compatto. Il tuorlo invece si
inspessisce a 65 °C e solidifica a 70 °C.
I materiali possono essere:
Amorfi: gli atomi sono disposti in modo disordinato
nella struttura (come nello stato liquido) ad es.
Vetri/materiali polimerici
Cristallini: Gli atomi si dispongono in un pattern
regolare ed è possibile individuare un’unità costitutiva
(cella unitaria) che ripetuta in tre dimensioni descrive
il cristallo
Sistemi amorfi
Si definiscono amorfi i sistemi in cui non
vi è un ordine strutturale periodico
Le molecole costituenti il solido
risultano essere orientate in modo
essenzialmente disordinato (casuale) tra
loro
M
M
M
M
M
M
M
M
M
M
M
M
M
Sistemi cristallini
Un solido è definito cristallino
quando è possibile riconoscere in
esso una regolarità strutturale
(ordine
spaziale)
che
si
riproduce periodicamente nello
spazio
Lo stato solido
Distinguiamo essenzialmente quattro classi di sistemi
solidi cristallini in base ai legami che sussistono tra
le loro particelle:
Solidi
Solidi
Solidi
Solidi
ionici
molecolari
covalenti o reticolari
metallici
Solidi ionici
I solidi ionici sono contraddistinti dalle seguenti proprietà:
Possiedono alte temperature di fusione e di ebollizione,
poichè occorre molta energia per trasformarli da solidi e
liquidi e da liquidi a gas.
Allo stato fuso sono buoni conduttori di elettricità.
Si sciolgono in solventi polari come l’acqua ed applicando un
campo elettrico esterno, queste soluzioni conducono bene la
corrente elettrica
Duri (non si lasciano penetrare facilmente), rigidi (non si piegano) e
fragili (si rompono senza deformarsi).
Caratteristiche dei composti ionici allo stato liquido
Quando il composto ionico è allo stato liquido, ogni ione è circondato da ioni di
segni opposto; per le caratteristiche proprie dei liquidi, gli ioni non sono vincolati
a posizioni fisse, ma possono muoversi attraverso il liquido. Ciò spiega perché i
composti ionici allo stato liquido sono in grado di condurre corrente elettrica. Si
ha, perciò, un passaggio di corrente quando delle particelle carche si muovono. Se
nel liquido si immergono due elettrodi aventi cariche di segno opposto, gli ioni
positivi migrano verso l’elettrodo negativo, mentre gli ioni negativi vanno verso
l’elettrodo positivo.
elettrodo
positivo
(+)
elettrodo
negativo
(-)
+
+
+
+
+
+
+
+
+
Direzione di migrazione degli ioni
verso i due elettrodi immersi in un
composto ionico allo stato fuso.
Solidi metallici
metalli: sono costituiti da cationi metallici tenuti
insieme da un mare di elettroni; malleabili,duttili,
conducono l'elettricità ed il calore
Legame metallico
Opacità e lucentezza
Densità elevata
Conducibilità elettrica e
termica
Duri, duttili, malleabili, elastici
Circa i quattro quinti di tutti gli elementi sono metalli, che sono tutti solidi tranne il
mercurio (Hg). I metalli hanno bassa energia di ionizzazione (quantità di energia
necessaria per strappare un elettrone a un atomo neutro) e di elettronegatività. Quindi i
loro elettroni esterni sono attratti debolmente dai rispettivi nuclei, e se ne separano
facilmente. Ciò avviene anche quando il metallo si trova allo stato solido. Nei metalli, le
posizioni (o nodi, occupati dalle particelle) del reticolo cristallino (schema geometrico
creato dalla disposizione delle particelle che costituiscono un solido) sono occupate
dagli ioni positivi del metallo. Gli elettroni esterni non rimangono vincolati ognuno al
proprio atomo ma sono liberi di muoversi per tutto il solido, tenendo insieme in questo
modo il solido stesso.
Gli elettroni esterni sono delocalizzati, cioè non appartengono ad un atomo specifico, e
nemmeno sono condivisi fra una coppia specifica di atomi, ma possono trovarsi in
qualsiasi zona all’interno del metallo. Perciò possiamo visualizzare la struttura del
metallo come reticolo cristallino con i nodi occupati dagli ioni positivi, immerso in una
nube elettronica formata da tutti gli elettroni esterni. La libertà di movimento degli
elettroni è all’origine delle proprietà dei metalli:
- conducibilità elettrica
- conducibilità termica
- lucentezza
- malleabilità e duttilità
Struttura compatta
Struttura esagonale compatta
Numero di
coordinazione
12. Esempi:
Mg e Zn
Struttura cubica compatta
Numero di
coordinazione
12. Esempi:
Al, Cu e Au
Molti metalli possiedono struttura compatta, con gli atomi ordinati
nell’assetto esagonale o in quello cubico; le strutture compatte
corrispondono al numero di coordinazione 12; esse presentano una
lacuna ottaedrica e due tetraedriche per ciascun atomo
Lega di sostituzione (rA ≤ 15% rB)
Conducibilità
elettrica e
termica
inferiori
Lega interstiziale rA ≤ 60% rB












