Capitolo
24
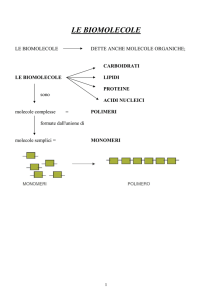
Le biomolecole
■
Abilità
• Comprendere il concetto di chiralità e di isomeria ottica.
• Prevedere quando un composto è chirale.
• Identificare dalle formule di struttura due molecole
come enantiomeri.
• Rappresentare le strutture, lineare e ciclica, del glucosio
e del fruttosio.
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
• Riconoscere gli a-amminoacidi e le proteine.
• Riconoscere l’azione di catalizzatori biologici degli enzimi.
• Classificare le vitamine.
• Riconoscere un lipide.
INDICE DEGLI ARGOMENTI
1.
2.
3.
4.
5.
6.
7.
Le biomolecole
Chiralità e isomeri ottici
Carboidrati
Monosaccaridi
Disaccaridi
Polisaccaridi
Amminoacidi
8. Le proteine
9. Acidi nucleici
e nucleotidi
10. La struttura del DNA
11. Gli enzimi
12. Le vitamine
13. I lipidi
© Joseph Alexander/Rockefeller University
Capitolo
24
Le biomolecole
1 le biomolecole
■ Abilità
• Comprendere il concetto
di chilarità e di isomeria ottica.
• Prevedere quando
un composto è chirale.
• Identificare
dalle formule di struttura
due molecole come enantiomeri.
• Rappresentare
le strutture, lineare e ciclica,
del glucosio e del fruttosio.
• Riconoscere
gli a-amminoacidi e le proteine.
• Riconoscere l’azione
di catalizzatori biologici
degli enzimi.
• Classificare le vitamine.
• Riconoscere un lipide.
Le conoscenze acquisite nello studio della chimica generale ed organica saranno adesso utilizzate per affrontare lo studio delle biomolecole,
cioè di quei composti organici indispensabili per la vita della cellula
e per la sua riproduzione.
Questi composti sono i carboidrati, i lipidi, le proteine, gli acidi nucleici
e le vitamine che svolgono alcune funzioni fondamentali:
• i carboidrati, assieme ai grassi, provvedono al fabbisogno energetico della cellula;
• le proteine e le vitamine sono indispensabili per l’accrescimento
corporeo e per il suo mantenimento;
• gli acidi nucleici sono responsabili della trasmissione dei caratteri
ereditari e della sintesi proteica negli organismi viventi.
2 Chiralità e isomeri ottici
Nella vita quotidiana siamo abituati alla presenza di strutture non
simmetriche, cioè che non presentano né un piano né un asse di simmetria: la mano ed il piede ne sono due esempi. Infatti un guanto che
va bene per una mano non può essere calzato dall’altra, perché la mano
sinistra è speculare a quella destra e non sovrapponibile.
Dinanzi allo specchio l’immagine speculare della mano destra corrisponde alla mano sinistra: la nostra mano è un esempio di struttura chirale (dal
greco chéir = mano) (figura 1).
A livello molecolare, sono detti chirali quei composti che hanno la
stessa formula chimica, ma differiscono nella loro struttura tridimensionale.
La molecola dell’acido lattico, o acido 2-idrossipropanoico,
1.
Le mani sono esempi
di oggetti chirali.
H
CH3 – C – COOH
OH
è asimmetrica in quanto all’atomo di carbonio centrale sono legati quattro gruppi atomici diversi (H, OH, CH3, COOH) disposti ai vertici di un
tetraedro.
2
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
CAPITOLO 24. LE
BIOMOLECOLE
In tal caso, il carbonio si presenta asimmetrico, quindi chirale, per cui sono possibili per
l’acido lattico due strutture (figura 2):
2a
COOH
COOH
2c
MODELLO
DI UNA STRUTTURA
DELL’ACIDO
LATTICO
C
C
OH
OH
C
H
CH 3 H
CH 3
2.
(a) Acido (+) lattico.
(b) Acido (–) lattico.
(c) Modello molecolare
di una struttura dell’acido lattico
(molecola con carbonio chirale).
acido (+) lattico
COOH
COOH
2b
C
C
H
H
OH
OH
CH3
CH3
acido (–) lattico
ENANTIOMERI
S
sorgente
ATOMO
DI CARBONIO
CHIRALE
3.
una molecola con carbonio chirale
dinanzi ad uno specchio:
lo specchio dà l’immagine
della seconda forma della molecola
che si presenta speculare
alla prima e non sovrapponibile.
I due modelli, corrispondenti all’acido lattico, non sono sovrapponibili, perché i raggruppamenti atomici di una configurazione,
per semplice rotazione, non possono corrispondere con quella
dell’altra configurazione.
Per ogni composto che contiene un atomo di carbonio asimmetrico (cioè legato con quattro atomi o gruppi differenti) si devono
prevedere due strutture che sono immagini speculari l’una dell’altra e non sovrapponibili.
Se immaginiamo di porre una delle due strutture asimmetriche
davanti ad uno specchio, l’immagine speculare non sovrapponibile che si ottiene corrisponde alla seconda forma (figura 3).
Coppie di molecole che presentano queste caratteristiche sono
anche dette enantiomeri.
Il concetto di chiralità è importante nei sistemi biologici perché
composti come i carboidrati e gli amminoacidi sono chirali.
La chiralità, a livello macroscopico, si può mettere in evidenza
sfruttando una proprietà fisica che possiedono queste molecole:
la capacità di ruotare il piano della luce polarizzata di un certo
angolo.
Per questa proprietà, questi composti sono detti isomeri ottici
o composti otticamente attivi.
luce non polarizzata
polarizzatore
lampada
a vapori di sodio
S
4.
Rotazione
del piano di luce
polarizzata
da parte di un
isomero ottico.
sorgente
di luce
monocromatica
( λ = 589 nm)
Paolo Pistarà, ChImICA
luce polarizzata
Campioni puri di enantiomeri hanno le stesse proprietà fisiche,
come il punto di fusione, il punto di ebollizione, densità, e solubilità nei comuni solventi, ma quando un pennello di luce polarizzata passa attraverso la soluzione di un enantiomero puro, la
luce polarizzata ruota.
Questo effetto è misurato con uno strumento, detto polarimetro
(figura 4).
α
luce non
polarizzata
polarizzatore
luce
polarizzata
ConCettI e APPlICAzIonI- © istituto italiano
tubo con
campione
Edizioni atlas - 2016
oculare
analizzatore
3
CAPITOLO 24. LE
a
BIOMOLECOLE
D (+) GLUCOSIO
MOLECOLA
DESTROGIRA
5.
Come riportato
dalle due etichette,
il glucosio è destrogiro (a),
mentre il fruttosio
è levogiro (b).
Il polarimetro utilizza una sorgente di luce monocromatica (luce di una
sola lunghezza d’onda), come la luce gialla del sodio. Dopo essere passata attraverso un polarizzatore, che può essere un polaroid, la luce viene
polarizzata, cioè oscilla in una sola direzione, a differenza della luce normale che vibra in tutte le direzioni.
Tra il polarizzatore ed una seconda lente, detta analizzatore, è posto un
tubo contenente il composto otticamente attivo.
Se facciamo passare un fascio di luce polarizzata su due campioni contenente ciascuno un solo enantiomero, il piano della luce polarizzata devia dello stesso angolo, ma in direzione opposta.
Se il composto determina la rotazione della luce polarizzata in senso orario, cioè verso destra, è detto destrogiro e si indica con (+); nel caso la rotazione si verifichi in senso antiorario, cioè verso sinistra, il composto è
detto levogiro e si indica con (–).
Il glucosio è un composto otticamente attivo e la sua molecola è destrogira (+) (figura 5a). Anche il fruttosio è un composto otticamente attivo, ma
la sua molecola è levogira (–) (figura 5b).
Esempio
D (–) FRUTTOSIO
MOLECOLA
LEVOGIRA
Un composto chirale
1 Quale dei seguenti composti ha carattere chirale?
b
H
H
a. H2N – C – COOH
b. F – C – Cl
H
H
NH2
H
c. CH3 – C – COOH
d. Cl – C – COOH
H
Cl
3 Carboidrati
I carboidrati sono composti costituiti da carbonio, idrogeno e ossigeno; i più semplici hanno formula (CH2O)n, in cui l’idrogeno e l’ossigeno hanno lo stesso rapporto
esistente nell’acqua. Ad esempio, nel glucosio C6H12O6 gli atomi di idrogeno sono il
doppio rispetto a quelli dell’ossigeno.
Con il termine carboidrati s’intendono quei composti, detti comunemente zuccheri,
che contengono un gruppo aldeidico o un gruppo chetonico e, inoltre, più di un
gruppo funzionale ossidrilico (– OH).
I carboidrati più semplici si dividono in monosaccaridi e disaccaridi. I carboidrati
che in natura si presentano sotto forma di grosse molecole sono detti polisaccaridi.
MONOSACCARIDI
CARBOIDRATI
o zuccheri
DISACCARIDI
POLISACCARIDI
4
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
CAPITOLO 24. LE
BIOMOLECOLE
4 monosaccaridi
I monosaccaridi vengono classificati secondo il numero di atomi di carbonio: quelli con tre atomi di carbonio sono chiamati triosi, quelli con
quattro atomi di C tetrosi, quelli con cinque atomi di C pentosi, con sei C
esosi.
A lato sono rappresentate le strutture di due monosaccaridi a sei atomi
di carbonio, il glucosio e il fruttosio, secondo le formule di proiezione di
Fischer. Queste proiezioni sono la rappresentazione sul piano della pagina
di molecole tridimensionali.
Il glucosio è un aldoesoso perché contiene il gruppo aldeidico; il fruttosio è un chetoesoso perché contiene il gruppo chetonico.
Per la numerazione della catena si procede in modo che il carbonio del
carbonile abbia il numero più basso. Ad esempio, nel caso del fruttosio gli
atomi di carbonio vengono numerati partendo dall’estremità più vicina al
carbonile.
Gli atomi di carbonio indicati con un asterisco rappresentano centri chirali
della molecola.
I monosaccaridi, per il fatto che hanno atomi di carbonio asimmetrici,
sono chirali e si possono presentare nelle due forme enantiomere D o L.
Per assegnare un monosaccaride alla serie D o L si deve considerare il
carbonio chirale più distante dal carbonio con il gruppo aldeidico o chetonico.
I monosaccaridi della serie D presentano il gruppo – OH alla destra
dell’osservatore, quelli della serie L a sinistra.
Gli organismi viventi producono solo uno dei due enantiomeri.
I monosaccaridi presenti in natura appartengono alla serie D.
GLUCOSIO
H
O
1C
H –2C*– OH
HO – 3C*– H
H –4C*– OH
H –5C*– OH
6
CH2OH
FRUTTOSIO
1
CH2OH
2
C
O
HO –3C *– H
H –4C *– OH
H –5C *– OH
6
CH2OH
D(+)
GLUCOSIO
D(–)
1
CHO
FRUTTOSIO
H –2C – OH
1
CH2OH
2
C
HO –3C – H
O
HO –3C – H
H –4C – OH
*
H –5C – OH
H –4C – OH
H –5C*– OH
6
6
CH2OH
CH2OH
Questa classificazione serve per assegnare la configurazione a ciascun
enantiomero, e ciò non è in relazione con il potere rotatorio della luce polarizzata. Infatti questa proprietà non dipende dalla disposizione spaziale
di un singolo gruppo, ma dall’insieme della sua configurazione. Ad esempio, il D-glucosio è destrogiro, mentre il D-fruttosio è levogiro.
■ Le strutture cicliche dei monosaccaridi
Per spiegare tutte le proprietà del glucosio e del fruttosio, è necessario
ammettere che in soluzione acquosa la catena aperta sia in equilibrio con
due strutture ad anello, dette formule di Haworth.
Le due strutture ad anello del D-glucosio in acqua hanno la forma di un
etere ciclico, detto emiacetalico.
Per il fatto che nella struttura chiusa il carbonio-1 è chirale, sono possibili
due isomeri detti anomeri che vengono indicati con a e β.
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
5
CAPITOLO 24. LE
BIOMOLECOLE
FORMULE DI HAWORTH
C2
C4
OH
OH
carbonio derivato
dal gruppo aldeidico
(carbonio anomerico)
OH
a-D-glucosio 36%
: :
OH
δ
H
OH
H
C3
C2
H
OH
+
δ
▼
O
CH2OH
5
C
H
1
C
C4
▼
C3
C
C
–
▼
H
1
6
CH2OH
▼
H
OH
H
H
H
▼
HO
O
▼
C4
C
▼
H
5
▼
5
6
CH2OH
H
HO
O
OH
H
OH
H
C3
C2
H
OH
1
C
▼
6
ossigeno derivato
dal gruppo ossidrilico
H
carbonio
anomerico
β-D-glucosio 64%
D-glucosio forma aldeidica
MODELLO
DELLA MOLECOLA
Nella forma a del D-glucosio il gruppo
OH legato al carbonio-1 è sotto il piano
dell’anello, mentre nella forma β è sopra
il piano dell’anello.
Anche per il fruttosio esistono due strutture, a e β.
β-D-glucosio
6
HO
CH2
5
C2
C
MODELLO
H
DELLA MOLECOLA
OH
O
a-D-glucosio
H
4
C
OH
OH
3
C
H
1
CH2OH
β-D-fruttosio
5 Disaccaridi
FORMULA
DEL
SACCAROSIO
a-D-glucosio
β-D-fruttosio
{
{
Formalmente i disaccaridi si possono considerare derivati dalla condensazione di due
monosaccaridi con eliminazione di una molecola di acqua; un atomo di ossigeno tiene legati i due monosaccaridi (legame glicosidico). I disaccaridi più importanti presenti in natura sono: il saccarosio, il lattosio, il maltosio.
Il saccarosio, che ha formula molecolare C12H22O11, è il comune zucchero da tavola e
viene ottenuto industrialmente dalla canna da zucchero e dalla barbabietola.
Si può considerare derivato dall’unione di una molecola di a-D-glucosio e una di β-Dfruttosio con perdita di una molecola di acqua.
Dopo il saccarosio, il lattosio è il più abbondante disaccaride presente in natura. Esso costituisce il 5% del latte dei mammiferi e ha formula molecolare C12H22O11.
6
Il lattosio è formato dall’unione di una molecola di
CH2OH
β-D-galattosio
e di una molecola di β-D-glucosio.
O
5
H
H
H
6
1
4
OH
HO
FORMULA
DEL
LATTOSIO
H
2
3
OH
H
6
H
O
HOH2C
5
H
HO
2
H
4
HO
OH
3
CH2OH
1
H
CH2OH
O
5
H
4
H
OH
3
H
saccarosio
OH
OH H
H
4
6
O
CH2OH
O
5
H
O
H
1
H
2
3
H
2
1
OH
β-D-glucosio
OH
β-D-galattosio
6
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
CAPITOLO 24. LE
BIOMOLECOLE
Molte persone sono intolleranti al lattosio: ciò comporta difficoltà a digerire prodotti come latte, formaggi, gelati. Il consumo di questi prodotti
è spesso accompagnato da disturbi intestinali. Le persone con questa sintomatologia non sono in grado di scindere il lattosio (lo zucchero del latte) nei suoi componenti, il glucosio e il galattosio.
Il maltosio è un disaccaride che si ottiene per idrolisi parziale dell’amido.
Il maltosio è costituito da due unità di a-D-Glucosio.
NORMAN HAWORTH
(1883-1950), chimico inglese.
Premio Nobel per la chimica
nel 1937 per le sue ricerche
sui carboidrati e sulla
vitamina C.
6 Polisaccaridi
Alcuni dei più comuni ed abbondanti carboidrati sono polisaccaridi:
questi composti derivano dall’unione di unità di glucosio per formare una
lunga catena (un polimero).
Le macromolecole che si formano quindi consistono di “sole unità di
glucosio”.
Amido, cellulosa e glicogeno sono tre famiglie di polisaccaridi, molto
spesso chiamate carboidrati complessi.
L’amido è presente in parecchi cibi, come patate e grano. Consiste di
due componenti molecolari: l’amilosio (20-30%) e l’amilopectina (7080%), costituite entrambe da molecole di a-D-glucosio.
6
4
O
3
2
H
OH
H
1
H
a
4
O
▼
H
6
CH2OH
5
O
H
H
OH
CH2OH
5
O
H
H
OH
3
H
2
OH
FORMULA
DELL’AMIDO
H
1
a
O
n
a- legame
L’amilosio è un polimero organizzato in maniera lineare, formato da circa
300 molecole di a-D-glucosio unite con legami glicosidici che riguardano
l’atomo di carbonio-1 di una molecola ed il carbonio-4 di una adiacente.
L’amilopectina presenta anch’essa una struttura lineare 1-4 di glucosio,
ma ogni 20 residui mostra una ramificazione 1-6.
6.
Immagine al microscopio
di granuli di amido presenti
in cellule del tubero di patata
colorati artificialmente (in violetto).
La cellulosa è il componente fibroso primario delle cellule delle piante
ed è costituito da molecole di β-D-glucosio.
FORMULA
DELLA
CELLULOSA
6
CH2OH
5
6
H
CH2OH
H
4
C
O
3
C
H
O
1
H
OH
C
4
H
2
C
OH
Cβ
H
▼
5
C
C
H
OH
3C
H
β- legame
O
1
H
2C
OH
O
Cβ
7.
Fibre di cellulosa
fotografate
al microscopio
elettronico
a scansione.
H
n
Sia l’amido che la cellulosa sono polimeri del glucosio, ma questi due
polisaccaridi si comportano in modo differente nel corpo.
L’uomo è capace in particolare di digerire l’amido perché possiede enzimi capaci di spezzare il legame che tiene assieme le molecole individuali di glucosio, mentre non è in grado di digerire la cellulosa.
7
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
CAPITOLO 24. LE
BIOMOLECOLE
Di conseguenza, noi dipendiamo da alimenti che contengono amido, come patate e pasta, come sorgente di carboidrati.
La ragione di questo comportamento è attribuibile alla differenza con cui le unità
di glucosio sono legate tra loro nell’amido e nella cellulosa.
Nel legame alfa (a) dell’amido (figura 6), le unità di glucosio sono legate tra loro con una particolare orientazione, mentre nel legame beta (β) della cellulosa sono legate tra loro con una orientazione differente (figura 7).
I nostri enzimi non sono in grado di catalizzare la rottura dei legami β della cellulosa. Di conseguenza non possiamo ricavare le molecole di glucosio, e quindi
energia, da verdure e foglie.
Mucche, capre, pecore e altri ruminanti riescono a scindere la cellulosa per il fatto che il loro apparato digerente contiene batteri che decompongono la cellulosa
nei monomeri di glucosio.
Analogamente le termiti digeriscono la cellulosa perché contengono batteri in
grado di decomporla.
Il glicogeno è contenuto essenzialmente nel fegato, l’organo regolatore del tasso glicemico del
sangue, e nei muscoli dove costituisce una riserva
di energia di immediato utilizzo perché serve per
la contrazione muscolare.
8.
Sotto sforzo gli atleti utilizzano il glicogeno
contenuto nei muscoli.
7 Amminoacidi
Gli amminoacidi sono composti caratterizzati dalla presenza del gruppo carbossilico – COOH e del gruppo amminico – NH2. Il gruppo amminico si trova legato al carbonio adiacente al gruppo carbossilico, cioè il carbonio a.
O
▼
carbonio a
– C – C – OH
N
H H
Al carbonio a sono uniti anche un idrogeno ed un gruppo R che può essere alchilico, aromatico o eterociclico.
Tranne la glicina, dove R = H, gli altri amminoacidi hanno l’atomo di carbonio a
chirale in quanto legato a 4 gruppi diversi. Questi composti sono pertanto otticamente attivi e presentano due enantiomeri che sono l’immagine speculare l’uno dell’altro e non sovrapponibili (figura 9).
Negli amminoacidi, L (sinistro) e D (destro) stanno a rappresentare le due serie in
relazione alla posizione del gruppo – NH2, perché il verso di rotazione della luce
polarizzata va segnalato con il segno (+), rotazione a destra, e con il segno (–), rotazione a sinistra.
Gli amminoacidi naturali appartengono alla serie L, mentre gli amminoacidi
che si trovano in alcuni prodotti di sintesi, ad esempio qualche antibiotico, appartengono alla serie D.
8
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
CAPITOLO 24. LE
O
C
OH
C
H
H
H
H
N
H
C
R
H
N
C
NH2
R
H
H
D – Amminoacido
C
NH2
R
H
H
9.
L’alanina presenta due enantiomeri.
Un enantiomero è l’immagine speculare dell’altro e non sovrapponibile.
D – Amminoacido
10.
L’amminoacido arginina è tra i più
importanti per l’uomo.
Sull’organismo compie un’azione
tonificante, eliminando le tossine
e inoltre ripara le ferite.
MODELLI
COOH
COOH
R
H
H
L – Amminoacido
H
C
C
R
O
C
OH
H
do
R
N
O ENANTIOMERI
C
OHDELL’ALANINA
COOH
H 2N
BIOMOLECOLE
Nella Tabella 1 nella pagina seguente sono riportati i 20 a-amminoacidi che normalmente sono presenti nelle proteine. Dieci amminoacidi
(valina, leucina, isoleucina, fenilalanina, treonina, lisina, arginina,
triptofano, istidina, metionina) sono detti essenziali in quanto l’uomo non
è in grado di sintetizzarli mediante il proprio metabolismo, per cui deve
introdurli con la dieta.
La carenza dei dieci amminoacidi essenziali, per una dieta sbilanciata,
può provocare gravi patologie.
Un qualsiasi amminoacido allo stato puro si presenta come un solido
bianco cristallino con temperatura di fusione molto elevata rispetto ai
composti organici di pari massa molecolare.
Per spiegare questo comportamento si ammette che questi composti,
in seguito ad una reazione acido-base, esistano prevalentemente come
ioni dipolari.
R – CH – COO –
+
NH3
MOLECOLARI DI ALCUNI AMMINOACIDI
O
N
S
O
ALANINA
(Ala)
Alanina (Ala):
in blu è rappresentato l’azoto,
in rosso l’ossigeno.
Paolo Pistarà, ChImICA
CISTEINA
(Cys)
Cisteina (Cys):
in giallo è rappresentato lo zolfo.
ConCettI e APPlICAzIonI- © istituto italiano
LISINA
(Lys)
Lisina (Lys)
Edizioni atlas - 2016
9
CAPITOLO 24. LE
BIOMOLECOLE
TABELLA 1. AMMINOACIDI NATURALI
COOH
H2N
C
H
formula generale
di un amminoacido
r
–R
Nome
glicina
–H
Simbolo
PuNto
iSoelettRico
gly
6,0
– CH3
alanina
ala
6,0
– CH (CH3 )2
Valina
Val
6,0
– CH2 CH (CH3 )2
leucina
leu
6,0
– CH – CH2 CH3
isoleucina
ile
6,0
Simbolo
PuNto
iSoelettRico
asparagina
asn
5,4
– CH2 CH2CNH2
glutammina
gln
5,7
– (CH2)4 NH2
lisina
lys
9,7
arginina
arg
10,8
istidina
His
7,6
Triptofano
Trp
5,9
– CH2 SH
cisteina
cys
5,1
– CH2 CH2 SCH3
metionina
met
5,7
– CH2 COOH
acido aspartico
asp
2,8
– CH2 CH2 COOH
acido glutammico
glu
3,2
–R
O
– CH2CNH2
O
NH
CH3
– (CH2)3NHCNH2
COOH
Prolina
HN – C – H
H2C
Pro
6,3
CH2
– H2C
NH
CH2
N
fenilalanina
– CH2
Serina
– CH2 OH
– CH2
– CHOH
CH3
Nome
OH
Tirosina
Treonina
Phe
5,5
Ser
5,7
Tyr
5,7
Thr
5,6
– H2C
N
H
nota
a. gli amminoacidi vengono designati con un codice a tre lettere.
b. in rosso sono segnati gli amminoacidi essenziali.
c. la struttura della prolina è completa.
8 le proteine
Le proteine sono macromolecole che derivano dalla combinazione chimica di
amminoacidi. Questi, susseguendosi l’un l’altro come mattoni, costituiscono strutture molecolari molto complesse.
Se abbiamo N amminoacidi, una macromolecola, in modo schematico, assume la
forma:
1
2
3
N
La combinazione chimica degli amminoacidi prende il nome di proteina se la massa
molecolare è superiore a 20 000, di peptide se inferiore.
10
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
CAPITOLO 24. LE
BIOMOLECOLE
Gli amminoacidi in una proteina sono legati mediante un legame peptidico, che deriva da una reazione di esterificazione tra il gruppo carbossilico di un amminoacido
ed il gruppo amminico di un altro, con eliminazione di una molecola di acqua a spese
di – OH del gruppo carbossilico e di – H del gruppo amminico.
Il legame peptidico tra due amminoacidi è così rappresentato:
R O
H – N – C – C – OH + H
H
H R
O
H R
N – C – C – OH
▼
H
H
O
H
R O
H – N – C – C – N – C – C – OH
H
H
■ Struttura primaria delle proteine
La sequenza degli amminoacidi di una catena proteica costituisce la struttura
primaria di una proteina. Per conoscere la struttura primaria di una proteina devono
essere determinati i tipi e il numero di amminoacidi presenti nella proteina e l’ordine
con cui essi sono legati tra loro. Uno studio importante del biochimico Frederick Sanger ha riguardato la struttura primaria dell’insulina.
L’insulina umana è formata da due catene di amminoacidi che sono legate mediante legami disolfuro tra molecole di cisteina (figura 11).
11.
Sequenza
degli
amminoacidi
dell’insulina
umana.
InSUlInA UmAnA
11
FREDERICK SANGER, 1918, biochimico
inglese.
Nel 1955 completò l’identificazione
e la successione dei 51 amminoacidi
che compongono l’insulina.
Per questo lavoro, nel 1958,
fu insignito del premio Nobel
per la chimica. Nel 1977 completò
la determinazione della sequenza
di nucleotidi nella molecola di DNA
di un batteriografo. In seguito
a questa ricerca, nel 1980,
Sanger ottenne un secondo premio
Nobel per la chimica.
■ Il glutine e la celiachia
L’attenzione verso la patologia della celiachia, cioè verso
l’intolleranza al glutine, risulta sempre maggiore.
Con il termine glutine s’intende un complesso proteico presente in diversi cereali (frumento, orzo, segale, avena, kamut, farro).
La prolamina, che rappresenta una frazione proteica del
glutine, è in grado di scatenare in alcuni individui predisposti reazioni di sensibilità o di vera intolleranza.
Paolo Pistarà, ChImICA
La prolamina del frumento è chiamata gliadina, quella
dell’orzo ordeina, della segale secalina.
L’intolleranza al glutine genera danni alla mucosa dell’intestino, in particolare ai villi intestinali.
Gli individui ai quali è stata diagnosticata la celiachia devono seguire una dieta priva di glutine. Disposizioni di legge impongono che nei cibi per celiaci la concentrazione in
glutine non deve superare i 20 mg per 1 kg di campione.
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
11
,4 A
CAPITOLO 24. LE
BIOMOLECOLE
■ Struttura secondaria delle proteine
Le catene polipeptidiche possono assumere conformazioni differenti in funzione
dei tipi di amminoacidi presenti nelle catene.
Mediante indagine con i raggi X, Linus Pauling, premio Nobel per la chimica nel
1954, ha proposto per l’a-cheratina, una proteina fibrosa (capelli, unghie, lana non
stirata), una struttura elicoidale, cioè una catena di amminoacidi che si avvolge a
spirale attorno ad un asse: questa rappresenta la struttura secondaria della proteina (figura 12).
a-elica
R
R
R
R
R
R
5,4 A
C
o
n
12.
Struttura secondaria ad a-elica
per l’a-cheratina.
R
H
R
R
radicale
R
R
Nell’a-elica i gruppi R sono rivolti verso l’esterno dell’elica e, all’interno della
stessa molecola, si vengono a formare legami a idrogeno tra il gruppo NH di un legame
e il gruppo CO immediatamente sovrastante.
N – H ....... O
5,4 A
Non tutte le proteine hanno una struttura ad a-elica; il componente principale della seta è una proteina chiamata fibroina, che è una β-cheratina, la cui
struttura ipotizzata da Pauling è a pieghe, cioè a strato ondulato (struttura β).
In questa conformazione le catene proteiche sono più distese e giacciono fianco a
fianco, collegate da legami a idrogeno; i
gruppi R sono perpendicolari all’asse
della molecola ma rivolti alternativamente verso l’alto e verso il basso (figura 13).
R
H
C
o
n
R
12
R
R
13.
Struttura secondaria di una proteina:
struttura a β-pieghe (o β-foglietto)
della fibroina della seta.
radicale
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
CAPITOLO 24. LE
BIOMOLECOLE
■ Struttura terziaria delle proteine
Una proteina con struttura ad a-elica dovrebbe presentare solo una forma
allungata; invece, una proteina con la struttura β solo una forma a foglietto.
Anche se esistono proteine che presentano le forme descritte, in tutte le
altre la struttura secondaria ad a-elica si ripiega su se stessa in modo da formare una struttura compatta, quasi sferica (forma globulare): la struttura
terziaria.
struttura tErziaria dElla globina
Proteina globulare a forma sferica,
con avvolgimento a spirale
della catena polipeptidica.
14.
Struttura terziaria
delle proteine.
Le forze che determinano la forma geometrica caratteristica della struttura terziaria delle proteine sono di quattro tipi:
a. Attrazioni tra ioni positivi e ioni negativi della proteina (ad esempio
lisina-acido glutammico)
b. Legami a idrogeno (ad esempio asparagina-acido glutammico);
c. Legame disolfuro (legame covalente cisteina-cisteina);
d. Forze di London, interazioni idrofobiche atte a respingere l’acqua, che
agiscono tra le catene laterali idrocarburiche (ad esempio valina-valina).
15.
Denaturazione di una proteina
globulare provocata dal calore.
La cottura di un uovo provoca la
denaturazione termica dell’albumina,
che si trasforma in una sostanza
solida bianca.
gruppo eme
Queste forze conferiscono alla molecola la massima stabilità. La struttura terziaria è responsabile della funzione biologica delle proteine.
In seguito a riscaldamento si verificano notevoli cambiamenti nelle proprietà fisiche e chimiche delle proteine globulari. È quello che avviene
quando si cucina un uovo.
L’albume perde il suo aspetto gelatinoso e coagula in una massa bianca
insolubile: si ha denaturazione delle proteine dell’albume (figura 15).
La struttura primaria, cioè la concatenazione degli amminoacidi, rimane inalterata, mentre si verifica la demolizione della struttura terziaria della proteina
passando da una forma globulare, tridimensionale, ad una struttura disordinata.
La denaturazione delle proteine si verifica anche per azione di acidi o di
basi. In seguito alla denaturazione, le proteine perdono una loro attività
biologica, cioè quella di agire da enzimi.
■ Struttura quaternaria delle proteine
16.
Struttura quaternaria e formula
chimica dell’emoglobina.
Paolo Pistarà, ChImICA
Alcune proteine presentano una struttura quaternaria in cui due o più subunità si associano tra loro.
L’emoglobina Hb, per esempio, è formata da quattro segmenti polipeptici quasi sferici (figura 16), ciascuno contenente uno ione ferro (II). Le
quattro subunità sono tenute assieme da forze elettrostatiche. L’emoglobina
contenuta nel sangue è responsabile del trasporto di O2. In una proteina la
sostituzione anche di un solo amminoacido può determinare modificazioni
profonde nella sua funzionalità.
La sostituzione ad esempio, nella catena β-dell’emoglobina, dell’acido
glutammico con la valina è responsabile di una grave malattia, l’anemia
falciforme.
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
13
CAPITOLO 24. LE
BIOMOLECOLE
■ Classificazione delle proteine
Le proteine costituite solo da amminoacidi sono
chiamate proteine semplici. Numerose proteine, oltre agli amminoacidi, contengono porzioni non proteiche legate con legami covalenti, dette gruppi prostetici: queste proteine vengono indicate come proteine coniugate.
Una classificazione delle proteine tiene conto del
gruppo prostetico presente.
Le proteine rappresentano il 30% del peso secco
del nucleo delle cellule: ciò sta ad indicare che nell’attività cellulare la funzione delle proteine è importante.
• Le lipoproteine, proteine coniugate con una catena lipidica, sono i costituenti delle membrane cellulari.
• Le glicoproteine si formano quando le proteine si
legano con legami covalenti ai carboidrati. Un
esempio è la g-globulina del sangue.
Le glicoproteine si trovano anche nelle membrane
cellulari.
• Le nucleoproteine contengono una struttura polipeptidica combinata con acidi nucleici e si trovano
nel nucleo delle cellule (cromosomi) oltre che nel
citoplasma.
9 Acidi nucleici e nucleotidi
Gli acidi nucleici sono macromolecole costituite da strutture di base chiamate nucleotidi. Ciascun nucleotide contiene uno zucchero, una base e
l’acido fosforico.
Gli zuccheri possono essere di due tipi: il ribosio e il 2-deossiribosio, ambedue a cinque atomi di carbonio.
La differenza tra i due monosaccaridi sta nella mancanza di un atomo di
ossigeno nel carbonio 2 del deossiribosio.
O
5
C4
OH
C
H
H
C
H
3
2
OH
1
OH
C4
C1
H
H
3
C
C
OH
OH
2
H
C
H
2-deossi-D-ribosio
Gli acidi nucleici prendono il nome dallo zucchero che contengono. È
chiamato acido deossiribonucleico (DNA) l’acido nucleico che contiene il
deossiribosio, mentre è chiamato acido ribonucleico (RNA) quello che
contiene il ribosio.
L’altro costituente di un nucleotide è una base eterociclica azotata. Tre basi
sono presenti sia nel DNA che nell’RNA.
NH2
6
1
N
5
N
2
3
N
4
NH2
O
7
6
1
8
9
N
H
adenina (A)
14
HO – CH2
H
H
D-ribosio
17.
Un filamento di DNA
fotografato
al microscopio
elettronico.
O
5
HO – CH2
Paolo Pistarà, ChImICA
HN
2
H2N
5
N
4
7
3
8
3
N
4
9
N
H
guanina (G)
N
5
2
O
1
6
N
H
citosina (C)
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
CAPITOLO 24. LE
BIOMOLECOLE
Oltre a queste, nell’RNA è presente l’uracile,
mentre nel DNA la timina.
La timina, rispetto all’uracile, presenta un CH3 in
posizione 5.
O
3
3
5
HN
2
O
4
1
5
HN
2
6
N
O
4
O
1
CH3
6
N
H
H
uracile (U)
timina (T)
18.
Ricostruzione al computer di una molecola di RNA.
In un nucleotide la base è legata all’atomo di carbonio 1 del monosaccaride, mentre il gruppo fosfato è legato generalmente con l’atomo di carbonio 5.
DI
STRUTTURA GENERALE
2-DEOSSIRIBONUCLEOTIDI DI DNA
STRUTTURA GENERALE
DI RIBONUCLEOTIDI DI RNA
Base
Base
O
O
HO
P
O
H2C
4
OH
H
H
3
OH
O
5
O
5
HO
H
2
1
H
P
OH
O
H2C
4
H
H
3
OH
H
H
2
1
H
OH
10 la struttura del DnA
19.
Immagine di diffrazione ai raggi X
effettuata su un sale di sodio cristallino
di DNA da Rosalind Franklin.
Paolo Pistarà, ChImICA
Il biochimico americano Erwin Chargaff, nel 1950, utilizzando la
cromatografia su carta per l’analisi degli acidi nucleici, aveva determinato per il DNA il rapporto 1:1 tra adenina e timina, e tra guanina e
citosina.
Lo scienziato, tuttavia, non si era reso conto dell’importanza della sua
scoperta. Nello stesso tempo, nel laboratorio del King’s College di Londra, una brillante ricercatrice Rosalind Franklin (1920-1958) conduceva indagini con i raggi X sul sale di sodio cristallino dell’acido deossiribonucleico (DNA) estratto da una ghiandola, il timo del vitello.
Una di queste fotografie ai raggi X risultò decisiva per spiegare la
struttura del DNA (figura 19).
Analizzando le macchie scure al centro della lastra fotografica, che
evidenziavano l’andamento incrociato dei raggi X, la Franklin ipotizzò
che il DNA avesse una struttura elicoidale con una distanza di 3,4 Å
tra le diverse unità di nucleotidi e un diametro di 20 Å.
James Watson e Francis Crick, che lavoravano al Cavendish Laboratory all’Università di Cambridge in Inghilterra, si resero conto che
una struttura elicoidale a un singolo filamento non poteva avere una
densità corrispondente a quella che era stata determinata sperimentalmente per il DNA.
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
15
CAPITOLO 24. LE
BIOMOLECOLE
ROSALIND FRANKLIN (1920-1958),
biologa inglese del King
College di Londra, ebbe
un ruolo importante
nella determinazione
della struttura del DNA.
H
N H
N
N
zucchero
N
N
Dopo aver osservato la fotografia della Franklin, ebbero l’intuizione che nella molecola del
DNA due filamenti si avvolgessero uno sull’altro a doppia elica. Le regioni molto scure in alto
e in basso della lastra fotografica indicavano che
i due filamenti della doppia elica erano tenuti
insieme da legami a idrogeno, perpendicolarmente all’asse dell’elica (figura 20).
Poiché i gradini della struttura del DNA sono
tutti uguali tra loro come lunghezza, l’accoppiamento delle basi, mediante legami a idrogeno, deve coinvolgere l’Adenina (A) con la Timina (T) e la Citosina (C) con la Guanina (G).
20.
Watson e Crick, osservando la lastra ai raggi X
della Franklin, ebbero l’intuizione che il DNA avesse
una struttura a doppia elica.
O
CH3
H
N H
21
H N
O
N
N
zucchero
zucchero
N
O
N
H N
O
H N
N
N
zucchero
H
Timina
Adenina
Citosina
Guanina
21.
L’accoppiamento
delle basi azotate nel DNA.
DNA
a
b
In questa foto del 1953, JAMES D.
WATSON (a sinistra) e FRANCIS CRICK
(a destra) osservano il loro modello
a doppia elica del DNA. Insieme
con MAURICE WILKINS, Watson e Crick
ricevettero il premio Nobel
per la medicina nel 1962.
22.
(a) Struttura del DNA con gli atomi che lo compongono.
(b) Schema a doppia elica del DNA con le coppie di basi.
16
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
CAPITOLO 24. LE
BIOMOLECOLE
11 Gli enzimi
Gli enzimi sono catalizzatori biologici che accelerano determinate reazioni
metaboliche a livello cellulare. Intervengono sulle reazioni come i catalizzatori
inorganici, senza alterare i valori di concentrazione all’equilibrio e senza subire
modificazioni alla fine della reazione.
Dai primi studi risultò evidente che gli enzimi sono proteine; infatti, si denaturano con il calore perdendo la loro azione catalitica. Ciò spiega perché l’uomo
non riesce a sopravvivere alle alte temperature che denaturano gli enzimi e le
proteine.
La caratteristica fondamentale degli enzimi è la specificità per il substrato, che
è la sostanza che deve essere trasformata dall’enzima.
La classificazione degli enzimi viene fatta in funzione della specificità di reazione.
Per spiegare la specificità di reazione bisogna ammettere che l’enzima possegga
dei centri attivi, rappresentabili come tasche o incavi, in cui per complementarietà vanno ad incastrarsi le molecole del substrato (figura 23).
S
S
E
E = enzima
s = substrato
E
23.
MECCANISMO CHIAVE-SERRATURA TRA ENZIMA E SUBSTRATO.
A lato, ricostruzione al computer della struttura
dell’enzima acetilcolinesterasi, un enzima fondamentale
per le funzioni nervose in tutti i mammiferi.
Inoltre, il substrato deve avere un legame chimico che possa subire l’attacco da
parte dell’enzima. La reazione di idrolisi di un estere può procedere con il seguente schema:
substrato
enzima
➡
substrato
enzima
A
B
➡
E
24.
Meccanismo della reazione di idrolisi ad opera di un enzima.
La molecola dell’enzima forma con il substrato un complesso instabile detto
complesso enzima-substrato. Avvenuta la reazione si liberano acido ed alcool.
La specificità dell’azione degli enzimi può essere evidenziata in presenza di
enantiomeri. Dei due enantiomeri, l’acido L-lattico e l’acido D-lattico, l’enzima
latticodeidrogenasi del muscolo sceglie selettivamente solo uno dei due, cioè
l’acido L-lattico, per dare l’acido piruvico.
Nelle strutture di Fischer, l’acido L-lattico ha il gruppo – OH alla sinistra rispetto all’osservatore, mentre l’acido D-lattico ha il gruppo – OH alla destra dell’osservatore.
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
17
CAPITOLO 24. LE
BIOMOLECOLE
Dalla figura 25 si può notare che solo l’enantiomero L-lattico si presenta complementare in alcuni punti (siti attivi) dell’enzima latticodeidrogenasi e può essere ossidato ad acido piruvico, mentre l’enantiomero D-lattico, comunque venga ruotato, non può incastrarsi nei siti attivi.
Acido L-lattico
COOH
HO
C
COOH
H
CH3
25.
Specificità dell’enzima
latticodeidrogenasi
del muscolo per l’acido
L-lattico.
COOH
Acido D-lattico
COOH
H
C
C
CH3
CH3
H
OH
H
Siti attivi dell'enzima
C
OH
CH3
OH
Siti attivi dell'enzima
La complementarietà tra substrato ed enzima, con una immagine efficace, è
rappresentata come una chiave che deve avere un profilo particolare perché, mediante rotazione, possa far scattare il meccanismo di apertura o di chiusura di
una serratura.
12 le vitamine
Le vitamine sono sostanze organiche necessarie all’uomo sia per l’accrescimento
dell’organismo sia per il suo mantenimento. Le piante e gli animali inferiori possono sintetizzarle, mentre l’uomo e gli animali superiori in genere, non essendo in
grado di svolgere questa attività di sintesi, devono assumerle con la dieta.
La struttura delle vitamine non permette di confrontarle chimicamente; una prima
classificazione distingue le vitamine in due gruppi:
a. Vitamine liposolubili, solubili nei grassi e nei solventi dei grassi. Sono presenti
in prevalenza negli alimenti contenenti grassi (latte, uova, oli).
b. Vitamine idrosolubili, solubili in acqua. Sono presenti in prevalenza negli alimenti contenenti acqua: carne, frutta, verdura.
Questa classificazione tiene conto della solubilità, una grandezza fisica.
VITAMINE
IDROSOLUBILI
LIPOSOLUBILI
18
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
CAPITOLO 24. LE
BIOMOLECOLE
La carenza di vitamine determina vere e proprie patologie. Con una dieta varia non si arriva
a stati di avitaminosi, che invece si manifestavano in tempi passati.
Le vitamine sono necessarie nella dieta in piccole quantità: per la vitamina B12 bastano pochi
μg (microgrammi), per la vitamina C qualche decina di milligrammi.
I processi biologici, come si è detto, necessitano di catalizzatori, gli enzimi. Gli enzimi sono
proteine che, per svolgere la loro azione catalitica, richiedono la presenza di molecole non proteiche, con cui sono legate con legami covalenti.
Le molecole che interagiscono con gli enzimi sono chiamate coenzimi. Molti coenzimi sono
vitamine; queste, per il fatto di prendere parte alla catalisi enzimatica, al termine della reazione
spesso si trovano modificate nella struttura e, pertanto, devono essere reintegrate con la dieta.
TABELLA 2. VITAMINE LIPOSOLUBILI E VITAMINE IDROSOLUBILI
vitamiNe liPoSolubili
vitamiNa
DOROTHY CROWFOOT HODGKIN
(1910-1994).
Biochimica americana,
premio Nobel per la chimica
nel 1964 per la
determinazione della struttura
della vitamina B12, usata per
trattare l’anemia perniciosa.
FoNte
azioNe
alimeNtaRe
a
Burro, latte, uova
pomodori, banane.
È attiva nella crescita.
Partecipa al processo
della visione.
d calciferolo
Latte, uova, pesce.
Interviene nel processo
di accrescimento delle ossa.
e Tocoferolo
Grassi ed oli animali
e vegetali.
Non è chiara la sua azione
contro la sterilità. Previene la distrofia muscolare. Antiossidante.
K1
Foglie verdi e legumi.
Antiemorragico.
Favorisce la normale
coagulazione del sangue.
K2
Prodotto del metabolismo
batterico intestinale.
vitamiNe idRoSolubili
vitamiNa
Vitamine idrosolubili
HO – C = C – OH
O =C
CH – CH – CH2OH
O
OH
Vitamina C (ac. ascorbico)
C
O
NH2
N
FoNte
B1 Tiamina
Carne, lievito, noci.
Antineuritica e antiberiberi.
B2 riboflavina
Latte, carne.
Presente nel coenzima FAD.
B6 Piridossina
In quasi tutti gli alimenti.
Partecipa al metabolismo
degli amminoacidi.
B3 (PP) o niacina
Fegato e lievito.
Antipellagra. Coenzimi piridinici NAD e NADP.
ac. Pantotenico
È presente in molti
alimenti.
Partecipa al metabolismo di
tutti gli alimenti.
Coenzima A.
Biotina
In molti alimenti.
Partecipa a reazioni biochimiche. Introduce CO2 per
formare – COOH.
acido folico
Foglie verdi
Partecipa a molte reazioni
biochimiche
Vitamina PP o Niacina
HO
CH2OH
CH2OH
CH3 N
Vitamina B6 o Piridossina
Paolo Pistarà, ChImICA
azioNe
alimeNtaRe
B12 cianocobalamina Latte, carne, pesce, molluschi. È assente nei vegetali.
Vitamina c
(acido ascorbico)
ConCettI e APPlICAzIonI- © istituto italiano
Agrumi, pomodori, kiwi,
peperoni.
Edizioni atlas - 2016
Antianemica. Ha influenza
nella formazione del sangue.
Antiinfettiva.
19
CAPITOLO 24. LE
BIOMOLECOLE
13 I lipidi
I lipidi (o grassi) sono biomolecole che si presentano insolubili in acqua mentre
sono solubili in solventi organici. Questo comportamento è dovuto alla presenza
nella loro molecola di catene carboniose che rendono questi composti idrofobici.
Oltre ai grassi e agli oli, anche alcune vitamine, ormoni e altri componenti della
membrana plasmatica sono lipidi.
■ Acidi grassi e trigliceridi
Gli acidi grassi sono i componenti carbossilici dei lipidi; raramente si trovano
liberi in natura, ma sono esterificati con il glicerolo sotto forma di trigliceridi.
Degli acidi grassi esistenti nel regno animale e vegetale i più importanti sono il
palmitico e lo stearico, acidi saturi rispettivamente con 16 e 18 atomi di carbonio,
e gli acidi insaturi, oleico, linoleico e linolenico con 18 atomi di carbonio.
Nei trigliceridi tutti e tre i gruppi ossidrilici del glicerolo sono esterificati con
acidi grassi.
In un trigliceride i gruppi OH del glicerolo sono esterificati con due o tre acidi
grassi differenti. Negli acidi insaturi i doppi legami hanno una configurazione cis.
O
CH2 – O – C – (CH2)16 – CH3
H
FORMULA
CHIMICA DI
UN TRIGLICERIDE
O
H
C
C
CH – O – C – (CH2)7
(CH2)7 – CH3
H
O
H H
C
C
C
H2
CH2 – O – C – (CH2)7
H
C
C
(CH2)4 – CH3
L’acido linolenico (omega-3) con tre doppi legami e l’acido linoleico (omega-6)
con due doppi legami sono due acidi grassi di notevole interesse nutrizionale che
il nostro organismo non è in grado di sintetizzare,
Questi acidi grassi polinsaturi sono detti “essenziali” perché svolgono una funzione antiinfiammatoria e regolano la pressione sanguigna, per cui devono essere
assunti con la dieta.
L’omega-3 è presente nel pesce azzurro, nel salmone, nel merluzzo e nell’olio di
mais. Invece sono fonte di omega-6 la frutta secca e i legumi.
O
9
15
16
H3C
10
OH
13
12
acido linolenico (omega-3)
26.
L’olio di semi di mais
e il pesce azzurro sono ricchi di acido
linolenico (omega-3).
20
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
CAPITOLO 24. LE
BIOMOLECOLE
Chapter 24 - biomolecules
SUMMARY
■ Biomolecules include carbohydrates, compounds
that together with lipids provide for the energy needs of
the cell; proteins, compounds essential for body growth;
nucleic acids, responsible for transmission of hereditary
characteristics and protein synthesis; enzymes, which
catalyze chemical reactions occurring in living organisms,
and vitamins.
■ Carbohydrates (or glucides) are composed of carbon,
hydrogen and oxygen. They are divided into
monosaccharides, disaccharides and polysaccharides.
The structure and reactivity of monosaccharides is given
by the presence of an aldehyde or ketone functional
group and of many – OH functional groups.
Disaccharides consist of two monosaccharides linked
together by a glycosidic bond, such as sucrose.
Polysaccharides are polymers of monosaccharides
linked together by glycosidic bonds, such as starch and
cellulose.
■ Proteins are macromolecules that derive from the
chemical combination of amino acids. Amino acids,
arranged in a linear sequence like building blocks, make
up very complex molecular structures.
■ Enzymes are biological catalysts that speed up certain
metabolic reactions at the cellular level.
■ Nucleic acids are macromolecules consisting of
basic structures called nucleotides.
Nucleic acids - deoxyribonucleic acid (DNA)
and ribonucleic acid (RNA) - contain genetic information.
■ Lipids (or fats) can be classified as triglycerides,
phospholipids, steroids.
The constituents of triglycerides are fats and oils.
■ Vitamins are organic substances necessary to man
both for body growth and for body maintenance. They
are divided into fat-soluble and water-soluble.
Per lo sviluppo delle competenze
CONOSCENZE
CHIRALITÀ
E ISOMERI OTTICI
1 Quale delle seguenti affermazioni non è corretta?
a. un composto otticamente attivo ruota la luce ordinaria di un certo angolo
b. un composto otticamente attivo mostra tale proprietà
sia allo stato solido che in soluzione
c. un composto otticamente attivo ruota la luce polarizzata di un certo angolo
d. il glucosio e il fruttosio sono composti otticamente
attivi
2 i composti otticamente attivi:
a. hanno un atomo di carbonio tetraedrico
b. hanno un atomo di carbonio con quattro sostituenti
diversi
c. hanno un doppio legame
d. non sono capaci di cambiare l’asse di vibrazione della
luce polarizzata
3 l’attività ottica di un composto dipende:
a. dalla presenza di un doppio legame
b. dalla mancanza di un alogeno
c. dalla mancanza di simmetria molecolare
d. dalla presenza di una catena di atomi di carbonio
4 i seguenti oggetti si presentano chirali?
rispondi con VEro o Falso
a. le viti
b. le scarpe
c. una palla
d. un ritratto
e. una tazza da caffè
f. un bicchiere
VERO
FALSO
❏
❏
❏
❏
❏
❏
❏
❏
❏
❏
❏
❏
5 in una molecola un atomo di carbonio è chirale se è
legato a:
a. quattro raggruppamenti diversi
b. tre gruppi alchilici diversi
c. un doppio legame e a due legami semplici
d. tre alogeni
6 Quale delle seguenti strutture presenta un carbonio
chirale?
oH
oH
a. CH3 – C – H
b. CH3 – C – CooH
H
H
c. CH3 – C – Cl
H
Paolo Pistarà, ChImICA
ABILITÀ
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
H
Cl
d. H – C – Cl
Cl
21
7 gli isomeri ottici sono composti con:
a. differente formula molecolare
b. differente gruppo funzionale
c. la stessa formula molecolare, ma dotati di attività ottica
d. la presenza di un doppio legame C = C
8 gli enantiomeri sono isomeri:
a. di conformazione
b. ottici, uno l’immagine speculare dell’altro e non sovrapponibili
c. che differiscono per la presenza di gruppi funzionali
diversi
d. con proprietà chimiche e fisiche differenti
15 i simboli L e D che precedono il nome di un carboidrato
stanno ad indicare:
a. il verso in cui il composto ruota il piano della luce
polarizzata
b.la posizione del gruppo oH vicino al gruppo aldeidico
o chetonico
c. la posizione del gruppo oH del carbonio chirale più
distante dal gruppo aldeidico o chetonico
d. la posizione del gruppo aldeidico o chetonico
16 nel passaggio del glucosio dalla forma aperta alla struttura ad anello, il gruppo aldeidico reagisce con l’ossidrile legato al carbonio in posizione:
a. 4
c. 2
b. 5
d. 6
17 il glucosio in soluzione acquosa è presente:
MONOSACCARIDI
9 i monosaccaridi sono composti contenenti i gruppi:
a. amminico e carbossilico
b. alcolico e carbossilico
c. aldeidico o chetonico e alcolico
d. amminico e alcolico
18 nel passaggio del fruttosio dalla forma aperta alla strut-
10 la formula molecolare del glucosio è:
a. C6H12o6
c. C3H6o3
a. soltanto nella forma anomerica a
b. soltanto nella forma anomerica β
c. soltanto nella forma aldeidica
d. nelle forme a e β ed in quella aldeidica
b. C12H22o11
d. C6H10o5
tura ad anello, il gruppo chetonico reagisce con l’ossidrile
legato al carbonio in posizione:
a. 6
c. 4
b. 3
d. 5
11 il glucosio è un:
a. aldoesoso
b. chetoesoso
c. chetopentoso
d. aldopentoso
DISACCARIDI
19 il saccarosio è un disaccaride che deriva dalla condensazione:
12 il glucosio è solubile in acqua perché:
a. ha più di un atomo di carbonio chirale
b. i gruppi oH del glucosio formano legami a idrogeno con
l’acqua
c. è una molecola apolare
d. è deliquescente
13 riguardo al potere rotatorio della luce polarizzata,
un monosaccaride può essere destrogiro (+) o levogiro
(–). Ciò dipende:
a. dalla posizione del gruppo – oH più lontano
b. dalla lunghezza della catena degli atomi di carbonio
c. dall’insieme della sua configurazione
d. dalla presenza del gruppo aldeidico o chetonico
14 i monosaccaridi in natura appartengono:
b. di a-d-glucosio e di β-d-fruttosio
c. di due molecole di β-d-fruttosio
d. di a-d-glucosio e di β-d-galattosio
20 il saccarosio è un disaccaride molto solubile in acqua
perché:
a.deriva dalla condensazione tra a-d-glucosio e β-d-fruttosio
b. non ha un gruppo oH anomerico libero
c. ha un numero elevato di gruppi oH
d. è destrogiro
POLISACCARIDI
21 la cellulosa:
a. è un polisaccaride del β-d-glucosio
b. è attaccata dagli enzimi dell’organismo umano
c. è un disaccaride del β-d-glucosio
d. è una proteina
a. alla serie l
b. sia alla serie l sia alla serie d
c. alla serie d
d. né alla serie d né alla serie l
22
a. di due molecole di a-d-glucosio
Paolo Pistarà, ChImICA
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
CAPITOLO 24. LE
22 rispondi con VEro o Falso alle affermazioni.
29 Quale gruppo funzionale è caratteristico delle pro-
VERO FALSO
a. il prodotto di condensazione di due
monosaccaridi è detto dimero
b. la cellulosa è digeribile
dagli esseri umani
c. gli esseri umani digeriscono l’amido
d. il glicogeno è contenuto nel fegato
e nei muscoli
BIOMOLECOLE
❏
❏
❏
❏
❏
❏
teine?
o
a. n – H
b. – C
o H
c. – C – n –
o
d. – C – H
o–
❏
❏
30 The most simple substances (monomers)
being repeated in proteins are
a. carboxylic acids
b. amino acids
c. amines
d. carbohydrates
AMMINOACIDI
ACIDI
23 Per amminoacido si definisce un composto:
a. ottenuto per sintesi di una ammina con un acido carbossilico
b. con un gruppo alcolico ed un gruppo carbossilico
c. con un gruppo carbossilico ed un gruppo amminico in
posizione a
d. che deriva dall’idrolisi di un polisaccaride
NUCLEICI E NUCLEOTIDI
31 un nucleotide è costituito da:
a. un pentoso ed un gruppo fosfato
b. un esoso ed un gruppo fosfato
c. un pentoso ed una base eterociclica
d. un pentoso, una base eterociclica ed il gruppo fosfato
32 il ribosio è un monosaccaride con:
24 individua l’affermazione non corretta.
I dieci amminoacidi detti essenziali:
a. devono essere introdotti con la dieta
b. non sono sintetizzabili dall’uomo
c. possono provocare gravi patologie in seguito ad una
loro carenza
d. sono i più abbondanti nell’organismo
25 gli amminoacidi non essenziali sono quelli:
a. che non partecipano alla sintesi proteica
b. sintetizzabili dall’organismo
c. non necessari per l’organismo
d. che si degradano con la luce (calore)
26 l’amminoacido alanina è otticamente attivo perché:
a. la molecola è simmetrica
b. il gruppo – CooH forma legami a idrogeno con l’acqua
c. al carbonio centrale sono legati quattro atomi o gruppi
atomici diversi
d. il gruppo – nH2 è un gruppo basico
PROTEINE
a. due atomi di carbonio
b. tre atomi di carbonio
c. quattro atomi di carbonio
d. cinque atomi di carbonio
33 rispondi con VEro o Falso alle seguenti affermazioni.
VERO FALSO
a. gli amminoacidi hanno il gruppo
amminico nel carbonio adiacente
al gruppo carbossilico
b. il legame peptidico risulta
da una reazione di condensazione
c. il glicogeno e l’amido sono
la stessa sostanza
d. i carboidrati sono prodotti mediante
reazioni di fotosintesi
e. le proteine svolgono nel corpo umano
solo la funzione di sostegno
f. i nucleotidi degli acidi nucleici sono
uniti tra loro mediante gruppi fosfato
❏
❏
❏
❏
❏
❏
❏
❏
❏
❏
❏
❏
ENZIMI
34 Quale delle seguenti affermazioni non è corretta?
27 se una proteina viene scaldata a 70 °C, si rompono i
legami:
a. peptidici
b. a idrogeno
c. disolfuro
d. di london
Un enzima:
a. è un catalizzatore biologico specifico
b. è caratterizzato dalla presenza di un sito attivo
c. resiste bene al calore
d. è una proteina
35 individua la definizione non corretta.
28 la denaturazione delle proteine non avviene:
a. a pH molto bassi
b. a pH molto alti
c. al pH fisiologico
d. ad alta temperatura
Paolo Pistarà, ChImICA
Gli enzimi sono:
a. catalizzatori biologici
b. proteine
c. catalizzatori specifici per il substrato
d. una miscela di amminoacidi
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016
23
CoMpetenze
1 Reazione dell’acido solforico con il saccarasio.
Quando si versa dell’acido solforico nel saccarosio,
questo si disidrata e, come si può notare, si trasforma in carbonio.
Quali atomi o gruppi atomici vengono rimossi?
3 La gelatina è una proteina che costituisce il tessuto connettivo della pelle degli animali. La pelle,
trattata con acido tannico (tannino), si trasforma in
cuoio.
Qual è la differenza tra pelle e cuoio?
4 Osserva il disegno e rispondi alle seguenti do-
mande.
2 L’amminoacido più semplice è la glicina la cui formula di struttura si può così rappresentare:
+
O
H3N – CH2 – C –
O
O–
o
H2N – CH2 – C − OH
La glicina, un solido cristallino, presenta le seguenti
proprietà:
– si decompone a 233 °C
– ha una solubilità di 26 g in 100 mL di acqua
Queste proprietà fisiche con quale struttura sono
compatibili, la ionica o la molecolare?
Motiva la tua risposta.
24
Paolo Pistarà, ChImICA
a. In una reazione enzimatica quale meccanismo
viene utilizzato?
b. Nel sito attivo della lattasi (enzima del latte), oltre
al lattosio possono entrare altri composti?
c. Quali prodotti si ottengono dalla scissione del
lattosio?
d. Se l’enzima lattasi non funziona, quale disturbo
ne consegue?
ConCettI e APPlICAzIonI- © istituto italiano
Edizioni atlas - 2016