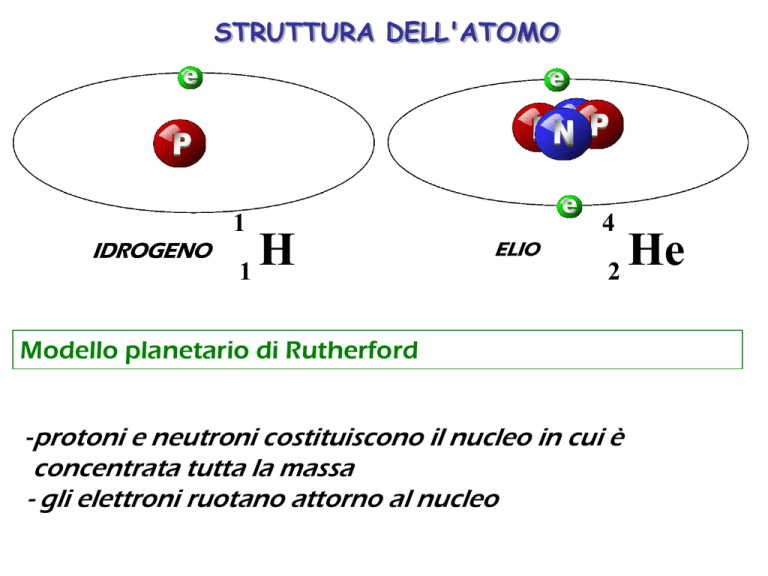
STRUTTURA DELL'ATOMO
1
IDROGENO
H
1
4
ELIO
2
Modello planetario di Rutherford
-protoni e neutroni costituiscono il nucleo in cui è
concentrata tutta la massa
- gli elettroni ruotano attorno al nucleo
He
Modello planetario di Rutherford
Il modello a planetario si basa sull’equilibrio tra la forza di attrazione gravitazionale e la
forza centrifuga.
fgrav
+
-
fcentr
Nel caso di particelle cariche bisogna considerare
che una carica elettrica che subisce una
accelerazione perde energia.
Quindi l’elettrone muovendosi nell’orbita
perderebbe energia cinetica andando a collassare
nel nucleo seguendo un percorso a spirale.
ATOMO INSTABILE!
Radiazioni elettromagnetiche
La maggior parte delle nostre conoscenze sulla struttura
dell'atomo è dovuto a esperimenti di interazione tra luce e
materia.
Natura ondulatoria della luce
Una radiazione elettromagnetica, di cui la luce è un caso
particolare, può essere considerata (Maxwell 1865) come un
campo elettromagnetico oscillante che si propaga nello spazio
Onde elettromagnetiche
Un’onda è caratterizzata dalla lunghezza d’onda () e dalla frequenza ()
- la distanza tra due massimi o due minimi successivi
- è il numero di lunghezze d’onda che passano per un punto fisso in un
secondo.
v (velocità di propagazio ne) m / s 1
Hz
(lunghezzad ' onda)
m
s
ONDE: la frequenza è inversamente proporzionale alla
lunghezza d’onda
Nel vuoto la radiazione elettromagnetica si propaga con la velocità della
luce c (3,00x108 m/s) e vale la relazione:
c=
Spettro delle radiazioni elettromagnetiche
by Andreas Kamlowski
Spettro delle radiazioni
elettromagnetiche
Mediante un prisma un fascio di luce solare
viene scomposta nei colori del visibile
ROSSO
Luce bianca
VIOLA
Effetto fotoelettrico
Quando la superficie di un metallo è esposta ad una radiazione
elettromagnetica si ha espulsione di un elettrone. Gli elettroni sono
espulsi solo se la luce ha una frequenza maggiore di un certo valore
di soglia (v0) caratteristico del particolare metallo.
E= h(-0)
Einstein introdusse il concetto di fotone
La luce è composta da particelle
(FOTONI) ognuno dei quali con una
propria energia (QUANTO DI ENERGIA)
h
Energia cinetica
dell’ e- emesso
Energia fornita
dal fotone
Energia necessaria
per rimuovere un edal metallo
Energia del fotone
insufficiente
Energia del fotone sufficiente
Eccesso di energia = E cinetica
del fotoelettrone
Efotone = hν
Potassio - 2 eV necessari per far emettere un elettrone
L’equazione di Plank.
Gli oggetti riscaldati emettono luce (radiazioni) la cui
lunghezza d’onda dipende dalla temperatura
Plank (1900): l’energia esiste in piccoli pacchetti
(quanti).
L’energia della radiazione e’ collegata alla frequenza
E = h . = h . c/
Costante di Plank
6.6 x 10-34 J. s
frequenza
Lunghezza d’onda
Velocità della luce
nel vuoto = 3x108 m/s
L’energia della radiazione aumenta con la frequenza
ma diminuisce con la lunghezza d’onda
Relazione fra energia e
frequenza
E = h
h = costante di Plank 6.62 x 10-34 J s
E
Dualismo onda-particella della
luce
Fotoni
La fisica classica tratta particelle ed onde come entità distinte
Per rendere conto del DUALISMO onda – particella occorre
una nuova descrizione
Linee spettrali atomiche
Alla fine dell’800 si era osservato che la luce emessa da gas riscaldati ad
alta temperatura o attraverso i quali era fatta passare una scarica
elettrica dà origine ad uno spettro a righe in cui sono presenti solo certe
specifiche lunghezze d’onda
Linee spettrali atomiche
Esperimenti fatti analizzando un fascio di luce bianca dopo
l’attraversamento di un campione mostravano che solo alcune specifiche
lunghezze d’onda erano assorbite dal campione.
Modello atomico di Bohr
Gli elementi eccitati emettono pacchetti specifici di energia (luce)
quindi gli elettroni possono occupare solo orbite specifiche intorno
al nucleo, ed ogni orbita ha energia quantizzata.
RH
E=- 2
n
n 1 , 2 , 3 , .........
in cui RH= 2,18 x 10-18 J è la costante di Rydberg e n è il numero
quantico principale
n=5 =4 =3 =2 =1
E = hc/
Questa transizione
non è possibile
Spettro di emissione
Secondo il modello proposto da Bohr l’emissione di specifiche lunghezze d’onda
può essere spiegato considerando che un elettrone in un atomo può cambiare
energia solo saltando da un livello energetico ad un altro.
Quando esso passa da un livello di energia dell'atomo più alto (Ei iniziale) ad
uno più basso (Ef finale) si ha emissione di luce con una frequenza tale che il
fotone emesso ha energia pari alla differenza fra i due livelli energetici.
h
Ei
Ef
Per la conservazione dell'energia si ha:
h =Ei - Ef
Con la teoria di Bohr è possibile definire anche l'assorbimento di luce.
Questo fenomeno consiste nell'assorbimento di un fotone da parte di un
elettrone in un livello energetico più basso e ne provoca la transizione ad un
livello energetico più alto.
h
Ei
Ei + h = Ef
h =Ef – Ei
Ef
Normalmente l'elettrone di un atomo di idrogeno esiste nel livello più basso
n=1 detto anche livello o stato fondamentale. I livelli di energia superiore sono
detti livelli eccitati.
Modello atomico di Bohr-Sommerfeld
1) Massa dell’atomo concentrata nel nucleo (protoni e
neutroni)
2) Elettroni che ruotano attorno al nucleo con orbite di
energia e dimensione quantizzata
3) NUMERI QUANTICI
principale
n
(1, 2, 3……)
angolare
l
(0, 1, n-1)
magnetico
m
(-l < m < +l)
magnetico di spin
ms
(+1/2, -1/2)
Ogni set di numeri quantici n, l, m, ms definisce un’orbita
per l’elettrone.
Nello stato non eccitato (fondamentale) l’elettrone
percorre l’orbita a minore energia, la più vicina al nucleo.
Limitazioni al modello di Bohr:
• non è “ortodosso”; si parte dalla meccanica tradizionale
(Newtoniana) e si arriva ad un modello fisico discontinuo
introducendo assunzioni non dimostrate.
• il modello fornisce una spiegazione delle proprietà
spettroscopiche dell’atomo di idrogeno ma non è
sufficientemente “robusto” per interpretare gli spettri
energetici degli altri elementi polielettronici.
MECCANICA ONDULATORIA
Ipotesi della dualità onda-corpuscolo di
de Broglie (1924)
Onda elettromagnetica
La luce ha un duplice comportamento
Fascio di particelle (fotoni)
Relazione di Planck
E= h
Relazione di Einstein
E= mc2
Per un fotone
mc 2 h h
c
Per una particella di massa m e velocità v
h
mc
h
mv
Ipotesi della dualità onda-corpuscolo di
de Broglie (1924)
• a tutti gli oggetti in movimento è possibile associare una lunghezza d’onda
• quanto più piccolo è l’oggetto tanto maggiore è la lunghezza d’onda associata
(e quindi il suo comportamento ondulatorio sarà più evidente)
•per una particella macroscopica la lunghezza d'onda associata ha un valore così
piccolo da non permettere di osservare alcuna proprietà ondulatoria
h
mv
Per esempio una palla da tennis che ha massa pari a 0.145 Kg che si muove
alla velocità di 30 m/s ha una lunghezza d'onda:
h
6.6 10-34 Js
1.5 10-34 m
mv 0.145 kg 30 m / s
Un elettrone che ha una massa di 9.11 10-31 Kg che si muove alla velocità di
106 m/s ha una lunghezza d'onda:
h
6.6 10-34 Js
-10
7
.
3
10
m
-31
6
mv 9.1110 kg 10 m / s
Principio di indeterminazione di Heisenberg
Come conseguenza della natura ondulatoria delle particelle microscopiche
esiste una limitazione sulla determinazione simultanea della posizione e della
velocità di tali particelle.
Non è quindi possibile conoscere con esattezza la traiettoria della particella.
Non è possibile descrivere il comportamento dell’elettrone attorno al nucleo
secondo un modello classico perché il prodotto dell'incertezza sulla
posizione e di quella sulla quantità di moto (massa x velocità) di una
particella è maggiore o uguale alla costante di Planck divisa per 4p
.
h
x (mv)
4p
Per si intende la
variazione di errore nella
determinazione
mv è la quantità di moto
Principio di indeterminazione di Heisenberg
Fenomeni macroscopici:
Per una particella macroscopica (m grande)
le incertezze sono trascurabili.
Nessuna conseguenza pratica
Dimensioni atomiche:
Per una particella microscopica (m piccola) le
incertezze diventano significative.
L'incertezza sulla posizione dell'elettrone è
confrontabile con le dimensioni dell'atomo.
Non e’ possibile definire la traiettoria di un
elettrone intorno al nucleo.
Si puo’ parlare della posizione dell’elettrone solo in
termini probabilistici: si trovera’ in una regione
dello spazio con una certa probabilita’.
Equazione di Schrödinger
Meccanica quantistica o meccanica ondulatoria: permette di descrivere
matematicamente le proprietà ondulatorie delle particelle microscopiche
(elettrone).
Invece di una traiettoria, Schrödinger associò all'elettrone un’onda stazionaria
detta funzione d'onda (x,y,z) tale che il suo quadrato |(x,y,z)|2 dà la
probabilità di trovare la particella nel punto dello spazio di coordinate (x,y,z).
onda stazionaria
onda non stazionaria
Orbitali atomici e numeri quantici
In accordo con la meccanica quantistica ogni elettrone in un
atomo è descritto da una funzione d'onda (x,y,z) che dà la
probabilità di trovare l'elettrone nei vari punti nello spazio.
Orbitali atomici e numeri quantici
Tra le infinite funzioni d’onda che sono soluzioni
dell’equazione di Schrödinger solo alcune hanno significato
fisico.
Le soluzioni accettabili derivano dalla combinazione di tre
costanti dette NUMERI QUANTICI.
Queste funzioni d'onda di un elettrone sono chiamate
ORBITALI ATOMICI.
L’orbitale atomico può essere descritto qualitativamente come
la regione dello spazio attorno al nucleo dove è maggiore la
probabilità di trovare l'elettrone.
Numeri quantici
Numero quantico principale n:
determina l'energia dell'elettrone e può assumere qualsiasi valore intero
positivo.
n= 1, 2, 3, ….
Numero quantico del momento angolare :
Determina la forma di orbitali con lo stesso n.
Per ogni dato n, può assumere tutti i valori interi compresi tra 0 e n-1
= 0, 1, 2, …, n-1
Numero quantico magnetico m
Determina l'orientamento spaziale di orbitali con n e definiti.
Per ogni dato m può assumere tutti i valori interi compresi tra - e +, cioè
m= -, …, -2, -1, 0, 1, 2, ….., +
L'elettrone è poi caratterizzato da un quarto numero quantico m s legato al
moto di spin dell'elettrone (rotazione attorno all'asse) e può assumere i valori
ms=+1/2 e ms=-1/2
Orbitali
Gli orbitali vengono indicati scrivendo prima il numero principale n (1,2,3,....)
Ai diversi valori di si associa per convenzione una lettera (s, p, d, f, ....).
Per esempio:
Per n=1 si può avere
=0
cioè l'orbitale 1s
Per n=2 si può avere
=0
=1
cioè l'orbitale 2s
Per n=3 si può avere
Per n=4 si può avere
cioè l'orbitale 2p
=0
=1
=2
cioè l'orbitale 3s
=0
=1
=2
=3
cioè l'orbitale 4s
cioè l'orbitale 3p
cioè l'orbitale 3d
cioè l'orbitale 4p
cioè l'orbitale 4d
cioè l'orbitale 4f
Orbitali
Per ogni valore di , il numero quantico m può assumere tutti i valori interi
compresi tra - e +. Quindi:
=0
=1
=2
=3
s
m=0
1 orbitale s
p
m=-1,0,+1
3 orbitali p
d
m=-2,-1,0,+1,+2
5 orbitali d
f
m=-3,-2,-1,0,+1,+2,+3
7 orbitali f
Orbitale atomico
Descrive l’onda stazionaria corrspondente all’elettrone.
2 E’ correlabile alla probabilita’ di trovare l’elettrone in qualche punto dello
spazio
Orbitale atomico
La probabilità di trovare un elettrone entro una certa area, dV, è data dal
valore di 2 dV.
Al crescere della distanza dal nuleo, cresce dV ma diminuisce 2.
Avrò quindi un massimo del prodotto 2 dV.
Forme degli orbitali
n = 1 l = 0, m= 0
1s
l = 0 m= 0
2s
n=2
l =1
m=1
m=0
m=-1
2px
2py
2pz
Orbitale sferico
Forme degli orbitali
n=3
l =2
m= +2, +1, 0, -1, -2
Orbitali nei primi tre livelli
Per l'atomo di idrogeno l'energia degli orbitali dipende
solo da n
4s
3s
2s
1s
4p
4d
3p
3d
4f
2p
L’unico elettrone si trova nell’orbitale
1s nello stato fondamentale e in un
orbitale superiore negli stati eccitati
Atomi polielettronici
Per gli elementi con più di un elettrone l’energia degli orbitali dipende anche
dal numero quantico , ma non da m.
Bisogna infatti considerara che esistono anche le interazioni repulsive tra gli
elettroni, oltre alle forze di attazione nucleo-elettrone.
Al crescere di n la dipendenza dell'energia da può essere così forte che
orbitali di uno strato superiore possono essere più bassi di quelli dello strato
inferiore con elevato:
Ordine di riempimento per un atomo polielettronico
5p
4d
5s
4p
4s
3s
2s
1s
3p
2p
3d
Configurazioni elettroniche di atomi polielettronici
Si può immaginare di costruire la struttura elettronica di un atomo
collocando tutti gli elettroni uno dopo l’altro partendo dall’orbitale libero
con l’energia più bassa.
1) PAULI: due elettroni di un dato non possono avere tutti e quattro i
numeri quantici uguali.
Quindi un orbitale definito da una terna n, l ed m può ospitare solo su
elettroni che differiscono per il numero ms -1/2 e-1/2.
n=1
l=0 m=0
orbitale 1s può contenere solo 2 elettroni
ms=+1/2 e ms= -1/2
2) HUND: gli orbitali con un dato valore di l devono essere occupati ciascuno
con un elettrone con spin +1/2 e successivamente completati con il
secono elettrone di spin opposto.
Configurazione elettronica
2
1s
numero di elettroni
nell’orbitale
orbitale
Strato (indicato dal numero quantico n)
L'ordine delle energie dei sottostrati è dunque:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p
In realtà questo è un particolare ordine di riempimento e
quando due sottostrati sono vicini l'ordine delle loro energie può
essere invertito.
H
Z=1
1s1
He
Z=2
1s2
Li
Z=3 1s2 2s1
1s
1s
1s
2s
2p
Per il carbonio e gli atomi successivi del secondo periodo si ha
quindi:
C
N
Z=6 1s2 2s2 2p2
2s
2p
1s
2s
2p
1s
2s
2p
1s
2s
2p
1s
2s
2p
Z=7 1s2 2s2 2p3
O
Z=8 1s2 2s2 2p4
F
Z=9 1s2 2s2 2p5
Ne
1s
Z=10 1s2 2s2 2p6
Configurazioni elettroniche e tavola periodica
L'elio He ed il neon Ne hanno gli strati n=1 e n=2 completi cosa
che conferisce a queste configurazioni una particolare stabilità
e rende gli elementi non reattivi
1s2
He
Z=2
Ne
Z=10 1s2 2s2 2p6
Per semplicità nella configurazione di un atomo si scrive [He]
per indicare lo strato n=1 mentre si sta riempiendo lo strato
n=2 o [Ne] per indicare gli strati n=1 e n=2 mentre si sta
riempiendo lo strato n=3. Ad esempio:
O
1s2 2s2 2p4 oppure [He] 2s2 2p4
Configurazione elettronica esterna
Gli elettroni che occupano il livello
energetico, o strato, piu’ esterno
definiscono la configurazione
elettronica esterna di ciascun
elemento
Es. Li [He] 2s1
n=3
Na
Z=11
[Ne] 3s1
Mg
Z=12
[Ne] 3s2
Al
Z=13
[Ne] 3s23p1
Ar
Z=18
[Ne] 3s23p6
oppure
1s2 2s2 2p6 3s1
Anche se non si è completato lo strato n=3 il sottostrato
rimanente, il 3d, è molto più in alto in energia del 3p, persino
più del 4s. Pertanto la configurazione con il sottostrato 3p
riempito è particolarmente stabile e l'argo è un elemento non
reattivo.
Successivamente inizia il riempimento dell'orbitale 4s con
K
Z=19
[Ar] 4s1
Ca
Z=20
[Ar]4s2
ovvero
1s2 2s2 2p6 3s2 3p6 4s1
A questo punto inizia a riempirsi il sottostrato 3d con i
metalli di transizione, 10 elementi perchè sono gli elettroni
che possono occupare i cinque orbitali del sottostrato 3d.
5p
4d
5s
4p
4s
3s
2s
3p
2p
3d
Gli elettroni appartenenti ai gusci più interni (elettroni di core).
Si trovano nei gusci più interni e sono in media più vicini al nucleo:
hanno energie più basse
Gli elettroni di valenza sono quelli che occupano lo strato più
esterno, quello che viene dopo la configurazione del gas nobile che
lo precede.
Quindi elementi successivi ai gas nobili in un gruppo qualsiasi della
tavola periodica sono costituiti da un core o nocciolo a gas nobile
più una configurazione analoga per i restanti elettroni di valenza.
Cl
Z=17
Core
[Ne] 3s23p5
Valenza
Le proprietà e il comportamento chimico di un atomo dipendono proprio
dalla configurazione elettronica di valenza.
Il principio di esclusione di Pauli dice che in un atomo non ci possono essere due elettroni caratterizzati:
• dalla stessa quaterna di numeri quantici
• dallo stesso valore del numero quantico principale
• dallo stesso valore del numero quantico magnetico
• dalla stessa terna di numeri quantici n, l ed m
Secondo il principio di esclusione di Pauli un orbitale può contenere al massimo:
• un elettrone
• due elettroni con spin parallelo
• tre elettroni con spin opposto
• due elettroni con spin antiparallelo
Sapendo che i numeri atomici di Cl (cloro), Ar (argon), e K (potassio) sono rispettivamente 17, 18 e 19, dire se i
due ioni Cl- e K+ e l'atomo di Ar hanno:
• le stesse dimensioni;
• lo stesso numero di elettroni
• lo stesso numero di protoni
• lo stesso numero di neutroni
Nel livello corrispondente a n=4 sono presenti complessivamente:
• 4 orbitali
• 9 orbitali
• 12 orbitali
• 16 orbitali
Nel livello corrispondente a n=3 sono presenti complessivamente::
• 4 orbitali
• 18 elettroni
• 12 elettroni
• 6 orbitali
Indicare quale tra le seguenti puo essere la combinazione dei numeri quantici (n, l, m, s) di un elettrone in un
atomo:
• (0, -1, 1, +1/2)
• (4, -1, 1, +1/2)
• (4, 3, 1, -1/2)
• (4, 4, 1, -1/2)
Indicare quale tra le seguenti combinazioni di numeri quantici (n, l, m, ms) rappresenta una coppia di elettroni
in un orbitale sferico
• (3, 0, 0, +1/2)
• (3, 0, 0)
• (3, 0, 0 -1/2)
• (3, 0, 1)
Indicare quale tra le seguenti combinazioni di numeri quantici (n, l, m, ms) rappresenta un elettrone in un
orbitale a quadrifoglio (4lobi)
• (3, 2, 0, +1/2)
• (3, 1, 0, +1/2)
• (3, 0, 0, -1/2)
• (2, 2, 1, -1/2)
Tavola periodica
Periodo = riga: contiene gli elementi con numero atomico
(e quindi numero di elettroni crescente) da sinistra verso
destra, fino a riempimento di uno strato caratterizzato
da un certo numero quantico principale n
Gruppo = colonna: gli elementi appartenenti allo
stesso gruppo hanno la stessa configurazione
elettronica esterna, ma n crescente dall’alto verso
il basso
Gli elementi del gruppo più a destra corrispondono al
riempimento completo di un sottostrato p (eccetto l’He), che è
molto più basso in energia del sottostrato successivo, e quindi
ad una configurazione molto stabile.
Tali elementi
He elio 1s2
Ne neon 1s2 2s2 2p6
Ar argon 1s2 2s2 2p6 3s2 3p6
Kr kripton 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
sono quindi non reattivi e noti come gas nobili e costituiscono
il gruppo VIII A della tavola periodica
Elementi dello stesso gruppo (colonna) della tavola periodica
hanno configurazioni elettroniche di valenza analoghe. Ad
esempio gli elementi del gruppo IA hanno configurazioni:
H
Li
Na
K
idrogeno
litio
sodio
potassio
1s1 (eccezione)
[He] 2s1
[Ne] 3s1
[Ar] 4s1
hanno tutti un solo elettrone di valenza ed una configurazione ns 1
Gli elementi del primo gruppo sono noti come METALLI
ALCALINI (eccetto H) ed hanno proprietà chimiche molto simili;
ad esempio formano facilmente ioni Li+, Na+, K+
Consideriamo gli elementi del gruppo IIA:
Be berillio
Mg magnesio
Ca
calcio
Sr stronzio
[He] 2s2
[Ne] 3s2
[Ar] 4s2
[Kr] 5s2
Essi sono noti come METALLI ALCALINO-TERROSI.
Hanno tutti una configurazione degli elettroni di valenza ns2 e
proprietà chimiche simili.
La somiglianza tra le configurazioni degli elettroni di valenza
spiegano la somiglianza tra le proprietà chimiche all'interno dei
gruppi. In molti casi è sufficiente solo conoscere la
configurazione di valenza che si può ricavare dal numero del
gruppo.
Anomalie nella configurazione elettronica
degli elementi di transizione
Sc
[Ar]3d14s2
Fe [Ar]3d64s2
Ti
[Ar]3d24s2
Co [Ar]3d74s2
V
[Ar]3d34s2
Ni [Ar]3d84s2
Cr
[Ar]3d54s1
Cu [Ar]3d104s1
Mn
[Ar]3d54s2
Zn [Ar]3d104s2
quando è possibile una configurazione con il riempimento a
metà o totale degli orbitali d, essa è favorita rispetto alle altre
Massa atomica
Numero atomico
8
Ossigeno
15,9994
Elettronegatività
13,61
Prima
ionizzazione
(eV)
O
0,66
[He] 2s2 2p4
Raggio atomico (Å)
3,5
-2
Numeri di
ossidazione
Proprietà fisiche e chimiche
Raggio atomico
Energia di ionizzazione
Affinità elettronica
Numeri di ossidazione
Struttura cristallina
Raggio atomico
I raggi atomici seguono il
seguente andamento:
- diminuiscono da sinistra a
destra lungo un periodo
- aumentano scendendo lungo
il gruppo
Lungo il gruppo n cresce e maggiore è il numero quantico n più
grande è l'orbitale
Lungo il periodo (a parità di n) cresce Z e quindi la carica del
nucleo. Il maggior numero di protoni nel nucleo esercita sugli
elettroni esterni una maggiore attrazione e quindi il raggio
decresce.
Energia di ionizzazione
L'energia (o potenziale) di prima ionizzazione è l'energia minima
necessaria per rimuovere l'elettrone più esterno di un atomo
neutro allo stato gassoso.
A(g) A+(g) + e-(g)
E.I.
Ad esempio per l'atomo di litio:
Li (1s2 2s1) Li+ (1s2) + e-
E.I.= 519 kJ/mol
Le energie di ionizzazione sono in genere riferite ad una mole di
atomi e riportate in kJ/mol.
Periodicità dell’energia di ionizzazione
Aumenta lungo il periodo e diminuisce lungo il gruppo.
Lungo il periodo cresce Z e quindi la carica nucleare, il raggio atomico decresce
e quindi è richiesta più energia per allontanare un elettrone più attratto dal
nucleo.
Lungo il gruppo principale (I-VIIIA) le energie di ionizzazione diminuiscono
andando verso il basso: ciò perchè scendendo lungo il gruppo le dimensioni
atomiche aumentano e l’elettrone più esterno è più facile da rimuovere.
E’ possibile rimuovere da un atomo più di un elettrone.
Le energie richieste sono note come energie di prima ionizzazione, seconda
ionizzazione, terza ionizzazione, ecc..
M M+ + e-
prima ionizzazione
M+ M2+ + e-
seconda ionizzazione
M2+ M3+ + e-
terza ionizzazione
Le energie di ionizzazione aumentano progressivamente.
Si ha inoltre un brusco aumento in corrispondenza della rimozione del primo
elettrone di core
Affinità elettronica
L‘affinità elettronica è la variazione di energia per il processo di
addizione di un elettrone ad un atomo neutro allo stato gassoso
per dare uno ione negativo.
A(g) + e- A-(g)
A.E. (kJ/mol)
Se lo ione negativo è stabile la variazione di energia ha un valore
negativo, mentre valori positivi indicano uno ione instabile
La variazione periodica dell’affinità elettronica è meno regolare
rispetto a quella dell’energia di ionizzazione
Valori grandi negativi sono osservati per gli elementi del gruppo
VIIA ai quali manca un solo elettrone per raggiungere una
configurazione stabile di gas nobile:
F (1s22s22p5) + e- F- (1s22s22p6) A.E.=-328 kJ/mol
In generale, con varie eccezioni, per EI ed AE si ha:
La maggior parte degli elementi è costituita da metalli:
Sostanze solide con buone conducibilità termica ed elettrica, malleabilità e
duttilità
H
He
Non metalli
Semimetalli
Li Be
Na
B
Metalli
M
g
C N O
Al Si P
Ne
Cl Ar
M
Fe Co Ni
n
Cu Zn Ga Ge
A
Se Br Kr
s
M
Tc Ru Rh Pd
o
Ag Cd In Sn
S
Te
b
K Ca
Sc
Ti
Rb Sr
Y
Zr Nb
Cs Ba
Lu Hf Ta W Re Os Ir
Fr Ra
Lr
La
S
F
V Cr
Pt
I
Xe
Au Hg Tl Pb Bi Po At Rn
Rf Db Sg Bh Hs Mt Uun Uuu
Ce
Pr Nd
Ac Th Pa
U
P
m
Sm Eu Gd Tb Dy Ho Er
Np Pu
A
m
C
m
Bk
Cf
Es
F
m
T
m
Yb
M
d
No
Element structures
I metalli formano cationi, per quelli non di transizione
la carica del catione è uguale al numero del gruppo.
Na([Ne]3s1) Na+([Ne])
Mg([Ne]3s2) Mg2+([Ne])
Gli elementi più pesanti dei gruppi IIIA-VA tendono a conservare gli elettroni
ns2
Sn ([Kr]4d105s25p2) Sn2+ ([Kr]4d105s2)
I non metalli formano anioni con carica pari al numero del
gruppo meno 8
Raggi ionici
Un catione è più piccolo del corrispettivo atomo neutro perchè ha perso gli
elettroni di valenza o parte di essi. R catione < Ratomo
Al contrario un anione è più grande del corrispettivo atomo neutro perchè
ha acquistato degli elettroni. Ranione > Ratomo
I raggi ionici aumentano scendendo lungo un gruppo a causa dell'aumento
del numero di elettroni.
I raggi ionici diminuiscono lungo un periodo (cationi ed anioni vanno
considerati separatamente)
Ione
raggio (Å)
Na+ Mg2+
0,95 0,65
Al3+
0,50
Isoelettronici con Ne
S21,84
Cl1,81
Isoelettronici con Ar
Variazioni delle proprietà periodiche e del carattere metallico nella tavola
periodica.











