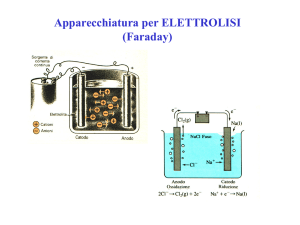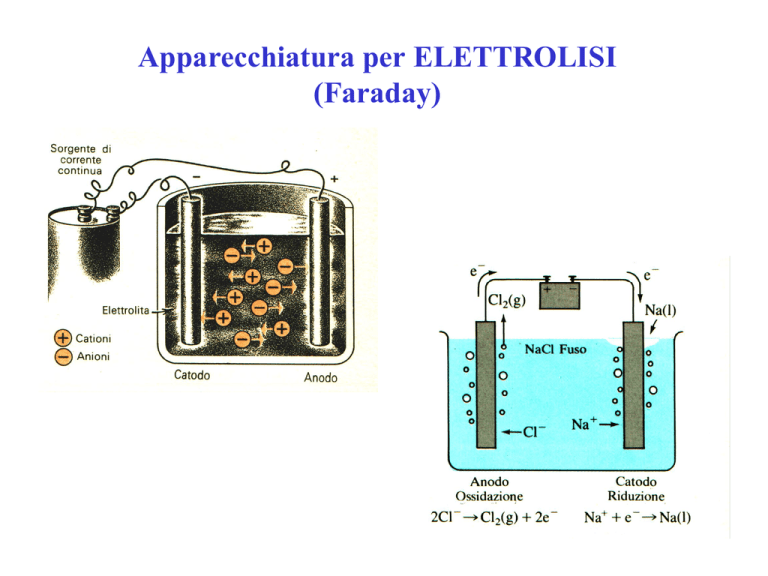
Apparecchiatura per ELETTROLISI
(Faraday)
Apparecchio usato per osservare la scarica
elettrica nei gas a bassa pressione
Studio della natura dei raggi catodici
Tubo catodico di Thomson
Tubo di scarica per lo studio delle
particelle positive
Particelle subatomiche
particella
c/m
(coul/g)
c
(coul)
m
(g)
Elettrone
1,76 . 108
-1,6 . 10-19
9,1 . 10-28
Protone
0,95 . 10
5
Neutrone
Part. a
0,48. 105
c = carica elettrica;
in unità elettroniche
c
m
-1
1
1,67 . 10
+1
1836
0
1,67 . 10-24
0
1838
+3,2 . 10-19
6,68 . 10-24
+2
7344
-19
+1,6 . 10
m = massa
-24
Deviazione dei raggi a, b e g in un campo
magnetico
L’esperimento di RUTHERFORD
L’esperimento di RUTHERFORD
La maggior parte delle particelle a non vengono deviate, ma
alcune vengono diffuse sotto ampi angoli. Per causare l’ampia
deflessione, gli atomi devono contenere nuclei pesanti, carichi
positivamente.
Dispersione spettrale della luce attraverso un
prisma ottico
Saggi alla fiamma per metalli alcalini
Li
Na
K
Spettri di emissione
Spettri di assorbimento
Forze che
agiscono
sull’elettrone
in moto su
un’orbita
Calcolo della forza centrifuga
in equilibrio con la forza
centripeta di attrazione
elettrostatica, nella teoria di
BOHR dell’atomo di H
Raggi delle orbite di
BOHR per l’atomo di H
corrispondenti a n=1,
n=2 e n=3
Relazione tra
energia e
raggio
dell’orbita
dell’H
secondo il
modello di
Bohr
Simile al sistema solare
?
Simile all’andamento dei fori su
un bersaglio ?
L’atomo dell’H
planetario e
quantomeccanico
Superfici nodali per
un atomo di H
orientazioni e superfici nodali degli
orbitali n =2 per l’atomo di H
Forme degli orbitali atomici s, p e d
Orbitali atomici di atomi monoelettronici
Orbitali atomici e numeri quantici
Suddivisione degli orbitali atomici in strati e
sottostrati
1s
Contenuto di energia negli orbitali
periodo
AUFBAU
Riempimento
graduale degli
orbitali atomici
con elettroni al
crescere del
numero atomico
1°
2°
3°
simbolo
Numero
atomico
Formula
elettronica
Struttura elettronica
esterna
s
p
H
1
1s
↑
He
2
1s2
↑↓
Li
3
[He] 2s
2 ↑
Be
4
[He] 2s2
2 ↑↓
B
5
[He] 2s2 2p
2 ↑↓
2 ↑
C
6
[He] 2s2 2p2
2 ↑↓
2 ↑ ↑
N
7
[He] 2s2 2p3
2 ↑↓
2 ↑ ↑
↑
O
8
[He] 2s2 2p4
2 ↑↓
2 ↑↓ ↑
↑
F
9
[He] 2s2 2p5
2 ↑↓
2 ↑↓ ↑↓ ↑
Ne
10
[He] 2s2 2p6
2 ↑↓
2 ↑↓ ↑↓ ↑↓
Na
11
[Ne] 3s
3 ↑
Mg
12
[Ne] 3s2
3 ↑↓
Al
13
[Ne] 3s2 3p
3 ↑↓
3 ↑
Si
14
[Ne] 3s2 3p2
3 ↑↓
3 ↑ ↑
P
15
[Ne] 3s2 3p3
3 ↑↓
3 ↑ ↑
↑
S
16
[Ne] 3s2 3p4
3 ↑↓
3 ↑↓ ↑
↑
Cl
17
[Ne] 3s2 3p5
3 ↑↓
3 ↑↓ ↑↓ ↑
Ar
18
[Ne] 3s2 3p6
3 ↑↓
3 ↑↓ ↑↓ ↑↓
Aufbau della 1° serie dei metalli di transizione
Formule elettroniche degli elementi del 1°, 5° e 8°
gruppo
Raggi atomici
(Ǻ)
Raggi atomici di elementi metallici (ängstroms)
Energia di 1° ionizzazione
Affinità elettroniche di alcuni elementi
significativi (kJ/mol)
La Tavola Periodica