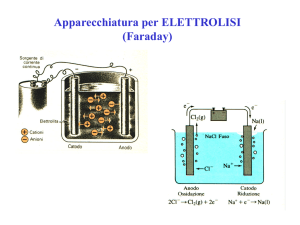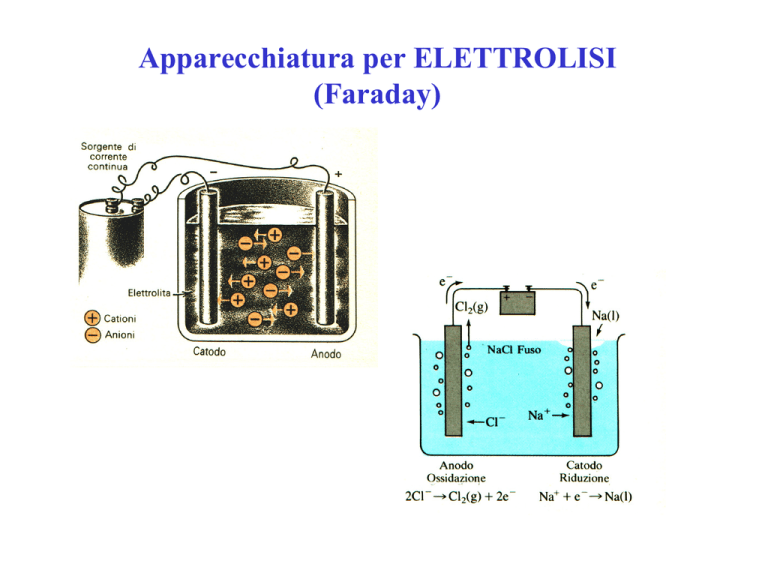
Apparecchiatura per ELETTROLISI
(Faraday)
Apparecchio usato per osservare la scarica
elettrica nei gas a bassa pressione
Studio della natura dei raggi catodici
Tubo catodico di Thomson
Tubo di scarica per lo studio delle
particelle positive
Particelle subatomiche
particella
c/m
(coul/g)
c
(coul)
m
(g)
Elettrone
1,76 . 108
-1,6 . 10-19
9,1 . 10-28
-1
1
Protone
0,95 . 105
+1,6 . 10-19
1,67 . 10-24
+1
1836
0
1,67 . 10-24
0
1838
+3,2 . 10-19
6,68 . 10-24
+2
7344
Neutrone
Part. α
0,48. 105
c = carica elettrica; m = massa
in unità elettroniche
c
m
Deviazione dei raggi α, β e γ in un campo
magnetico
L’esperimento di RUTHERFORD
Dispersione spettrale della luce attraverso un
prisma ottico
Saggi alla fiamma per metalli alcalini
Li
Na
K
Forze che
agiscono
sull’elettrone
in moto su
un’orbita
Calcolo della forza centrifuga
in equilibrio con la forza
centripeta di attrazione
elettrostatica, nella teoria di
BOHR dell’atomo di H
Raggi delle orbite di
BOHR per l’atomo di H
corrispondenti a n=1,
n=2 e n=3
Relazione tra
energia e
raggio
dell’orbita
dell’H
secondo il
modello di
Bohr
Simile al sistema
solare ?
Simile all’andamento dei fori su
un bersaglio ?
L’atomo dell’H
planetario e
quantomeccanico
Superfici nodali per
un atomo di H
orientazioni e superfici nodali degli
orbitali n =2 per l’atomo di H
Forme degli orbitali atomici s, p e d
Orbitali atomici di atomi monoelettronici
Orbitali atomici e numeri quantici
Suddivisione degli orbitali atomici in strati e
sottostrati
1s
Contenuto di energia negli orbitali
periodo
AUFBAU
Riempimento
graduale degli
orbitali atomici
con elettroni al
crescere del
numero atomico
1°
2°
3°
simbolo
Numero
atomico
Formula
elettronica
Struttura elettronica
esterna
s
p
H
1
1s
↑
He
2
1s2
↑↓
Li
3
[He] 2s
2 ↑
Be
4
[He] 2s2
2 ↑↓
B
5
[He] 2s2 2p
2 ↑↓
2 ↑
C
6
[He] 2s2 2p2
2 ↑↓
2 ↑
↑
N
7
[He] 2s2 2p3
2 ↑↓
2 ↑
↑
↑
O
8
[He] 2s2 2p4
2 ↑↓
2 ↑↓ ↑
↑
F
9
[He] 2s2 2p5
2 ↑↓
2 ↑↓ ↑↓ ↑
Ne
10
[He] 2s2 2p6
2 ↑↓
2 ↑↓ ↑↓ ↑↓
Na
11
[Ne] 3s
3 ↑
Mg
12
[Ne] 3s2
3 ↑↓
Al
13
[Ne] 3s2 3p
3 ↑↓
3 ↑
Si
14
[Ne] 3s2 3p2
3 ↑↓
3 ↑
↑
P
15
[Ne] 3s2 3p3
3 ↑↓
3 ↑
↑
↑
S
16
[Ne] 3s2 3p4
3 ↑↓
3 ↑↓ ↑
↑
Cl
17
[Ne] 3s2 3p5
3 ↑↓
3 ↑↓ ↑↓ ↑
Ar
18
[Ne] 3s2 3p6
3 ↑↓
3 ↑↓ ↑↓ ↑↓
Aufbau della 1° serie dei metalli di transizione
Formule elettroniche degli elementi del 1°, 5° e 8°
gruppo
Raggi atomici
(Ǻ)
Raggi atomici di elementi metallici (ängstroms)
Energia di 1° ionizzazione
Affinità elettroniche di alcuni elementi
significativi (kJ/mol)