Chimica acido-base dei composti carbonilici
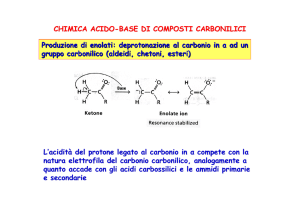
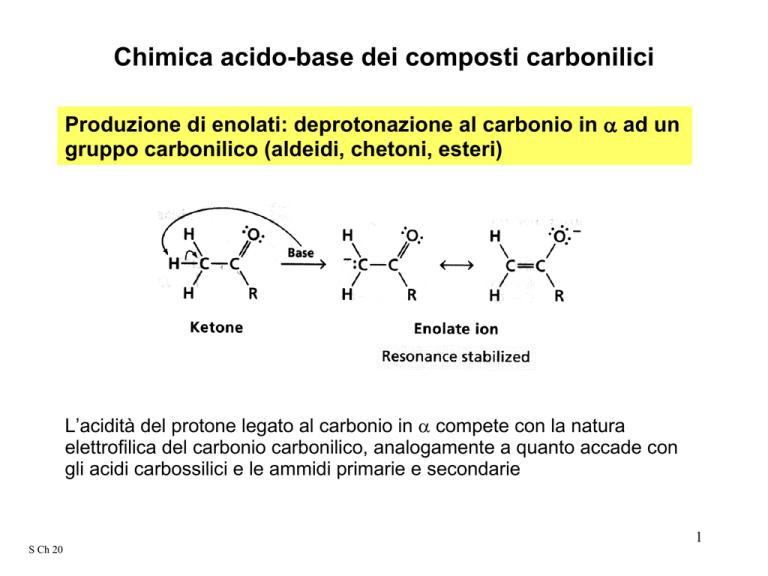
Produzione di enolati: deprotonazione al carbonio in α ad un
gruppo carbonilico (aldeidi, chetoni, esteri)
L’acidità del protone legato al carbonio in α compete con la natura
elettrofilica del carbonio carbonilico, analogamente a quanto accade con
gli acidi carbossilici e le ammidi primarie e secondarie
S Ch 20
1
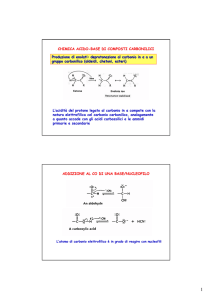
Addizione di una base/nucleofilo al carbonile
L’atomo di carbonio elettrofilo è in grado di reagire con nucleofili
Il protone acido è in grado di reagire con basi
S918
2
Acidità di acidi carbossilici, solfonici e fosforici
Maggiore è la forza dell’acido più basso è il valore di pKa.
Gli acidi carbossilici tendono a dare reazioni acido-base con i nucleofili.
Il pKa di un acido carbossilico è circa 5, cosa che li rende le molecole più acide
contenenti solamente C, H e O.
Questa acidità origina dalla stabilizzazione della base coniugata, lo
ione carbossilato
S980
3
Acidità di acidi solfonici (pKa < 0) e fosforici (pKa ≈ 2)
Gli altri acidi solfonici e fosforici sono ancora più forti.
Gli acidi fosfonici in basse concentrazioni possono anche perdere il secondo
protone (cosa che accade ad esempio in condizioni fisiologiche)
Esercizio:
Disegnare le formule di risonanza del dianione di un acido fosforico
ottenuto per dissociazione di due protoni (RO-PO32-)
S980
4
Acidità in acqua di acidi carbossilici, solfonici
e fosforici
In acqua tutti questi acidi si dissociano
S981
5
Variazione di acidità – Effetti induttivi
Perchè l’acido cloroacetico ha pKa più basso?
Una razionalizzazione semplificata si basa
sull’elettronegatività dei sostituenti: la maggior
elettronegatività del cloro rende più positivo il
carbonio ad esso legato, che a sua volta sottrae
densità elettronica al carbonio carbonilico e
all’ossigeno, rendendo il legame O-H più debole
e di conseguenza il protone più acido.
Un effetto analogo agisce sulla base coniugata,
che risulta quindi più stabile.
S982
6
Variazione di acidità – Effetti induttivi
Derivati acido acetico
S983
7
Variazione di acidità – Effetti Induttivi
Derivati acido butanoico
Gli effetti induttivi influenzano l’acidità degli acidi carbossilici: gruppi
elettron-attrattori aumentano l’acidità; gli elettron-donatori la
dimuiscono.
L’effetto diminuisce all’aumentare del numero di atomi che separano il
sostituente dalla funzione carbossilica.
S984
8
Variazione di acidità – Effetti Induttivi
Derivati acido benzoico
S985
9
Variazione di acidità – Effetti Induttivi
Derivati acido benzoico
Anche nel caso dei derivati degli acidi benzoici possiamo individuare un effetto induttivo
dei sostituenti in anello sull’acidità. Anche in questo caso i sostituenti elettron-attrattori
(EWG) aumentano l’acidità mentre quelli elettron-donatori (EDG) la diminuiscono.
Un sostituente in posizione orto porta ad una diminuzione sul valore della pKa,
indipendentemente dalla sua natura. Questo fenomeno (effetto orto), deriva da
interazioni di carattere sterico tra il sostituente e la funzione carbossilica.
pKa
pKa
pKa = 4.21
S985
10
Acidi dicarbossilici
Sulla base di quanto visto
precedentemente, questi acidi
sono acidi più forti dell’acido
acetico, per lo meno per quel
che riguarda la dissociazione
della prima funzione
carbossilica, e l’effetto del
sostituente dipende fortemente
dal numero di legami che lo
separano dalla funzione acida.
Il valore più alto della seconda
pKa dipende dalla presenza di
un sostituente carbossilato
(effetto elettron-donatore) e
dalla solvatazione.
S985
11
Esercizio:
La prima dissociazione dell’acido ossalico e malonico potrebbe essere
aumentata anche dalla formazione di un forte legame ad idrogeno nel
mono-anione.
Disegnare queste strutture e spiegare perchè dovrebbero essere più
stabilizzate rispetto a quelle generate dagli altri diacidi mostrati nella
tabella precedente.
O-
O
COOH
COO-
COOH
COOH
H
O
O
O
COOH
COO-
OH
COOH
COOH
O
O
S986
12
Acidità degli acidi carbossilici e delle ammidi
S986
1.
Gli effetti di risonanza sono molto importanti nel determinare
l’acidità dei composti organici, rendendo gli acidi carbossilici i
composti organici più acidi tra quelli che contengono gruppi O-H
2.
Gli effetti induttivi di sostituenti presenti sulla molecola ne
modulano l’acidità, rimuovendo o donando densità elettronica
dal o al gruppo carbossilico
13
Acidità delle ammine e delle ammidi
Un’ammina (pKa ≈ 40) può essere
deprotonata solo da una base
molto forte, quale RLi.
Un’ammide può essere deprotonata, almeno in parte, da basi molto meno
forti, anche OH-. Tra i derivati degli acidi, le ammidi sono quelle che si
idrolizzano più difficilmente in condizioni basiche. Infatti l’ammide
deprotonata, stabilizzata per risonanza, è meno prona a reagire con un OHdel carbonile degli altri derivati degli acidi.
L’N,N-dimetilbutanammide viene
idrolizzata in NaOH acquoso più
velocemente della butanammide
stessa. Perchè?
S987
14
Acidità dei chetoni
In un composto come l’acetone, il gruppo metile in α al carbonile si comporta
come un OH di un acido carbossilico o un NH di un’ammide. In presenza di
una base forte il protone può essere rimosso generando un carbanione,
l’enolato.
La stabilizzazione della carica negativa mediante risonanza consente di
spiegare perchè la pKa di un protone legato ad un carbonio in α a un carbonile
ha un valore ≈ 20 rispetto al CH di un alcano (pKa ≈ 50).
S987-8
15
Valori di pKa di derivati carbonilici e dei loro analoghi
metilenici
La presenza di un gruppo carbonilico rende i protoni di un gruppo in α
molto più acidi rispetto all’analogo idrocarburo
S988
16
Come si forma un enolato?
Un enolo (alcol vinilico) può essere ottenuto per idratazione di un
alchino:
L’enolo non è un composto stabile e si trasforma velocemente in un
composto carbonilico mediante un processo chiamato tautomeria
cheto-enolica
S989
17
Un polimero molto diffuso: l’alcol polivinilico
OH
CH٢
CH
n
OH
n H٢ C
CHOH
CH٢
???
CH
n
CH٣CHO
OH
OCOCH٣
idrolisi
HC
CH
n H٢ C
CHOCOCH٣
CH٢
CH٢
CH
CH
n
n
vinile acetato
poli(vinile acetato)
18
Esercizio: nel seguente processo la forma enolica è favorita: perchè?
S989
19
Come si forma un enolato?
L’enolato altro non è che il prodotto di una reazione acido-base di un
enolo (alcol vinilico)
H
C
OH
H+, OH- cat.
O
C
C
C
OC
H
O
C
OH
- H+
- H+
C
C
cheto
O
C
enolo
cheto
C
C
C
enolo
O
enolato
C
C
Carica negativa
delocalizzata tra C e O
20
Meccanismo della tautomeria cheto-enolica
(ambiente acido):
H2O come nucleofilo idrato
H2O come base enolo
S990
21
Meccanismo della tautomeria cheto-enolica
(ambiente basico):
Formazione di enolati a partire da composti carbonilici:
S991
22
Enoli in biochimica
Processo di glicolisi:
Isomerizzazione di zuccheri mediante trasposizione della funzione carbonilica
(D-glucosio fosfato a D-fruttosio fosfato)
La reazione avviene via formazione di
un endiolo acido-catalizzata (l’enzima
utilizza funzioni acide)
Vitamina C
S991
CH2OH
H C OH
O
O
HO
OH
23
Reazioni di racemizzazione di composti carbonilici
Se un chetone enantiopuro viene trattato con un acido o una base
racemizza attraverso la formazione di un intermedio achirale, l’enolo
La racemizzazione è un processo entropicamente favorito, poiché la
concentrazione dell’enantiomero di partenza si dimezza durante il processo
∆G° = ∆H° - T∆S° ; ∆H° ca. 0
∆ S = − R ( x1 ln x1 + x2 ln x2 ); x1 = x2 =
1
2
∆ S = − R ( 12 ln 12 + 12 ln 12 ) = − R ln 12 = R ln 2 (> 0)
∆ G = − T∆ S = − RT ln 2 = − 0.41 kcal/mol a 25 ° C
S992
24
Reazioni di racemizzazione di composti carbonilici
Racemizzazione dell’(R)-Thalidomide
sedativo
teratogeno
Anche gli amminoacidi possono racemizzare con questo tipo di
meccanismo, anche se questo normalmente non avviene in
condizioni fisiologiche
S992
25
α-Alogenazione dei chetoni
O
O
H
C
X2, H+ oppure OH-
X
C
H
H
H
H
X = Cl, Br, I
La reazione porta alla sostituzione di uno o tutti gli H con X.
Procede attraverso la formazione dell’enolo o enolato
26
α-Alogenazione dei chetoni via enolato: condizioni
basiche
Formazione dell’enolato
Addizione elettrofila
α-bromochetone
Formazione di un nuovo
enolato (H più acido)
Addizione elettrofila
(Dibromo derivato)
La monoalogenazione non può essere ottenuta in condizioni basiche.
La maggior reattività dei prodotti può essere sfruttata per la produzione di
un aloformio (CHX3)
S993
27
Reazione dell’aloformio
L’α,α,α-triiodometilchetone reagisce con OHSi forma un intermedio
tetraedrico. l’ α,α,α-triiodometil
carbanione è un gruppo uscente
relativamente buono in queste
condizioni di reazione.
La protonazione del
carbanione genera lo
iodoformio.
S994
28
α-Alogenazione dei chetoni via enolo: condizioni acide
Protonazione del chetone
Formazione dell’enolo
(stadio lento)
Addizione elettrofila
Br- agisce da base e rigenera la
funzione carbonilica
S995
29
α-Alogenazione dei chetoni via enolo: condizioni acide
Cosa accade se Br- porta un attacco
nucleofilo al carbonio carbonilico?
Si genera una bromoidrina
geminale che è instabile e
rigenera la funzione carbonilica
eliminando HBr
L’α-bromo-chetone enolizza più lentamente del chetone non
sostituito, quindi si può ottenere il prodotto monoalogenato.
S995-6
30
Sintesi di enolati con basi forti
Se si vogliono utilizzare nucleofili diversi da un alogenuro si deve
generare l’enolato in presenza di una base forte (pKa ≈ 20-25).
Generalmente si utilizzano solventi aprotici quali il THF (nel quale LDA è
solubile). Con l’LDA si utilizza una base non nucleofila, con NaH si ottiene H2
come prodotto secondario
S996
31
Sintesi di enolati con basi forti
Un enolato generato in queste condizioni è generalmente stabile.
H
O
H
O
H
H
H
H
Solitamente si disegna un enolato con la carica
localizzata sull’atomo di ossigeno:
L’ossigeno è più elettronegativo e quindi queste sono
le forme di risonanza più significative
Cationi piccoli quali Li+ e K+ hanno maggior affinità per
l’ossigeno che per il carbonio.
L’atomo di carbonio è più nucleofilo, e quindi è in questa posizione
che le reazioni avvegono preferenzialmente
32
Cosa avviene se abbiamo un chetone non simmetrico?
Prodotto cinetico (minor
ingombro sterico)
Prodotto termodinamico
(alchene più stabile)
Si possono formare due enolati: il primo è quello che si forma più
velocemente (prodotto cinetico).
Il secondo è quello più stabile (prodotto termodinamico) (alchene
tetrasostituito). Si forma principalmente se il sistema viene portato
all’equilibrio.
S997
33
Prodotto cinetico vs. prodotto termodinamico
I protoni in posizione 6 sono meno ingombrati da un punto di vista sterico, per cui
possono essere rimossi più facilmente se si utilizza una base stericamente
ingombrata come l’LDA. Per cui, scegliendo le condizioni di reazione possiamo
favorire la formazione del prodotto cinetico o del prodotto termodinamico. Se
lavoriamo a bassa temperatura e con una base forte favoriamo il prodotto
cinetico (diminuiamo l’energia dello stato di transizione); se lavoriamo a
temperature più elevate, eccesso di chetone e con basi deboli favoriamo il
prodotto termodinamico.
S998
34
Prodotto cinetico vs. prodotto termodinamico
Controllo cinetico: base forte e ingombrata, bassa T
Controllo termodinamico: base meno forte e poco
ingombrata, alta T
S998
35
Esercizio: Razionalizzare la selettività di queste due reazioni.
Prodotto cinetico (meno
ingombrato)
S998
Prodotto termodinamico
(più stabile)
36
Reazione di un enolato con un alogenuro alchilico
Se si tratta un enolato con un alogenuro alchilico si ottiene il prodotto di
alchilazione. La reazione procede con un tipico meccanismo SN2 se l’alogenuro
è primario. Con alogenuri secondari e terziari i prodotti di eliminazione
prevalgono poiché l’enolato è una base forte.
In realtà la reazione non si ferma a livello di mono alchilazione. Infatti l’enolato di
partenza può agire da base e deprotonare nuovamente il prodotto monoalchilato
S999
37
Reazione di un enolato con un alogenuro alchilico
Il nuovo enolato può nuovamente essere alchilato portando al derivato
diachilato. Per cui si ottengono miscele di prodotti polialchilati.
In alcuni casi si possono ottenere selettivamente prodotti di
mono-alchilazione
S999-1000
38
Esercizio: Come preparereste questi composti utilizzando
un’alchilazione? Potete utilizzare composti organici fino a 8 atomi di
carbonio e qualsiasi reagente inorganico.
O-
O
CH2
X
α
O
CH3
S1000
39
S1002
40
Alchilazione di un chetone via derivati enamminici
I problemi principali dell’alchilazione di composti carbonilici via
formazione dell’enolato sono la polialchilazione e la scarsa
regioselettività del processo.
Le ammine secondarie possono reagire con composti carbonilici
generando un’enammina.
S1002
41
Alchilazione di un chetone: derivati enamminici
Le enammine sono
nucleofili stabili, e possono
reagire con alogenuri
alchilici reattivi generando
un ione imminio sostituito,
che non ha più carattere
nucleofilo.
Dopo idrolisi si ottiene il composto carbonilico di partenza mono-alchilato
S1003
42
Alchilazione di un chetone: derivati enamminici
Il processo avviene solamente con alogenuri alchilici molto reattivi
S1003
43
Carbanioni di chetimmine
Invece che un’enammina possiamo generare un carbanione di una
chetimmina, che avrà un carattere nucleofilo maggiore
Molti chetoni condensano facilmente con ammine primarie come la
cicloesilammina per generare l’immina corrispondente
S1004
44
Carbanioni di chetimmine
Il trattamento dell’immina con un composto di
Grignard genera un derivato molto simile ad un
enolato, nel quale il metallo è probabilmente
associato più fortemente con l’eteroatomo che con il
carbonio in α.
In presenza di un alogenuro alchilico si ha la reazione di sostituzione
S1004
45
Carbanioni di chetimmine
L’idrolisi porta alla rigenerazione della funzione carbonilica di partenza
L’anione di una chetimmina è un utile nucleofilo poiché è stabile e regisce con
elevate regioselezioni senza fornire prodotti di polialchilazione. Generalmente si
ottiene il prodotto di alchilazione al carbonio meno sostituito.
S1005
46
Esercizio: I dimetil idrazoni possono essere usati al posto delle immine nelle
reazioni viste prima. Quale sarà il prodotto atteso dalla seguente serie di
reazioni? (il trattamento con sodio periodato idrolizza l’idrazone in condizioni
blande)
O
NNMe2
Me2NNH2
LDA
NNMe2
NNMe2
i-PrI
NaIO4
O
S1006
47
Carbanioni di immine ingombrate – enolati di aldeidi
Gli enolati delle aldeidi non hanno problemi di regiochimica nella reazione di
alchilazione, ma sono molto reattivi e subiscono reazioni di
autocondensazione
La reazione di un aldeide con un’ammina primaria produce l’immina
corrispondente, che per trattamento con una base forte produce un
carbanione molto più stabile e meno tendente all’auto-condensazione
S1006
48
Carbanioni di immine ingombrate – enolati di aldeidi
Alchilazione e idrolisi acida che rigenera la funzione carbonilica di
partenza
Possono anche essere usati reagenti di Grignard
S1007
49
Enolati di esteri e nitrili
Il pKa di un protone in α di un estere (pKa = 24-25) è 4-5 ordini di grandezza
maggiore di quella di un chetone o un’aldeide (pKa ca. 20).
Questo deriva dalla minore stabilizzazione dell’anione, poiché il sistema
carbossilico è già parzialmente delocalizzato ancor prima della deprotonazione.
Una delle formule di risonanza pone
una carica positiva sul carbonio
carbonilico, aumentando per effetti
induttivi l’acidità dei protoni in α
Una delle formule di risonanza pone la
carica positiva sull’atomo di ossigeno
estereo piuttosto che su quello
carbonilico
S1008
50
Enolati di esteri e nitrili
Vi è comunque un elevato grado di stabilizzazione della carica negativa rispetto
ad un alcano
Per i protoni legati al carbonio in α ad un nitrile, anch’esso stabilizzato per
risonanza, si hanno valori di pKa = 25-30.
S1008
51
Enolati di esteri e nitrili
Se si utilizzano basi forti come LDA, le reazioni tipo condensazione di solito
non competono. Inoltre c’è solo una posizione α
Una volta formato, l’enolato può reagire con un alogenuro alchilico con un
tipico meccanismo SN2 portando al prodotto alchilato. Se si utilizzano
alogenuri secondari o terziari la reazione di eliminazione può competere
poiché lavoriamo in presenza di una base forte.
S1009
52
Enolati di esteri e nitrili
Come elettrofili possono essere usati alogenuri alchilici o epossidi
S1009
53
Alchilazione di reagenti contenenti metileni attivati
Anche la presenza di un gruppo fenile riesce ad attivare un metilene
consentendo l’ottenimento di chetoni ed esteri α-sostituiti
S1013
54
Enolati degli acidi
Può essere generato l’enolato di un acido?
Il pKa dei protoni di un carbonio in α al carbonio di un acido ha un valore
confrontabile con quella di un estere
Per cui in presenza di 2 equiv. di base si ottiene l’enolato
S1010
55
Enolati degli acidi
La reazione con un alogenuro alchilico seguita da trattamento acido porta
all’acido sostituito.
La reazione è analoga alla formazione di un enolato di un estere, alchilazione
e idrolisi. E’ quindi più semplice da un punto di vista operativo e la reazione di
condensazione non compete.
S1010
56
Esercizio: proporre delle vie sintetiche per i seguenti composti partendo
sia da un acido che da un estere e da un organoalogenuro.
OCOOH
X
C
O-
α
Cl
Cl
COOH
H
S1010
57
Metileni attivati: malonati, acetoacetati, cianoacetati
La presenza di due gruppi elettron-attrattori rende i protoni del carbonio
metinico o metilenico particolarmente acidi e reattivi nella formazione di
enolati. Questi protoni hanno pKa = 10-14.
S1011
58
Enolati fortemente stabilizzati per risonanza
La carica viene delocalizzata su tutto il
sistema: i due carbonili e il carbonio
metinico.
D’altro canto già il derivato di partenza esiste
parzialmente nella forma enolica, stabilizzato da
HB intramolecolari
S1011
59
Spettro 1H NMR (300 MHz) del tert-butil acetoacetato
In che rapporto sono? Lo si può determinare via 1H NMR?
S1012
60
Alchilazione di reagenti contenenti metileni attivati
L’enolato che si forma è il prodotto cineticamente e termodinamicamente
favorito. Inoltre la reazione richiede condizioni molto meno drastiche: si usa
una base molto meno forte (NaOEt).
In presenza di un eccesso di base si ottiene la doppia sostituzione
Se si utilizzano α,ω-dialoalcani in presenza di un eccesso di base si
possono ottenere cicloalcani (anelli da 3 a 6 atomi).
S1013
61
Esercizio: Come preparereste i seguenti composti utilizzando un alogenuro
alchilico e un derivato con metileni attivati?
O
COOEt
H
S1013
O
O
EtO-
COOEt
BrCH2(CH2)5COOEt
COOEt
CH2(CH2)5COOEt
62
Attivazione dell’idrogeno α con gruppi solforati
Diversi gruppi funzionali contenenti lo zolfo (e anche il fosforo) hanno
proprietà elettron-attrattrici e possono quindi attivare gli idrogeni di un
carbonio in α. Lo stesso DMSO in condizioni basiche può essere
deprotonato:
La presenza del gruppo carbonilico attiva ulteriormente i gruppi
metilenici rendendoli più acidi
S1014
63
Attivazione dell’idrogeno α con gruppi solforati
L’etil fenilsolfoacetato viene deprotonato facilmente in presenza di NaH
generando l’enolato corrispondente:
Quindi in generale:
S1014
64
Attivazione dell’idrogeno α con gruppi solforati
Ad elevate temperature un solfossido elimina facilmente portando alla
formazione di un doppio legame.
Come ottenere il β-cheto solfossido?
S1015
65
Esercizio: un enolato di un estere reagisce con dimetil o difenil disolfuro
producendo l’analoga specie α-solfenilica. Quale è il prodotto atteso dalla
seguente sequenza di reazioni?
SMe
R
CH2
COOEt
LDA
R
CH
COOEt
EtI
R
C
R
CH
COOEt
SMe
SMe
NaH
Me2S2
COOEt
R
C
COOEt
Et
S1015
66
Decarbossilazione di funzioni carbossiliche in β a
gruppi carbonilici
La presenza di due gruppi attivanti rende i protoni metilenici più acidi e
quindi reattivi, ed elimina problemi di regiochimica o reazioni collaterali
S1016
67
Decarbossilazione di funzioni carbossiliche in β a
gruppi carbonilici
Cosa possiamo fare se vogliamo il prodotto monofunzionalizzato?
La funzione esterea decarbossila facilmente per semplice riscaldamento
in acido diluito
S1016
68
Decarbossilazione di funzioni carbossiliche in β a
gruppi carbonilici
Idrolisi acida
L’acido carbossilico che si forma ha una funzione C=O in posizione β che facilita
la rimozione di CO2 in ambiente acido grazie alla formazione di un enolo. Il
processo può avvenire sia con l’intervento dell’H2O (2a) che per via
intramolecolare (2b)
S1017
69
Decarbossilazione di funzioni carbossiliche in β a
gruppi carbonilici
L’enolo poi tautomerizza
generando il chetone
La stessa reazione con il dietil malonato o l’etile cianoacetato porta
all’ottenimento di un estere o un nitrile
S1017-8
70
Alchilazione e decarbossilazione dei metileni reattivi
O
H3C
C
CH2
H3C
COOEt
EtOOC
CH2
COOEt
NC
CH2
COOEt
O
R
C
CH
1. EtOH/EtONa
2. RX
COOEt
R
EtOOC
CH
COOEt
R
NC
CH
COOEt
O
- CO2
H3C
C
CH2
Acetoacetato Metil chetone
R
R
CH2
COOH
R
CH2
CN
ENOLATO EQUIVALENTE
Malonato Acido acetico sostituito
Cianoacetato Nitrile
71
Composti con metileni attivati enolato equivalenti
S1018
72
Esempio: proporre una sintesi per il seguente composto utilizzando reagenti
che abbiano fino a 7 atomi di carbonio
S1018
73
Esercizio: Come preparereste questi composti utilizzando un precursore
dicarbonilico?
COOEt
COOEt
EtO-
CH2
COOEt
CH-
COOEt
O
COOEt
H
O
COOEt
EtO-
decarb.
COOH
COOEt
O
S1019
COOEt
Br(CH2)3Br
O
COOEt
R
decarb.
RX
R
74
Riepilogo: reazioni degli enolati
Acidità: Acidità di acidi, ammidi, ammine. Effetti induttivi e di
risonanza. Acidità C-H
Enoli/enolati
Tautomeria cheto-enolica (acido o base catalizzata)
Isomerizzazione zuccheri, racemizzazione aa
75
Riepilogo
Alfa-alogenazioni (sintesi aloformio)
Ambiente basico: trialogenazione fino ad aloformio
Ambiente acido: solo α-alogenazione
O
R
O
X2 / H3O+
+ CHX3
R
R
CH2X
O
X2 / OH-
CH3
O-
76
Riepilogo
Sintesi enolati di chetoni con basi forti: regiochimica
Alchilazione enolati: polialchilazione – alchil. via enammine, chetimmine
regiochimica?
polialchilazione?
O
O
O
CH3
CH3
CH3X
LDA
O
CH3
O
O
N
pirrolidina
CH3
CH3X
no polialchilazione
CH3X
Vedi anche
aldeidi
O
cicloesilammina
N
N
RMgBr
77
Riepilogo
Gli enolati di esteri, nitrili e acidi possono essere alchilati
COOEt
COOEt
EtOOC
CH3X
LDA
COO-
COOH
CN
LDA
HOOC
CH3
NC
CH3
CH3X
2 LDA
CN
CH3
CH3X
78
Riepilogo
Enolati di derivati con metileni attivati; decarbossilazione
O
H3C
C
EtOOC
CH2
CH2
1. EtOH/EtONa H3C
2. RX
COOEt
COOEt
O
R
C
CH
COOEt
R
EtOOC
CH
COOEt
O
H3C
- CO2
R
O
1. LDA
2. PhSSPh
3. NaIO4
C
CH2
CH2
Acetoacetato Metil chetone
R
Malonato Acido acetico sost.
COOH
O
O
H
NaH
R
SPh
SPh
O
R
O
O
O
SPh
O
79
Addenda
80
Decarbossilazione di β-cheto acidi: una
importante trasformazione metabolica in processi
biologici
Questo processo avviene a causa della intrinseca instabilità degli acidi
carbossilici in β a una funzione carbonilica
Ciclo dell’acido citrico – metabolismo aerobico
Il citrato viene isomerizzato a isocitrato via formale eliminazione e
addizione di acqua
S1020
81
Decarbossilazione di β-cheto acidi: una
importante trasformazione metabolica in processi
biologici
L’ossidazione della funzione alcolica a CO da parte del NAD+ produce un βchetoacido intermedio che decarbossila fornendo l’α-chetoglutarato.
Il meccanismo di decarbossilazione non è molto diverso da quello che
abbiamo visto avvenire in soluzione.
S1020
82
Decarbossilazione di β-cheto acidi: una
importante trasformazione metabolica in processi
biologici
La perdita di CO2 porta
alla formazione di un
enolato stabilizzato da
un catione Mn(II)
presente nel sito attivo
dell’enzima.
La protonazione
dell’enolato porta al
derivato carbonilico
corrispondente
S1021
83