Chimica Organica
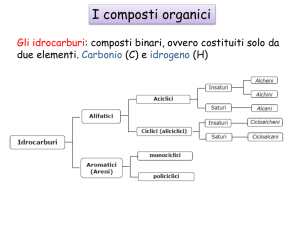
Idrocarburi
Idrocarburi ALIFATICI
• • SATURI
– • Alcani
– • Cicloalcani
• • INSATURI
– • Alcheni
– • Alchini
Gli ALCANI presentano la seguente formula generale
CnH2n+2
Gli atomi di carbonio sono tutti ibridati sp3 con gli
idrogeni diretti verso i vertici di un tetraedro
Alcheni
Gli alcheni sono idrocarburi che contengono almeno
un doppio legame carbonio-carbonio.
Nel caso della presenza di un singolo doppio legame la
formula generale degli alcheni è:
CnH2n
Negli alcheni gli atomi di carbonio impegnati nel
doppio legame sono ibridati sp2.
Alchini
Gli alchini sono idrocarburi che contengono almeno un
triplo legame carbonio-carbonio.
Nel caso della presenza di un singolo triplo legame la
formula generale degli alchini è:
CnH2n-2
Negli alchini gli atomi di carbonio impegnati nel triplo
legame sono ibridati sp.
Idrocarburi aromatici
• Originariamente definiti tali per il loro
caratteristico odore, gli idrocarburi aromatici
sono una classe di composti che presentano un
elevato livello di insaturazione.
• Il composto di riferimento è il benzene (C6H6).
Strutture di risonanza per il Benzene
La freccia a due teste tra le due possibili forme del
benzene viene usata per mettere in evidenza formule di
struttura risonanti. Queste formule rappresentano
strutture limite che in realtà non esistono
NOTE : la risonanza coinvolge solo il movimento di
elettroni per descrivere formule di struttura diverse
Proprietà del benzene
• formula molecolare C6H6
• Liquido incolore
• Altamente infiammabile
• odore caratteristico
Gruppi funzionali
• Sono atomi o raggruppamenti di atomi che conferiscono
particolari proprietà (funzioni) ai composti che li contengono.
In genere i composti organici di importanza biologica
contengono più gruppi funzionali.
In base alla loro priorità vengono identificati con:
Un Suffisso : nel caso della massima priorità
Un Prefisso : nel caso in cui vi è un altro gruppo
funzionale a più alta priorità
Principali gruppi funzionali
Gruppo Funzionale Composto -­‐OH -­‐O-­‐ -­‐CHO CO -­‐COOH
-­‐COOR
-­‐NH2 -­‐CONH2
Alcoli e fenoli Eteri Aldeidi Chetoni Acidi carbossilici Esteri Ammine Ammidi Alcoli e fenoli
• Presentano un gruppo - OH legato ad un radicale alchilico (alcoli)
o arilico (fenolo).
H H H C C OH H H H H O H H C C C H H H H CH3CH2OH CH3CHOHCH3 C2H5OH C2H4OHCH3 C2H6O C3H8O OH C6H6O • La loro denominazione deriva dal nome dell’ idrocarburo con lo
stesso numero di atomi di carbonio sostituendo la -o finale con olo. La posizione del gruppo OH viene indicata nella catena con
il numero più basso.
CH3CH2CH2OH CH3CHOHCH2CH3 1-­‐propanolo 2-­‐butanolo Alcol n-­‐propilico Alcol 2-­‐buFlico Frequentemente il nome si può ottenere facendo seguire
alla parola alcol il nome del radicale alchilico a cui è legato
il gruppo OH.
Alcoli e fenoli:
Nomenclatura
H H H C C OH H H CH3CH2OH C2H5OH etanolo H H O H H C C C H H H H CH3CHOHCH3 C2H4OHCH3 2-­‐propanolo OH C6H5OH fenolo Alcoli: proprietà fisiche
Sono composti polari in quanto presentano un legame covalente polarizzato tra carbonio e
ossigeno.
δ -
δ +
C
O
δ +
H
Possono inoltre formare legami ad idrogeno
intermolecolari e per questo motivo sono generalmente
liquidi.
Gli alcoli con un più basso peso molecolare (ridotto
numero di atomi di carbonio) sono solubili in acqua a
causa della formazione di legami ad idrogeno con il
solvente.
Eteri
• Presentano un atomo di ossigeno legato a due radicali, che
possono essere alchilici o arilici.
H H H C O C H H H CH3OCH3 C2H6O H H H H C O C C H H H H O CH3OCH2CH3 CH3OC2H5 C6H5OC6H5 C3H8O C12H10O Eteri: nomenclatura
• Si fa seguire al nome dei due radicali, ordinati in ordine
alfabetico, la parola etere.
H H H C O C H H H CH3OCH3 C2H6O DimeFl-­‐etere H H H H C O C C H H H H O CH3OCH2CH3 CH3OC2H5 C3H8O EFl-­‐meFl-­‐etere C6H5OC6H5 Difenil-­‐etere Aldeidi
Presentano un atomo di carbonio legato contemporaneamente ad
un atomo di ossigeno con un doppio legame e ad un atomo di
idrogeno. Il gruppo C=O viene definito gruppo carbonilico.
H O H C C H H CH3CHO H H O H C C C H H H C2H4O C3H6O etanale CH3CH2CHO 2 meFl-­‐propanale Sono composti polari in quanto presentano un legame covalente polarizzato carbonioossigeno.
Chetoni
Presentano due radicali alchilici e/o arilici legati ad un
gruppo carbonilico.
O CH3 C CH3 CH3COCH3 C3H6O Propanone O CH3 CH2 C CH2 CH3 CH3CH2COCH2CH3 C5H10O 3-­‐Pentanone Sono composF polari in quanto presentano un legame covalente polarizzato carbonio-­‐
ossigeno. Acidi carbossilici
Presentano un atomo di carbonio legato contemporaneamente ad un atomo di ossigeno con un doppio legame e ad un gruppo -­‐OH. Il gruppo -­‐COOH viene definito gruppo carbossilico. H O H C C H OH CH3COOH C2H4O2 Acido etanoico H H O H C C C H H OH CH3CH2COOH C3H6O2 Acido 2 meFl-­‐propanoico Sono composti polari in quanto presentano due legami covalenti polarizzati carbonioossigeno nella stessa molecola. Ammine
Presentano un gruppo amminico (—NH2) legato ad un radicale alchilico o arilico
(R—NH2) . Si possono considerare come derivate dall’ammoniaca per
sostituzione di uno o più atomi di idrogeno.
H R N H H R N R R R N R Ammina primaria Ammina secondaria Ammina terziaria CH3-­‐NH2 meFl-­‐ammina
R R N R X R Sale ammonico quaternario CH3-­‐NHCH2CH3 etil-metil-ammina
Possono formare legami ad idrogeno intermolecolari (tranne le ammine terziarie) ma
sono più volatili dei corrispondenti alcoli in quanto l’azoto è meno elettronegativo
dell’ossigeno.
Ammidi
Presentano un gruppo amminico (—NH2) legato ad un gruppo
carbonilico
Sono composti polari e
possono formare forti legami
ad idrogeno intermolecolari.
2
Inoltre, per lo stesso motivo
sono molto solubili in acqua.
NH R
C
O
Il loro nome si ricava dal nome dell’acido carbossilico
corrispondente eliminando la parola acido e sostituendo la
desinenza -oico con -ammide
HCONH2
Metanammide
CH3CONH2 Etanammide
α-Amminoacidi
NH2
|
α C
COOH
R
|
H
Presentano un gruppo
amminico (—NH 2 ) ed un
gruppo carbossilico (—COOH)
nella stessa molecola
Sono composti organici molto diffusi in natura.
• Costituenti delle proteine
• Intermedi del metabolismo azotato
• Neurotrasmettitori
Nelle proteine si ritrovano esclusivamente α-amminoacidi (i più
comuni sono 20) mentre per le altre funzioni si possono avere anche βe γ- amminoacidi
Legame peptidico
I gruppi -COOH e -NH2 di due diversi α-amminoacidi possono reagire e
attraverso l’eliminazione di una molecola di acqua formando il legame
peptidico responsabile della struttura primaria delle proteine
O
H2N
OH
C
|
C
|
R
H
+
N
H
H
amminoacido1
Legame ammidico
o peptidico
COOH
|
C
H
|
R
amminoacido2 H2O +
HOOC
H
O
C
H2N
C
N
R
H
C
R
H
dipeptide