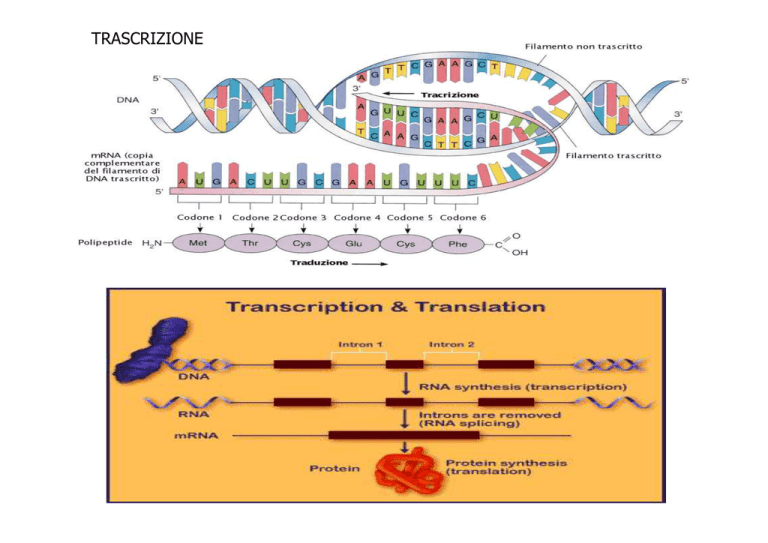
TRASCRIZIONE
Il DNA funziona da stampo per la sintesi di molecole di RNA.
In questo modo l’informazione genetica
diventa direttamente utilizzabile per la cellula
Capacità di esprimersi dell’informazione genetica
DOGMA CENTRALE
DNA
(linguaggio chimico=nucleotidi)
TRASCRIZIONE
RNA
(linguaggio chimico=nucleotidi)
TRADUZIONE
PROTEINE
(linguaggio chimico=aminoacidi)
INTERAZIONE TRA mRNA, tRNA e RIBOSOMI
mRNA:
porta l'informazione per la sintesi di una determinata proteina.
tRNA:
molecola adattatrice - ogni tRNA è specifico per il trasporto di un
determinato aminoacido – converte sequenze di nucleotidi in sequenze di
amminoacidi
Ribosoma:
officina che permette il corretto appaiamento tra mRNA e i diversi tRNA e
partecipa attivamente alla formazione della catena proteica.
STRUTTURA MOLECOLARE DEL tRNA
Nel piano: il filamento 5'→
→3' assume una forma detta a quadrifoglio
-zone a bracci in cui le basi sono appaiate
-anse senza appaiamento per basi modificate post-trascrizionalmente
Iniziando dal 5‘:
- ANSA D: vi si lega l'enzima aminoacilsintetasi specifico per legare un
determinato aminoacido al suo tRNA.
- ANSA dell'ANTICODONE: contiene una tripletta complementare e antiparallela
al codone che sull'mRNA codifica per un determinato aminoacido.
- Un'ansa variabile
- ANSA del Tϕ
ϕC (ϕ
ϕ=pseudouracile): necessaria per il legame tra il tRNA e rRNA 5S
presente nella subunità grande del ribosoma.
Il tRNA termina al 3' con un codone CCA
(aggiunto postrascrizionalmente)
a cui viene legato l'aminoacido specifico di quel
tRNA.
Il tRNA nello spazio si ripiega in una struttura detta a L rovesciata dove
rimangono bene accessibili l'ansa dell'anticodone e l'aminoacido
legato.
Esempio di reazione di legame dell'aminoacido al tRNA
aminoacilsintetasi
leu(specifico
tRNA + LEUCINA+ ATP
per leucina)
tRNALEU + AMP+P+P
(energia)
L'aminoacido con il suo gruppo carbossilico (-COOH)
si lega all'-OH del C3 del ribosio del nucleotide (A) al
3' del tRNA.
Le aminoacil-sintetasi
aminoacido.
sono
20
una
per
ogni
Ognuna trasferisce un AA diverso sul rispettivo tRNA.
I tRNA sono più di 20 (circa 30-40 in procarioti e
anche 50 in Eucarioti) per cui ad alcuni aminoacidi
corrisponde più di un tRNA.
STRUTTURA MOLECOLARE DEL RIBOSOMA
Il ribosoma ha una struttura molecolare complessa formata da rRNA e
proteine ribosomiali.
In eucarioti gli rRNA vengono prodotti nel nucleolo (tranne il 5S
prodotto nel nucleo) dove entrano anche le proteine ribosomiali
prodotte nel citoplasma che si assemblano con i rispettivi rRNA per dare
i ribosomi.
In procarioti tutto ciò avviene nel citoplasma.
I ribosomi procariotici sono più piccoli dei ribosomi eucariotici.
Le differenze tra ribosomi procariotici ed eucariotici sono dovute al
numero e alle grandezze diverse degli rRNA e al numero e alle
grandezze diverse delle proteine.
I ribosomi sono formati da due subunità (piccola e grande) che si
assemblano solo al momento della traduzione (le due subunità
ribosomiali si assemblano e diventano funzionali solo in presenza di
mRNA).
Assemblaggio del ribosoma
citoplasma
citoplasma
Proteine del
ribosoma
nucleolo
Nucleo
Pori nucleari
Sito A per l’aminoacil-tRNA
Sito P per il peptidil-tRNA
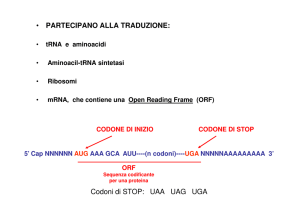
STRUTTURA DEGLI mRNA
IN PROCARIOTI
Il filamento di mRNA inizia con una sequenza detta LEADER, che non viene
tradotta in proteina, contenente la sequenza di Shine-Delgarno.
Tale sequenza si appaia durante la traduzione con l'rRNA 16S.
La sequenza codificante inizia sempre con la tripletta AUG e termina con una
tripletta detta di STOP.
Segue un tratto detto TRAILER (rimorchio) non codificante.
I geni che codificano per proteine sono POLICISTRONICI (ad un unico promotore
seguono tutti i geni di una determinata via metabolica per cui vengono trascritti
tutti contemporaneamente).
IN EUCARIOTI
L'mRNA ha struttura simile a quella dei Procarioti.
In aggiunta:
-5’ CAP (7-metilguanosina): si legherà all'rRNA 18S durante la traduzione
-coda di poliA al 3'.
I geni che codificano per proteine sono MONOCISTRONICI (ciascun gene ha il
suo proprio promotore).
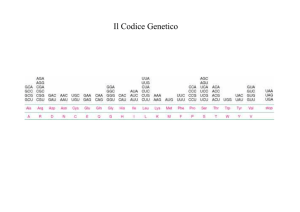
IL CODICE GENETICO
Perché avvenga la traduzione è necessario passare da un linguaggio
fatto di NUCLEOTIDI ad un linguaggio di AMINOACIDI.
Gli aminoacidi presenti in tutte le proteine sono 20 mentre le basi sono
solo 4.
Se ogni base specificasse per 1 amminoacido, avremmo solo 4
aminoacidi specificati 41=4.
Se la combinazione di due basi specificasse per 1 aminoacido,
avremmo:42=16 aminoacidi specificati.
Se la combinazione di tre basi specificasse per 1 aminoacido, avremmo:
43=64 combinazioni per 20 aminoacidi.
Il codice pertanto è a triplette, cioè la combinazione di tre basi specifica
per 1 aminoacido.
Ogni tripletta è detta CODONE.
Esistono 3 triplette non codificano per nessun aminoacido e sono dette
di STOP (UAG; UAA; UGA).
Poiché ci sono 64-3 (codoni di stop)=61 triplette per 20 aminoacidi si
dice che il codice è DEGENERATO o RIDONDANTE cioè ogni
aminoacido può essere specificato da più di un codone.
Esempio: leucina 6 codoni, valina 4 codoni, triptofano e metionina 1
codone, etc…. (Si può osservare inoltre che i diversi codoni per un
aminoacido sono diversi soprattutto nella 3 base).
CARATTERISTICHE DEL CODICE GENETICO
Il codice genetico è UNIVERSALE cioè uguale per tutti gli esseri
viventi tranne alcune eccezioni.
Il codice genetico NON E' AMBIGUO cioè un determinato codone
specifica per un solo aminoacido.
Il codice genetico è senza punteggiature cioè viene letto linearmente
(di tre basi in tre basi) e non è sovrapponibile (es. la stessa base non
può essere letta come l’ultima di un codone e la prima del successivo).
MUTAZIONI PUNTIFORMI IN ZONE CODIFICANTI
una base
-Transizione da purina a purina (A o G) o da pirimidina a pirimidina (C o T)
-Trasversione da purina a pirimidina o viceversa
Conseguenze:
1) nessuna se ad essere colpita è la terza base di un codone e il nuovo codone codifica
per lo stesso aminoacido
2) cambio dell'aminoacido specificato dal codone ora mutato
3) proteina più corta se un codone per l'aminoacido si tramuta in un codone di STOP
Es. UUA→
→UAA
(Leu→
→ stop)
4) proteina più lunga se ad esempio da un codone di stop per mutazione si passa ad un
aminoacido qualsiasi
B) DELEZIONE o INSERZIONE di una base
Cambio della cornice di lettura. Da quel nucleotide (deleto o inserito) la proteina sarà
tutta diversa perché a codoni diversi corrisponderanno AA diversi
AUG
CAA
CCC
GGA
UAA
GCU
UAA
(delezione)
AUG
CAA
CCC
GGU
AAG
CUU
AA…
TRADUZIONE
1) La lettura dell'mRNA procede in direzione 5'→3‘
2) La sintesi proteica procede
dall'estremità N-terminale
all'estremità C-terminale del polipeptide
3) La traduzione ha inizio sempre con
Formil-metionina in Procarioti
Metionina in Eucarioti.
Il codone per Metionina è AUG
L'anticodone è UAC.
1) INIZIO:
L'mRNA si lega alla SUBUNITA' PICCOLA ribosomiale e al tRNAmet (codone
con anticodone) grazie a fattori di inizio (3 in procarioti, 7/8 in eucarioti) e
ad 1 GTP→
→GMP+P+P che dona energia necessaria per il legame.
L'mRNA in procarioti si lega con la sequenza SHINE-DALGARNO al 16S rRNA
mentre in eucarioti l'mRNA si lega con il cappuccio (5-metilguanosina) al 18S
rRNA.
Successivamente si assembla la SUBUNITÀ GRANDE contenente due siti detti
A e P per accogliere i tRNA.
Solo il 1° tRNAmet si lega direttamente al sito P.
2) ALLUNGAMENTO
Il 2° tRNA con l‘AA corrispondente si lega all'mRNA (2°codone/anticodone) e alla
subunità grande, nel sito A del ribosoma, grazie a fattori di allungamento (in
Procarioti Ts e Tu, in Eucarioti Ef1-Ef1β) e ad 1 molecola di GTP che si scinde
donando energia.
Il legame che si forma tra i due AA avviene tra il gruppo carbossilico (-COOH)
della metionina e il gruppo amminico (-NH2) del 2° AA (legame peptidico).
Enzima responsabile è la Peptidil-transferasi.
Dopo la formazione del legame peptidico il 1° tRNA, rimasto scarico della
metionina, viene allontanato dal sito P.
Avviene quindi la traslocazione:
l'mRNA scivola di un codone trascinandosi il 2° tRNA che passa dal sito A al sito
P, lasciando il sito A libero per l'attacco del 3° tRNA.
Questa traslocazione è mediata da un fattore di traslocazione e dalla scissione di
una molecola di GTP.
Il ciclo si ripete tante volte quanti sono gli AA che devono essere legati.
3) TERMINAZIONE
Quando sul sito A si trova un codone di STOP, a cui non
corrisponde nessun tRNA, la sintesi si arresta.
Inoltre esistono fattori di rilascio che si legano al sito A
impedendo comunque l'attacco dei tRNA.
La catena polipeptidica si stacca dall'ultimo tRNA grazie
ad un enzima (idrolasi) con consumo di una molecola di
GTP. Le due subunità ribosomiali si disassemblano.
IL VACILLAMENTO DELLE BASI
Il legame tra codone e anticodone è complementare e
antiparallelo.
Esempio:
3'CAG5' (anticodone)
5'GUC3' (codone)
Il numero dei codoni (61) è più grande di quello degli anticodoni.
61 codoni (3 sono codoni di stop) mentre i tRNA sono circa 30-40
in procarioti e anche 50 in Eucarioti)
Questo implica che alcune molecole di tRNA con il loro anticodone
sono capaci di accoppiarsi a più di un codone.
Alcuni tRNA hanno una struttura tale da richiedere un appaiamento
accurato nelle prime due posizioni del codone (5') e da tollerare un
appaiamento scorretto (oscillante) in terza posizione.
Questo appaiamento approssimativo rende possibile combinare 20 AA ai
loro 61 codoni servendosi per esempio di solo 30/50 molecole di tRNA.
Frequentemente al 5' dell'anticodone (corrispondente alla terza base
del codone) esiste la base modificata inosina capace di complementarsi
sia con A, C, U.
BILANCIO ENERGETICO
DELLA TRADUZIONE
Esempio proteina di 100 aa
1 GTP per il complesso di inizio
99 GTP per l'attacco dei 99 tRNA
99 GTP per la traslocazione dei 99 tRNA
1 GTP per il rilascio della proteina
Totale 200 GTP che corrisponde a 2 GTP per ogni
aminoacido.
Riassumendo 1AA=2GTP
PROTEINE
Le proteine sono dei polimeri di aminoacidi detti anche catene
polipeptidiche.
Gli aminoacidi possono essere destrogiri (D-) e levogiri (L-).
Negli organismi viventi sono presenti solo L-aminoacidi.
aminoacidi sono 20.
Gli
Ciascun aminoacido è costituito da un Cα
α a cui sono legati un
gruppo carbossilico (COOH), un gruppo amminico (NH2), un H,
e un gruppo variabile detto radicale. I radicali conferiscono ad
ogni aminoacido la propria specificità.
-APOLARI (idrofobici) che contengono nel radicale un gruppo idrofobico ( es.CH3)
-POLARI (idrofilici) che si suddividono in:
POLARI ACIDI che contengono nel radicale un gruppo acido (es.-COOH),
POLARI BASICI che contengono nel radicale un gruppo basico (es.-NH2),
POLARI NON CARICHI che contengono nel loro radicale sia un gruppo acido che un
gruppo basico o comunque un gruppo idrofilico per cui il loro pH è neutro.
Gli aminoacidi tra loro sono legati con un legame peptidico che si
forma tra il gruppo COOH di un aminoacido e il gruppo NH2 del
successivo aminoacido con l'eliminazione di una molecola di acqua.
Questo legame è un legame covalente più forte perché più breve
del singolo legame e quindi si avvicina ad avere le caratteristiche
di un doppio legame.
LE PROTEINE E LORO STRUTTURA
Le proteine presentano tre livelli di struttura e alcune anche un quarto
livello.
STRUTTURA PRIMARIA
E' rappresentata dalla sequenza lineare degli aminoacidi legati da legami
peptidici determinata dal gene.
STRUTTURA SECONDARIA
Gran parte delle proteine, anche se in alcuni punti hanno una struttura
irregolare, presentano lunghi tratti con una struttura regolare ad α-elica o a
foglietto pieghettato β.
L'α
α-elica e il foglietto pieghettato β sono dati da legami ad H che si
instaurano tra differenti gruppi peptidici.
Nell' α-elica l'ossigeno carbossilico di ciascun legame peptidico forma un
legame ad idrogeno con l'idrogeno del gruppo amminico dell'aminoacido
che si trova quattro residui più avanti nella sequenza lineare.
Nel foglietto pieghettato β i legami ad H si instaurano tra gli atomi che
formano i legami peptidici appartenenti a catene polipeptidiche diverse o a
porzioni dello stesso polipeptide ripiegato su se stesso.
STRUTTURA TERZIARIA
La struttura terziaria è determinata da legami che si formano tra
radicali di diversi aminoacidi che organizzati nelle strutture
secondarie vengono a trovarsi vicino.
Tali legami possono essere di tutti i tipi
( ionici, covalenti, ad idrogeno, idrofobici etc…) e determinano la
struttura tridimensionale della catena polipeptidica (es. proteine
globulari).
La struttura terziaria viene modificata inoltre dalle interazioni degli
aminoacidi con l'ambiente in cui la catena polipeptidica si trova.
(es. proteine di membrana tenderanno ad esporre all'esterno gli aminoacidi
idrofobici capaci di interagire con i lipidi ).
STRUTTURA QUATERNARIA
Alcune proteine specialmente quelle con funzione enzimatica,
possono assumere una struttura quaternaria che deriva
dall'associazione di più catene polipeptidiche.
Se le catene polipeptidiche sono uguali si parlerà di dimeri (2 catene
polipeptidiche), tetrameri (4), etc…
Le catene che si associano possono essere differenti e ciascuna
prende il nome di subunità (vedi RNA-polimerasi in procarioti).
Considerando la definizione di introni indicare il rapporto corretto in
ogni gene tra il numero degli esoni e degli introni:
a)
Esoni= introni +1
b)
Esoni=introni
c)
Esoni= introni –1
d)
Esoni= 2 volte gli introni
La TATA box è una sequenza presente:
1. Al 5’ dei geni in procarioti
2. Al 5’ dei geni per mRNA in eucarioti
3. Sull’ mRNA nella sequenza leader
4. Al 5’ dei geni per rRNA in eucarioti
5. Al 5’ dei geni per tRNA in eucarioti
Descrivete le possibili conseguenze nella traduzione del seguente mRNA
mutato rispetto a quello nativo
5’ UUCCCAAUCACAUAAGUAGCC 3’ RNA mutato
5’ UUCCCAAUCACAUACGUAGCC 3’ RNA nativo
(codoni di stop UAG, UAA, UGA)
La polimerasi I è la polimerasi che trascrive:
1. Tutti gli RNA in procarioti
2. tRNA e 5S ribosomiali in eucarioti
3. Gli snRNA e si trova nel nucleolo
4. Gli rRNA e si trova nel nucleolo
5. Gli hnRNA in eucarioti
RNA-POLIMERASI I
Si trova nel nucleolo
1)
Trascrive un filamento precursore 45S da cui vengono poi ritagliati i tre rRNA: 28S,
18S, 5,8S.
2)
Il DNA contenente i geni per gli rRNA si trova nel nucleolo.
3)
La trascrizione avviene nel nucleolo
4)
Le proteine ribosomiali vengono prodotte nel citoplasma e successivamente rientrano nel
nucleo e quindi nel nucleolo dove si assemblano con i rispettivi rRNA per dare le due
subunità ribosomiali.
1)
La polimerasi I ha bisogno di 2 fattori trascrizionali generali (B ed S) per poter
iniziare la trascrizione che si legano al promotore (da -100/-50 a +20).
RNA-POLIMERASI III
Si trova nel nucleo.
1)
Trascrive i diversi tRNA e l' rRNA 5S (unico ribosomiale non prodotto nel nucleolo
dove poi migrerà).
La polimerasi III ha bisogno di fattori di trascrizione generali per iniziare (A,B,C
per rRNA 5S e B,C per i tRNA).
2)
3)
Le zone regolatrici di attacco dei fattori trascrizionali e RNA-polimerasi non sono a
monte del trascritto ma a valle: Promotori Interni.
RNA-POLIMERASI II
Si trova nel nucleo.
1)
Trascrive RNA primari (hnRNA) che successivamente verranno modificati
(maturazione) per dare mRNA funzionanti.
2)
Per iniziare ha bisogno di fattori trascrizionali generali (D, B, F, E, H).
3)
Tali fattori si legano ad una sequenza del promotore detta TATA BOX (40).
Esistono anche a monte della TATA BOX sequenze ricche di CG e CAAT BOX
.