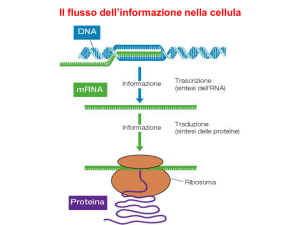
• PARTECIPANO ALLA TRADUZIONE:
•
tRNA e aminoacidi
•
Aminoacil-tRNA sintetasi
•
Ribosomi
•
mRNA, che contiene una Open Reading Frame (ORF)
CODONE DI INIZIO
CODONE DI STOP
5’ Cap NNNNNN AUG AAA GCA AUU----(n codoni)----UGA NNNNNAAAAAAAAA 3’
ORF
Sequenza codificante
per una proteina
Codoni di STOP: UAA UAG UGA
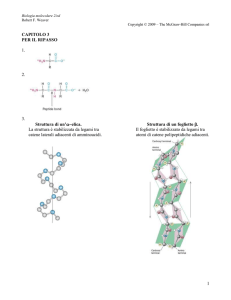
LUNGHEZZA: TRA 73 E 93 BASI
CIRCA 30 TIPI DIVERSI
Aggiunta post-trascrizionale
STELO ACCETTORE
ANSA
VARIABILE
INOSINA
Aminoacil-AMP
legame fosfo-anidridico
“ad alta energia”
(alto potenziale di
trasferimento)
AA
sempre legato all’enzima
Legame acilico
“ad alta energia”
Aminoacil tRNA sintetasi
Sono 20 diversi isoenzimi (uno specifico per ogni AA)
Non specifica per un singolo tRNA
poiché per molti AA ci sono più tRNA (tRNA isoaccettori)
Siti di riconoscimento principali:
stelo accettore e ansa anticodone
Classe
Sito di correzione (proof reading)
II
e
I
La AA-tRNA sintetasi
è il vero traduttore
Nella traduzione
viene aggiunta Ala
in corrispondenza
dei codoni per Cys
INIZIO TRADUZIONE
Nei procarioti
Il ribosoma inizia la ricerca del primo AUG
a partire da RBS
(legame al ribosoma).
Negli eucarioti
Il ribosoma inizia la ricerca del primo AUG
dal CAP legato al ribosoma.
Seq. Di Kozaz per stabilizzare tRNA di inizio
16 S rRNA
mRNA poli-cistronico
(comune nei procarioti)
Seq.
Shine-Dalgarno
RBS
mRNA mono-cistronico
(eucarioti)
Seq. Di
Kozak
Legame al ribosoma
Fasi della traduzione
• Attivazione e caricamento dell’ AA sul tRNA
• Inizio
(un AA, codone AUG))
• Allungamento (n – 1 AA)
• Terminazione (codone di Stop)
• Targeting
• Modificazioni post-traduzionali
TRADUZIONE
COTRASCRIZIONALE
solo
in procarioti
Peptidil
transferasi
Inizio della traduzione
(procarioti)
Gruppo formile
Inizio della
traduzione
(procarioti)
IF2
Proteina G
che lega il GTP (stato attivo)
e lo idrolizza a GDP
(stato inattivo)
Prima si legano i fattori proteici
e poi fMet-tRNAi e mRNA
ALLUNGAMENTO
Simile in tutti gli organismi
Partecipano due fattori
COMPLESSO
DI INIZIO
Caricamento del 2°AA-tRNA sul sito A
Formazione del legame peptidico
(peptidil transferasi)
Il COOH del 1° AA si lega all’ NH2
del
2°AA-tRNA
Traslocazione
(per la lunghezza di un codone)
EF-Tu-GTP
Proteina –G
attiva
tRNA
correttamente
posizionato
nel sito A
EF-Tu-GDP
non attiva
ALLUNGAMENTO
(EF-G)
EF-Tu
SCAMBIO GDP/GTP
mediato da EF-Ts
EF-G
è più affine
al GTP che al GDP
ricaricamento spontaneo
ELONGAZIONE
PEPTIDIL-TRANSFERASI
rRNA 23S
Ribozima
E
EF-G
Induce la traslocazione
mediante idrolisi di GTP
E
TRASLOCAZIONE
Nuovo legame peptidico
tRNA deacilato
MIMETISMO MOLECOLARE
tRNA
RF1
“anticodone peptidico”
di 3 aminoacidi
• RF1 e RF2 in procarioti
• eRF1 in eucarioti
riconoscono i codoni di stop
e idrolizzano il legame
tra polipeptide e tRNA
RF3 / eRF3 = proteina G
Il rilascio di RF1/2 è mediato da
RF3-GDP
RF3-GTP
SPESA ENERGETICA
della sintesi proteica
ELONGAZIONE
1
ATP per il la formazione di AA-tRNA
(ed anche del legame peptidico)
2 GTP
3
per l’elongazione
(EF-Tu ed EF-G)
NUCLEOSIDI TRIFOSFATO per ogni AA aggiunto
1 GTP
2 GTP
INIZIO
(IF2) procarioti
(eIF2 e eIF5B) eucarioti
TERMINAZIONE
1 GTP
(RF-3)
2 / 3 NUCLEOSIDI TRIFOSFATO
per ogni polipeptide
ANTIBIOTICI TRADUZIONALI
(ED ALCUNE TOSSINE !)
Codice genetico
Ridondante (degenerato)
Codoni sinonomi
Non ambiguo
Universale (quasi !)
Letto in direzione 5’ – 3’
Produce polipeptide in direzione NH2 - COOH
Senza punteggiatura
Un mRNA ha un solo “frame” di lettura (determinato da AUG)
GCN
GCY
GCR
Perche’ questo codice ?
Contenuti in GC possono cambiare
Mut. in pos.1 = spesso AA simili.
Mut in pos. 2: Pur = polare Pyr = idrof.
O R F
•
C’è ATG !
5’ GCGTAATGAATCAGTCGTAGCAAGCTTTTGGCTTAAAGGCG
divisione in triplette:
un solo “frame” di lettura
5’ GCGTA ATG AAT CAG TCG AAG CTA GCT TTT GGC TTA AAG GCG
Codice genetico
Yanofsky, Brenner e Crick (1960-61)
colinearita tra RNA – proteina
codone = tripletta
La sequenza
La sequenza
Utilizzo di RNA sintetici
UUUUUUUUUUUU traduce un poli-Phe
UAUAUAUAUAUA traduce Tyr-Leu-Tyr-Leu
DECIFRAZIONE
COMPLETATA NEL 1966
Mutazioni puntiformi
1
2
2
4
2
6
2
6
Met His Phe Thr Asn Arg Tyr Ser STOP
AUG CAC UUU ACU AAC CGC UAU UCC UAA
N° codoni/AA
5’
CAU
silente
ACC
silente
AUU
AAG
UAG
missenso
Phe/Ile
missenso
Tyr/Lys
nonsenso
Tyr/Stop
Beta-TALASSEMIE
Sbilanciamento alfa/beta
MUTAZIONI SOPPRESSIVE
RETROMUTAZIONE DI UNA
MUTAZIONE PUNTIFORME
MUTAZIONE NONSENSE DI UN GENE
si crea un codone UAG
MUTAZIONE DI UN tRNA
diventa capace di leggere un codone di UAG
(mutazione amber)
SOPPRESSIONE DELLA MUTAZIONE
DIFETTI NELLA TERMINAZIONE
Interferenza a RNA
RNA interference
RNAi
Premi Nobel 2006
Fenomeno scoperto nelle piante
e poi studiato in
Arabidopsis thaliana
e Caenorhabditis elegans
Pianta erbacea
Con genoma piccolo
Nematode,
circa 1000 cellule
Con genoma piccolo
Craig Mello
Andew Fire
dsRNA
Esogeni
(p.e. virus)
Pre-miRNA
dsRNA
siRNA
DICER
siRNA
piccolissimi RNA
associati a proteine
con capacità idrolitica
su RNA virali
Difesa
dall’infezione
dsRNA
Trascritti dal
genoma
Esogeni
(p.e. virus)
Pre-miRNA
pri-miRNA
siRNA
e
miRNA
dsRNA
pre-miRNA
DICER
mi-RNA
siRNA
piccolissimi RNA
associati a proteine
con capacità idrolitica
su mRNA cellulari
su RNA virali
Controllo
posttrascrizionale
Difesa
dall’infezione
Meccanismo antico
(solo con siRNA)
che nasce come
difesa da virus e da trasposoni.
Nelle piante è una sorta di
sistema immunitario endocellulare antivirale
In seguito si è evoluto il processo dei miRNA
(sfrutta l’esistenza di DICER e Argonauta)
per la regolazione genica
In alcuni organismi
il processo
è andato completamente perso
(S.cerevisiae)
Somministrazione sperimentale
di RNA
Meccanismo antico
(solo con siRNA)
che nasce come
difesa da virus e da trasposoni.
Nelle piante è una sorta di
sistema immunitario endocellulare antivirale
In seguito si è evoluto il processo dei miRNA
(sfrutta l’esistenza di DICER e Argonauta)
per la regolazione genica
In alcuni organismi è andato
completamente perso
(S.cerevisiae)
Poi sono arrivati i biotecnologi !
possibilità di
modulare a piacere
l’espressione di specifici geni