Azienda Ospedaliera Nazionale
SS. Antonio e Biagio e Cesare Arrigo
Alessandria
Via Venezia, 16 – 15121 ALESSANDRIA
Tel . 0131 206111 – www.ospedale.al.it
[email protected]
[email protected] (solo certificata)
C.F. – P.I. 01640560064
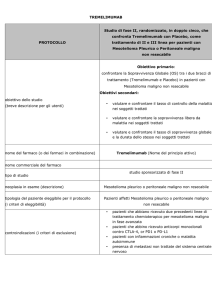
Efficacia e sicurezza di uno schema terapeutico intensificato con Tremelimumab per il
mesotelioma maligno resistente alla chemioterapia: studio di fase II, in aperto, a braccio singolo.
“Efficacy and safety of an intensified schedule of tremelimumab for chemotherapy-resistant
malignant mesothelioma: an open-label, single-arm, phase 2 study” Calabrò L, Morra A, Fonsatti E,
Cutaia O, Fazio C, Annesi D, Lenoci M, Amato G, Danielli R, Altomonte M, Giannarelli D, Di
Giacomo AM, Maio M. Lancet Respir Med. 2015 Mar 25.
L’incidenza del mesotelioma maligno è in incremento a livello mondiale, soprattutto a causa
dell’esposizione ad amianto. La terapia a base di pemetrexed e cisplatino è attualmente lo
standard di prima linea per questo tipo di patologia. I pazienti che, dopo la prima linea, presentano
progressione della malattia hanno necessità di poter usufruire di terapie alternative.
I checkpoints del sistema immunitario possono, in questo contesto, essere utilizzati come targets,
attraverso l’impiego di anticorpi monoclonali immunomodulatori; si tratta di una strategia
terapeutica a rapida evoluzione, il cui prototipo si basa sul blocco dei segnali inibitori rilasciati da
CTLA4 (la proteina 4 associata ai linfociti T citotossici), espressa sui linfociti T. L’anticorpo
monoclonale anti-CTLA4 capostipite, Ipilimumab, ha profondamente cambiato il panorama
terapeutico per il melanoma metastatico. Tremelimumab, un altro anticorpo monoclonale umano
anti-CTLA4, è stato sviluppato come isotipo dell’immunoglobulina G2 in grado di minimizzare
l’attivazione del sistema del complemento ed il rilascio di citochine. Gli studi iniziali con
Tremelimumab hanno mostrato come vi sia una regressione del tumore nei pazienti con
melanoma metastatico. Ciò nonostante, facendo un confronto con Dacarbazina o Temozolomide
(in trial di fase III) si osserva come il Tremelimumab usato in prima linea non aumenti la
sopravvivenza nei pazienti con melanoma metastatico. Una possibile spiegazione per questa
osservazione potrebbe essere riferibile alla sottoesposizione dei pazienti a Tremelimumab con il
regime terapeutico utilizzato (15 mg/kg ogni 90 giorni).
Azienda Ospedaliera Nazionale
SS. Antonio e Biagio e Cesare Arrigo
Alessandria
Via Venezia, 16 – 15121 ALESSANDRIA
Tel . 0131 206111 – www.ospedale.al.it
[email protected]
[email protected] (solo certificata)
C.F. – P.I. 01640560064
Da questo stesso gruppo di ricerca, sono stati precedentemente riportati dati incoraggianti
riguardo l’attività del Tremelimumab somministrato a 15 mg/kg ogni 90 giorni come trattamento
di seconda linea nel mesotelioma maligno, con due risposte parziali su 29 pazienti (una con durata
pari a 6 mesi e l’altro con durata superiore a 18 mesi), 7 pazienti con stabilità per una durata
media di 12.4 mesi ed una sopravvivenza media di 10.7 mesi. Queste scoperte iniziali, insieme ai
dati sulla farmacocinetica ottenuti dai pazienti con melanoma, hanno indirizzato verso l’analisi
dell’attività del Tremelimumab somministrato con pianificazione intensificata nei pazienti con
mesotelioma maligno.
Questo studio in aperto, a braccio singolo, di fase II (MESOTREM-2012) è stato svolto all’Ospedale
Universitario di Siena (Italia); sono stati arruolati individui adulti con mesotelioma maligno
pleurico o peritoneale (avanzato ed inoperabile), con progressione di malattia dopo un regime
chemioterapico basato su platino. Gli altri criteri di eleggibilità includevano la presenza di malattia
misurabile come definito dai criteri RECIST, aspettativa di vita di almeno tre mesi ed un ECOG
performance status pari o inferiore a 2. I pazienti con malattie autoimmuni o metastasi cerebrali
sono stati esclusi, così come i pazienti precedentemente trattati con anticorpi monoclonali antiCTLA4 o anti-PD1/PD-L1.
Ai pazienti è stato somministrato Tremelimumab con infusione intravenosa in un’ora alla dose di
10 mg/kg ogni 4 settimane (pari ad un ciclo) per sei cicli (fase di induzione), seguite da dosi ogni 12
settimane (fase di mantenimento) a partire da 4 settimane dopo il completamento della fase di
induzione, fino a progressione di malattia confermata, effetti tossici eccessivi o rifiuto di
prosecuzione del trattamento.
La sicurezza del trattamento è stata valutata ogni quattro settimane dopo ogni dose di farmaco
nella fase d’induzione e poi ogni dodici settimane durante la fase di mantenimento, attraverso
un’osservazione medica degli eventi avversi riferiti, una valutazione dei parametri vitali e test di
laboratorio clinico.
L’endpoint primario è stata la determinazione della proporzione di pazienti trattati che hanno
raggiunto una risposta oggettiva immuno-mediata (con risposta completa o parziale). Gli
endpoints secondari riguardavano la determinazione della proporzione di pazienti trattati che
hanno raggiunto il controllo della patologia immuno-mediato (risposta completa, parziale, stabilità
Azienda Ospedaliera Nazionale
SS. Antonio e Biagio e Cesare Arrigo
Alessandria
Via Venezia, 16 – 15121 ALESSANDRIA
Tel . 0131 206111 – www.ospedale.al.it
[email protected]
[email protected] (solo certificata)
C.F. – P.I. 01640560064
della patologia), la sopravvivenza libera da progressione immuno-mediata, la sopravvivenza
globale, la sicurezza ed i cambiamenti nel fenotipo linfocitario indotti da Tremelimumab.
In un periodo compreso tra il 30 luglio 2012 ed il 15 luglio 2013 sono stati arruolati 29 pazienti, 11
nella prima fase e 18 in una seconda fase.
Per quanto riguarda l’istologia, il mesotelioma era epitelioide in 21 pazienti, bifasico in 6,
sarcomatoide in 1 e non definito in 1. 28 pazienti avevano mesotelioma pleurico ed 1 presentava
mesotelioma peritoneale.
19 pazienti hanno completato la fase di induzione e 12 sono entrati nella fase di mantenimento (i
rimanenti 7 hanno avuto progressione di malattia e non hanno proseguito lo studio). La
proporzione dei pazienti con controllo della patologia è stata del 52% (15 pazienti su 29) ed il
tempo libero da progressione di malattia è stato di 6.2 mesi. La durata media del tempo di
controllo della malattia è stato di 10.9 mesi, dato interessante considerata la prognosi difficile dei
pazienti con mesotelioma in seconda linea di trattamento. La sopravvivenza globale media è stata
di 11.3 mesi.
I pazienti con un performance status di 0 o 1 hanno avuto una sopravvivenza globale migliore
rispetto a pazienti con performance status pari a 2.
Non sono state segnalate morti legate all’utilizzo del farmaco, ma sono state registrate 23 morti
non correlate al trattamento. 26 pazienti (pari al 90%) hanno mostrato almeno un evento avverso
di grado 1 o 2 legato al trattamento e 2 pazienti (7%) hanno manifestato un evento avverso di
grado 3, legato al farmaco. 12 pazienti (41%) hanno saltato una dose di Tremelimumab a causa
della persistenza di un evento avverso di grado 2 (legato al trattamento). Nessun paziente ha
terminato il trattamento a causa della mancata somministrazione di due dosi consecutive di
Tremelimumab. I più comuni eventi avversi sono stati gastrointestinali, dermatologici e febbrili.
Sono stati prelevati campioni di sangue per l’isolamento dei linfociti da tutti i 29 pazienti;
comparati con le analisi al baseline, il numero di linfociti CD4+ circolanti è significativamente
aumentato ad ogni timepoint investigato; è stato notato anche un lieve incremento nel numero di
linfociti CD8+.
I risultati di questo studio di fase II suggeriscono come lo schema terapeutico intensificato di
Tremelimumab sembri avere un’attività immunologica e clinica nei pazienti con mesotelioma
Azienda Ospedaliera Nazionale
SS. Antonio e Biagio e Cesare Arrigo
Alessandria
Via Venezia, 16 – 15121 ALESSANDRIA
Tel . 0131 206111 – www.ospedale.al.it
[email protected]
[email protected] (solo certificata)
C.F. – P.I. 01640560064
maligno. Questa scoperta è attualmente in fase di ulteriore indagine in uno studio di fase IIb, in
doppio cieco, randomizzato, contro placebo (NCT01843374) che usa lo stesso schema di terapia.
E’ importante sottolineare che i sei pazienti con mesotelioma bifasico e l’unico paziente con
istologia sarcomatoide hanno avuto una sopravvivenza globale media di 15.8 mesi e tutti i sei
pazienti con istologia bifasica hanno raggiunto il controllo della malattia immuno-mediato. Anche
se questa osservazione deve essere interpretata con cautela a causa del basso numero di pazienti,
lo studio suggerisce che il Tremelimumab deve avere un effetto benefico in questa tipologia di
pazienti che tipicamente non rispondono al trattamento.
Siccome non si sono osservate differenze nei markers linfocitari in pazienti con istotipo bifasico e
sarcomatoide confrontandoli con pazienti con istotipo epitelioide, si stanno studiando le
caratteristiche immunofenotipiche delle cellule del mesotelioma delle differenti istologie, in modo
da comprendere se queste possono avere un ruolo nell’outcome dei pazienti a cui è stata
somministrata la terapia.
E’ stato osservato infine un lieve incremento nella frequenza di effetti tossici di grado 1 e 2 relativi
al trattamento facendo un confronto con lo studio precedente che impartiva un schema di terapia
meno intensivo in una popolazione di pazienti simile. In ogni caso un’appropriata analisi medica
degli effetti collaterali ha permesso di continuare il trattamento per tutti i pazienti, mostrando
come lo schema di terapia usato in questo studio possa essere ulteriormente indagato, senza
significativi problemi riguardanti la sicurezza del trattamento.