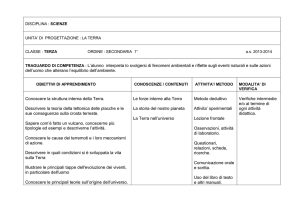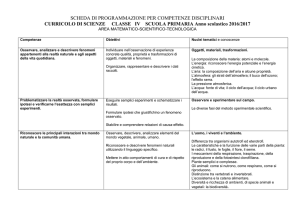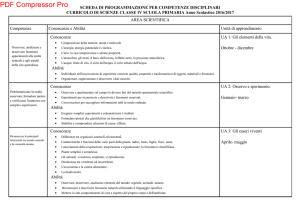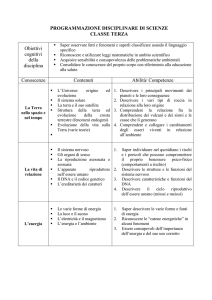
ALLEGATO QT1
QUESTIONARIO TECNICO
Il presente questionario tecnico deve essere debitamente compilato dal
Concorrente in ogni sua parte
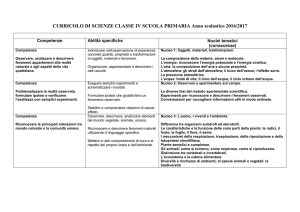
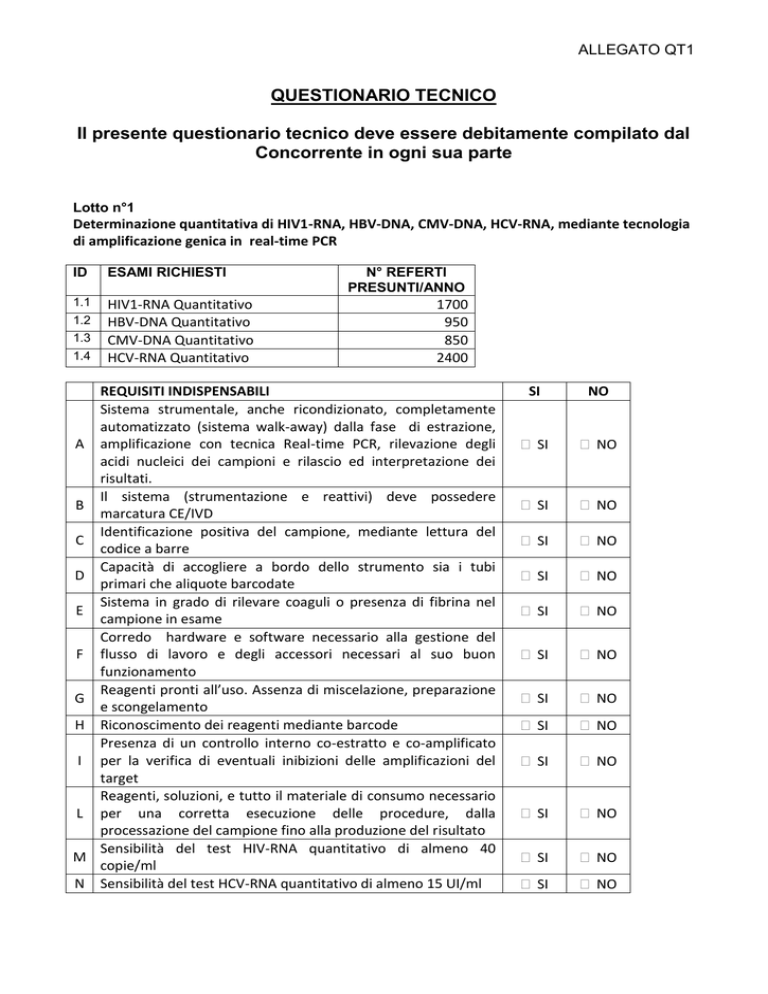
Lotto n°1
Determinazione quantitativa di HIV1-RNA, HBV-DNA, CMV-DNA, HCV-RNA, mediante tecnologia
di amplificazione genica in real-time PCR
ID
ESAMI RICHIESTI
1.1
HIV1-RNA Quantitativo
HBV-DNA Quantitativo
CMV-DNA Quantitativo
HCV-RNA Quantitativo
1.2
1.3
1.4
N° REFERTI
PRESUNTI/ANNO
1700
950
850
2400
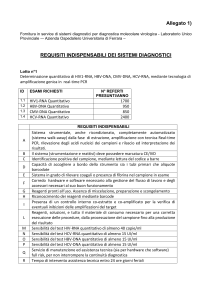
REQUISITI INDISPENSABILI
Sistema strumentale, anche ricondizionato, completamente
automatizzato (sistema walk-away) dalla fase di estrazione,
A amplificazione con tecnica Real-time PCR, rilevazione degli
acidi nucleici dei campioni e rilascio ed interpretazione dei
risultati.
Il sistema (strumentazione e reattivi) deve possedere
B
marcatura CE/IVD
Identificazione positiva del campione, mediante lettura del
C
codice a barre
Capacità di accogliere a bordo dello strumento sia i tubi
D
primari che aliquote barcodate
Sistema in grado di rilevare coaguli o presenza di fibrina nel
E
campione in esame
Corredo hardware e software necessario alla gestione del
F flusso di lavoro e degli accessori necessari al suo buon
funzionamento
Reagenti pronti all’uso. Assenza di miscelazione, preparazione
G
e scongelamento
H Riconoscimento dei reagenti mediante barcode
Presenza di un controllo interno co-estratto e co-amplificato
I per la verifica di eventuali inibizioni delle amplificazioni del
target
Reagenti, soluzioni, e tutto il materiale di consumo necessario
L per una corretta esecuzione delle procedure, dalla
processazione del campione fino alla produzione del risultato
Sensibilità del test HIV-RNA quantitativo di almeno 40
M
copie/ml
N Sensibilità del test HCV-RNA quantitativo di almeno 15 UI/ml
SI
NO
SI
NO
SI
NO
SI
NO
SI
NO
SI
NO
SI
NO
SI
NO
SI
NO
SI
NO
SI
NO
SI
NO
SI
NO
ALLEGATO QT1
Sensibilità del test HBV-DNA quantitativo di almeno 15 UI/ml
Sensibilità del test HCV-DNA quantitativo di almeno 15 UI/ml
Servizio di manutenzione ed assistenza tecnica (sia per
Q hardware che software) full risk, per non interrompere la
continuità diagnostica
Tempo di intervento assistenza tecnica entro 24 ore giorni
R
feriali
O
P
SI
SI
NO
NO
SI
NO
SI
NO
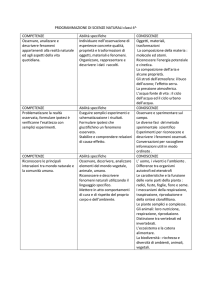
REQUISITI OGGETTO DI VALUTAZIONE DELLA FORNITURA REAL- TIME PCR (HIV1-RNA, HBV-DNA,
HCV-RNA, CVM-DNA)
REQUISITO
1
2
3
4
5
6
7
8
9
1
0
1
1
Caricamento in continuo dei campioni
durante la seduta in corso
Possibilità di eseguire contemporaneamente
tutti i test oggetto della presente fornitura
Altri ulteriori test eseguibili sulla stessa
piattaforma
Possibilità di estrazione degli acidi nucleici da
differenti tipi di campioni biologici
Possibilità di recuperare il materiale estratto
al termine per eseguire anche altre
applicazioni
Strumento per estrazione degli acidi nucleici
aperti
Campionatura da provetta primaria
Controllo completo delle contaminazioni, sia
strumentale che chimico mediante utilizzo
della UNG inserito in metodica, marcata CE
Reazione di amplificazione e rivelazione in
provette chiuse
Nessun utilizzo di calibratori (documentare)
HCV-RNA: appropriatezza con terapia nuovi
farmaci DAA (documentare)
DESCRIVERE/
DOCUMENTARE
descrivere
PUNTI
descrivere
3
descrivere
2
descrivere
4
descrivere
4
descrivere
6
descrivere
descrivere
1
6
descrivere
2
documentare
4
documentare
8
3
1
2
1
3
HIV dual target
descrivere
8
Regione target per HIV non implicata nelle
mutazioni associate a farmacoresistenza
descrivere
8
1
4
Tempi di intervento tecnico su chiamata e
possibilità di assistenza tecnico-scientifica
anche per via telematica
descrivere
1
ALLEGATO QT1
1
5
Quantità e classificazione dei reflui e dei rifiuti
solidi prodotti dal sistema e modalità di
smaltimento
Indicare e descrivere
/
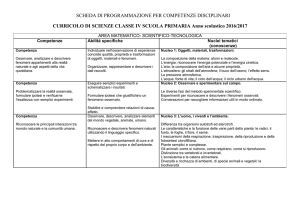
Lotto n°2
Genotipizzazione del virus HCV
ID
ESAMI RICHIESTI
1.1
Genotipizzazione del virus HCV
A
B
C
D
E
F
G
2
3
4
300
REQUISITI INDISPENSABILI
SI
NO
Strumentazione, anche ricondizionata, per l’esecuzione della
ibridazione (escluso il termociclatore).
Reagenti per la retrotrascrizione e l’amplificazione in singolo
tubo della regione 5’UTR e della regione del CORE del
genoma del virus HCV
Reagenti per la ibridazione inversa dei prodotti di
amplificazione sia della regione 5’UTR che della regione del
CORE del virus HCV
Reagenti per la rivelazione colorimetrica del prodotto ibridato
Il sistema (strumentazione e reattivi) deve possedere
marcatura CE/IVD
Servizio di manutenzione ed assistenza tecnica full risk, per
non interrompere la continuità diagnostica
Tempo di intervento assistenza tecnica entro 24 ore giorni
feriali
SI
NO
SI
NO
SI
NO
SI
NO
SI
NO
SI
NO
SI
NO
REQUISITI OGGETTO DI VALUTAZIONE
GENOTIPIZZAZIONE DEL VIRUS HCV
REQUISITO
1
N° REFERTI
PRESUNTI/ANNO
DELLA
FORNITURA
Test di ibridazione inversa del DNA su strisce di
nitrocellulosa (tecnologia Reverse Dot Blot) con primers
biotinilati per l’amplificazione della regione 5’UTR e della
regione Core del HCV
Identificazione dei 6 principali genotipi e discriminazione dei
sottotipi (1a, 1b, 1a o 1b, 1, 2a o 2c, 2b, 2, 3a, 3b, 3c, 3,
4a/4c/4d, 4b, 4e, 4f, 4h, 4, 5a, 6a-b, 6c-I).
Controllo completo della contaminazione tramite utilizzo
dell’enzima UNG inserito in metodica marcata CE-IVD
Quantità di referenze bibliografiche internazionali che ne
DI
SISTEMA
PER
DESCRIVE
RE/
DOCUME
NTARE
descrivere
PUNTI
descrivere
5
descrivere
15
descrivere
5
5
LA
ALLEGATO QT1
5
6
7
8
9
comprovino le performance qualitativa e marcature CE per
kit di amplificazione, kit di rilevazione.
Possibilità di eseguire anche un solo test per volta senza
spreco di materiale
Possibilità di utilizzare pannello di controlli dedicato
(almeno 5 sieri)
Reagente unico per fasi di astringenza e ibridazione
Ridotte dimensione della strumentazione
Quantità e classificazione dei reflui e dei rifiuti solidi
prodotti dal sistema e modalità di smaltimento
descrivere
10
descrivere
10
descrivere
descrivere
Indicare e
descrivere
5
5
/